تداخل آنتیبادیهای درونزاد با سنجش هورمونها
دکتر حمیدرضا هجرانی
دکترای علوم آزمایشگاهی
خلاصه
آنتیبادیهای درونزاد (EA)Endogenous antibodies ممکن است با روشهای ایمونواسی تداخل داشته باشند که این تداخل میتواند منجر به نتایج اشتباه در سنجش هورمونها گردد. از آنجا که در بیشتر موارد این تداخل ناشی از چارچوب و ماهیت روش ایمونواسی میباشد، لذا ممکن است در کیتهای تولیدی از سازندههای مختلف مشاهده شود. در این مقاله به شرح بیماری میپردازیم که آنتیبادیهای درونزاد در وی، با آزمایشهای هورمونی متعددی تداخل داشت. همچنین در خصوص اتخاذ استراتژی پی بردن به تداخل بحث خواهیم کرد.
مواد و روشها: آقایی سی ساله بهواسطه بالا بودن نتایج هورمونی بهویژه هورمونهای با منشأ هیپوفیز که با علائم بالینی وی تطابق نداشت، در طی 4 سال بارها مجبور به انجام آزمایشها و تصویربرداریهای متعدد گردید.
نتایج: وقتیکه به وجود تداخل در سنجش شک به وجود آمد، بهترین کار تکرار آزمایش با روش دیگر و مجاور ساختن سرم با مواد بلوککننده آنتیبادی بود. استفاده از یک روش خودساخته در داخل آزمایشگاه که به تداخل حساسیت نداشته باشد اقدام دیگری بود که میشد انجام داد. از آنسو، رقیق کردن متوالی سرم در مورد بیمار ما نتیجهبخش نبود و رسوب دادن سرم با پلیاتیلن گلیکول (PEG) نیز نتیجه مطلوب دربر نداشت که این امر احتمالاً مربوط به استفاده از غلظت نامناسب PEG در برخی از آزمایشها است.
نتیجه: پزشکان و آزمایشگاهیان باید از محدودیت روشهای ایمونواسی آگاه باشند و در مواردی که نتیجه آزمایش با وضعیت بالینی بیمار تطابق ندارد به وجود آنتیبادیهای مداخلهگر درونزاد شک کنند.
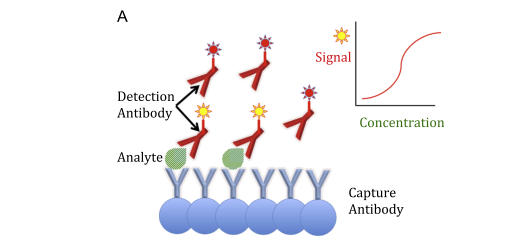
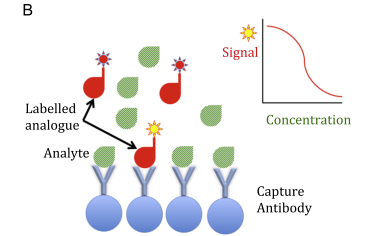
Fig. 1. Examples of immunoassay formats. (A) Sandwich immunoassay: the reaction kit includes both capture and labelled detection antibodies that bind
different epitopes of the analyte. The higher the amount of analyte, the greater the signal developed. (B) Competitive immunoassay: the reaction kit
includes a capture antibody and a labelled analogue of the analyte that competes for the capture antibody. The higher the amount of analyte, the lesser the signal developed.
1- مقدمه
برای اندازهگیری هورمونها (آنالیتها) با روش ایمونواسی، دو چارچوب اصلی وجود دارد:
- روش ساندویچ که عموماً برای اندازهگیری هورمونهایی به کار میرود که مولکولهای بزرگ دارند (1).
- روش رقابتی که اغلب برای سنجش هورمونهای آزاد و یا مولکولهای کوچک استفاده میشود (2).
مثالهایی از هر دو نوع روش در شکل 1 به نمایش در آمده است، اگرچه مدلهای مختلفی از هر دو روش ابداع شده است.
آنتیبادیهای درونزاد (EA) {اعم از آنتیبادی هتروفیل، آنتیبادیهای علیه حیوانات و اتوآنتیبادیها{ (3) میتوانند در روشهای ایمونواسی ایجاد تداخل نمایند که نهایتاً این تداخل بهصورت نتایج اشتباه منعکس میشود. آنتیبادیهای هتروفیل بهطور طبیعی و بدون مواجهشدن با ایمونوژن خاصی تولید میشوند. آنتیبادی علیه حیوانات، اختصاصی گونه بوده و درنتیجه مواجهه مزمن با پروتئینهای (ایمونوگلوبولینها) حیوانی ایجاد میشود. درنهایت اتوآنتیبادیها به آنالیتهای اختصاصی خود همچون تیروگلوبولین یا انسولین متصل میشوند.
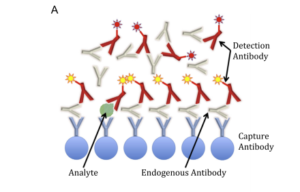
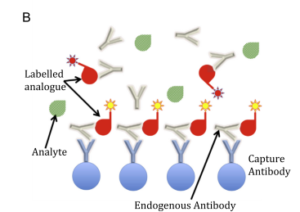
مکانیسمی که توسط آن EA ایجاد تداخل مینماید برحسب نوع آنتیبادی و نوع ایمونواسی تفاوت میکند؛ بهعنوانمثال آنتیبادیهای ضد حیوان و آنتیبادیهای هتروفیل با متصـــــــــل کردن capture antibodies (که معمولاً در کف پلیت الیزا فیکس شدهاند) با detection antibodies (آنتیبادیهای نشاندار شده) به یکدیگر (در غیاب آنتیژن) موجب نتیجه مثبت کاذب میشوند (البته بسته به سازوکار سنجش و محل تداخل احتمال ایجاد منفی کاذب هم هست)، بنابراین این نوع تداخل در پروتکلهای سنجش ساندویچی (شکل A2) بیشتر دیده میشود. تداخل EA در روشهای رقابتی هم بندرت گزارش شده است (شکل B2). جالب است بدانیم که روشهای ایمونواسی رقابتی جدید در مقایسه با روشهای رادیوایمونواسی قدیمیتر بیشتر در معرض تداخل با EA هستند که این موضوع ناشی از ترکیب اجزایی است که در معرفهای امروزی به کار میبرند (2).
گفته میشود که تا 40% از افراد دارای آنتیبادیهای ضد آنتیبادی حیوانی هستند، گرچه تصور بر این است که بیشتر این موارد در روشهای ایمونواسی تداخلی ایجاد نمیکنند (1)، معالوصف این نوع از تداخل به همراه سایر عوامل پیشآزمایشی (همچون عوامل فیزیولوژیک، داروها، پایبندی به پروتکلهای نمونهگیری و نگهداری نمونه …) باید همیشه در تفسیر صحیح نتایج آزمایش مدنظر قرار گیرد. متأسفانه در آزمایشگاههای امروزی که هزاران نمونه در روز مورد آزمایش قرار میگیرند، پی بردن به این عوامل مداخلهگر بسیار مشکل است بهویژه وقتیکه اطلاعات بالینی کافی هم در دسترس نباشد.
Fig. 2. Examples of endogenous antibodies (EA) interference in immunoassays. (A) Sandwich immunoassay. EA can bind both the capture and the detection
antibodies. In the case depicted, interference causes a falsely elevated result. (B) Competitive immunoassay. The example shows EA binding both
the capture antibody and only the labelled analogue (but not the analyte). In this case, interference will produce a falsely low result.
آزمایشگاهها با تلاش جهت به حداقل رساندن اثر متغیرهای پیشآزمایشی و همچنین شرکت در برنامههای کنترل کیفی خارجی (EQAS) میکوشند تا از کیفیت نتایج خود اطمینان حاصل کنند، اما باید در نظر داشت که معمولاً برنامههای کنترل کیفی خارجی (EQAS) به مواردی از قبیل اثرات مداخله کننده EA در متدهای اندازهگیری نمیپردازند (4).
در چنین مواردی برای رفع تعارضات، آزمایشگاهها تدابیر خاصی اتخاذ میکنند؛ از جمله توجه به نتایج قبلی بیمار (دلتاچک) یا توجه به ناهماهنگی بین نتایج دو آزمایش مرتبط مانند FT4 و TSH. معذلک اینگونه کنترلها نسبت به آشکارسازی برخی خطاها حساس نیستند؛ مثلاً امکان دارد که علیرغم نرمال بودن FT4 مقدار TSH بالا باشد (کمکاری تحت بالینی) و یا تومورمارکری افزایش نشان دهد (و نشانه یک نئوپلازی باشد). تمام این موارد (8-5) به همراه موارد بسیار دیگر ممکن است در هر روش آزمایشی ایجاد خطا نماید (9) که عواقب خطرناک آن در مواردی گریبانگیر بیمار میشود (1).
با توجه به وجود اینهمه شواهد مبنی بر ایجاد تداخل و خطا در روشهای ایمونواسی، جای تعجب است که گاهی مشاهده میشود با اتکا به نتیجه یک آزمایش و بدون تأیید آن توسط روشهای دیگر، اقدامات درمانی دارویی یا حتی جراحی به عمل میآید. این اتفاق شاید ناشی از عدم آگاهی پزشکان از خطاهای آزمایشگاهی و اعتماد کور آنها به هر نتیجهای است که از آزمایشگاه به دست آنها میرسد. با فراهم آمدن امکان درخواست الکترونیک آزمایش و انجام آزمایشهای متعدد بهمنظور کشف بیماری، تمایل اعتماد کورکورانه به نتایج آزمایش در بین پزشکان بیشتر شده است (10).
گرچه گزارش و تفسیر نتایج خطا وظیفه آزمایشگاه است (11)، اما اغلب پزشکان هستند که این خطاها را کشف میکنند (4). ارتباط خوب بین آزمایشگاه و پزشک معالج برای شناسایی نتایج خطا ضروری است و در چنین مواردی آزمایشگاه محتاج راهکارهایی است که بتواند حضور مواد مداخلهگر را شناسایی کند (13-11 و 2 و 1).
در این مقاله در خصوص یک بیمار سرپایی صحبت میکنیم که وجود EA در وی منجر به نتایج اشتباه شده است. در ابتدا تصور بر این بود که بیمار هیپوتیروئیدی تحت بالینی دارد و بعداً احتمال وجود آدنوم هیپوفیز مطرح شد. در نهایت بیمار به یکی از نویسندگان مقاله ارجاع گردید که وی به وجود مواد مداخلهگر ظنین شد. وجود EA در این فرد سبب بروز تداخل در سنجش هورمونهای متعدد بهویژه هورمونهای با منشأ هیپوفیز شده بود. این مورد بسیار نادر است و اخیراً یک مورد مشابه دیگر توسط Gulbahar و همکارانش گزارش شده است (14). هر دوی این مطالعات حکایت از آن دارند که تعداد نمونههایی که مشکوک به تداخل متعدد در سنجش ایمونواسی هستند ممکن است بیش از آن چیزی باشد که تاکنون تصور میشد.
- شرح مورد
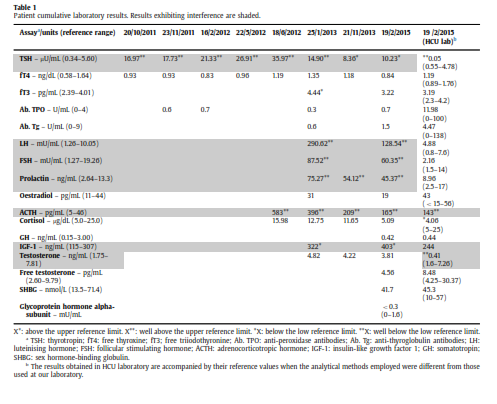
در اکتبر 2011 مرد سی سالهای با شکایت از اسهال طولانی به پزشک خانوادگی خود مراجعه نمود. در تاریخچه پزشکی وی نکته قابلتوجهی وجود نداشت. از وی آزمایشهای خون، ادرار و مدفوع به عمل آمد. تمــامی نتایج وی طبیعی بود بهجز آزمایش TSH که نسبتاً بالا بود (U/mlµ 16/97 با محدوده مرجع 5/6-0/34). این در حالی بود که FT4 نیز در محدوده مرجع قرار داشت. آزمایش آنتیبادیهای ضدپراکسیداز و ضدتیروگلوبولین هم منفی بودند. یک ماه بعد با تکرار آزمایش، نتایج آزمایش تیروئید تأیید شد. بیمار هیچگونه سابقه شخصی یا خانوادگی در خصوص بیماری تیروئید نداشت. در سونوگرافی گردن اندازه تیروئید متوسط بود و هیچ ناهنجاری خاصی مشاهده نشد. جریان خون در عروق تیروئید هم طبیعی بود. علیرغم این واقعیت که بیمار هیچگونه علامت و نشانهای از ابتلا به کمکاری تیروئید نداشت و نیز علیرغم این واقعیت که عده بسیار کمی از مردان جوان (زیر یک درصد) چنین شرایطی را بروز میدهند (15)، تشخیص کمکاری تحت بالینی تیروئید داده شد و تحت درمان روزانه 50 میکروگرم لوتیروکسین قرار گرفت. با کمال تعجب نهتنها مقدار TSH وی کاهش نیافت بلکه بهطور مستمر افزایش نشان میداد (جدول 1).
این افزایش در حالی بود که مقدار لوتیروکسین وی به روزی 200 میکروگرم افزایش یافته بود. پاسخ ندادن بیمار به درمان ابتدا مورد شک واقع شد ولی بعداً نادیده گرفته شد. برای رد تشخیص سوءجذب رودهای، مارکرهای بیماری سلیاک مورد آزمایش واقع شد و همگی منفی بودند. او هیچ داروی دیگری هم مصرف نمیکرد که فرض تداخل با لوتیروکسین مطرح شود. از زمانی که دوز لوتیروکسین به 200 میکروگرم در روز افزایش یافته بود، بیمار از سردرد و بیخوابی شکایت میکرد اما کاهش وزن یا تپش قلب نداشت.
در ژوئن 2012 مجدداً از وی آزمایش بعمل آمد و مقدار TSH همچنان بالا بود. برای رد تشخیص بیماری آدیسون {که در آن مقادیر بالای TSH در برخی بیماران درماننشده دیده میشود (16)} آزمایش ACTH و کورتیزول انجام شد که مقدار ACTH بالا بود. با انجام آزمایش سرکوب دگزامتازون با دوز پایین بیماری کوشینگ و با آزمایش Synacthen (کوزینتروپین) کوتاه هم بیماری آدیسون رد شدند.
در ژانویه 2013 یک سری آزمایشهای هورمونی مجدداً درخواست شد. نهتنها TSH و ACTH بلکه LH، FSH و پرولاکتین هم بالا بودند (جدول 1). به خاطر نتایج غیرطبیعی هورمونها تصویربرداریهای متعددی جهت بررسی احتمال تومور هیپوفیز انجام شد. متأسفانه بیمار در قرار ویزیت بعدی مراجعه نکرد و دفعه بعد در فوریه 2015 ویزیت شد. تکرار آزمایشهای هورمونی نتایج قبلی را تأیید میکرد. مجدداً MRI جهت بررسی تومور هیپوفیز انجام شد که نتیجه طبیعی بود. در این موقع پرونده وی توسط یک متخصص غدد دیگر بررسی شد و او به وجود آنتیبادیهای درونزاد در بیمار شک کرد و از بیمار در مورد سابقه تماسش با حیوانات سؤال نمود. بیمار اذعان داشت که در دوران کودکی و نوجوانی در یک مزرعه کار میکرده و در تماس مستقیم با حیواناتی همچون بز، گوسفند، گاو، خرگوش و خوک بوده است.
- مواد و روشها
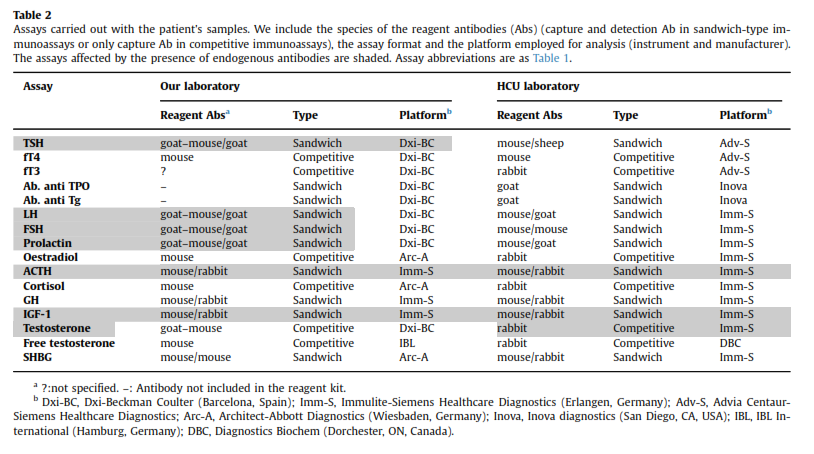
نمونه خون از بیمار گرفته شد و فوراً با روشهایی که جزئیات آن در جدول 2 آمده است مورد آزمایش واقع گردید. تمام آزمایشها بر روی نمونه سرم انجام شد مگر آزمایش ACTH که برای آن پلاسمای EDTAدار استفاده گردید.
در مواردی که احتمال تداخل وجود داشت عملیات ذیل انجام گردید:
یک سری رقت از نمونه (2،3 و 5 بار رقیقشده) با استفاده از رقیقکنندههای شرکت سازنده تهیه گردید. از طرفی نمونه بیمار با محلول بافر فسفات 25% (W/V) پلیاتیلن گلیکول 6000 (مرک) طبق دستورالعمل Sturgeon و Vilgoen (13) مخلوط گردید. جهت مقایسه، نمونه بیمار به یک بیمارستان همجوار ارسال شد تا آزمایشهای هورمونی در آنجا هم انجام شوند.
از پروتئینهای خاصی جهت پیشگیری از تداخل ایمونوگلوبولینهای بز، موش، خرگوش و گاو استفاده بعمل آمد تا وجود آنتیبادی درونزاد مدلل گردد.
- نتایج و بحث
وقتیکه به وجود آنتیبادیهای درونزاد مشکوک میشویم تکرار آزمایش با کیت و دستگاه دیگر در بسیاری از موارد مشکل تداخل را حذف میکند. معالوصف راههای متعدد دیگری جهت اثبات وجود آنتیبادی درونزاد در دسترس میباشند (13-11 و 2 و 1). یکی از سادهترین راهکارها رقیق کردن سریالی نمونه با رقیقکننده کیت میباشد، چراکه در حضور آنتیبادی درونزاد، اغلب یک رابطه غیرخطی مشاهده میشود. همچنین تحت تأثیر قرار دادن نمونه با پلیاتیلن گلیکول موجب رسوب پروتئینها و درنتیجه رسوب آنتیبادی درونزاد میگردد. اما امروزه بهترین روش برای اثبات وجود تداخل آنتیبادیهای درونزاد استفاده از لولههای آزمایش تجاری است که دارای پروتئینهای سرم و ایمونوگلوبولینهای حیوانات مختلف هستند و وقتی سرم در این لوله قرار میگیرد آنتیبادی درونزاد به پروتئین موردعلاقهاش متصل شده و از سرم حذف میگردد.
راه دیگر استفاده از روشهای ساندویچ ساختهشده توسط خود آزمایشگاه است که دارای معرف دو آنتیبادی علیه آنالیتهای مختلف و یا استفاده از یک معرف آنتیبادی هم بهعنوان آنتیبادی capture و هم بهعنوان آنتیبادی detection میباشد (17). این روش تنها در حضور مواد درونزاد که آنتیبادیهای معرف را به هم متصل میکنند واکنش مثبت میدهد.
وقتی ما نمونه را رقتهای متوالی دادیم نتایج آزمایش هورمونها خطی بود. به این ترتیب به نظر میرسد که نتیجه اولیه صحیح بوده است، اما باید توجه داشت که حدود 40% نمونههایی که واجد آنتیبادیهای تداخلکننده هستند در آزمایش رقیقسازی، واکنش غیرخطی نشان نمیدهند (18) که نمونه بیمار ما جزو این 40% میباشد.
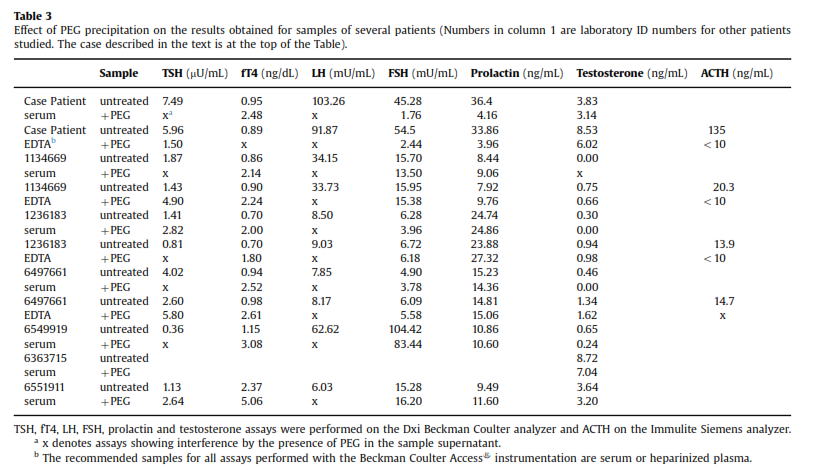
همچنین رسوب با پلیاتیلنگلیکول PEG هم منجر به نتیجه دلخواه نشد. در مورد برخی هورمونها همچون FSH و پرولاکتین پس از رسوب دادن نمونه با PEG، وجود تداخل ثابت شد اما در مورد هورمونهای دیگر (LH ,TSH) قضیه فرق میکرد (جدول 3).
در خصوص نتایج متناقض سنجش هورمونها پس از رسوب با PEG مقالات متعددی وجود دارد (21، 20، 13، 11). پس از مطالعه این مقالات به این نتیجه رسیدیم که احتمالاً همه هورمونها را نباید با یک غلظت واحد از PEG رسوب داد بلکه باید از غلظتهای مختلف برای هورمونهای مختلف استفاده کرد، اما ازآنجاکه ما با هورمونهای متعددی در این بیمار سروکار داشتیم به نظر آمد که صرف وقت برای تعیین غلظت دقیق PEG برای تکتک هورمونها استراتژی مناسبی نباشد.
این بار هم نمونه بهطور همزمان به آزمایشگاه بیمارستان دیگری ارسال گردید تا آزمایش با یک روش دیگر تکرار شود (جدول 2).
همانطور که در جدول 1 میتوان دید بیشتر آزمایشها در آزمایشگاه دوم بهطور کامل طبیعی گزارش شدند جز در مورد ACTH و آنهم به این دلیل بود که هر دو آزمایشگاه از یک روش استفاده میکردند.
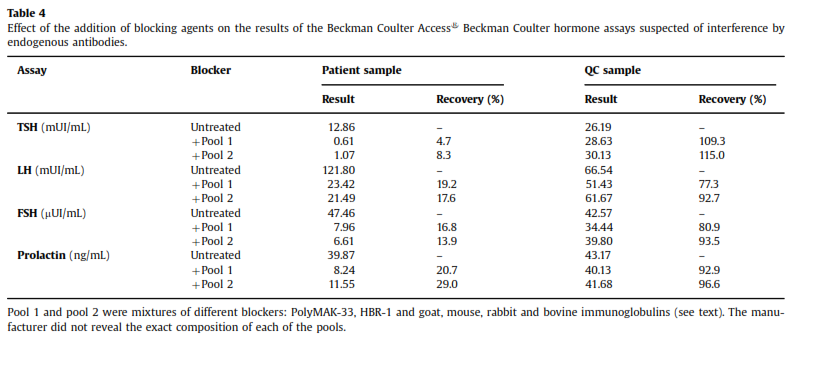
نمونه بیمار همزمان به آزمایشگاهی با تجهیزات Beckman Coulter ارسال شد که نمونه با مواد بلوککننده (ایمونوگلبولینهای گاو، خرگوش، موش و بز) مخلوط شده و سپس آزمایش میشد. ایمونوگلبولینهای مختلف حیوانی احتمال حذف تداخلات ناشی از EA را افزایش میدهند. خلاصه این نتایج را در جدول 4 میتوانید مشاهده نمایید.
بازیابی (recovery) نمونه کنترل کیفی پس از مخلوط کردن با مواد بلوککننده حدود 100% بود ولی در خصوص نمونه بیمار بهوضوح کاهش نشان میداد، بنابراین مشخص شد که با سیستم Beckman Coulter هم نمونه دارای مواد تداخل کننده است که سبب افزایش کاذب TSH، LH، FSH و پرولاکتین میگردد (جدول 2).
باید خاطرنشان کرد که استفاده از مواد بلوککننده بهطور کامل سبب رفع تداخل در سنجش TSH نشد گرچه آن را به محدوده مرجع سوق داد اما مقدار واقعی آنکه در بیمارستان دیگر اندازهگیری شده بود (0.05 µU/ml) بود که عددی منطقی است، چون فردی که 4 سال متوالی لوتیروکسین مصرف کرده باشد دچار هیپرتیروئیدی ایاتروژنیک میشود. گفته میشود که استفاده از مواد بلوککنـــنده در
20-30% از مواردی که آنتیبادیهای درونزاد وجود دارند منجر به رفع تداخل نخواهد شد (11) و حتی اگر تداخل اثبات شود استفاده از این مواد منجر به رفع کامل تداخل نمیگردد.
جهت تأیید وجود مواد مداخلهگر اقدام دیگر ما ساخت یک کیت داخل آزمایشگاهی بود که در این کیت تنها راه بالا رفتن سیگنال از حد بلانک وجود مواد مداخلهگر بود (17). نتایج این اقدام را در جدول 5 میتوان مشاهده کرد.
پس از بحث در خصوص نتایج آزمایش با پزشک معالج قرار بر این شد که ادامه درمان متوقف شده و هیچ اقدام تشخیصی دیگری انجام نشود. چهار ماه بعد آزمایش خون در هر دو آزمایشگاه انجام شد و نتایج مشابه نتایج قبلی بود با این تفاوت که در آزمایشگاه دوم (که عوامل مداخلهگر قادر به اختلال نبودند) نتیجه TSH پس از قطع درمان با تیروکسین به حد طبیعی بازگشته بود.
نتایج حاصله در پرونده بیمار درج شد و هشداری به پزشکان معالج آتی نوشته شد که در تفسیر نتایج آزمایش این بیمار به حضور عوامل مداخلهگر نهایت توجه را داشته باشند. این مورد بهخوبی نشان میدهد که آنتیبادیهای مداخلهگر چه اثرات بالینی و اقتصادی میتوانند در پی داشته باشند. این بیمار به مدت چهار سال تحت درمان غیرضروری با دوز بالای لوتیروکسین قرار گرفت و طی 21 مرحله خونگیری 405 آزمایش خون از وی به عمل آمد، مضاف بر اینکه چهار مورد تصویربرداری تشخیصی نیز در کارنامه وی قرار گرفت. همچنین 19 بار ویزیت توسط دو پزشک عمومی و سه متخصص غدد از وی به عمل آمد که فقط متخصص آخری بود که به وجود آنتیبادی مداخلهگر مشکوک شد. ازاینرو باید حداکثر تلاش جهت آگاه ساختن پزشکان بالینی ازاینگونه موارد به عمل آید چراکه پزشک معالج مناسبترین فرد جهت تشخیص ناهماهنگی بین نتایج آزمایش و بالین بیمار است (4). احتمال وجود هیپوتیروئیدی تحتبالینی در مردان جوان کمتر از یک درصد است (15)، لذا اگر اولین پزشک بیمار به احتمال خطا در آزمایشها توجه داشت باید به وجود TSH بالا در مرد بدون علائم بالینی شک میکرد. اسماعیل و همکارانش (23) تخمین میزنند که احتمال مثبت کاذب بودن افزایش TSH در مردان جوان بیش از 30% است.
ارتباط زودهنگام بین پزشک معالج و آزمایشگاه نهایت اهمیت را دارد، لذا هر نتیجه آزمایشی که با بالین بیمار هماهنگی نداشته باشد باید در خصوص آن بحث شود. اگر احتمال تداخل آنالیتیکال مطرح باشد آزمایشگاه میتواند با روشهایی که گفته شد نسبت به بررسی آن اقدام کند (23).
مکانیسم تداخل آنتیبادیهای درونزاد پیچیده است و از یک بیمار به بیمار دیگر فرق میکند (11). در مورد این بیمار هم ما درصدد کشف مکانیسم دقیق تداخل نبودیم، اما از آنجا که تداخل در روشهای مختلف که معرفهایی با منشأ حیوانی (بز، موش و خرگوش) داشتند دیده میشد، لذا شاید بتوان نتیجه گرفت که حضور فرد در مزرعه و مواجهه با این حیوانات سبب تولید آنتیبادیهای مداخلهگر شده است. آنتیبادی ضد آنتیبادی میتواند anti- isotypic، anti-allotypic یا anti- idiotypic باشد. آنتیبادیهای درونزاد anti- idiotypic بسیار اختصاصی بوده و تنها در یک روش و بر روی یک دستگاه ایجاد تداخل میکنند (14). اینکه چرا در دو روش که از یک گونه سرم استفاده میکنند در یکی تداخل مشاهده میشود و در دیگری مشاهده نمیشود ممکن است ناشی از حضور آنتیبادیهای anti- isotypic یا anti-allotypic درونزاد در سرم فرد باشد.
- نتیجهگیری
این گزارش موردی شامل نکات آموزنده متعددی میباشد:
- هر نتیجه آزمایش ممکن است اشتباه باشد، لذا تمام نتایج آزمایش که در تعارض با وضعیت بالینی بیمار هستند باید مورد ارزیابی بیشتر قرار گیرند.
- پزشکان باید از زمینه وجود خطا در روشهای ایمونومتریک آگاه باشند و بدانند که میزان آنتیبادیهای مداخلهگر ممکن است بیش از آن حدی باشد که تاکنون تصور میشد.
- ارتباط پزشک معالج و آزمایشگاه برای اجتناب از خطاهای خطرناک برای بیمار ضروری و حیاتی است.
وقتیکه به وجود تداخل مشکوک شدیم از روشهای متعددی همچون رقیقسازی سریال، رسوب با PEG، استفاده از لولههای بلوککننده آنتیبادی و استفاده از یک روش و دستگاه دیگر برای آزمایش جهت تأیید تداخل میتوان استفاده کرد.
این مقاله ترجمهای است از:
Serum sample containing endogenous antibodies interfering with multiple hormone immunoassays. Laboratory strategies to detect interference
Practical Laboratory Medicine 4 (2016) 1–10
کاهش تداخل مواد اندوژن در آزمایشگاه هماتولوژی و بیوشیمی بالینی
چگونه تداخل در ایمنیسنجی را شناسایی و برطرف کنیم
مداخله بیوتین در تستهای آزمایشگاهی
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام