تکنیکهای RFLP و PCR-RFLP
دکتر مهدی فصیحی رامندی (عضو هیئت علمی دانشگاه علوم پزشکی بقیها… (عج))
زهرا کریمی (مرکز تحقیقاتی زیست سلول پژوهان تدبیر)
دکتر رضا میرنژاد (استاد دانشگاه)
در بين نشانگرهاي مولكولي، RFLP اولين نشانگر مورد استفاده در نقشهبرداري ژنومي است، به همين دليل از اين نشانگر بهعنوان نسل اول نشانگرها ياد ميشود. RFLP ناشي از تغيير در توالي DNA است كه اين تغييرات ميتواند شامل جهشهاي تك نوكلئوتيدي، حذف و اضافه و بازآراييهاي بزرگ کروموزومی باشد. اين تغييرات توالي موجب ايجاد، حذف و يا جابجايي يك محل برش آنزيمي میگردد كه اين برش آنزيمي اساس تكنيك RFLP است.
تاريخچه RFLP
RFLP اولين بار در سال 1974 بهعنوان يك نشانگر ژنتيكي توسط Grodzicker و همكاران بهمنظور بررسی نژادهای موتانت آدنوویروس مورد استفاده قرار گرفت. استفاده از RFLP بهعنوان نشانگر بيماري ژنتيكي اولين بار توسط Kon و Dozy در سال 1974 براي آناليز بيماري کمخونی داسي شكل بهكار گرفته شد. Botstein و همكاران (1980) تئوري پايه اين روش را براي نقشهيابي ژنهاي مرتبط با بيماري در انسان مطرح كردند. Southern روش انتقال DNA از ژل به غشاء نيتروسلولزي در RFLP را ابداع کرد. Backman (1986) براي اولين بار استفاده از اين نشانگر را مطرح نمود. كاربردهاي مهم همچون نقشهيابي و دستكاري مكان ژنهای کنترلکننده صفات کمی با استفاده از RFLP در سال 1983 توسط Backman و Soller بیان گردید. با گسترش كاربرد اين نشانگر قدرتمند، ژنها و گاهی ژنوم تعدادي از گونههاي دام چون گاو، گوسفند، بز، اسب، خوك و جوجه نيز آناليز شدند.
كليات تكنيك
مشخص شده است كه ژنوم موجودات بهطور طبيعي داراي تفاوتهایی در رديف بازهاي خطي هستند. این تغییرات طبيعي كه سبب گوناگوني در افراد يك جمعيت ميشود، چندشكلي ژنتيكي نام دارد. اگر اين چندشكلي در رديف بازهاي DNA در جايگاه شناسایی آنزيم محدودكننده ايجاد شده باشد، بهراحتي قابل ردیابی است. روش RFLP شامل همسانه کردن ردیفهای منحصربهفرد یا دارای نسخههای کم در ژنوم است که بهعنوان کاوشگر از آنها استفاده میشود. RFLP وجود الگوهاي غيريكسان است كه بر اثر هضم آنزيمي يك ناحيه خاص از DNA بهوسیله آنزيمهاي محدودکننده مشخص ميشود. اين الگوهاي غيريكسان به علت تفاوت در حضور يا عدم حضور جايگاه آنزيمهاي محدودکننده بر روي DNA بوجود ميآيد. اين الگوها را به دو شكل ميتوان مشخصكرد:
- هضم آنزيمي و سپس الكتروفورز و استفاده از لكهگذاري ساترن
- PCR قطعه موردنظر و هضم آنزيمي
در روش اول ابتدا نمونهاي از DNA را با يك نوع آنزيم محدودگر، هضم ميكنند كه در نتيجه آن تعداد زيادي قطعه با طول متفاوت بهدست ميآيد. در بيشتر مواقع توالي مورد شناسايي اين آنزيمها يك پاليندروم است كه معمولاً شامل چهار يا شش جفت باز داراي تقارن دو طرفي است؛ يعني از چپ و راست به يك صورت خوانده ميشود. حاصل فرآيند هضم، تعدادي قطعه است كه اين قطعات با استفاده از ژلآگارز از يكديگر جدا میگردند. شناسایی و تشخيص يك قطعه خاص با استفاده از كاوشگرها امکانپذیر است كه اين عمل با استفاده از تكنيك ديگري تحت عنوان لكهگذاري ساترن صورت ميگيرد.
روش PCR-RFLP
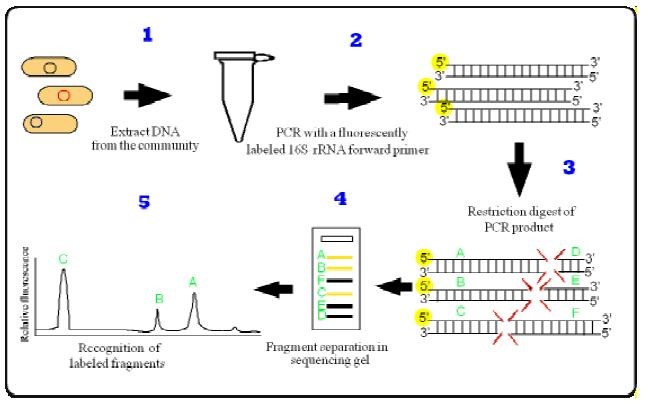
روش (RLFP Restriction fragment length polymorphism) که به معنی قطعات طولی مختلف ایجاد شده بهوسیله آنزیم محدودالأثر (Restriction Enzyme) است، معیار مولکولی مورد استفاده در نقشههای ژنتیکی کروموزوم بوده و یک تکنیک رایج در ژنوتایپینگ است. این روش بهعنوان Cleaved Amplified Polymorphic Sequence (CAPS) نیز شناخته میشود. اولین گام در تجزیه و تحلیل PCR-RFLP تکثیر قطعه حاوی تغییر (variation) است.
از آنجا که حضور یا عدم حضور سایت شناسایی آنزیمهای محدودالاثر منجر به تشکیل قطعات هضم آنزیمی با اندازههای مختلف میشود، بنابراین شناسایی آلل را میتوان با الکتروفورتیک قطعات انجام داد.
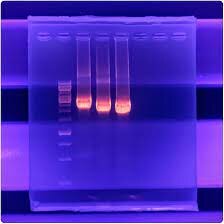
در روش RFLP، آنزیمهای محدودالاثر جهت برش DNA در مکانهای خاص 4-6 جفت بازی استفاده میشود. DNA نمونه با یک یا چند آنزیم محدودالأثر هضم میشود و قطعات بر اساس طول مولکولی با استفاده از ژل الکتروفورز از یکدیگر تفکیک میشوند. طول قطعه DNA هضمشده بسته به وجود یا عدم وجود توالی مخصوص آنزیم هضم متفاوت خواهد بود. تفاوت طول قطعات نتیجه جهشهای حذف، اضافه، جابهجایی و یا بازآراییهای صورتگرفته درون ناحیه مربوط به هضم است. در این روش با مخلوط کردن ساده محصول PCR، بافر X 10 محدودکننده و گرماگذاری آن برای انجام واکنش هضم و در نهایت آشکارسازی آنها روی ژل آگارز بهکمک الکتروفورز، نتایج نسبتاً سریع و روشنی بدست میآید. در روش RFLP ابتدا نمونهای از DNA را با یک نوع آنزیم برشی، هضم میکنند که در نتیجه تعداد زیادی قطعه با طول متفاوت بدست میآید، سپس این قطعات با استفاده از ژل آگارز از همدیگر جدا میشوند. شناسایی و تشخیص یک قطعه خاص با استفاده از کاوشگرها امکانپذیر است. زمانی که یک آنزیم برشی به DNA اضافه میشود، DNA از بسیاری از مکانها که از آنها قبلاً عنوان سایت برشی یاد شد، شکاف برمیدارد و در اصطلاح هضم میشود. حاصل فرآیند هضم، تعدادی قطعه است. هضم ژنوم باکتریایی بهوسیله آنزیمهای محدودالاثر همراه با ژل الکتروفورزیس برای تولید الگوهای مختلف DNA است (شکل 1). روش مولکولی PCR-RFLP، روش حساس، دقیق، سریع و بدون نیاز به ابزار پیشرفته بوده که باکتری را در سطح گونه تشخیص میدهد، همچنین این روش قادر به شناسایی درونگونهای و بینگونهای نیز هست. در این روش نیاز به اطلاعات سکانس کامل ژن نیست. از معایب این روش عبارتند از:
- نیاز به اندونوکلئاز خاص
- مرحله جداگانه هضم و الکتروفورتیک
- در نتیجه وقتگیر بودن آن است.
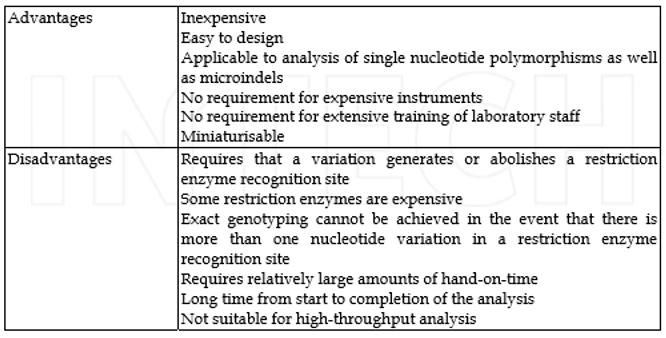
مزایا و معایب روش PCR-RFLP در جدول 1 آمده است.
تصویر 1- شمایی از روش PCR- RFLP
جدول 1- مزایا و معایب روش PCR-RFLP
كاوشگر و تكنيك-RFLP ساترن
قطعه خاصي از DNA را كه مربوط به يك ژن خاص يا cDNA است، بهوسيله آنزيمهاي برشي خاص هضم میشود و قطعات حاصل، در حاملهاي پلاسميد كه توسط همان آنزيم محدودگر برش داده شدهاند، جاگذاري ميگردد. اين پلاسميدها جهت تكثير و نگهداري به باكتريهاي آزمايشگاهيكه اغلب اشريشيا كلي (E.coli) هستند، منتقل ميشوند. اين قطعات پس از جداسازي و خلوص، توسط راديوايزوتوپها يا مواد شيميايي چون بيوتين و يا فلوروفور نشاندار ميشوند. در صورت وجود رابطه مكملي واتسون- كريك بين رديف بازي كاوشگر و DNA هضمشده اتصال بين اين دو برقرار خواهد گرديد. علاوه بر اين ميتوان از تواليهاي بينظير و اختصاصي در حال بيان، يعني ESTs[1] بهعنوان كاوشگر استفاده نمود.
اما توجه به اين نكته ضروري است كه تكنيك-RFLP ساترن وقتگير است و حجم كار زيادي را ميطلبد، همچنين در اين روش مقدار زيادي DNA موردنياز است، به همين دليل تكنيك PCR-RFLP و SCAR بوجود آمدند.
برای انجام عمل هیبرایداسیون لازم است که علاوه بر قطعه کاوشگر، قطعاتDNA هضمشده نیز تکرشتهای شوند، لذا ابتدا DNA روی ژل آگارز که حاوی قطعات هضم شدهاست را در محلولهای قلیائی مثل اوره یا فرمالدئید یا هیدروکسید سدیم تکرشته مینمایند، سپس صفحهای از غشاء نیترو سلولزی را روی قسمت فوقانی ژل قرار داده و روی آن غشاء مقداری کاغذ جاذبالرطوبه میگذارند. محلول بافر تانک الکتروفوزر بهوسیله فشار اسمزی کاغذ فوقانی بالا کشیده میشود و حین عبور از ژل به غشاء نیتروسلولزی که دارای بار مثبت است منتقل میگردد. با تسهیل عمل هیبریداسیون بین کاوشگر و قطعاتDNA هضم شده در معرض پروب نشاندار رادیواکتیو در نقاطی که همولوژی وجود دارد، هیبرید میگردد. قطعاتی که هیبریداسیون در آنها صورت نگرفته است از محیط شسته میشوند و سپس از غشای نیتروسلولزی در مجاورت فیلم عکاسی اتورادیوگرافی بعمل میآید. پس از ظهور و ثبوت فیلم، قطعات ویژهای ازDNA که با پروب هیبرید هستند بهصورت یک باند مرئی دیده میشود.
روش (PCR-RFLP) PBR
در روش دوم RFLP كه به RFLP بر پايه PCR[2] يا PCR-RFLP معروف است، ابتدا قطعه حاوي جايگاه چندشكلي را با واكنش زنجيرهاي پليمراز و استفاده از دو آغازگر مخصوص كه به همين منظور طراحي شده، تكثير مينمايند و پس از هضم آنزيمي، الكتروفوز ميكنند. نشانگرهاي ژنتيكي كه در اين روش شناسايي ميشوند، تحت عنوان CAPS[3] شناخته ميشوند. اين نشانگرها ابزارهاي قدرتمندي در تعيين ژنوتيپ SNP[4] و لوكوسهاي حاوي جهش ميباشند. در PBR جهشهایی از نوع نقطهاي و حذف و اضافه که باعث تغيير در محل اثر آنزيم محدودگر ميگردند، قابل تشخيص است.
فرق لكهگذاري ساترن و PBR
در RFLP ساترن تنوع توالي DNA در داخل منطقه مكمل كاوشگر به طول kb30 تعيين ميگردد. در حالی که در PBR تنوع در داخل منطقهاي كه از دو طرف به آغازگر ختم شده، تعيين ميشود. اين ناحيه معمولاً به طول 2-0/5 كيلوباز است. علاوه بر اين در PBR مزایایی چون سادگي، سرعت زياد، عدم نياز به مواد راديواكتيو و تكرارپذيري بالا مطرح است. ميزان پليمورفيسم و تعداد آللها در PBR كمتر از RFLP ساترن است.
مزایای RFLP عبارت از موارد زیر است:
– تحت تأثیر محیط نیست و صددرصد ژنتیکی است.
– تکرار پذیری آن بالاست.
روش انجام RFLP– ساترن استاندارد
- آمادهسازي DNA: بعد از انجام الكتروفورز DNA ژنومي بر روي آگارز 0/8% و بررسي خلوص و كيفيت آن، همه نمونهها را از لحاظ غلظت، همتاسازي كنيد (lµ ng/500). دقت كنيد كه خلوص بالاي نمونه DNA نكته كليدي در موفقيت هضم آنزيمي است.
- هضم آنزيمي: مقدار مشخص و ثابتي از DNA مرحله قبل را برداشته و در داخل ميكروتيوب و يا چاهك پليتهاي 96 خانهاي PCR قرار دهيد.
- محلول واكنش آنزيمي را آماده كرده و در آخر آنزيم محدودگر را به اين محلول اضافه كنيد. نسبت مواد موجود در واكنش بهصورت زير است:
DNA 10µg
10X buffer 1X
Restriction enzyme 3.5 U/µl DNA
dd H2O to 30µl
سپس محلول واكنش فوق را در دماي اپتيمم هر آنزيم به مدت حداقل 6 ساعت انكوبه نماييد.
- الكتروفورز ژل آگارز و لكهگذاري ساترن: پس از اتمام زمان انكوباسيون، µl5 از بافر بارگذاري[5]X 6 را به هر كدام از نمونهها اضافه كنيد، سپس همه نمونهها را بر روي ژل آگاروز 0/8% قرار داده و با ولتاژ پائين 5 volt/ cm) به مدت 18-16 ساعت) الكتروفورز نمایید. بر روي هر ژل، نشانگر اندازه DNA[6] نيز قرار دهيد. پس از اتمام الكتروفورز، قطعات DNA را با استفاده از روش لكهگذاري ساترن بر روي غشاي نيتروسلولزي Hybond N+ منتقل كنيد.
- نشاندار كردن[7] كاوشگر: بهمنظور نشاندار كردن كاوشگر با فسفر راديواكتيو (P32)، معمولاً از روش نشاندارسازي تصادفي آغازگر[8] استفاده ميشود.
- دو رگهگيري[9] و اتوراديوگرافي
روش انجام PCR-RFLP
- تكثير قطعه مدنظر با PCR: در اين مرحله مواد موردنیاز آزمايش را به نسبت زير آماده سازيد:
PCR buffer 1X
MgCl2 2.5
DNTPs 200 µM (each)
Forward primer 1 µM
Reverse primer 1µM
Taq DNA polymerase 1 U
DNA template 1–10 ng
برنامه PCR به شرح ذيل به دستگاه ترموسيكلر[10] داده ميشود:
- دناچورهسازي اوليه[11]: C ْ95 به مدت 5 دقيقه
- دناچوره سازي: 95 به مدت 30 ثانيه
- اتصال آغازگر[12]:60-50 درجه سانتیگراد به مدت 30 ثانيه (بستگي به دماي ذوب آغازگرها دارد)
- همانندسازی و طويل شدن[13]: 72 درجه سانتیگراد به مدت 45 ثانيه
- تكرار سه مرحله اخير براي 35 چرخه
- طويل سازي نهايي[14]:72 درجه سانتیگراد به مدت 5 دقيقه
- نگهداري در 4 درجه سانتیگراد
2. هضم با اندونوكلئاز:
a. حدود lµ 10 از محصول PCR را به يك ميكروتيوب منتقل كنيد.
b. محلول واكنش آنزيمي را بهصورت زير آماده سازيد:
Restriction buffer 1ox 2µl
Restriction enzyme 5-10U
dd H2O to 20 µl
- lµ 10 از محلول فوق را به محصول PCR اضافه نمایید.
- ميكروتيوب واكنش را در دماي مناسب آنزيم محدودگر به مدت 3 ساعت قرار دهيد.
3- الكتروفورز
- به نمونه فوق 2 ميكروليتر از بافر بارگذاري X6 را اضافه كنيد، سپس اين محلول را بر روي ژل آگارز 3-2% حاوي اتيديوم برومايد قرار داده و با بافر TBE الكتروفورز را آغاز نمایید.
- با استفاده از نور ماوراءبنفش، باندهاي موجود در ژل را آشكار ساخته و از آن عكس تهيه نمایید.
Mismatch PCR-RFLP
روش CAPS داراي يك محدوديت مهم است، زيرا در اين روش فقط جهشهاي ايجادكننده و حذفکننده محل اثر آنزيم محدودگر مورد شناسايي قرار ميگيرند، در حالی که بيشتر تغييرات تك نوكلئوتيدي هيچ تغييري در نحوه اثر آنزيم محدودگر بهوجود نميآورند. يك تكنيك مشابه به نام dCAPS[15] توسعه يافته است كه در آن آغازگر حاوي يك يا چند نوكلئوتيد بدون رابطه مكملي واتسون- كريك است. اين نوكلئوتيد (ها) وقتي با تك نوكلئوتيد تغییریافته مدنظر همراه شود، موجب ايجاد يا حذف محل اثر يك آنزيم محدودگر ميشود (Neff et al. 1998). بقيه مراحل اين تكنيك مشابه PCR-RFLP است.
آنزیمهای محدودکننده
اندونوكلئازهاي محدودکننده، گروهي از آنزیمهای DNase هستند كه توالي نوكلئوتيدي خاصي را شناسايي میکنند. اين آنزیمها dsDNA را بهصورت اختصاصي يا غیراختصاصی برش میدهند. اين آنزیمها اولين بار در دهه 1950 بهعنوان سیستمهای Restriction و Modification (باکتریها براي جلوگيري از حمله باكتريوفاژها و عناصر ژنتيك خارجي اين سیستمها را بهكار میبرند) كشف شدند. باکتریها توسط سيستم R-M میتوانند DNA بیگانه كه از خارج هنگام عفونت، كانژوگاسيون و ترانسفكشن وارد آنها میشود را تخريب كنند. سيستم R-M باكتريايي معادل سيستم ايمني پروكاريوتي است.
سیستمهای R-M كه در میکروارگانیسمها (باکتریها) يافت میشوند، بسيار گوناگون هستند (حتي در داخل يك سلول). تعداد اين آنزیمها از 2100 فراتر رفته و 17 آنزيم نوع I، 179 آنزيم نوع II و 4 آنزيم از نوع III و همچنین مشخصات 190 متيل ترانسفراز تغییردهنده DNA تعيين و شناسايي شده است.
سیستمهای R-M دو فعاليت آنزيمي دارند:
الف) يك اندونوكلئاز (R.ENase) با جايگاه اختصاصي كه مسئول هضم DNA خارجي است.
ب) يك متيلاز تغییردهنده DNA (متيل ترانسفراز) كه همان توالي ويژه را شناسايي میکند. متيل ترانسفراز (M.MTase) مسئول تغيير و حفظ DNA خودي از هضم شدن توسط R.ENase است. ممكن است فعاليت R و M در يك آنزيم (واحد) كه داراي چند زيرواحد است، قرار داشته باشد و يا از نظر فيزيكي آنزیمهاي جداگانه باشند. علیرغــم اينـــكه آنـــــــــــــــــزیمهاي Restriction و Cognate Modifications سكانس مشابه را شناسايي میکنند، ترادف اسیدآمینه آنها يكسان نيست. شايد اين آنزیمها با مكانيسم متفاوت DNA هدف را شناسايي میکنند.
انواع سیستمهای آنزيمي Restriction – Modification
آنزیمهای محدودگر بر اساس تركيب آنزيم، كوفاكتورهاي موردنیاز، توالي مورد شناسايي و مشخصات هضم DNA به چهار نوع تقسيم میشوند. لازم به ذكر است كه گروه متيلدهنده سوبسترا در تمام متيل ترانسفرازها AdoMet است.
آنزیمهاي R-M نوع I:
مجموعه چند آنزيمي متشكل از زيرواحدهای غيرهمسان به نام R ,M و S هستند. زيرواحد S اختصاصيت را براي M و R تعيين میکند. كوفاكتورهاي اين آنزیمها ATP و +Mg2 هستند و DNA تغییرنیافته را در محلي دور از جايگاه شناسايي و تا اندازهای بهصورت احتمالي (Random) برش میدهند. هیدرولیز ATP قسمتي از فعاليت Restriction اين آنزیمها است و به طريق رقابتي با فعاليت اندونوكلئازي خودش جايگاه اختصاصي DNA هدف را متيله میکنند.
آنزیمهاي R-M نوع II:
اين آنزیمها داراي فعاليت R.ENase و M.MTase جداگانه هستند. R.ENase دايمر بوده و زيرواحدهاي آن همسان است، درصورتیکه M.MTase آنزیمهاي مونومر هستند. R.ENase نوع II براي فعاليت خود فقط به +Mg2 نياز دارد.
R.ENase و M.MTase توالیهای اختصاصي نوكلئوتيدي مشابه را شناسايي میکنند. اكثر R.ENase نوع دوم، DNA را از محل جايگاه شناسايي برش میدهند، ولي تعداد كمي از آنها كه نوع IIS گفته میشوند، DNA را در فاصله معيني از جايگاه شناسايي برش میدهند.
آنزیمهاي R-M نوع III:
اين آنزیمها متشكل از دو زيرواحد غيرهمسان هستند كه براي فعاليت برشی خود به ATP و +Mg2 نياز دارند. اين آنزیمها توالیهای كوتاه غيرپاليندرم را شناسايي كرده و DNA را از جایگاه معين (درصورتیکه در جایگاه شناسايي تغييري ايجاد نشده باشد) برش میدهند. اين آنزیـــــــــــمها ATP را هيدروليز نمیکننــــــــــــــــــــــــــــــــد و براي برش دادن DNA
به AdoMet (S-adenosylmethionine) نياز ندارند، اما AdoMet موجب تحريك فعاليت اندو نوكلئازي آنها میشود.
آنزیمهاي نوع IV:
اين آنزیمها از نظر تكاملي بين آنزیمهاي نوع IIو III هستند. اين آنزیمها (مانند Eco571) متشكل از R.ENae و M.MTase جداگانه هستند، اما R.ENase كه يك آنزيم مونومر است فعاليت متيلازی هم دارد. اين فعاليت متيلازي قدرت كافي ندارد تا DNA ميزبان را در In vivo محافظت كند. R.ENase و M.MTase توالیهای ناقرينه را شناسايي میکنند. R.ENase در حضور +Mg2 در فاصله معيني از جايگاه شناسايي، DNA هدف را برش میدهد (مثلاً Eco571 به فاصله 14/16 نوكلئوتيد از محل شناسايي اين كار را انجام میدهد). فعاليت برشی این دسته از آنزیمها توسط AdoMet تحريك میشود.
سیستمهای Modification يا Restriction مستقل
علاوه بر چهار سيستم آنزيمي كه بحث شد، بعضي از باکتریها سیستمهای ديگري مانند سيستم R مستقل از M و سيستم M مستقل از R دارند. يك مقوله از سیستمهای R-M كه در تكنولوژي نوتركيب اهميت بخصوصي دارد Restriction وابسته به Methylation) MDRS) است كه R.ENase ترجیحاً DNA را در جایگاههای متيله برش میدهد. MDRS متشكل از فرآوردههای ژني است كه به چندين جايگاه مستقل در ژنوم E.coli K12 مانند mcrA, mcrB و mrr متصل هستند.
جدول 2 – طبقهبندی سیستمهای R-M
| گروه آنزیمی | نوع I | نوع II
پروتوتايپ نوع IIS |
نوع III | نوع IV |
| ساختمان فعال R-M | يك آنزيم با سه زيرواحد (R.M.S) | آنزیمهاي جداگانه
R دايمر R مونومر M مونومر M مونومر |
يك آنزيم با دو زيرواحد | آنزیمهاي مونومري جداگانه |
| كوفاكتورها | ATP و +mg2 | +mg2 | ATP و +mg2 | (AdoMet) +mg2 |
| جايگاه شناسايي | غيرقرينه | پاليندرم غيرقرينه | غيرقرينه | غيرقرينه |
| هضم DNA | فاصله متغير از هر طرف | همان جايگاه به فاصله معيني از طرف `3 | 25-27bp از طرف `3 | 14bp از طرف `3 |
| متيلاسيون | دو رشته را بهوسیله M متيله میکند | دو رشته، يك متيل ترانسفراز روي هر رشته | فقط يك رشته | دو رشته |
سیستمهای آنزيمي R-M نوع II:
آنزیمهاي محدودكننده، مخصوصاً نوع II، توالي نوكلئوتيدي منحصربهفردی را شناسايي میکنند. دقت در انتخاب توالي نوكلئوتيدي خاص، تنوع توالي جايگاه شناسايي و آساني نسبي كنترل Restriction با استفاده از M.MTase، آنزیمهاي نوع II را وسیلهای ضروري براي دستكاري DNA نموده است، بهعلاوه توسعه DNA نوتركيب نتيجه كشف آنزیمهاي با جايگاه اختصاصي است.
تاکنون ژن حدود صد سيستم R-M همسانهسازی و تعيين مشخصات شده است. ژن سیستمهای R-M از نظر سازمان، Orientation و اندازه هتروژن هستند. كلونينگ ژنهای آنها خالصسازی آنزيم را آسانتر كرده و آنزيم با خلوص بالاتر تهيه میشود، بنابراين با قيمت كمتر براي استفاده وسیعتر در دسترس قرار دارند. اين كشف موجب شد تا جزئيات مكانيسم واكنش و برخورد DNA-protein در سطح مولكولي مطالعه شود. اغلب R.ENaseها بهصورت تجاري در دسترس قرار دارند و براي ايجاد قطعات DNA، براي كلون كردن ژن، تعيين نقشه DNA و كروموزوم، تعیین توالیDNA و هيبريداسيون بهطور گسترده استفاده میشوند.
نامگذاری آنزیمهاي R-M
1- سه حرف اول (ايتاليك) جنس (اولين حرف جنس باكتري) و گونه (دومين و سومين حرف) ارگانيسم منبع را بيان میکند. مانند Eco براي E.coli و Hin براي هموفيلوس آنفلوآنزا.
2- بعد از سه حرف مذكور حرف اول سويه يا گونه بهصورت غير ايتاليك و يا عدد میآید مانند: EcoK بري Ecoli سويهK ، Hind براي هموفیلوس آنفلوآنزا سويه d يا Sau 3A براي استافيلوكوكوس اورئوس 3A. عناصر خارج كروموزومي مانند ويروس يا پلاسميد به همين صورت متعاقب اسم مذكور آورده میشود مانند: EcoRI و EcoPI.
3- متعاقب آن بدون در نظر گرفتن فاصله، اعداد رومی ( I ,II ,III,…) براي تعيين آنزیمهاي مختلف كه توسط همان سويه توليد میشوند، مانند HindII و HindIII.
4- براي اختصاصي كردن R.ENase يا M.MTase، حروف بزرگ R و M در جلو نشانه آنزيم قرار گرفته و با يك نقطه از آن فاصله میگیرد، مانند: R.EcoRI و M.EcoRI.
جدول 3- كد اسيدهاي نوكلئيك جايگاه شناسايي آنزیمهاي محدودگر
| اسيد نوكلئيك | كد | اسيد نوكلئيك | كد |
| A, C or T | H | G or A | R |
| A, C or G | V | C orT | Y |
| C, G or T | B | A or T | W |
| A, G or T | D | A or C | M |
| G, A, T or C | N | G or T | K |
| C or G | S |
[1] Expressed tag sequences
[2] PCR Base RFLP(PBR)
[3] Cleaved amplified polymorphic sequences
[4] Singe nucleotide polymorphism
[5] loading buffer
[6] DNA size marker
[7] Labeling
[8] Random primer labeling method
[9] Hybridization
[10] Thermo cycler
[11] Initial denaturation
[12] Annealing
[13] Elongation
[14] Final extension
[15] Derived cleaved amplified polymorphic sequence
روشهای عملی در Time PCR – Real قسمت5
نشانگرهای مولکولی و تكنيكهاي نقشهبرداري ژنومي و انگشتنگاري DNA
تشخیص سریع عوامل میکروبی با بیوسنسورها (قسمت اول)
تست بتا دو- میکروگلوبولین (beta-2-M)
برای دانلود پی دی اف برروی لینک زیر کلیک کنید
ورود / ثبت نام