نقش Quorum sensing در باکتریها
(بخش دوم)
لیلا دهاقین
فوقلیسانس بيماريشناسي گياهي – دانشآموخته دانشگاه تربيت مدرس
در بخش قبلی، در مورد مفاهیم و ساختار Quorum Sensing(Q.S) در باکتری بحث گردید. در این مقاله در خصوص نقش Quorum Sensing در باکتریهای گرم مثبت و تنظیمکنندههای این پدیده در باکتریها مطالبی ارائه میگردد.
Quorum sensing در باکتریهای گرم مثبت
مشابه باکتریهای گرم منفي، در باکتریهای گرم مثبت نيز برخي از پروسههای سلولي از طریق يك روش وابسته به تراكم سلولي يا وابسته به مرحله رشدی تنظيم ميشوند. موارد چنين روش تنظيم ژني در باکتریهای گــــرم مثبت شامل ايجاد Genetic competence در باكتــــــري Bacillus subtilis و Streptococcus pneumoniae، بیماریزایی در Staphylococcus aureus و توليد پپتيدهاي ضدميكروبي (Antimicrobial peptides, AMP) توسط تعدادي از گونههای باكتريايي گرم مثبت مثل باکتریهای مولد اسيد لاكتيك است.
روش تنظيم وابسته به تراكم سلولي در باکتریهای گرم مثبت يك طرح كلي و مشترك دارد. با این وجود نه پروسههای تنظيمي وابسته به تراكم سلولي كه در مقاله قبلی اشاره شد و نه هيچكدام از ساير پروسههای تنظيمي شناختهشده در باکتریهای گرم مثبت دربرگيرنده مولكولهاي سيگنال شبيه N –آسيل هموسرين لاكتون وابسته به سيستم دوبخشی LuxI-LuxR ميباشند. گاما- بوتيرولاكتون (همولوگ ساختاري AHL) تنها استثناء ميتواند باشد كه بهعنوان يك مولكول تنظيمي كليدي در تنظيم توليد آنتیبیوتیک و تمايزيابي در گونههای استرپتومايسس عمل ميكند. طرح كلي تنظيم وابسته به تراكم سلولي در باکتریهای گرم مثبت بهصورت زير است (شکل1):
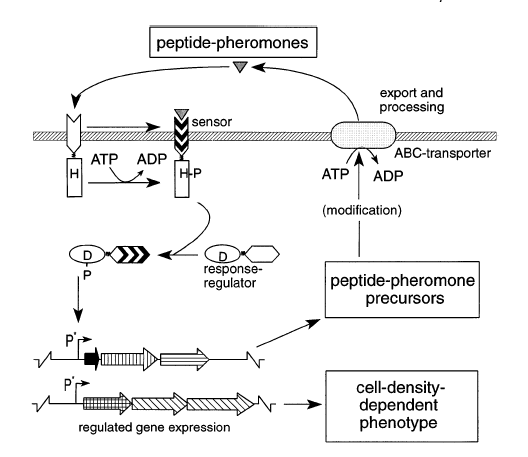
شکل 1: بيان شماتيكي از مدلي براي ساختار مولكولي درگير در Q.S كه از طريق سیگنالهای پپتيدي و سیستمهای تنظيمي دوبخشی در باکتریهای گرم مثبت كنترل میشود
مولكول سيگنال در اينجا يك پپتيد پردازششده بعد از ترجمه است كه توسط يك كاست متصلشونده به ATP، بهطور اختصاصي به خارج از سلول فرستاده ميشود. اين پپتيد صادرشده توسط دومين ورودي يك مولكول حسگر تيپيك كه خود بخشي از سيستم انتقالدهنده سيگنال دوبخشی است، تشخيص داده میشود. اين سیستمهای تنظیمکننده دوبخشی از يك حسگر و پروتئين تنظیمکننده پاسخ تشكيل شدهاند. پروتئين تنظیمکننده پاسخ از فسفوريلاسيون بهعنوان وسیلهای جهت انتقال اطلاعات استفاده ميكند و به اين ترتيب يك مكانيسم مهم جهت انتقال اطلاعات در باکتریها محسوب ميشود و يك نقش كليدي در ايجاد تغييرات فيزيولوژيكي در سلول به دنبال تغييرات محيطی دارد. يك ويژگي مشترك ديگر در بسياري از سیستمهای Q.S مذکور اين است كه ژنهای كدكننده پيشساز پپتيد و نيز ژنهایی كه پروتئینهای دخيل در سيستم تنظيمي دوبخشی را كد ميكنند و آنهايي كه در تغييرات پسترجمهای پيشساز و صادر كردن آن به خارج از سلول نقش دارند همه در سطح رونويسي به هم متصلند و پروسه سنتز پپتيد، يك پروسه خودتنظیمی است.
در اينجا سازماندهی ژنتيكي و نيز فاكتورهاي دخيل در بروز genetic competence در باكتري B.subtilis بهعنوان نمونهای از فنوتيپهاي كنترلشونده بهواسطه Q.S در باکتریهای گرم مثبت مطرح ميشود (شکل 2).
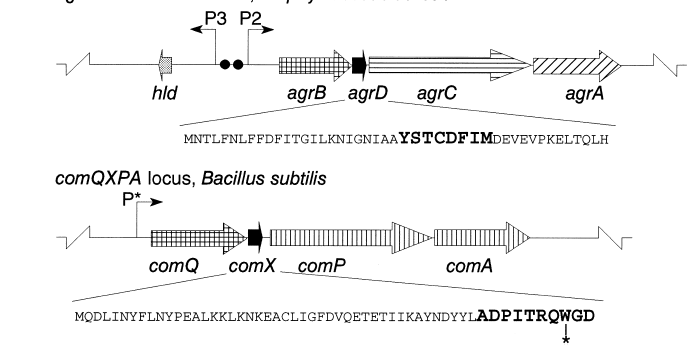
شکل 2: بيان شماتيكي سازماندهی ژنتيكي لوكوس comQXPA در باكتري B. subtilis
ژن كدكننده پپتيد پيشساز با رنگ سياه و اسیدآمینه تريپتوفان كه در توالي پپتيد پيشساز تغيير ميكند با ستاره مشخص شده است. P: Promoter
صفت genetic competence طبيعي، توانايي سلولهای باكتري براي جذب DNA خارجي است. در يك محيط كشت B. subtilis كه تحت شرايط مناسب رشد يافته و به تراكم بالاي سلولي رسیدهاند، بخشي از سلولها تمايز پيدا كرده و Competent ميشوند. اين سلولهای Competent از نظر متابوليكي فعاليت كمتري داشته و تعدادي پروتئين توليد ميكنند كه ميتوانند به قطعات DNA، مستقل از توالي نوكلئوتيدي آنها متصل شده و آنها را جذب كنند. توليد اين سيستم جذبکننده DNA، وابسته به حضور فاكتور رونويسي Competence به نام ComK است. توليد ComK تحت کنترل خودتنظيمي قرار دارد. فعاليت تشدیدکننده رونويسي که توسط ComK اعمال میشود در طول مرحله رشد لگاريتمي با واکنش مستقيم MPca و MecB با ComK مهار میشود. اين مهار میتواند بهوسیله پروتئين کوچک ComS برداشته شود. سنتز پروتئين ComS در پاسخ به تجمع يک پپتيد تغییریافته در محيط کشت سویههای B. sutilis صورت ميگيرد، زمانی که تراکم سلولي آنها بالا میرود. پيشساز اين پپتيد بهوسیله ژن comX کد میشود. تغييرات پسترجمهای پپتيد روي تنها اسیدآمینه تريپتوفان موجود در پپتيد اعمال میشود. اين کار احتمالاً توسط محصول ژن comQ انجام ميگردد. پاسخ سلول باکتري به پپتيد مشتقشده از comX (يعني سنتز ComS) بهوسیله يک پروتئين حسگر به نام ComP و يک تنظیمکننده پاسخ به نام ComA که به ترتيب محصولات ژنهای comP و comA هستند، ميانجيگري ميشود.
ComP بهعنوان يک حسگر براي پپتيد مشتقشده از comX عمل کرده و رونويسي از comS را از طريق انتقال سيگنال به ComA فعال ميکند و نهايتاً از طريق ComK باعث ايجاد genetic competence ميگردد.
آرايش مسيرهاي Quorum Sensing چندگانه
برخي از باکتریها داراي چندين مسير Q.S هستند. با وجود اينکه سیگنالهای Q.S چندگانه و مسيرهاي پاسخ آنها بهخوبی شناختهشدهاند، اما عملکردي که به شکل هماهنگشده در باکتریهای مختلف تنظيم میکنند هنوز کاملاً مشخص نشده است. مدل مهمي که در حال توسعه است پيشنهاد ميکند که مسيرهاي Q.S مختلف در يک باکتري لزوماً غيروابسته و کاملاً مجزا از هم نيستند، بلکه میتوانند با هم در ارتباط باشند تا باکتري در زمان رويارويي با سیگنالها و محیطهای مختلف بتواند بهترين پاسخ را بدهد.
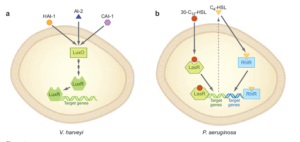
مســـــيرهاي Q.S چنـــــــــدگانه در باکتــــــــریهای مختلف میتوانند آرایشهای متفاوتي داشته باشند؛ براي مثال مســيرهاي پاسخ به ســـه سيگنال AI شــــامل HAI-1 (harveyi autoinducer 1)، CAI-1 (cholera autoinducer 1) و (AI-2) در V. harveyi بهصورت موازي آرايش یافتهاند (شکل 3)، بهطوری که هر مسير میتواند مستقلاً بهوسیله سيگنال متفاوتي فعال شود. در عين حال هر سه آنها در تأمين سیگنالها براي مسير مشترک و فنوتيپهاي مشترک (مثل بيولومينسانس) همسو میشوند. در V. harveyi، پروتئين LuxO واسطهاي است که از طريق آن هر سه سيستم Q.S اثر خود را اعمال میکنند. از آنجا که اين نوع آرايش باعث میشود تا سلولها پاسخهایشان را نسبت به سیگنالهای مختلف هماهنگ کنند، براي سلول باکتري مفيد است. علاوه بر اين وجود چندين مسير Q.S موازي و نياز به حضور چندين سيگنال میتواند پاسخهای Q.S را بهشدت تنظيم کند، بهطوری که فعال شدن غیراختصاصی پاسخهای سلولي به حداقل برسد.
برخلاف V. harveyi، در باکتري Pseudomonas aeruginosa مسيرهاي Q.S Rhl و Las جداگانه آرايش یافتهاند، بطوريکه هر سيستم Q.S بيان سریهای متفاوتي از ژنها را تنظيم ميکند. در تراکم سلولي بالا ابتدا سيستم Las تحريک شده و باعث سنتز مولکول سيگنال 3-oxo-C12-HSL میشود. اين سيگنال به گيرنده خود (LasR) متصل شده و آن را فعال میکند.
LasR فعالشده نيز بيان برخي ژنها از جمله LasI را از طريق بازخورد مثبت افزايش میدهد. ژنهای هدف LasR عبارتند از آنزيم AI سنتاز (RhlI) و تنظیمکننده مربوط به سيستم (Q.S Rhl RhlR) که فعال شدن LasR منجر به سنتز يک سيگنال AI متفاوت و فعال شدن سيستم Q.S دوم میگردد. از آنجا که سيستم Las قبل از فعال شدن سيستم Rhl فعال میشود به نظر میرسد که سیستمهای Q.S در P. aeruginosa به شکل سري آرايش یافتهاند.
البته بايد اضافه کرد که همه سیستمهای Q.S چندگانه بهصورت پيوسته عمل نميکنند. نشان داده شده است که برخي از سیستمهای Q.S با هم مقابله ميکنند؛ براي مثال در باکتري Bacillus subtilis يک سيگنال پپتيد (ComX) شروع genetic competence را تنظيم ميکند در حاليکه سيگنال دوم (CSF) با سيگنالدهي ComX تداخل کرده و اسپورسازي را تحريک ميکند.
شکل 3: چندين مسيرQuorum sensing در V. harveyi به شکل موازي و دو مســير مهم در P. aeruginosa به شکل سري آرايش یافتهاند (توضيح بيشتر در متن)
تنظیمکنندههای منفي Quorum Sensing
چند نوع تنظیمکننده منفي Q.S وجود دارند که عبارتند از:
- پروتئینهای غیرفعال كننده
- همولوگهاي تنظیمکنندههای رونويسي
- آنزیمهای تجزیهکننده AHL
- تنظيم منفي وابسته به mRNA
در اينجا به دو مورد از آنها اشاره ميشود:
1- پروتئینهای غیرفعال كننده: در باكتري tumefaciens، فعاليت پروتئين تنظیمکننده Q.S به نام TraR بهوسیله چندين پروتئين غیرفعال كننده Q.S، آنتاگونيزه ميشود. پروتئين TraM يكي از اين نوع پروتئینهاست كه توسط پلاسميد Ti در A. tumefaciens كد ميگردد. فعاليت مهاري TraM روي TraR بیشک براي عملكرد طبيعي سيستم Q.S در باكتري مذكور موردنیاز است. سيستم Q.S Tra، انتقال پلاسميد از طريق كانجوگاسيون و ژنهای تكثيري را در A. tumefaciens تنظيم ميكند. يك موتانت TraM به ميزان زيادي دچار كونجوگاسيون ميشود و باعث انتقال پلاسميدهاي Ti با كارايي بالا به سلولهای دریافتکننده، حتي در تراكم پايين سلولهای باكتريايي میگردد، بنابراين نقش اصلي TraM تنظيم فعاليت كمپلكس AHL-TraR است، بهصورتي كه اين كمپلكس تنها بهشرط رسيدن به يك حد خاص به شكل كارآمد عمل كند.
2- آنزیمهای تجزیهکننده AHL يا خاموشکنندههای Quorum Quenchers/Q.S
آنزيم attM حلقه لاكتون را در 3-oxo-C8-HSL (همولوگ AHL كه توسط باكتري A. tumefaciens در سيستم Q.S Tra توليد ميشود) هيدروليز ميكند. بيان attM بهوسیله يك پروتئين بازدارنده كه توسط ژن attj كد ميشود در مرحله رشد لگاريتمي مهار ميگردد و به اين ترتيب اجازه تجمع AHLها و كونجوگاسيون كارآمد را در مرحله رشد لگاريتمي به باكتري ميدهد. در بدو ورود به مرحله ايستايي، AHL بهسرعت تجزيه ميشود كه این امر در هماهنگي با بيان زیاد attM در مرحله رشد ايستايي همراه است.
در باکتریهای گرم منفي آنزیمهای مختلفی مشخص شدهاند كه تجزیهکننده AHL میباشند و براي كنترل فنوتيپهاي باكتريايي تنظيمشونده بهواسطه Q.S مورد استفاده قرار ميگيرند. البته برخي از باکتریهایي كه AHL توليد نميكنند نيز آنزیمهای تجزیهکننده AHL را ميسازند تا از اين مولکولها بهعنوان منبع كربن و نيتروژن استفاده كنند. تجزيه و غیرفعال شدن AHLها همچنين باعث خالي شدن سريع سیگنالهای Q.S شده و بنابراين تضمینکننده اين مسأله است كه غلظت AHLها در محيط، نشانگر صحيح تراكم جمعيت باكتريايي است.
اختصاصيت سیگنالهای AI
يك ويژگي مهم سيگنالدهي بهواسطه AIها در Q.S، درجه بالاي اختصاصيت سيگنال AI به گيرنده مربوطهاش (پروتئين شبه LuxR) ميباشد، از اين رو تركيب و ساختار سیگنالها در حفظ ويژگي سيگنالدهي مهم است. مطالعات ساختاري نشان ميدهد كه ايجاد تغيير در طول ساختار و جايگزينيها در گروههای زنجيره جانبي آسيل AI میتواند به اتصال مابين AIها و پروتئینهای شبه LuxR آسيب بزند. اختصاصيت آنزيم سيگنال سنتتاز به بخش زنجيره جانبي AI تضمين ميكند كه تنها انواع ويژهاي از سیگنالها در گونههای مختلف سنتز شوند. براي مثال همولوگهاي LuxI شامل EsaI و LasI از دو گونه مختلف باكتريايي به ترتيب 3-oxo-C6-HSL و 3-oxo-C12-HSL را سنتز ميكنند و اين اختصاصيت وابسته به واحدهاي آمينواسيدي خاص در جايگاه اتصالي آنزيم است كه محل اتصال زنجيره جانبي است. اگر نوع اسيدهاي آمينه در جايگاه مذكور تغيير كنند، آنزيم سيگنال سنتاز يك مولكول acyl-HSL ديگر با طول متفاوت زنجيره جانبي سنتز خواهد كرد.
اين مطلب نشان ميدهد كه دامنه سیگنالهای توليدي در هرگونه باكتريايي بهشدت تنظيم میگردد. روش تنظيمي مشابهي براي اختصاصيت سیگنالهای پپتيدي در مورد باکتریهای گرم مثبت بكار گرفته ميشود. اكثريت سیگنالهای مذكور يك پپتيد مركزي دارند كه توالي آن حفاظتشده نيست و میتواند توسط باکتریهای گرم مثبت مختلف به اشكال متفاوت تغيير داده شود. اختصاصيت در مرحله تشخيص سيگنال هم مشابه باکتریهای گرم منفي اعمال میشود؛ به اين ترتيب كه هر سيگنال به حسگر كيناز خاص خود كه در سطح سلول قرار گرفته است متصل میگردد.
علیرغم وجود محدودیتهای ساختاري و محدودیتهای مربوط به مكانيزمهاي تنظيمي كه بهمنظور ايجاد اختصاصيت در Q.S اعمال ميشوند، سيگنالدهي غیراختصاصی در هر دو باکتریهای گرم منفي و گرم مثبت مشاهده شده است.
ارتباطات وابسته به سيگنال غیراختصاصی شامل تشخيص سيگنال تولیدشده توسط باكتري متفاوت و يا ايجاد تداخل در پردازش سيگــــنال از طريق رقابت اســت. يك مثال براي مورد اول در باکتریهای Pseudomonas aeruginosa و Burkoholderia cepacia مطرح است؛ به اين ترتيب كه هموسرين لاكتونهاي تولیدشده توسط P. aeruginosa در غلظتهای پايين توسط B. cepacia تشخيص داده ميشود و باعث فعال شدن سيستم Q.S آن ميشود، اگرچه P. aeruginosa توانايــــــــي استفاده از acyl-HSLهاي تولیدشده توسط B. cepacia را جهت فعال كردن سيستم Q.S خود ندارد. نبود اختصاصيت در سيگنالدهي همچنين در باكتري گرم مثبت Staphylococcus aureus مشاهده شده است. اين مشاهدات نشان ميدهند كه تداخل بر پايه Q.S ميتواند توسط يك پاتوژن براي ايجاد niche ويژه برای خود در طول آلودگي بكار گرفته شود؛ يعني فقط يك استرين كه سيگنال پپتيد خاصي را توليد ميكند ميتواند رقابت كرده و در آن محيط خاص بقاء پيدا كند. بايد اضافه كرد كه تمامي مكالمات بهواسطه سيگنال مابين گونهها غیراختصاصی نيستند چرا كه بسياري از گونههاي باكتريايي همچنين سيگنالهايي توليد ميكنند كه به شكل اختصاصي براي سيگنالدهي با ساير گونههای باكتريايي مورد استفاده قرار ميگيرند. از آنجا كه باکتریها اغلب در اجتماعات چندگونهای زندگي ميكنند، بنابراين ارتباط و هماهنگي (مثل هماهنگي متابوليكي) بين گونههای مختلف براي ايجاد و تداوم بقاء يك جمعيت ميكروبي ضروري ميباشد. تاكنون تنها يك سيگنال شناسايي شده است كه بهعنوان يك سيگنال مكالمه بينسلولي مابين گونهها عمل ميكند. اين سيگنال AI-2 نام دارد و توسط ژن luxS كد ميشود. ژن مذكور در بيش از 55 گونه باكتريايي (شامل باکتریهای گرم مثبت و گرم منفي) شناسایی شده است.
منابع:
Parkinson, J. S., and Kofoid, E. C. (1992). Communication modules in bacterial signaling proteins. Annual Review of Genetics, 26: 71-112.
Grossman, D. A. (1995). Genetic network controlling the initiation of sporulation and the development of genetic competence in Bacillus subtilis. Annual Review of Genetics, 29: 477-508.
Gera C, Srivastava s. quorum – sensing: the phenomenon of microbial communication. Current Science. 2006;90(5):666-76.
Fuqua, C., Parsek, M. R. and Greenberg, E. P. (2001). Regulation of gene expression by cell-to-cell communication: acyl-homoserine lactone quorum sensing. Annual Review of Genetics, 35: 439–468.
Visick, K. L. and McFall-Ngai, M. J. (2000). An exclusive contract: specificity in the Vibrio fischeri–Euprymna scolopes partnership. Journal of Bacteriology, 182: 1779–1787.
Finney, A. H., Blick, R. J., Murakami, M., Ishihama, A. and Stevens, A. M. (2002). Role of the C-terminal domain of the alpha subunit of RNA polymerase in LuxR dependent transcriptional activation of the lux operon during quorum sensing. Journal of Bacteriology, 184: 4520–4528.
Shadel, G. S. and Baldwin, T. O. (1992). Identification of a distantly located regulatory element in the luxCD gene required for negative autoregulation of the Vibrio fischeri luxR gene. Journal of Biological Chemistry, 267: 7690–7695.
Bassler, B. L. (2002). Small talk: cell-to-cell communication in bacteria. Cell 109: 421–24.
Abraham, W. R. (2006). Controlling biofilms of gram-positive pathogenic bacteria. Current Medicinal Chemistry, 13: 1509–1524.
Andersson, R. A., Koiv, V., Norman-Setterblad, C. and Pirhonen, M. (1999). Role of RpoS in virulence and stress tolerance of the plant pathogen Erwinia carotovora subsp. carotovora. Microbiology, 145: 3547–3556.
Bainton, N. J. (1992b). A general role for the lux autoinducer in bacterial cell signalling: control of antibiotic synthesis in Erwinia. Gene, 116: 87–91.
Bainton, N. J., Stead, P., Chhabra, S. R., Bycroft, B. W., Salmond, G. P. C., Stewart, G. S. A. B. and Williams, P. (1992a). N-(3-oxohexanoyl)-L-homoserine lactone regulates carbapenem antibiotic production in Erwinia carotovora. Biochemical Journal, 288: 997–1004.
Coulthurst, S. J., Lilley, K. S. and Salmond, G. P. C. (2006). Genetic and proteomic analysis of the role of luxS in the enteric phytopathogen, Erwinia carotovora. Molecular Plant Pathology, 7: 31–45.
Day, W. A. and Maurelli, A. T. (2001). Shigella flexneri LuxS quorum sensing system modulates virB expression but is not essential for virulence. Infection and Immunity, 69: 15–23.
De Keersmaecker, S. C., Sonck, K. and Vanderleyden, J. (2006). Let LuxS speak up in AI-2 signaling. Trends in Microbiology, 14: 114–119.
Zhao J, Quan C, Jin L, Chen M. Production, detection and application perspectives of quorum sensing autoinducer-2 in bacteria. J Biotechnol. 2018 20;268:53-60.
Defoirdt T. Quorum-Sensing Systems as Targets for Antivirulence Therapy. Trends Microbiol. 2017 . pii: S0966-842X(17)30232-9.
Banerjee G, Ray AK. The talking language in some major Gram-negative bacteria.Arch Microbiol. 2016;198(6):489-99.
نقش Quorum sensing در باکتریها (1)
نقش Quorum sensing در باکتریها (2)
نقش Quorum sensing در باکتریها (قسمت اول)
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام