نقش Quorum sensing در باکتریها
(قسمت اول)
دکتر رضا میرنژاد (دانشیار دانشگاه) – وهاب پیرانفر (کارشناسی ارشد)
مقدمه
باکتریها در زندگی دستهجمعی و اجتماعی برای اینکه بیشترین فایده را از محیط رقابتی خود ببرند از مکانیسم تنظیمی ژنتیکی ارتباطی بنام Quorum sensing (QS) یا درک حدنصاب استفاده میکنند. Quorum در لغت به معنای تجمع یا تعداد ثابت از گروهی از هر شیئی است و QS در میکروبها به معنای آگاهی از وجود تعداد باکتری و اجتماع خود میباشد. QS در تمام باکتریها (پاتوژن و غیرپاتوژن) موجب تنظیم فعالیت سلول در سازگاری سریع با تغییرات محیطی جهت حفظ و بقای باکتری در محیط میشود. همچنین QS در فرار باکتری از سیستم ایمنی بدن نقش دارد. در این مقاله، به بررسی وجود QS در باکتریهای گرم منفی و مثبت و نقش آن در پاتوژنز بعضی از عوامل بیماریزای مهم پرداخته شده است و در ادامه به عوامل تجزیهکننده این مولکولها در پروکاریوتها و یوکاریوتها اشاره میشود. امید میرود که با استفاده از آنتاگونیستها و آگونیستها بتوان بسیاری از عوامل عفونی خطرناک را کنترل نمود.
تاریخچه شناخت QS
برای اولین بار در سال 1970، QS در باکتری ویبریو فیشری (Vibrio fischeri) مشاهده شد. محققان مشاهده کردند که این باکتری گرم منفی که بهصورت آزادزی در دریاها و اقیانوسها زندگی میکند در تعداد کم، تولید آنزیم لوسیفراز )که سبب تولید نور میشود) نمیکند، ولی هنگامیکه این باکتری از سوراخهای اندامهای نورانی (Saqid) ماهیهای دریایی یا سفالوپودها (مانند Euprymna scolopes) وارد حفرههای این اندامها شده در آنجا تکثیر مییابد و پس از افزایش تعداد باکتری، QS فعال و باعث میشـــــود که ژن لوسیفراز فعال و پدیده لومینانس رخ دهد. به دلیل اینکه Saqid در طول روز، حدود 95 – 90 درصد از باکتریهای خود را از دست میدهد، لذا در این مدت از خود نوری تولید نمیکند، ولی بایستی تا شب حدود 11/ml10 باکتری را به خود جذب نماید تا بتواند در شب نور تولید کرده و آسیب نبیند.
مکانیسمهای پیامرسانی در پروکاریوتها
پروکاریوتها برای پیامرسانی سلول به سلول از مکانیسمهای متفاوتی مانند تولید فرمونهای پپتیدی، پپتیدهای تغییریافته، QS و فعال کردن کینازهای داخل سلولی استفاده میکنند. در جدول زیر مکانیسمهای پیامرسانی و نقش آن در روندهای مختلف باکتریها نشان داده شده است. همانطورکه ملاحظه میشود QS و فرمونهای پپتیدی در واکنش خودالقایی در تعداد زیادی از باکتریها نقش دارند.
جدول 1: گفتگوی باکتریها با یکدیگر با مکانیسمهای متفاوت پیامرسانی سلول به سلول
|
روند یا مکانیسم باکتری |
مولکول پیامرسان |
| اسپورزائی و تشکیل جسم سخت در میکسوکوکوس گزانتوس | فرمون پپتیدی |
| کونجوگیشن در انتروکوکوس فکالیس | فرمون پپتیدی |
| تمایز مورفوژنز در استرپتومایسس کوئیکولار | پپتیدهای اصلاحشده |
| رفتار خودالقایی در تعدادی از باکتریها | اسیل هموسرین لاکتون (AHLs)، فرمون پپتیدی |
میکسوکوکوس گزانتوس (Myxococcus xanthus)، نوعی باکتری گرم منفی موجود در خاک میباشد، هنگامی که در شرایط گرسنگی و فقر غذایی قرار میگیرد تغییرات مورفوژنز از خود نشان داده و لایههای پلیساکاریدی را در خارج خود انباشته و حالت کیست را بوجود میآورد که به آن میکسوسپور گویند. اگر باکتری مجدداً در شرایط مناسب رشد قرار بگیرد این لایهها برداشته شده و باکتری تکثیر مییابد. این مراحل تمایز بهوسیله پیامهای خارج سلولی با تولید پپتیدهای کوچک KD17 صورت میگیرد. همچنین باسیلوس سوبتیلیس (باسیل گرم مثبت موجود در خاک)، دو پپتید متفاوت تولید میکند که برای مستعد شدن (Competence) جهت ترانسفورماسیون و تشکیل اسپور آن ضروری میباشد.
Quorum sensing در باکتریهای گرم منفی
همانطورکه در بالا اشاره شد مفهوم QS برای اولین بار در باکتریهای گرم منفی مورد بحث قرار گرفت. باکتریهای گرم منفی چه پاتوژن و چه غیرپاتوژن، مولکولهایی از خود ترشح میکنند که در پدیدههای مختلف ازجمله تولید بیوفیلم، بیماریزایی، حرکت، تولید آنتیبیوتیک، لومینانس و انتقال پلاسمید میتوانند نقش داشته باشد. Quorum sensing در پاتوژنز باکتریهای مانند سودوموناس آئروژینوزا، بورخورلدریا سپاشیا، سالمونلا تیفیموریم، یرسینیا انتروکولیتیکا، اشریشیا کلی، ویبریوکلرا، گونههای سراشیا، اروینیا و غیره نقش دارد.
Quorum sensing در باکتریهای گرم مثبت
در باکتریهای گرم مثبت همانند باکتریهای گرم منفی، QS در پاتوژنز، تولید آنتیبیوتیک، بیوفیلم و غیره نقش دارد، ولی مولکول و ساختمان QS در باکتریهای گرم مثبت با گرم منفی با هم تفاوت دارند. در گرم مثبتها بیشتر مولکولهای پپتیدی اکتا یا هپتا که فرمون نامیده میشوند در انتقال پیام نقش دارند. این مولکولها که هیدروفوب میباشند دارای وزن مولکولی کم (m11-10´5) هستند و در هر سلول حداقل دو مولکول از این پپتیدها با فعالیت بیولوژیک وجود دارد. مطالعه با آگونیست گیرندهها نشان میدهد که سیستم پیامرسانی این مولکولها مشابه سیستم پیامرسانی سیـــــتوکینها در یوکاریوتها است. Quorum sensing در باکتریهای مختلف گرم مثبت ازجمله استافیلوکوکوس ارئوس، باسیلوسها و اکتینومیستها مشاهده و مورد بررسی قرار گرفته است.
انواع مولکولهای Quorum sensing
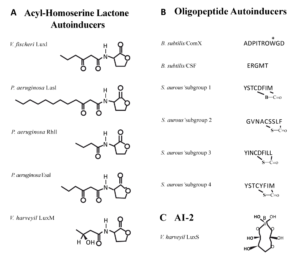
بجز در مواردی، باکتریها با خودالقاهای (Autoinducers= AI) مشابه با یکدیگر ارتباط برقرار میکنند و بدلیل اینکه هر باکتری به خودالقای گونه مشابه خود پاسخ میدهد، لذا انواع مختلفی از خودالقا در باکتریها موردبحث قرار گرفته است. مهمترین سیگنال ارتباطی سلول به سلول که برای اولین بار در باکتری کشف شد، اسیل هموسرین لاکتون (AHL= Acyl homoserine lactone) میباشد که تنها در باکتریهای گرم منفی تولید شده و دارای یک حلقه لاکتون و زنجیره جانبی در ساختمان خود است (شکل 1). باکتریهای مختلف مولکولهای AHL متفاوت تولید میکنند که تفاوت آنها بیشتر در زنجیره جانبی میباشد. لازم بذکر است که زنجیره جانبی و حلقه لاکتون برای فعالیت QS ضروری بوده و هرگونه تغییری در آنها (ایجاد باندهای غیراشباع یا تشکیل گروههای حجیم)، فعالیت خودالقا را تحتتأثیر قرار میدهد؛ مثلاً اگر در ویبریو فیشری در حلقه لاکتون از هموسستئین بجای هموسرین استفاده شود میزان فعالیت خودالقا کاهش مییابد.
در باکتریهای گرم منفی مولکولهای زیر بهعنوان سیگنال ارتباط سلول به سلول مورد استفاده قرار میگیرند: اسیل هموسرین لاکتون، تیولاکتون حلقوی(AIP)، هیدروکسیل پالمیتیک اسید متیل استر (PAME)، متیل فورانوزیل بورات (AI-2) و متیل دودیکانوئیک اسید (DSF).
لازم به ذکر است که QS تنها محدود به پروکاریوتها نبوده و در یوکاریوتها بهخصوص قارچها این مولکولها تولید شده و در پاتوژنز آنها نقش دارد، مثلاً کاندیدیا البیکنس با تولید اسید فورانوزئیک (FA)، تبدیل حالت فرم مخمری به فرم میسیلیومی را که نقش مهمی در بیماریزایی خود دارد کنترل میکند.
شکل 1: ساختمان انواع مختلف خودالقاها (AI) در باکتریهای گرم منفی و مثبت
مکانیسم مولکولی پیامرسانی Quorum sensing
بهطورکلی QS برای انتقال پیام نیاز به دو پروتئین ProI (خودالقا) و ProR (عامل نسخهبرداری و گیرنده) دارد (شکل 2). همانطورکه مشاهده میشود سیستم پیامرسانی توسط ژنهای i و r کنترل شده و ژنهای دخیل در بیماریزایی توسط کمپلکس پروتئین R-I کنترل میگردد، همچنین کمپلکس R-I، نسخهبرداری ژنهای کدکننده ProI و ProR را با مکانیسم تنظیمی فیدبکی فعال یا غیرفعال میکند. وقتی در این سیستم میزان ProI در محیط زیاد شد با اتصال به ProR که عامل نسخهبرداری میباشد سبب افزایش تولید AI میگردد.
شکل (2): مولکولهای درگیر در پیامرسانی توسط QS
در باکتریهای مختلف همولوکوس ProI و ProR متفاوت میباشد که در جدول زیر نشان داده شده است.
جدول (2): ژنهای درگیر و عملکرد آنها در پیامرسانی باکتریهای مختلف
|
ارگانیسم |
همولوکوس
ProI |
همولوکوس
ProR |
عملکرد تنظیمشده |
| ویبریو فیشری |
LuxI
|
LuxR |
بیولومینانس |
|
اگروموباکتریوم توموفاسینس |
TraI
|
TraR
TraR
|
کونجوگیشن
غیر مشخص |
| کروموباکتریوم ویولاسوم پروتئاز | CviI
|
CviR
|
تولید پیگمانت ویولاسین، همولیزین و اگزوآنزیم |
|
اروینیا کارتوورا
|
ExpI(carI)
|
ExrR
CarR
|
تولید آنتیبیوتیک کارباپنم
|
| اروینیا استوارتی
|
EsaI
|
EsaR
|
تولید اگزوپلیساکارید کپسولی
|
|
سراشیا لیکوفاسینس
|
SwrI
|
– | تمایز سلولی
|
| اشریشیا کلی | – | SdiA |
تقسیم سلولی |
|
سودوموناس آئروژینوزا |
LasI
RhiI |
LasR
RhiR |
الاستاز، اگزوتوکسین و دیگر عوامل بیماریزایی |
Quorum sensing در ویبریو فیشری
همانطورکه در بالا اشاره شد، این باکتری بهصورت آزادزی در دریاها و اقیانوسها زندگی میکند و به مقدار کم مولکول خودالقا (AHL) را به محیط ترشح میکند. هنگامیکه این باکتری وارد اندامهای نورانی سفالوپودها میشود، در آنجا تجمع یافته و در غلظت 1011 در هر میلیلیتر، خودالقا (AHL) تولید مینماید که این مولکول، ژن لوسیفراز را فعال و در شب نور تولید میکند. در این باکتری LuxI همولوکوس ProI و LuxR همولوکوسProR است. وقتی این دو پروتئین تولید شدند با همدیگر کمپلکس R-I را تشکیل داده که علاوه بر کنترل و تولید LuxI و LuxR روی ژنهای تولیدکننده نور دخالت دارند (شکل 3).
شکل 3: ساختار ساده QS در ویبریو فیشری
Quorum sensing در ویبریوکلرا
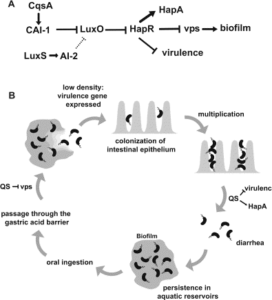
ویبریوکلرا با تولید اگزوتوکسین (کلراتوکسین) سبب بیماری وبا میشود. این باکتری دارای یک رگولون بیماریزایی متشکل از 20 ژن درگیر در استقرار، تولید و ترشح سم و ژنهای موردنیاز برای زنده ماندن در سلولهای میزبان میباشد. این رگولون توسط ژنهای تنظیمکننده رونویسی toxT ,tcpP/I ,toxR بهصورت آبشاری کنترل میشود. این تنظیمکنندهها به عوامل خارجی چون دما، pH، فشار اسمزی و غیره پاسخ میدهند. همچنین امروزه مشخص شده که QS در تنظیم ژنهای فوق دخالت دارد (شکل 4).
شکل (4): نقش QS در استقرار ویبریو کلرا در روده و ایجاد بیماری وبا
در ویبریو کلرا، QS دارای دو سیستم است که در هر سیستم یک نوع مولکول دخالت دارد (شکل 4). در سیستم یک، مولکول CAI-1 و در سیستم دو به فارنسیل بورات دیاستر (AI-2) پاسخ میدهد. این دو سیستم فعالیت پروتئین تنظیمی مشترک بنام LuxO را تنظیم میکنند. در غلظت کم سلول ویبریو کلرا، LuxQ و CqsS که خاصیت کینازی دارند با خاصیت اتوفسفریلاسیون، خود را فسفریله کرده و بدنبال فعال شدن آنها، LuxO را فسفریله کرده که فرم LuxO فسفریله، 54δ را فعال مینماید. با فعال شدن فاکتور δ، نسخهبرداری از ژن مهاری hapR {یک تنظیمکننده مثبت ژن hap (هماگلوتیناسیون/پروتئاز)} صورت میگیرد که با تولید عامل مهاری، ژن hapR بیان نشده و ژنهای بیماریزایی بیان میشوند. وقتی غلظت سلول به حد مناسب رسید، سیستم یک (CqsA) با تولید مولکول خود القای CAI-1 و سیستم 2 (LuxS) با تولید AI-2 بهعنوان مولکول دیگر QS سبب فعال شدنLuxQ ,LuxP ,CqsS شده و بعد از فعال شدن آنها، این ترکیبات LuxU را فعال میکنند که درنهایت با دفسفریله شدن LuxO (LuxQ و CqsS LuxP, خاصیت فسفاتازی دارند و سبب دفسفریله شدن LuxU میشوند) رپرسور HapR فعال نشده و در اثر عدم فعال شدن رپرسور، HapR تولید و مانع بیان ژنهای بیماریزایی میشود. همانطورکه در شکل (4) مشاهده میشود باکتری در تعداد کم با بیان ژنهای بیماری زایی مانند پیلی سبب استقرار در روده کوچک میشود. در این مرحله بعد از مستقر شدن به دلیل عدم تولید HapR، اگزوتوکسین تولید شده که سبب اسهال شدید میشود. وقتی تعداد باکتری بالا رفت میزان HapR هم افزایش مییابد و از تولید بیشتر ژنهای بیماریزایی ازجمله ژنهای تولیدکننده پیلی و اگزوتوکسین جلوگیری شده و باکتری از سطح روده جدا و انتشار باکتری تسهیل میشود.
سیستم تنظیمی سومی هم در ویبریوکلرا وجود دارد که مستقیماً روی LuxO عمل کرده و به فعالیت انتقال پیام مولکولهای داخلی سلولی مانند cAMP وابسته است، ولی جزئیات بیشتری از مکانیسم عمل آن تاکنون مشخص نشده است. لازم بذکر است که پروتئین گیرنده cAMP برای بیان HapA (که بهوسیله QS تنظیم میشود) لازم است و HapR هم برای بیان HapA ضروری است. در شکل زیر، نحوه فعالیت QS در ویبریو کلرا نشان داده شده است.
شکل (5): نحوه فعالیت Q.S در ویبریو کلرا
منابع:
Stevens, A.M. & Greenberg, E.P. Cell-Cell Signalling in Bacteria (eds Dunny, G.M. & Winans, S.C.) (ASM Press, Washington D.C., 1999).
- Miller MB, Bassler BL: Quorum sensing in bacteria. Annu Rev Microbiol 2001, 55:165-199.
- Fuqua C, Greenberg EP: Listening in on bacteria: acylhomoserine lactone signalling. Nat Rev Mol Cell Biol 2002,3:685-695.
- de Kievit TR, Iglewski BH: Bacterial quorum sensing in pathogenic relationships. Infect Immun 2000, 68:4839-4849.
- Cha, Chung, Gao, Ping, Chen Yu-Ching, Shaw and et.al . Production of Acyl-Homoserine Lactone Quorum-Sensing Signals by Gram-Negative Plant-Associated Bacteria. 1998. Mol. Plant-Microbe Interact 11: 1119-1129.
- Joelsoon A, LiuZ,Zhu J. Genetic and phenotypic diversity of quorum-sensing systems in clinical and environmental isolates of Vibrio cholera. Infect Immun;2006;74(2):1141-7.
- http://2011.igem.org/Team:UNIPV-Pavia/Project/Motivation#Engebrecht
- Cámara M, Hardman A, Williams P, Milton D. Quorum sensing in Vibrio cholerae. Nat Genet. 2002;32(2):217-8.
- Saghi H, Moradi F, Mohseni R, Abadi AH, Ataee RA, et al. (2015) Quorum Sensing in Bacterial Pathogenesis. Glob J Infect Dis Clin Res 1(1): 004-009.
مکانیسمهای مقاومتهای آنتیبیوتیکی (2)
کارباپنمازها در باکتریهای گرم منفی
متابولیسم کربن و انرژی باکتریهای بیهوازی
اثرات نانوساختارهای فلزی بر روی باکتریها (قسمت دوم)
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام