Prenatal Screening Tests; cffDNA
دكتر ابوالفضل گلستاني1، امیر حسین دوستی مطلق2
دانشیار گروه بیوشیمی بالینی دانشکده پزشکی دانشگاه علوم پزشکی تهران1، دانشجوی دکتری تخصصی بیوشیمی بالینی دانشکده پزشکی دانشگاه علوم پزشکی تهران2
- مقدمه
تستهای غربالگری سلامت جنین عموماً به منظور تشخيص قبل از تولد سندرم داون (تریزومی 21)، سندرم ادوارد (تریزومی 18)، سندرم پاتو (تریزومی 13) و پره اکلامپسی انجام ميشود. این تستها به دو دسته تهاجمی و غیرتهاجمی تقسیم میشوند؛ تستهای تهاجمی عبارتند از آمنیوسنتز و نمونهگیری از پرزهای جفتی (CVS[1]) و تستهای غیرتهاجمی نیز مشتمل بر غربالگری سه ماهه اول، غربالگری سه ماهه دوم، غربالگری تجمعی و NIPT[2] میباشند.
- تستهاي غربالگري تهاجمي
تستهای غربالگری تهاجمی شامل آمنیوسنتز و CVS هستند که ایراد اصلی آنها سقط جنین ناخواسته میباشد.
- آمنیوسنتز
آمنیوسنتز یک تکنیک تشخیصي قبل از تولد است که طی آن حدود 20-15 ميليليتر از مایع آمنیون اخذ و مورد بررسی ژنتیکی قرار میگیرد. این روش یکی از رایجترین روشهای تهاجمی تشخیصي قبل از تولد در سهماههی دوم بارداری است. آمنیوسنتز بین هفتههای 15 تا 22 بارداری انجام میشود و انجام آن زودتر از اين زمان منجر به آسیب جنین میشود. از عوارض آمنیوسنتز میتوان به زایمان زودرس، دیسترس تنفسی، ناهنجاریهای جسمی، آسیب به جنین و بیماریهای مربوط به Rh مادر اشاره کرد. مطالعات اخیر در سالهای 2006-2000، خطر سقط ناشی از روش آمنیوسنتز را 0/6 % تا 0/86% تخمین زده است (1).
- نمونه گیری از پرزهای جفتی (CVS)
اين روش به منظور تشخیص ژنتیکی در دوران جنینی بین هفته 10 تا 13 بارداری انجام میگیرد. در این روش پرزهای کوریونی از جفت گرفته شده و بررسی کروموزومی بر روی آن انجام میگیرد. خطر سقط ناشي از اين روش نیز 2-1% است (2).
- تستهاي غربالگري غيرتهاجمي
تستهای غربالگری غیرتهاجمی شامل روشهای سنتی غربالگری سه ماهه اول، سهماهه دوم، تجمعی و تست جدید NIPT میباشند. اشکال اصلی روشهای سنتی غربالگری، میزان مثبت کاذب بالای آنها میباشد.
- غربالگری سه ماهه اول بارداری
این تست در بین هفته 10 تا ۱۴ حاملگی انجام ميشود. در این روش از مارکرهای سونوگرافی (NT[3] يا ضخامت پشت گردن رحم) و بیوشیمی ([4]PAPP-A و [5]β-HCG) استفاده میشود. حساسيت آن براي غربالگري سندرم داون 87-82% و ميزان مثبت كاذب آن حدود 5% است.
- غربالگری سه ماهه دوم بارداری
نام ديگر اين تست كواد[6] است و در بین هفته 15 تا 20 حاملگی انجام ميشود. در اين روش ماركرهاي بيوشيميايي (شامل β-HCG، آلفا فيتوپروتئين، استريول غيركنژوگه و اينهيبين A) اندازهگیری ميشوند. حساسيت اين روش براي غربالگري سندرم داون حدود 80% و میزان مثبت کاذب آن حدود 5% است (3).
- غربالگری تجمعی
از ترکیب معيار خطر محاسبه شده در سه ماهه اول و دوم بدست میآید و حساسيت این تست براي غربالگري سندرم داون 97-94% است.
- NIPT با استفاده از [7]cffDNA موجود در پلاسمای مادر
روش جديد و غيرتهاجمی غربالگری است كه با استفاده از تکنولوژی تعيين توالي، ميزان افزايش DNAآزاد جنين را در خون مادر از هفته دهم بارداری بررسی میکند. در اين روش بدون نياز به سلولهای بافت جفت (CVS) يا نمونه گيری از مايع آمنيوتيک (آمنيوسنتز)، از چند ميليليتر خون وريدی مادر استفاده شده و در يک تست همزمان، تريزومی های 21، 18 و 13 بررسی میشود. حساسيت اين روش براي غربالگري سندرم داون بيش از 99% و ميزان مثبت كاذب آن كمتر از 0/1% است (4, 5).
- cff DNA
در سال 1997، Dennis Loو همكارانش براي اولين بار وجود DNA آزاد جنیني را در خون مادر گزارش دادند. نیمه عمر این DNA بسیار کوتاه و حدود 16 دقيقه است و در کمتر از 2 ساعت بعد از تولد از خون مادر حذف میشود. cffDNA عمدتاً از سلولهاي جفتي آپوپتوتيك جنيني آزاد ميشود (6). اما مكانيسمهاي ديگری نیز برای آزاد شدن DNA جنيني وجود دارد که از آن جمله میتوان به آزاد شدن DNA از سلولهاي هماتوپوئيتيك جنيني و انتقال مستقيم مولكولهاي DNA اشاره کرد. DNA موجود در خون مادر شامل DNA مادری و DNA جنینی است که به صورت قطعات کوتاه (200-150 جفت باز) در گردش خون دیده میشوند. منشاء اصلی DNA مادری (cfDNA[8]) سلول های خونی مادر میباشد. ميزان DNA جنيني موجود در پلاسمای مادر از 5% تا 10% متغیر است؛ اين مقدار با پیشرفت بارداری افزايش مییابد و در اواخر دوران بارداري به حداکثر ميرسد (7).
- مزاياي استفاده از cffDNA
صحيحترين تست غربالگري غیر تهاجمی است كه در حال حاضر براي تشخيص آنوپلوئيدي وجود دارد و تشخیص زودهنگام را ممكن ميسازد.
- محدودیتهای استفاده از cffDNA
برای اطمینان از وجود اختلال، میبایست علاوه بر تست cffDNA، تست غربالگری تهاحمی (CVS یا آمنیوسنتز) نیز انجام شود. همچنین در مواردی که ميزان DNA جنيني موجود در پلاسمای مادر کمتر از 4% باشد، نمونهها با این تست قابل تفسیر نیستند.
- جمعآوری نمونه و استخراج DNA
ده تا بیست میلیلیتر خون محیطی در لوله حاوی 200 میکرولیتر EDTA 0/5 مولار جمعآوری و سریعاً به دمای 4 درجه سانتیگراد منتقل می شود. نمونههای خون به مدت 10 دقیقه در g 3000 سانتریفوژ و محلول رویی (حاوی پلاسما و بافیکوت) با دقت جدا شده و به میکروتیوب 1/5 میلیلیتری منتقل میشود. در مرحله بعد به کمک کیت، DNA ژنومی استخراج ميگردد. مطالعهی Wong و همکاران در سال 2013 در خصوص پایداری cffDNA نشان داد که میزان cffDNA موجود در پلاسمای مادر به مدت 7 روز در طیف دمایی (4، 23، 37 و 40 درجه سانتیگراد) پایدار است، در حالی که در دمای بالاتر از 23 درجه سانتیگراد میزان DNA توتال (عمدتاً مادری) به خاطر تجزیه سلولهای مادر و آزاد شدن DNA آنها افزایش مییابد (8).
2-4- فاکتورهایی که بر میزان cffDNA تأثير میگذارند
- میزان cffDNA با پیشرفت بارداری افزایش مییابد، مطالعه Wang و همکاران در سال 2013 نشان داد که میانگین cffDNA در هفته دهم (روز 1 تا 6) 10/2% بود که تا هفته 21 به تدریج هفتهای 0/1% و از هفته 21 به بعد هفتهای 1% افزایش یافت (9).
- میزان cffDNA با افزایش وزن مادر کاهش مییابد (9).
- مطالعه Urato و همکاران در سال 2008 نشان داد که میزان cffDNA در سرم زنان باردار سیگاری سه برابر زنان باردار غیر سیگاری است (10).
- کاربردهای بالینی cffDNA
عبارتند از: تعیین جنس جنین، تشخیص نوع RhD، تشخیص آنوپلوئیدی جنین، تعیین اختلالات تکژنی و تعیین ابوّت.
- تعیین جنس جنین
اولین کاربرد cffDNA تعیین جنس جنین است که از طریق آشکار شدن ژنهای موجود بر روی کروموزم Y جنینهای مذکر مشخص میشود. برای تعیین جنس جنین از ژن SRY[9] به عنوان مارکر DNA جنینی جنس مذکر استفاده میشود. این تست برای بررسی خطر بروز اختلالات جنسی وابسته به X، تشخیص مبهم بودن ژنیتال و مدیریت شرایط متابولیک کاربرد دارد و از هفته پنجم به بعد انجام میشود. فاکتورهایی که بیشترین تأثیر را در نتیجه تست دارند عبارتند از سن بارداری و روش تکثیر DNA. چندین مطالعه در هفتههای پنجم و هفتم بارداری با کمک Real-Time PCR انجام شده که میزان حساسیت آن را 100% نشان دادهاند (11).
- تشخیص نوع RhD
برای پیشگیری از بروز بیماریهای همولیتیک باید وضعیت RhD جنین و مادر مشخص شود. روشهای سنتی تشخیص وضعیت RhD مشتمل بر تکثیر ژن RhD در مایع آمنیوتیک و آزمایش سرولوژی در بدو تولد میباشد. برای تشخیص وضعیت RhD جنین به کمک cffDNA از دو منطقهي ژن RhD (اگزون 5 و 7) استفاده میشود. دلایل نتایج منفی کاذب این تست؛ عبارتند از: کمبود DNA جنینی موجود در پلاسمای مادر، علل بیولوژیکی (انجام تست در اوایل دوران بارداری) و علل تکنیکی (استخراج ضعیف DNA) (12).
تشخیص آنوپلوئیدی جنین
آنوپلوئیدی علت اصلی نقص تولیدمثل و بیماریهای مادرزادی همراه با اختلال کروموزومی مثل تریزومی 21 (سندرم داون)، تریزومی 18 (سندرم ادروارد)، تریزومی 13 (سندرم پاتو)، سندرم کلاینفلتر (XXY) و سندرم ترنر (XO)، میباشد. همانطور كه اشاره شد رایجترین تکنیکهای تشخیص آنوپلوئیدی قبل از تولد CVS و آمنیوسنتز هستند که هر دو از روشهاي تهاجمی محسوب ميشوند. جدیدترین تکنیک برای تشخیص آنوپلوئیدی، ارزیابی مقادیر نسبی کروموزوم هدف (مثلاً 21) با تكنيك Real-Time PCR است. مطالعات متعدد نشان دادهاند که میزان cffDNA در شرایط آنوپلوئیدی افزایش مییابد. Lo و همکاران نشان دادند که به واسطه cffDNA موجود در پلاسمای مادر، میتوان جنین دارای تریزومی 21 را با حساسیت 100% و اختصاصیت 9/97% تشخیص داد. بر اساس اطلاعات بدست آمده طي 8 مطالعه تا سال 2012، cffDNA از نظر وضعیت آنوپلوئیدی غربالگری شد. در پنج مورد از مطالعات مذکور از تکنیک [10]MPSS و در بقیه از تکنیک DANSR[11] استفاده گرديد. همچنين هر 8 مطالعه تریزومی 21، 6 مطالعه تریزومی 18 و دو مطالعه نيز تریزومی 13 را بررسی کردند. به عنوان مثال در مطالعه Norton و همکاران که بر روی 3228 زن باردار انجام شد نشان داده که حساسیت روش DANSR برای غربالگری تریزومی 21 (سندرم داون)، 100% و برای غربالگری تریزومی 18 (سندرم ادوارد)، 97% است. در همه این مطالعات وضعیت صحیح کروموزومی بوسیله CVS یا آمنیوسنتز تأیید شد (13).
- تعیین اختلالات تکژنی
بیماریهايی مثل آکندروپلازی، هانتینگتون، دیستروفی عضلانی، هیپرپلازی مادرزادی آدرنال، هموفیلی و β- تالاسمی به دلیل جهشهای تکنقطهای ایجاد میشوند و برای تشخیص آنها میتوان ژنهای جهشیافته را در خون مادر شناسايي کرد. بیماری آکندروپلازی در اثر جهش نقطهای در ژن FGFR3[12] ایجاد میشود. در مطالعهای که در آن از cffDNA استفاده شد، در بیش از 98% موارد، این بیماری تشخیص داده شد. به کمک cffDNA میتوان بیماری هانتینگتون را در حدود هفته دهم بارداری با صحت بسیار بالا تشخیص داد. رایجترین علت بیماری β- تالاسمی جهش در ژن CTTT میباشد که میتوان به کمک PCR این جهش را با حساسیت 100% و اختصاصیت بالا شناسایی نمود.
- تعیین ابوّت
تعیین ابوّت جنین به کمک سیستم ژنوتیپی [13]DNA- STR امکانپذیر است. DNA- STR آللهای چندگانه دارد و میتواند تنوع بسیار بالایی داشته باشد (11).
تستهای تجاری موجود برای NIPT
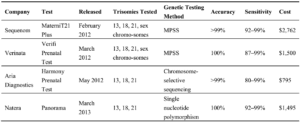
تعدادی از شرکتها مثل [14]Sequenom، Verinata[15]، Ariosa[16] و [17]Natera نسل جدیدی از تستهای NIPT را طراحی کردهاند كه همه آنها برای بدست آوردن اطلاعات موجود در cffDNA از روش تعیین توالی استفاده میکنند. هر شرکت برای تفسیر دادههای ژنتیکی از اَلگوریتم مخصوص خود استفاده میکند. اگر چه تکنولوژی مورد استفاده این شرکتها متفاوت است ولی کاربرد بالینی همه مشابه است و همگي cfDNA موجود در خون مادر را برای بررسي وجود آنوپلوئیدی آنالیز میکنند. میزان تشخیص این کیتها برای تریزومیهای مختلف متفاوت است؛ به عنوان مثال شرکت Natera تست Panorama را بر اساس SNP طراحی کرده است که ميتواند تریزومیهای 21، 18 و 13 را با اختصاصیت 100% و حساسیت 99-92% غربالگری کند (جدول 1) (3, 14).
جدول 1: تستهای تجاری موجود برای تست NIPT
4-1- مراحل انجام تست Panorama
- خون مادر در حدود هفته 9 بارداری اخذ و پلاسما و بافیکوت آن جدا می شود.
- DNA موجود در پلاسما و بافیکوت، تکثیر و به کمک دستگاه توالییاب آنالیز میشود. به كمك اين تكنيك ميتوان تفاوت ژنتیکی SNPهای بین ژنوم مادر و جنین را مشخص نمود.
- دادههای حاصل از مرحله قبل به کمک اَلگوریتم NATUS آنالیز میشوند. این اَلگوریتم میتواند سیگنال ناشی از DNA مادر را از سیگنال ناشی از DNA جنین تميز دهد.
- گزارش حاوی معیار خطر برای کروموزومهای 21، 18، 13، X و Y آماده میشود.
5- نتيجهگيري
بزرگترين ايراد روشهای سنتی غربالگری، درصد بالای نتايج مثبت و منفی کاذب و در تست تأئيدی، احتمال سقط جنين به علت تهاجمی بودن روش نمونهگيری است، در حالي كه با روش NIPT تقریباً همه جنينهاي مبتلا به سندرم داون با مثبت کاذب بسیار پایین شناسایی میشوند. براي درك اهميت اين موضوع به اين مثال توجه نماييد: كل موارد حاملگي در ايران در سال 92 حدود 1/5 ميليون نفر بوده است. در روشهاي سنتي غربالگري براي اين تعداد حاملگي، تعداد زنان باردار با نتايج مثبت كاذب حدود 75000 نفر تعيين ميشود ولي با روش NIPT اين تعداد تنها 510 نفر خواهد بود. به این ترتیب، با توجه به نتايج مثبت كاذب بسيار پايين روش NIPT، سالانه بيش از 74490 مورد انجام آزمايش آمنيوسنتز کمتر درخواست میشود كه هزينه آن به تنهايي معادل 745 ميليارد ريال است و چنانچه از اين روش استفاده شود، اين هزينه به خانواده ها تحميل نميشود. همچنين تعداد موارد سقط جنين ناشي از نمونهگيری تهاجمی در روشهای سنتی غربالگری 600 مورد و در روش NIPT تنها 23 مورد میباشد؛ يعنی با استفاده از روش NIPT، سالانه جان 573 جنين نجات داده ميشود.
:References
- Wilson R, Langlois S, Johnson J. Mid-trimester amniocentesis fetal loss rate. Journal of obstetrics and gynaecology Canada: Journal d’obstetrique et gynecologie du Canada. 2007;29(7): 586-95.
- Dodgson J, Martin J, Boswell J, et al. Probable amniotic fluid embolism precipitated by amniocentesis and treated by exchange transfusion. British medical journal (Clinical research ed). 1987; 294 (6583):1322.
- Norwitz ER, Levy B. Noninvasive Prenatal Testing: The Future Is Now. Reviews in obstetrics and gynecology. 2013; 6(2):48.
- Musci TJ, Fairbrother G, Batey A, et al. Non‐invasive prenatal testing with cell‐free DNA: US physician attitudes toward implementation in clinical practice. Prenatal diagnosis. 2013; 33: 424-428.
- Lau TK, Chan MK, Salome Lo PSY, et al. Clinical utility of noninvasive fetal trisomy (NIFTY) test-early experience. Journal of Maternal-Fetal and Neonatal Medicine. 2012; 25(10):1856-9.
- Caroline F W, Hilary B. The use of cell-free nucleic acids in maternal blood for non-invasive prenatal dignosis. Human Reproduction Update. 2009; 1(15): 139-151.
- Jiang F, Ren J, Chen F, et al. Noninvasive Fetal Trisomy (NIFTY) test: an advanced noninvasive prenatal diagnosis methodology for fetal autosomal and sex chromosomal aneuploidies. BMC medical genomics. 2012;5(1):57.
- Wong D, Moturi S, Angkachatchai V, Mueller R, DeSantis G, van den Boom D, et al. Optimizing blood collection, transport and storage conditions for cell free DNA increases access to prenatal testing. Clinical Biochemistry. 2013; 46(12): 1099-104.
- Wang E, Batey A, Struble C, et al. Gestational age and maternal weight effects on fetal cell‐free DNA in maternal plasma. Prenatal diagnosis. 2013; 33(7):662-6.
- Urato AC, Peter I, Canick J, et al. Smoking in pregnancy is associated with increased total maternal serum cell‐free DNA levels. Prenatal diagnosis. 2008; 28(3):186-90.
- Ghorbian S. Applications of Cell-Free Fetal DNA in Maternal Serum. International Journal of Infertility and Fetal Medicine. 2012; 3(2):33-9.
- Macher HC, Noguerol P, Medrano-Campillo P, et al. Standardization non-invasive fetal RHD and SRY determination into clinical routine using a new multiplex RT-PCR assay for fetal cell-free DNA in pregnant women plasma: results in clinical benefits and cost saving. Clinica Chimica Acta. 2012; 413(3):490-4.
- Walsh JM, Goldberg JD. Fetal aneuploidy detection by maternal plasma DNA sequencing: a technology assessment. Prenatal diagnosis. 2013; 33(6):514-520.
- Agarwal A, Sayres LC, Cho MK, et al. Commercial landscape of noninvasive prenatal testing in the United States. Prenatal diagnosis. 2013; 33(6):521-31.
[1] – Chorionic Villus Sampling
[2] – Noninvasive Prenatal Trisomy
[3] – Nuchal Translucency
[4] – Pregnancy-associated Plasma Protein-A
[5] – β-Human Chorionic Gonadotropin
[6] – Quad
[7] – Cell free fetal DNA
[8] – Cell Free DNA
[9] – Sex Determining Region Y
[10] – Massively Parallel Signature Sequencing
[11] – Digital Analysis of Selected Regions
[12] – Fibroblast Growth Factor Receptor 3
[13] – Short Tandem Repeat
[14] – http://www.laboratories.sequenom.com
[15] – http://www.verifitest.com
[16] – http://www.ariosadx.com
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام