Micro M.RNA، مارکری برای تشخیص سرطان
الهام پوییده 1، دکتر احسان عارفیان2، دکتر عباس اخوان سپهی3
1- کارشناس ارشد میکروبیولوژی دانشگاه علوم تحقیقات، تهران، ایران
2- استادیار بخش ویروسشناسی، دانشکده زیستشناسی، پردیس علوم پایه، دانشگاه تهران، تهران، ایران
3- استاد گروه میکروبیولوژی، دانشکده علوم زیستی، دانشگاه آزاد اسلامی واحد تهران شمال، تهران، ایران
مقدمه
microRNAها (miRNAs)، RNAهای کوچک غیرکدگذار 19 تا 25 (معمولاً 22) نوکلئوتیدی هستند که از پیشسازهای سنجاقسری 70 الی 100 نوکلئوتیدی، بریده شدهاند. آنها میتوانند بیان ژن را از طریق تحریک تخریب مستقیم mRNA یا مهار ترجمهی آن تنظیم نمایند؛ درواقع روی شبکههای بیان ژنی از طریق مهار mRNAهای هدف از راه میانکنشهای جفت شدنهای اختصاصی تأثیر میگذارند.miR ها در یک رفتار اختصاصی برای بافت بیان شده و فاکتورهای حیاتی را در تنظیم مسیرهای مختلف درگیر در رشد و نمو، تمایز سلولی، تکثیر و آپوپتوز، تنظیم میکنند. حجم زیادی از اطلاعات نشان میدهد که miRها در بدخیمیهای انسانی از تنظیم خارج شدهاند. پیشنهاد شده که برخی از آنها میتوانند عملکردهای انکوژنی یا مهارگر توموری داشته باشند.
همگام با این عقیده، هردوی بیان بیشازحد (overexpression) و خاموش شدن miRهای خاص، در برخی بیماریهای قلبی عروقی و نیز بسیاری از انواع سرطانها گزارش شده است؛ مثلاً کاهش بیان miRNAها در تومورها در مقایسه با بافتهای نرمال دیده شده که نشان میدهد برخی از miRNAها بهعنوان مهارگرهای توموری بالقوه عمل میکنند. برخی از مکانیسمهایی که در تنظیم بیان miRNAها دخیل هستند شامل تنظیمات خاص در سطح رونویسی، مکانیسمهای اپیژنتیکی از جمله متیلاسیون و داستیلاسیون هیستونها و موتاسیونهای ژنی است که روی پروتئینهای شرکتکننده در پردازش و بلوغ miRNAها اثر میگذارند یا باعث تنظیم پایداری miRNAها میشوند.
مطالعات جدید نشان میدهند که بیان miRNAها میتواند توسط مکانیسمهای اپیژنتیکی مختلفی از جمله متیلاسیون نابجا و غیرطبیعی نواحی پروموتری یا تغییرات هیستونی تنظیم شوند، بنابراین یکی از روشهای خاموشسازی رونویسی miRها، میتواند مکانیسمهای اپیژنتیکی مرتبط با متیلاسیون DNA بهصورت نابجا در
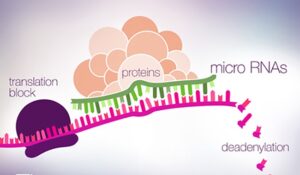
´5 UTR باشد که این مسئله در بسیاری از انواع معمول TSGها دیده شده است. اتصال miRNA به mRNA باعث جدا شدن (splitting) اختصاصی، دآدنیلاسیون یا مهار ترجمه میشود.miRNA ها ترجمهی حدود 60% از تمام ژنهای غیرکدگذار انسانی را تنظیم میکنند .یک mRNA میتواند چند منطقهی اتصال (binding site) برای یک یا چند miRNA داشته باشد، بنابراین اثر miRNAها روی مهار ترجمهی mRNA، تشدید میشود.
بسیاری از ژنهای miRها، درون اینترونهای ژنهای کدگذار پروتئینها قرار دارند (و نتیجتاً از یک ترانسکریپت اولیه مشترک با ژن میزبان منشأ میگیرند)، بنابراین میتوان پیشبینی کرد که به مهار رونویسی توسط متیلاسیون نابجای یک CpG island درون ´5 UTR ژن میزبان حساس هستند. در برخی از موارد فرض شده که تنظیم رونویسی بیان ژن miR میتواند توسط تغییرات اپیژنتیکی عناصر تنظیمی ژن میزبان به دست آید که میتواند دور از لوکوس miR، واقع شده باشد.
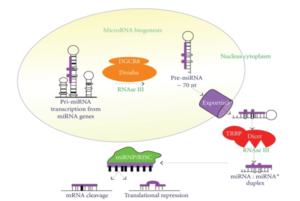
توليد (biogenesis) ميكرو RNAهاي انساني
ژنوم انساني حاوي بيش از 1000 ژن miRNA است كه بيشتر آنها توسط RAN پليمراز II رونويسي میشوند.
مسير متعارف توليد miRNA شامل پردازش هستهای miRNA اوليه (Pri-miRNA) بهوسیلهی ريبونوكلئاز Drosha و پردازش سيتوپلاسمي (Pri-miRNA)ها بهوسیلهی ريبونوكلئاز Dicer است.
(Pri-miRNA): کلاهکگذاری (capped)، پليآدنيله و حاوي يك يا بيشتر ساختمان سنجاقسري (Hairpine) میشود. اين ساختمان سنجاقسري براي Pri-miR منحصربهفرد است كه شامل يك شاخهی
30 bp است. اين ساختمان بهوسیلهی يك كمپلكس ميكروپروسور حاوي ريبونوكلئاز Drosha ( ااا RNase)، پروتئين اتصالي RNA بنام DGCR8 و تعداد ديگري پروتئين تشخيص و برش داده میشود.
ساختار DNA انسانی
ماشين برشدهنده كمپلكس RISC، ريبونوكلئاز DICER يك RNase ديگر است كه موجـــب تبديـــــــــــــل Pre-miRNA به miRNA بالغ میشود. كه حاوي دو نوكلئوتيد برآمده در دو انتهاي´ 3 است.
DICER انساني يك پروتئين Kd 200 چند دومینی شامل دومين هليكاز در انتهاي N، يك دومين با عملكرد ناشناخته بنام DUF283 و يك دومين بنام PAZ و دو دومين حفاظتشده بنامهای RIIIA و RIIIB و یک دومين اتصالي dsRNA در انتهاي C است. اولين miRNA در سال 1995 مشخص شد، بااینحال عملكرد تنظيمي آنها تا سال 2000 مشخص نبود. از آن زمان به بعد محققان نقشهای مختلفي را در تأمین تنظيم منفي و تنظيم مثبت رونويسی و ترجمه كشف نمودند.
miRNAهای متفاوتي در سلول و بافتهای مختلف بيان میشوند. هرگونه انحراف در بيان miRNAها موجب بیماریهای متفاوت میشوند و در حال حاضر درمان با miRNA در حال بررسي و تحقيق است.
همانگونه كه گفته شد ميكرو RNAها كلاسي از RNAهاي غيركدکنندهی كوچك تکرشتهای هستند كه بيان ژن را بهصورت تنظيم منفي انجام میدهند. ميكرو RNAها كنترل تجزيه miRNA يا مهار ترجمه را بهوسیلهی اتصال به جایگاههای مكمل 3’UTR ژن هدف به عهده دارند، بعلاوه ميكرو RNAها نقش كليدي را در چندين پروسهی بيولوژيكي مانند كنترل سيكل سلولي، رشد و افتراق سلولي، اپوپتوزيس و تكامل جنين عهدهدار هستند، به همين صورت هرگونه اختلال در miRNAهاي پروسههای فوق، موجب ايجاد بيماري مربوطه میشود، كه بهطورکلی به آنها miR disease گفته میشود.
سيستم نامگذاری miRNAها
تحت يك سيستم نامگذاری استاندارد، miRNAها قبل از انتشار كشف آنها میبایست نامگذاری و تأیید شوند؛ بهطور مثال پسوند “mir” بعلاوهي يك خط تيره و يك عدد میآید، مثل 123-mir که در اين مثال ” mir” اشــــــــــــاره دارد به pre-miRNA، درحالیکه “miR” اشاره به شكل بالغ miRNA دارد.
miRNAهايي با توالیهای مشخص نزديك به هم با اختلاف 2-1 نوكلئوتيد با حرفهای كوچك مشخص میشـوند، مثلاً 123a-mir بسيار شبيه و مرتبط است با 123b- mir.
Pri-miRNAهاي hsa-mir-194-1 و hsa-mir-194-2 داراي miRNAهاي بالغ مثل هم هستند (hsa-mir-194)، اما آنها در جایگاههای مختلف از ژنوم قرار گرفتهاند.
منشأ گونهیmiRNA نيز با يك پسوند سهحرفی مشخص میشود، مثلاً hsa-mir-123 يك MiRNA انساني اسـت (homo sapiens) و oar-mir-123 يك ميكرو RNA خوكي است (ovis aries).
ساير حرفها نيز بكار میرود، مثلاً پسوند “V” براي viral و پسوند “d” براي Drosophila. وقتي منشأ دو miRNA بالغ از بازوهاي مقابل همان miRNA باشد با پسوند -p3 يا -p5 مشخص میشود.
امروزه با پیشرفت تکنیکهای جدید مولکولی، امیدهای جدیدی در درمان بیماریهای انسانی ظهور نموده است. یکی از اینها microRNAها هستند.
مطالعات جدید نشان دادهاند که تا 30% از ژنهای انسانی و اغلب مسیرهای ژنتیکی توسط miRNAها تنظیم میشوند. بیش از 500miRNA ی مختلف در سلولهای انسانی شناخته شده است. در سالهای اخیر microRNAها (miRNA) بهعنوان عوامل مولکولی نوینی که در کارسینوژنر درگیر میشوند، شناسایی شدهاند؛ بهنحویکه از تنظیم خارج شدن بیان آنها در سرطانهای مختلف انسانی شناسایی شده است. کشف microRNAها، گروهی ازRNA های غیرکدگذار تنظیمی، دیدگاه جدیدی در مورد تشخیص و مدیریت سرطان نمایان کرده است. شرکت RNAهای غیرکدگذار در کارسینوژنز و پیشرفت تومور توسط بسیاری از مطالعات عملکردی در دهههای اخیر تأیید شده است. از میان تمام انواع ncRNAها، microRNAها به دلیل فراوانی از تنظیم خارج شدنشان در سرطان، بیش از همه موردتوجه قرار گرفتند. MiRها دستهای بزرگ از RNAهای اندوژن کوچک غیرکدگذار سلول را تشکیل داده و بیان ژن را پس از رونویسی، تنظیم کرده و بسیاری از مکانیسمهای مولکولی از جمله تمایز بافتی، تکثیر سلولی، تقسیم سلولی، تمایز سلولی، عدم تقارن نورونی، متابولیسم، مشخصه و ویژگیهای سلولی، آپوپتوز و عفونت ویروسی را کنترل مینمایند. پیشبینی شده است که هر miRای تعداد زیادی mRNA را براساس جفتشدگی توالی آنها با سکانس seed در ´3 UTRاش، هدفگیری مینماید که این هدفگیری نتایج متمایزی دارد، بنابراین اختلال در بیان miRها میتواند از طریق هدفگیری تعداد زیادی mRNA، باعث سرعت بخشیدن به آغاز تومورزائی، تکثیر آن یا مهار آپوپتوز و نیز تهاجم شود.
MicroRNAها و اهمیت آنها بهعنوان مارکر در تشخیص سرطان
MicroRNAها، در پاتوژنز انواع مختلفی از سرطانها دخیل هستند. شواهد زیادی پیشنهاد میکنند که miRها میتوانند بهعنوان انکوژن (oncomiR) یا ژن مهارگر تومور (tsmiR) عمل کنند و در مراحل اولیهی کارسینوژنز دخیل باشند. الگوی بیان miRها میتوانند برای طبقهبندی انواع مختلف سرطان مورداستفاده قرار بگیرند و پروفایلهای بیانی آنها میتوانند کاربردهای prognostic و نیز درمانی داشته باشند.
در مقایسه با mRNA، تعداد کمتری از miRها میتوانند برای اهداف کلینیکی کافی باشند. بهطور جالبتری، miRها در بافتهای مختلف به میزان زیادی دستنخورده باقی میمانند و عملاً بهواسطه تخریب توسط RNA تحتتأثیر قرار نمیگیرند. تمام این مشخصهها،miR ها را یک ابزار بسیار جالب و سودمند برای تشخیص زودهنگام تومور، تعیین پیشآگهی و درمان آن میسازد. دلیل بیان افتراقی گستردهی miRها بین سلولهای طبیعی و سلولهای توموری هنوز نامشخص است. حدوداً 20 درصد از تمام miRها، درونCpG island ها قرار دارند. کم شدن بیان global در microRNAها، یک مشخصهی شایع در سرطان است. از آنجائی که هایپرمتیلاسیون جزایر CpG مکانیسمی برای خاموشسازی miRها فراهم میکند، اکثر محققین تنها گزارش کردهاند که miRNAها فقط با mRNAها در ´3 UTRشان میانکنش میکنند، ولی تحقیقاتی هم گزارش شدهاند که miRNAها به نواحی ´5 UTR و یا CDS یک mRNA نیز متصل میگردند. اولین مرحله در پردازش miRNAها با برش خوردن رونوشتهای miRNAی اولیه یا pri-miRNAها توسط کمپلکس Drosha/DGCR8 در هسته انجام میشود. ساختارهای ساقه-حلقهی miRNA، میتوانند در اینترونهای ژنهای کدگذار پروتئین یا ژنهای RNAهای غیرکدگذار و یا در اگزونهای ژنهای غیرکدگذار یا در نواحی بینژنی باشند. اکثریت miRNAهای انسانی در اینترونها قرار دارند. تقریباً 10% از miRNAها از جمله miR-137،miR-155، miR-146a، miR-22 و miR-34a، درون اگزونهای ژنهای غیرکدگذار قرار دارند. اطلاعات کنونی در مورد پردازش pri-miRNAها بیشتر در مورد miRNAهای اینترونی یا بین ژنی بهدستآمده است. پردازش miRNAهای اینترونی همزمان با رونویسی در تعاون و همکاری با splicing رونوشتهای اولیه انجام میشود. اجزای microprocessor و spliceosome، در یک کمپلکس قرار داشته و با همدیگر پیشسازهای miRNA (pre- miRNA) و رونوشتهای spliced شده را از pri-miRNAهای splice نشده تولید میکنند (1). Splicing برای پردازش pri-miRNAها لازم نیست، ولـی گرد هم آمدن spliseosome میتواند میـــــزان رها شدن pre-miRNAها را از اینتــــــــــــــرونهای pri-miRNAای، افزایش دهد. برای miRNAهای اگزونی، آزاد شدن
pre-miRNAها، اگزون pri-miRNA را مختل کرده و روی تشکیل رونوشتهای spliceشده، تأثیر میگذارد، بنابراین احتمالاً رونوشتهای pri-miRNA ی spliceنشدهی miRNA های اگزونی، رونوشتهای pre-miRNA یا spliceشده تولید میکنند. پردازش miRNAهای اگزونی هنوز با جزئیات دقیق مطالعه نشده است.
اغلب miRNAهای اگزونی درون ژنهای RNAای غیرکدگذار قرار دارند که تنها عملکردشان این است که ژن میزبان آن miRNA باشند. همانطور که بیان شد، برخلاف miRNAهای اینترونی، فرایند پردازش رونوشتهای pri-miRNA از miRNAهای اگزونی به pre-miRNA ها، با فرایند طبیعی splicing رونوشت، تداخل میکند. عقیده بر این است که miRNAهای اگزونی نسبت به miRNAهای اینترونی، مسیرهای فیزیولوژیکی مهمتری را تنظیم میکنند، مثـــلاً miRNA-155 و miRNA-146a، برای اجزای تنظیمی پاسخ ایمنی و hematopoiesis و کارسینوژنز حیاتی بوده و miRNA-22، نقش مهم در فرایند کارسینوژنز دارد. miRNA-137، یکی از مهمترین این دسته از miRNAها بوده و به دلیل فعالیت ضدتوموری شایانی که داراست، نقش بسیار مهمی در کارسینوژنز کولورکتال دارد.
منابع:
- Kataoka N, Fujita M, Ohno M. Functional association of the Microprocessor complex with the spliceosome. Molecular and cellular biology. 2009;29(12):3243-54.
- Esteller M. Non-coding RNAs in human disease. Nature reviews Genetics. 2011;12(12):861-74.
- Place RF, Li LC, Pookot D, Noonan EJ, Dahiya R. MicroRNA-373 induces expression of genes with complementary promoter sequences. Proceedings of the National Academy of Sciences of the United States of America. 2008;105(5):1608-13.
- Farazi TA, Spitzer JI, Morozov P, Tuschl T. miRNAs in human cancer. The Journal of pathology. 2011;223(2):102-15.
- Salmena L, Poliseno L, Tay Y, Kats L, Pandolfi PP. A ceRNA hypothesis: the Rosetta Stone of a hidden RNA language? Cell. 2011;146(3):353-8.
- 6. Finnegan EF, Pasquinelli AE. MicroRNA biogenesis: regulating the regulators. Critical reviews in biochemistry and molecular biology. 2013;48(1):51-68.
- 7. Ling H, Fabbri M, Calin GA. MicroRNAs and other non-coding RNAs as targets for anticancer drug development. Nature reviews Drug discovery. 2013;12(11):847-65.
- 8. Sundarbose K, Kartha R, Subramanian S. MicroRNAs as Biomarkers in Cancer. Diagnostics. 2013;3(1):84-104.
- 9. Li W, Zhang X, Zhuang H, Chen HG, Chen Y, Tian W, et al. MicroRNA-137 is a novel hypoxia-responsive microRNA that inhibits mitophagy via regulation of two mitophagy receptors FUNDC1 and NIX. The Journal of biological chemistry. 2014;289(15):10691-701
microRNAها در هموستاز و ترومبوز
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام