IMMUNO-PCR
فرزندی از نسل الیزا و PCR
کاظم مشایخی
دانشجوی دکترای ایمونولوژی، دانشگاه علوم پزشکی مشهد
خلاصه
از زمانی که تشخیص عوامل میکربی، سموم و هر آنتیژن (Ag) دیگر اهمیت پیدا کرد، روشهای تشخیصی متعددی روی کار آمده و معرفی شدهاند که امروزه دو روش PCR و الیزا (ELISA) از همه مهمتر و پرکاربردترند اما با پیشرفتهایی که در شناخت عوامل میکربی، عفونتها و بیماریها صورت گرفت، کمکم ضعف این روشها در تشخیص آشکار شد. برای غلبه بر مشکلات بوجود آمده، محققین این دو روش را با یکدیگر ترکیب کرده و سیستم تشخیصی IMMUNO-PCR (I-PCR) را معرفی کردند که بهمراتب دارای حساسیت و دقت بیشتری نسبت به دو روش قبلی است. در این مقاله سعی شده است تا بهصورت خلاصه، به اساس این روش، انواع آن، کاربردها و اهمیت آن پرداخته شود.
مقدمه
داشتن یک روش مناسب، قابلاعتماد، سریع، حساس و دقیق جهت تشخیص بیماری عفونی و عوامل میکروبی برای محققین و آزمایشگاهها، یک مشکل بسیار مهم بوده است. برای این هدف، روشهای زیادی روی کار آمدهاند و در دسترس هستند مانند تشخیص مستقیم عوامل میکروبی و یا کشت و بررسیهای میکروسکپی، ولی اگر میکروارگانیسم دارای رشد و تکثیر آهسته بوده و یا کشت آن مشکل باشد، این روشها چندان مناسب و آیدهآل نخواهند بود (1). این مشکل با معرفی تکنیک PCR توسط کری مولیس (1984) که مستقیماً نوکلئیک اسید عوامل پاتوژن را شناسایی میکرد، رفع شد و از حساسیت و دقت بالایی نیز برخوردار بود (5)، ولی در برخی عفونتها و یا آلودگی با سموم (توکسینها) میکروبی که عامل آنها پروتئینی است، روش PCR چندان کارایی نخواهد داشت. با معرفی روشهای ایمونواسی، این مشکل نیز حل شد و روشهای کارآمدی که میتوانستند Agهای میکروبی و یا آنتیبادیهای (Ab) ضد آنها را شناسایی کنند، روی کار آمدند که الیزا یکی از مهمترین و پرکاربردترین آنهاست (6). علیرغم اینکه الیزا روشی حساس و دقیق است، اما در برخی موارد که میزان Ag کم است، این روش کارایی لازم را نخواهد داشت. دراینباره مهمترین مثال بارز، تشخیص عفونت HBV است. در مراحل ابتدایی عفونت، مقدار Agهای ویروسی و Abهای ضد آن در خون بسیار پایین است که با روش الیزا قابلشناسایی نیست و از طرفی ویروس برای فرار از سیستم ایمنی، مقدار تکثیر خود را کاهش داده که نتیجه آن کاهش ژنوم ویروسی در خون بیماران است که با روش PCR بهسختی میتوان آنها را تشخیص داد (7). در سال 1992، Sano و همکاران، روشی معرفی کردند که حساسیت و دقت آن از الیزا و PCR بهمراتب بیشتر بود. آنها با ترکیب دو روش الیزا و PCR، تکنـــــــــــــــــــیک فوقالعاده حساس IMMUNO-PCR (I-PCR) را معرفی کردند (8).
کلیات و اساس I-PCR:
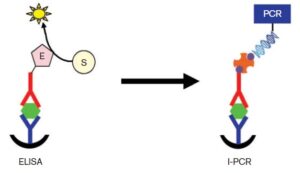
از نقطهنظر عملی، I-PCR همانند الیزا است، با این تفاوت که Ab تشخیصی در این روش، توسط یک پل ارتباطی (Linker) به رشتهای از DNA متصل میشود و در پایان واکنش، برخلاف الیزا که با تعیین جذب نوری تولید شده، حضور یا عدم حضور یا غلظت آنالیت هدف تعیین میشود، محصول نهایی کف پلیت برای انجام واکنش PCR فرستاده میشود و مقدار محصول PCR با مقدار آنالیت متناسب است؛ یعنی اگر یک Ab متصل به DNA، به Ag هدف وصل شود، در مرحله PCR قابلشناسایی است و این در حالی است که شاید در الیزای معمولی قابلشناسایی نباشد. همانطور که در شکل 1 نشان داده شده است، میتوان از استراتژیهای مشابهی همانند الیزا در طراحی انواع I-PCR استفاده کرد. این روش از حساسیت بالایی برخوردار بوده و توانایی آنالیز. شناسایی مقادیر کم Ag را در نمونههای مختلف (از جمله سرم، خون، مدفوع، کشت سلول، بزاق، مواد غذایی و …) را دارد (4).
شکل 1: اساس دو روش الیزا و I-PCR که تا حدودی مانند یکدیگر بوده با این تــفاوت که در پایان واکنش I-PCR تولید رنگ نخواهیم داشت (4)
انواع سیستمهای I-PCR:
با معرفی این روش، محققین بر آن شدند که مشکلات این سیستم را رفع کرده و آن را بهینه کنند. نتیجه این تلاشها، پایه و عنوان بسیاری از مقالات I-PCR را تشکیل میدهد. در قدم اول، محققین در تلاش برای رفع دو مشکل بودند:
- شناسایی و معرفی روشهایی که بتوان DNA و Ab را بهراحتی به هم متصل کنند و این اتصال نیاز به زمان انکوباسیون طولانی نداشته باشد.
- اندازهگیری کمی محصول PCR تا بتوان غلظت مقدار آنالیت هدف را تعیین کرد. تکنیک I-PCR اولیه برای غلبه بر این مشکلات، تغییرات زیادی کرد و راهکارهای مختلفی برای افزایش کارایی آن انجام شد. بر این اساس انواع مختلف سیستمهای I-PCR طراحی شد از جمله:
- Original I-PCR
- Universal I-PCR
- Magnetic-Bead I-PCR
- Nanoparticle Based I-PCR
- Biologic Based I-PCR
- Original I-PCR:
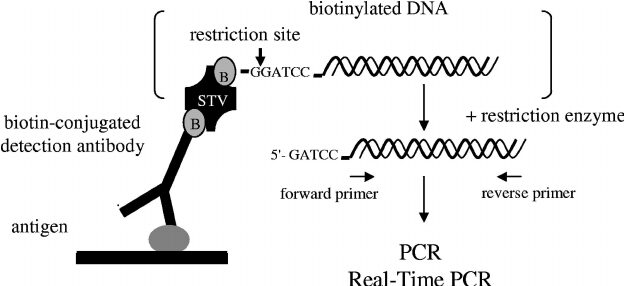
برای اولین بار که I-PCR توسط Sano و همکاران (1992) معرفی شد، آنها از پروتئین کایمر استرپتوآویدین- پروتئین آ (STV-Pro A) بهعنوان Linker استفاده کردند و چون اولین I-PCR معرفی شده بود، به Original I-PCR معروف شد.
در این سیستم، پروتئین کایمر STV-Pro A از سر Pro A (همان Pro A استافیلوکوکی است که توانایی اتصال به انتهای Fc-IgG را دارد) به Ab تشخیصی و از سر استرپتوآویدین به DNA بیوتینه متصل میشود که در شکل 2 نشان داده شده است. این سیستم دو مشکل عمده داشت:
- فیوژن STV-Pro A در دسترس همه نبود.
- افینیتی Pro A به Abهای مختلف متفاوت است (8).
شکل 2: طرح اولیه Original-I-PCR که توسط Sano ارائه شد (2)
Universal- I-PCR:
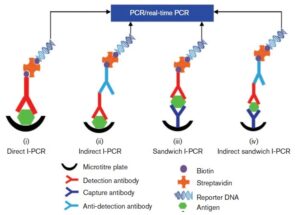
یک سال بعد (1993) Zhou و همکاران برای رفع مشکل استفاده از کایمر STV-Pro A، از سیستم آویدین بیوتین استفاده کردند و به کمک یک Linker استرپتوآویدین، DNA بیوتینه و Ab تشخیصی بیوتینه را به هم متصل کردند. چون Linkerهای آویدین-بیوتین در دسترس همه بود، این سیستم را Universal- I-PCR (U-I-PCR) نامیدند و بعدها این روش با فرمتهای مختلف شبیه الیزا، از جمله U-I-PCR مستقیم، غیرمستقیم، ساندویچ و غیرمستقیم ساندویچ طراحی کردند که همگی در شکل 3 نشان داده شده است. از جمله ایرادات این سیستم، داشتن مراحل متعدد و زمانهای طولانی برای انکوباسیون بود که نتیجه آن افزایش زمان انجام تست است. همچنین این روش تکرارپذیر نیز نبود (9).
شکل 3: مدل U-I-PCR که توسط Zhou معرفی شد و همانند الیزا به هر 4 صورت مستقیم، غیرمستقیم، ساندویچ و ساندویچ غیرمستقیم قابل انجام بود (4)
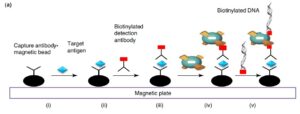
Magnetic-Bead I-PCR:
در سال 2002، Barletta و همکاران از بیدهای مگنتیک برای طراحی نوع جدیدی از سیستم I-PCR استفاده کردند که به Bio-Barcode معروف شد که جزئیات آن در شکل 4 نشان داده شده است. در این سیستم چون از پلیت استفاده نمیشد، اتصالات غیراختصاصی هم کاهش پیدا کرد و به دلیل ساختمان گرد بیدها، در مقایسه با پلیت، آنها میزان کمتری از Agهای زمینه (Background) را جذب میکردند و چون سطح مقطع بیشتری هم داشتند، واکنش بین Abهای متصل به بید با Agها سریعتر و شدیدتر رخ میدهد که در شکل 4 اساس آن نشان داده شده است. همچنین در این سیستم مراحل شستشو و انکوباسیون هم کاهش پیدا کرد (10).
در سال 2007، Wacker و همکاران نوع دیگری از سیستم مگنتیک را معرفی کردند و آن را Magnetosome نامیدند که در آن مگنتها به استرپتوآویدین وصل بودند و توانایی اتصال به Ab تشخیصی بیوتینه را داشتند که نسبت به روشهای مگنتیک قبلی 25 برابر حساستر بود. بعدها محققین متوجه شدند که بیدهای مگنتیک روی مرحله PCR خاصیت مهاری دارند و به فکر استفاده از سایر نانوپارتیکلها افتادند (11).
شکل 4: سیستم مگنتیک که توسط Barletta معرفی شد (3)
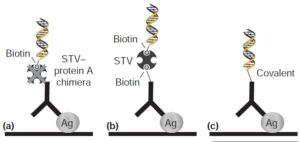
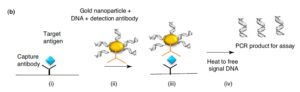
- Nanoparticle Based I-PCR:
مهمترین نانوپارتیکل موردمطالعه، نانوپارتیکلهای طلا (GNP) هستند و سیستم مبتنی بر آنها را GNP- I-PCR گویند. در این سیستم Ag هدف در کف پلیت توسط Abهای پلیکلونال جذب شده و سپس کمپلکس Ab تشخیصی و DNA که توسط GNP به هم متصل شدهاند، به مجموعه اضافه میشود. در پایان DNA توسط حرارت جدا شده و وارد مرحله PCR میشود که جزئیات آن در شکل 5 نشان داده شده است (12).
شکل 5: سیستم GNP- I-PCR (3)
Biologic Based I-PCR:
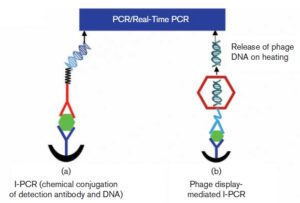
نوعی سیستم I-PCR ابتکاری هستند که اساس آنها از سیستمهای زنده تقلید شده است و من به آنها سیستمهای بیولوژیک میگویم! در این رابطه دو مورد از آنها عبارتند از Phage Display I-PCR (PD- I-PCR) و سیستم Tus-Ter- I-PCR.
شکل 6: در سمت چپ تصویر، I-PCR معمولی نشان داده شده است و در سمت راست آن PD-I-PCR که تحولی در سیستمهای I-PCR ایجاد کرد (4)
سیستم PD- I-PCR، تحولی عظیم در I-PCR ایجاد کرد؛ چون فاژها هم DNA دارند و هم میتوانند Ab تشخیصی را حمل کنند و دیگر نیازی به اتصال DNA و Ab نبود. اســـــــــــــــــاس آن به این صورت است که یک Single chain Fv-IgG (Sc Fv-IgG) در سطح فاژ بیان میشود که میتواند به Ag هدف متصل شود و سپس توسط حرارت، DNA فاژ جدا شده و با PCR اندازهگیری میشـــــود که جزئیات آن در شکل 6 آورده شده است،
ولی مشکل اصلی این روش، افینیتی پایین Sc Fv-IgG در مقایسه با مونوکلونال Ab به Ag است و این امر باعث کاهش حساسیت این روش میشود (13).
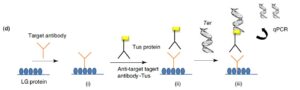
شکل 7: سیستم Tus-Ter- I-PCR که در آن از سیستم پایان رونویسی ا.کلای تقلید شده است (3)
در سیستم Tus-Ter- I-PCR، از پروتئین Tus استفاده میشود (نوعی پروتئین پایان رونویسی در باکتری است که میتواند به سکانسی از DNA در ژن Ter متصل شود). حال Ab ضد Ag هدف را به Tus وصل میکنند که آن هـــم بهصورت ذاتی تمایل اتصال به DNA حاوی ژن Ter را دارد و در اینجا Tus بهعنوان Linker عمل میکند. جزئیات این سیستم در شکل 7 نشان داده شده است (14).
تمامی سیستمهای ابتکاری که عنوان شد، مشکلات I-PCR اولیه را حل کرده و توانستهاند از تکنیک I-PCR یک روش قابلاعتماد برای تشخیص بسازند. همانظور که گفته شد، I-PCR ترکیبی از الیزا و PCR است که محققین در تلاش برای استانداردسازی هر دو بخش هستند. پیشتر، در مورد بهینه کردن مرحله الیزا و اتصال DNA و Ab بحث شد اما همچنان مطالعه روی بخش PCR نیز زیاد است و اینکه بتوان روشی مناسب و بهینه برای اندازهگیری DNA بهصورت کمی طراحی کرد، ادامه دارد. از جمله روشهایی که برای این کار مورد مطالعه گرفته است عبارتند از:
- ژل الکتروفورز: که بسیار وقتگیر و پرزحمت بوده و حساسیت و دقت پائینی هم دارد.
- سیستمهای میکروارری: بسیار مناسب و پربازده هستند و توانایی ارزیابی تعداد زیادی نمونه را بهطور همزمان دارند اما این روش بسیار پرهزینه است.
- روش Real-time PCR: روش ایدهآل و قابلاعتمادی است که با حساسیت و دقت بالا میتواند تعداد DNA تکثیری را بهصورت کمی گزارش کند (2).
کاربردهای I-PCR:
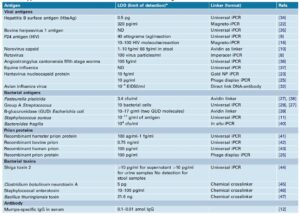
از آنجایی که روش I-PCR باعث کاهش LOD (Limit of Detect) روشهای معمولی مانند الیزا و PCR میشود، دارای کاربردهای وسیعی است. از زمان معرفی این سیستم در سال 1992 تاکنون، روشهای I-PCR از سطح تحقیقاتی تا روشی روتین در آزمایشگاهها، کاربردهای گستردهای داشته که بسیاری از آنها در زمینههای ایمونولوژیک و تشخیص بالینی است که لیست بلندی از آنها در جدول 1 آورده شده است و حتی به مرحله تجاریسازی نیز رسیدهاند که از جمله کمپانی Chimera biotech در این زمینه پیشگــــــام است و توانسته کیت تشخیصی سروتونین را بر مبنای I-PCR که حساسیتی تا 1000 برابر بیشتر از الیزا دارد، روانه بازار کند (11).
- تشخیص Agهای باکتریال:
در این رابطه دو نکته حائز اهمیت است:
- تشخیص سریع و صحیح عفونت در مراحل اولیه
- تشخیص پاتوژنهایی که کشت آنها سخت است و دیررشد هستند؛ بنابراین محققین سراغ روش I-PCR رفتند. برای این منظور، Chang و همکاران نوعی I-PCR ساندویچ طراحی کردند که قادر به شناسایی تنها 40 عدد از مولکول گلوکورونیداز (مارکر تشخیصی باکتری ا.کلای) بود یعنی 108 برابر حساستر از الیزا (15).
- تشخیص توکسینها:
در این مورد، مهمترین توکسین، سم بوتولیسم است که در بیوتروریسم استفاده میشود. در این زمینه Chao و همکاران I-PCR را طراحی کردند که توانایی تشخیص این توکسین را در 50 فمتوگرم داشت و این یعنی 105-104 حساستر از الیزا (16).
- تشخیص عفونتهای انگلی:
یکی از عوامل مهم مننژیت ائوزینوفیلیک در جنوب غربی آسیا، نماتود Angiostrongylus است و تشخیص این انگل بسیار مشکل است چون در CSF بیماران دیده نمیشود. حال Chye و همکاران نوعی I-PCR ساندویچ طراحی کردند که میتوانست آنتیژن Acl5 این نماتود را در سرم بیماران شناسایی کند و حساسیت آن برای بیماران مبتلا به کرم 100درصد و برای افرادی که علائم بیماری داشتند، 97درصد بود (17).
- تشخیص عفونتهای ویروسی
برای تشخیص عفونتهای ویروسی، عمدتاً از نوکلئیک اسید آنها با روش PCR استفاده میشود ولی از عوامل مهم دخیل در پاتوژنز ویروس، پروتئینهای آن هستند که با روش PCR قابلشناسایی نیستند. حساسترین راه تشخیص ویروس HIV، تشخیص RNA ویروسی در پلاسمای بیماران است که تنها قادر است 50 کپی از ذره ویروسی را در هر میلیتر از خون شناسایی کند و برخلاف آن، آنتیژن P24 که در پلاسمای بیماران حضور دارد، نشاندهنده میزان زیادتری از RNA ویروسی است، تشخیص P24 با روش I-PCR در مراحل اولیه عفونت، قدرت تشخیص بیماری را تا 104 برابر بیشتر از الیزا و 25 برابر بیشتر از RT-PCR افزایش میدهد (حدوداً 3000 کپی از P24 نشاندهنده تنها 2 کپی از RNA ویروسی است که در این شرایط، روشهای الیزا و RT-PCR قدرت چندانی برای تشخیص آنها ندارند). همچنین 42درصد بیماران نیز کمتر از 50 کپی RNA ویروسی دارند که با روش RT-PCR قابلشناسایی نیستند، بنابراین Barletta و همکاران I-PCR برای تشخیص P24 طراحی کردند که با حساسیتی بسیار بالاتر از الیزا میتوانست P24 را شناسایی کند (10). در مورد ویروس HBV نیز چنین طراحیهایی صورت گرفته است زیرا زمانی که ویروس برای حضور دائمی در بدن میزان، رونویسی و کپیبرداری از ژنوم خود را کاهش میدهد، تشخیص آن با مشکل روبهرو میشود. محققین با طراحی روشی مبتنی بر I-PCR برای تعیین HBs.Ag، نشان دادند که این روش 25 برابر حساسیت بالاتری نسبت به سایر روشهای ایمونواسی دارد (11).
نتیجهگیری:
در سالهای اخیر، سعی شده است که روشهای مختلف I-PCR را بهینه و استانداردسازی کنند و از آنجایی که این استاندارسازیها مشکل است، هنوز این تکنیک در دوران کودکی خود بسر میبرد و تا رسیدن به آزمایشگاهها و تبدیل شدن به تکنیکی روتین، راه زیادی را باید طی کند؛ اما از آنجایی که مطالعات بسیاری از این روش برای تشخیص انواع عوامل میکروبی، پاتوژن و پروتئینها استفاده کردهاند، پیشبینی میشود که در آیندهای نزدیک، این تکنیک بهعنوان روشی روتین وارد آزمایشگاههای تشخیصی شود.
منابع:
- Houpikian P, Raoult D. Diagnostic methods current best practices and guidelines for identification of difficult-to-culture pathogens in infective endocarditis. Infectious disease clinics of North America. 2002 Jun;16(2):377-92, x. PubMed PMID: 12092478.
- Niemeyer CM, Adler M, Wacker R. Immuno-PCR: high sensitivity detection of proteins by nucleic acid amplification. Trends in biotechnology. 2005 Apr;23(4):208-16. PubMed PMID: 15780713.
- Malou N, Raoult D. Immuno-PCR: a promising ultrasensitive diagnostic method to detect antigens and antibodies. Trends in microbiology. 2011 Jun;19(6):295-302. PubMed PMID: 21478019.
- Mehta PK, Raj A, Singh NP, Khuller GK. Detection of potential microbial antigens by immuno-PCR (PCR-amplified immunoassay). Journal of medical microbiology. 2014 May;63(Pt 5):627-41. PubMed PMID: 24568881.
- Mullis KB. The unusual origin of the polymerase chain reaction. Scientific American. 1990 Apr;262(4):56-61, 4-5. PubMed PMID: 2315679.
- Lequin RM. Enzyme immunoassay (EIA)/enzyme-linked immunosorbent assay (ELISA). Clinical chemistry. 2005 Dec;51(12):2415-8. PubMed PMID: 16179424.
- Brechot C, Degos F, Lugassy C, Thiers V, Zafrani S, Franco D, et al. Hepatitis B virus DNA in patients with chronic liver disease and negative tests for hepatitis B surface antigen. The New England journal of medicine. 1985 Jan 31;312(5):270-6. PubMed PMID: 2981408.
- Sano T, Smith CL, Cantor CR. Immuno-PCR: very sensitive antigen detection by means of specific antibody-DNA conjugates. Science. 1992 Oct 2;258(5079):120-2. PubMed PMID: 1439758.
- Zhou H, Fisher RJ, Papas TS. Universal immuno-PCR for ultra-sensitive target protein detection. Nucleic acids research. 1993 Dec 25;21(25):6038-9. PubMed PMID: 8290366. Pubmed Central PMCID: 310491.
- Barletta J, Bartolome A, Constantine NT. Immunomagnetic quantitative immuno-PCR for detection of less than one HIV-1 virion. Journal of virological methods. 2009 May;157(2):122-32. PubMed PMID: 19138706.
- Wacker R, Ceyhan B, Alhorn P, Schueler D, Lang C, Niemeyer CM. Magneto immuno-PCR: a novel immunoassay based on biogenic magnetosome nanoparticles. Biochemical and biophysical research communications. 2007 Jun 1;357(2):391-6. PubMed PMID: 17428442.
- Perez JW, Vargis EA, Russ PK, Haselton FR, Wright DW. Detection of respiratory syncytial virus using nanoparticle amplified immuno-polymerase chain reaction. Analytical biochemistry. 2011 Mar 1;410(1):141-8. PubMed PMID: 21111702. Pubmed Central PMCID: 4208676.
- Guo YC, Zhou YF, Zhang XE, Zhang ZP, Qiao YM, Bi LJ, et al. Phage display mediated immuno-PCR. Nucleic acids research. 2006;34(8):e62. PubMed PMID: 16682441. Pubmed Central PMCID: 1458518.
- Morin I, Dixon NE, Schaeffer PM. Ultrasensitive detection of antibodies using a new Tus-Ter-lock immunoPCR system. Molecular bioSystems. 2010 Jul;6(7):1173-5. PubMed PMID: 20464017.
- Chang TC, Huang SH. A modified immuno-polymerase chain reaction for the detection of beta-glucuronidase from Escherichia coli. Journal of immunological methods. 1997 Oct 13;208(1):35-42. PubMed PMID: 9433458.
- Chao HY, Wang YC, Tang SS, Liu HW. A highly sensitive immuno-polymerase chain reaction assay for Clostridium botulinum neurotoxin type A. Toxicon: official journal of the International Society on Toxinology. 2004 Jan;43(1):27-34. PubMed PMID: 15037026.
- Chye SM, Lin SR, Chen YL, Chung LY, Yen CM. Immuno-PCR for detection of antigen to Angiostrongylus cantonensis circulating fifth-stage worms. Clinical chemistry. 2004 Jan;50(1):51-7. PubMed PMID: 14709636.
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام