IMMUNO-PCR
هادی عتباتی، کارشناسی ارشد ایمونولوژی
چکیده
بطور کلی «واکنش زنجیره پلیمراز» به روش ازدیاد مقادیر جزئی DNA یا RNA تا حد مشاهده آنها توسط روشهای ساده و رایج آزمایشگاهی اطلاق میشود که در سال1984 توسط کری مولیس ارائه شد و پایه اولیه بسیاری از تکنیکهای جدیدPCR را سبب شد. همچنین تکنیکهای زیادی هم در زمینه سنجش انواع پروتئینها و آنتیژنهای پروتئینی همچون الایزا در سال 1971 توسط Peter Perlmann و Eva Engvall مطرح شد. در سالهای اخیر تکنیک بسیار حساس و دقیقی بنام immune-PCR ارائه شد که ترکیبی از هر دو روش الایزا و PCR بوده و میزان LOD (محدوده تشخیص) را به میزان 100 تا 10000 برابر افزایش میدهد. تکنیک IMMUNO-PCR بر اساس تشخیص انواع آنتیژنهای پروتئینی و افزایش قدرت سیگنالدهی آن به روش PCR میباشد. این روش در سالهای اخیر بسیار مورد توجه قرار گرفته و برای تعیین بسیاری از آنتیژنهای ویروسی و باکتریایی در بیماریهای مختلف استفاده شده است
مقدمه
تاریخچه تکامل تکنیک immuno-PCR تقریباً مربوط به 15 سال اخیر میباشد. ایده اولیه ترکیب اتصال آنتیبادی به یک آنتیژن با قدرت تقویت سیگنالدهی PCR به شکل اولیه خودش مربوط به سال 1992 است و Sano/Smith پروتوکل اولیه IPCR را ارائه داد که این پروتوکل برعکس پروتوکل Elisa بود؛ بدین صورت که در الایزا از ترکیب Ab-Ag استفاده میشود و سوبسترای آنزیم به صورت آزاد و پراکنده اضافه میشود ولی در تکنیک immune-PCR سوبسترای آنزیم با همان الگوی DNA به آنتیبادی متصل میشود و آنزیم بعداً به آن اضافه میشود که با تقویت DNA نشاندار شده در این تکنیک قدرت LOD بین 100 تا 10000 برابر افزایش مییابد. بعد از گذشت سالها و پیشرفت تکنولوژی، با تکمیل مدل اولیه کار Sano و همکارانش در بین سالهای 1993تا 1995 پروتوکلی کاملتر بنام universal-IPCR ارائه شد و در سالهای بین 2004 تا 2011 نسلهای کاملتری شامل Magneto –IPCR/ BIO-barcode/Tus-Ter system ارائه شد که بدلیل کاهش زمان انجام آزمایش، کاهش تعداد مراحل شستشو، کاهش میزان آلودگی نمونهها و … باعث افزایش Sensitivity و Specifity میشود.
ساختار و عملکرد IPCR
این تکنیک در حقیقت ترکیبی از روش الایزا وPCR است، بدین صورت که قدرت تشخیص آنتیژنهای پروتئینی را با توجه به روش الایزا داشته و از طرفی با استفاده از روش real time PCR این توانایی را دارد که بطور اختصاصی فقط توالی مربوط به آنتیژن هدف را شناسایی نموده و طی سیکلهای متعدد PCR این توالی را برای تشخیص دقیقتر افزایش دهد، در نتیجه بدلیل قدرت بسیار بالایی که در تشخیص آنتیژنهای پروتئينی و آنتیبادی پروتئینی دارا است این روش بیشتر برای اجزای آنتیژنهای باکتریایی و ویروسی بکار میرود (VP6 رتروویروسها، P24 ویروس ایدز، پروتئین A استافیلوکوک اورئوس و …).
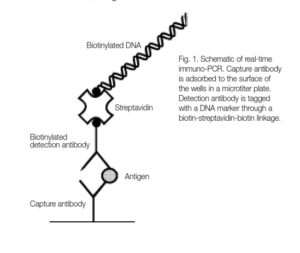
تکنیک IMMUNO-PCR تشکیل شده از:
- Ab Detection
- Capture Ab
- Biotinylated-DNA
- Linker بین DNA و آنتیژن
- میکروپلیت
- Real-time PCR
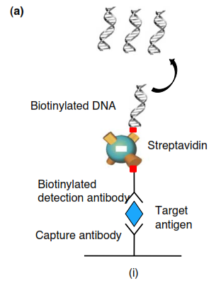
در ابتدا آنتیژن موردنظر در کف میکروپلیتها coat میشود، سپس detection Ab را در محیط قرار داده و بعد از اتصال و انجام مراحل شستشو مولکولlinker اضافه میشود و بدین صورت بین مجموعه Ab –Ag و DNA نشاندار شده اتصال برقرار میگردد. در این تکنیک پروتئین Streptavidin به عنوان مولکول اتصالدهنده مورد استفاده قرار میگیرد. در ادامه بعد از انجام مراحل شستشو و اتصال آنتیژن موردنظر با آنتیبادی متصل شده با DNA مراحل PCR توسط تکنیک real time PCR انجام میگیرد. نهایتاً بعد از گذشت سیکلهای متعدد و انجام امپلیفیکاسیون، قطعه ژن موردنظر، آنتیژن موردنظر یا آنتیبادی موردنظر با حساسیت بسیار بالایی تشخیص داده میشود. نکته بسیار مهم تنوع نمونههای آزمایش است که عبارتند از:
- سرم
- ادرار
- مدفوع
- عصاره گیاهی
- محیط کشت سلولی
Universal –IPCR
برای مدتهای طولانی سیر پیشرفت IPCR وابسته به دو فاکتور بسیار مهم بوده است:
- تکامل و پیشرفت استراتژیهایی که بتواند اتصال و جفت شدن DNA-Marker با Ab را پایدار نماید تا زمان انکوباسیون را کاهش بدهند.
- روشی را طراحی نمایند تا بتوانند توسط آن محصولات DNA تولید شده را تعیین کنند.
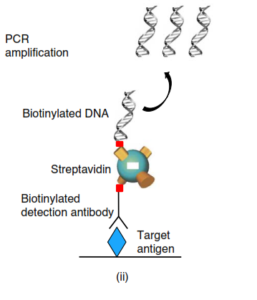
از سال 2004 به بعد و با پیشرفت سریع علم با جایگزین کردن پروتئین Strevadine بعنوان اتصالدهنده و رابط بین DNA و Ab، مشکل ارتباط بین DNA و Ab را برطرف نمودند و از طرفی با قرار دادن ژل الکتروفورز و یا real time PCR توانستند بطور کمی و دقیق میزان تولیدات DNA را تعیین نمایند. با برطرف نمودن این موانع فرمت اصلی در روشهای تحقیقاتی بنام Universal –IPCR معرفی شد. این فرمت براساس نحوه قرارگیری و اتصالات Ab وAg به سه روش طراحی شد:
- Sandewich
- Direct
- Associated with Elisa
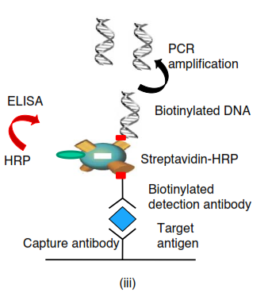
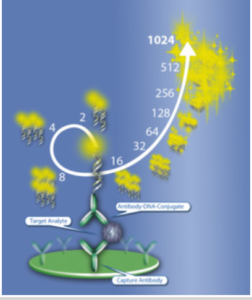
ملکول streptavidin یک ویژگی بسیار مهم دیگری هم دارد؛ علاوه بر اینکه نقش اتصالدهنده بین DNA بیوتینیله و آنتیبادی را بازی میکند این توانایی را دارد که به آنزیمهای خاصی متصل شود که بیشتر آنزیم پراکسیداز بوده و با متصل شدن این آنزیم و واکنش رنگزایی، واکنش الایزا هم رخ میدهد که همان روش سوم است (Associated with Elisa). در این واکنش بعد از Detect کردن Ag موردنظر و شستشو و حذف اتصالات غیراختصاصی (nonspesefic) واکنش وارد مرحله PCR شده و در حقیقت DNA دورشتهای نشاندارشده با بیوتین که حاوی آنتیژن موردنظر بوده شروع به تکثیر میکند و DETECTIONرا بشدت افزایش داده و بدین صورت Sepesifity و sensitivity بین 10000 -100 برابر افزایش مییابد..
IPCR associated with new technologies
تکنیک UNIVERSAL-IPCR باوجود تأثیر زیادی که در پیشرفت علم مولکولی دارد و باعث افزایش اختصاصیت و حساسیت آزمایش میشود، ولی معایبی هم دارد که باعث شده تحقیقات گستردهتری انجام شود و روشهای متنوعتری ارائه بشوند که تحت عنوان تکنولوژیهای جدید مرتبط با IPCR (IPCR associated with new technologies) مطرح شدهاند. این معایب عبارتند از:
- درمقایسه با الایزا روش UNIVERSAL-IPCR دارای پروتوکلهای پیچیدهتری بوده که باعث افزایش میزان ERROR میشود.
- روش UNIVERSAL-IPCR بدلیل باندهای غیراختصاصی دارای خطای bachgraund بالایی است.
- عدم reproducibility به دلیل تأثیر ماتریکس (matrix-effect)
برای برطرف کردن این موانع، شرکتهای مختلف ایدههای متفاوتی را ارائه دادند که باعث برطرف شدن مشکلات و ظهور روشهای جدید شد:
- تهیه کیتهای محلول آماده و محلولهای reagent آماده که باعث شد هم مراحل کار آسان شود و هم روشهای استانداردسازی دقیقتر شوند.
- ارائه محلولهای blocking و Diluent متفاوت که با کاهش تأثیر ماتریکس، خطاهای Backgraund کاهش یابد.
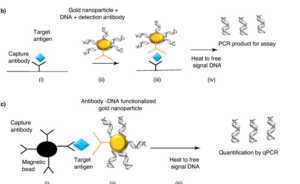
- استفاده از فرمتهای قدیمی که بر روی سطوح میکروپلیتها طراحی میشد، بدلیل ظرفیت اتصالی بالایی که دارند باعث اتصالات غیراختصاصی میشدند، به همین دلیل فرمت جدیدی ارائه شد که به صورت مایع بوده و بجای میکروپلیتهای جامد از ذرات ریزمگنت استفاده میشود که تکنیک نانو تولید شده و توانایی اتصالات اختصاصی را بالا برده و باعث افزایش اختصاصیت و حساسیت میشود.
بدین صورت تکنیک جدید IPCR ارائه شد که براساس نوع ساختار و عملکرد خود شامل سه روش متفاوت است:
- Magnetic-IPCR
- Bio-barcode-IPCR
- Tus-Ter system
Magnetic-IPCR
در این فرمت ساختار پایه تکنیک IPCR حفظ شده است، با این تفاوت که از فاز مایع بجای میکروپلیت استفاده شده و Ag موردنظر را بر روی nano particleها نصب نموده و از ذرات nano magnetic برای جذب آنتیژنهای موردنظر استفاده مینمایند.
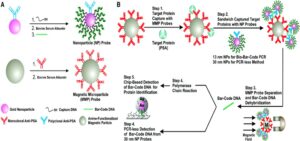
استفاده از این ذرات مگنتیک در روش مذکور باعث افزایش اختصاصیت فرمتهای جدید میشوند بدلیل:
- کاهش زمان انجام آزمایش
- کاهش مراحل شستشو و انکوباسیون
- کاهشinteraction های غیراختصاصی، بدلیل عدم استفاده از میکروپلیتها که دارای ظرفیت بالایی برای پروتئینهای مختلف هستند.
- سطح اتصال بسیار بالای ذرات نانو برای اتصال آنتیژن موردنظر نسبت به میکروپلیت
منابع:
- Barletta, J. et al. (2009) Immunomagnetic quantitative immuno-PCRfor detection of less than one HIV-1 virion. J. Virol. Methods 157, 122–132
- Perez, J.W. et al. (2011) Detection of respiratory syncytial virus using nanoparticle amplified immuno-polymerase chain reaction. Anal. Biochem. 410, 141–148
- Morin, I. et al. (2010) Ultrasensitive detection of antibodies using a new Tus-Ter-lock immunoPCR system. Mol. Biosystems 6, 1173–1175
- Ron Wacker*a and Christof M. Niemey (2012) Sensitivity by combination: immuno-PCR and related technologies Michael Adler,DOI: 10.1039/b718587c
- Deng, M.J. et al. (2010) A highly sensitive immuno-PCR assay for detection of H5N1 avian influenza virus. Mol. Biol. Rep. 38, 1941–1948
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام