مروری بر آزمون ELISPOT
الهام عبدالهی، دانشجوی دکترای تخصصی ایمونولوژی پزشکی دانشکده پزشکی، دانشگاه علوم پزشکی مشهد
امیرعباس ممتازی بروجنی، دانشجوی دکترای تخصصی بیوتکنولوژی پزشکی، دانشکده پزشکی دانشگاه علوم پزشکی مشهد
فتانه توسلیان، دانشجوی دکترای تخصصی ایمونولوژی پزشکی، دانشکده پزشکی، دانشگاه تربیت مدرس
چکیده
آزمون ELISPOT (Enzyme linked immunospot) که اساس انجام آن مانند آزمون الایزا است، به منظور تعیین فراوانی انواع سلولهای ایمنی مترشحه مانند زیرمجموعههای سلولهای T، سلولهای B و سلولهای ایمنی ذاتی به کار میرود. در مقایسه با تکنیک الایزا، اجرای آزمون ELISPOT آسانتر بوده و دارای حساسیت بالاتری است (20 تا 200 بار بیشتر از روش الایزا). این آزمون توانایی شناسایی 1 سلول در 100,000 سلول را داراست. در آزمون ELISPOT توانايی سلول ترشح كننده با شمارش نقاط ایجاد شده در كف چاهكها بررسی میشود. واحد اندازهگیری، تکنیک SFC(Spot forming cells) است که سنجش كمی و ارزیابی فعاليت ترشحی سلولی را امکانپذیر میسازد. در این مقاله مروری سعی شده تا بررسی جامعی بر جنبههای مختلف این آزمون انجام شود.
مقدمه
تاریخچه
در سال 1983 دو محقق به نامهای Sedgewick و Holt مقالهای مبنی بر استفاده از تکنیک جدیدی برای شمارش سلولهای ترشح کننده آنتیبادی در مجله روشهای ایمونولوژیک (Immunological methods) منتشر کردند. اساس این روش همانند الایزا بود؛ آنتیژنی که روی یک سطح جامد ثابت شده بود (دیش پلاستیکی) با آنتـیبادی آزاد شــده از ســلولهای طحال واکنـــش میداد.
در همان سال مقاله دیگری در همــان مجــله توســط Czerkinsky و همـکاران منتـــشر شد. آنـها در این مـقاله، این تکنیک را ELISPOT (Enzyme linked immunospot) نامگذاری کردند. بعدها تکنیک اولیه تغییر داده شد، بدین صورت که سطح جامد به جای آنتیژن به وسیله آنتیبادی پوشیده شد تا آنتیژنهای آزاد شده از سلولها مانند سایتوکاینها بتوانند توسط این آنتیبادی به دام بیفتند. این تکنیک برای افتراق از تکنیک اولیه Elispot معکوس یا وارونه (Reverse Elispot) نامیده شدکه موارد استفاده آن بیشتر از تکنیک اولیه بود.
مزایای آزمون ELISPOT
آزمون ELISPOT فعالیت ترشحی سلولهای منفرد را میتواند مورد ارزیابی قرار دهد که جنبه منحصر به فرد تکنیک است. واحد اندازهگیری تکنیک SFC(Spot forming cells) است که سنجش كمی و ارزیابی فعاليت ترشحی سلولی را امکانپذیر میسازد. در مقایسه با روشهایی که بر اساس سنجش آنالیت در سرم است {مانند الایزا، سنجش سایتوکاین به وسیله bead ها (CBAs)} این تکنیک دارای حساسیت بالاتری است، زیرا مواد ترشحی مورد سنجش در آزمون Elispot پس از آزاد شدن از سلولها، سلولها را فرا گرفته و قبل از رقیق شدن در محیط و یا قبل از تأثیر پروتئازها بر آنها و یا اتصال به رسپتورهای محلول و حذف شدن، به آنتیبادی پوشاننده متصل میشوند.
مقایسه آزمونهای الایزا و ELISPOT
- حساسیت آزمون 20 تا 200 برابر بیشتر از آزمون الایزا است. حساسیت آزمون حدود 100% است.
- در آزمون الایزا حداقل 104 سلول لازم است تا سایتوکاینهای ترشحی به اندازهای برسند که قابل سنجش باشند، در حاليكه در ELISPOT محصول تنها حدود ۱۰ تا ۱۰۰ سلول در هر چاهك برای سنجش فعالیت سلولهای تولیدکننده سایتوکاین کافی است.
- همانطور که اشاره شد مواد ترشحی مورد سنجش در آزمون Elispot پس از آزاد شدن از سلولها، سلولها را فرا گرفته و قبل از رقیق شدن در محیط و یا قبل از تأثیر پروتئازها بر آنها و یا اتصال به رسپتورهای محلول و حذف شدن، به آنتیبادی پوشاننده متصل میشوند در حالیکه در آزمون الایزا ممکن است قسمتی از آنالیت مورد سنجش حذف شود و مورد بررسی قرار نگیرد
- در آزمون الایزا سایتوکاینها مورد سنجش قرار میگیرند که دارای نیمهعمر پایینی هستند.
برای رفع این مشکل باید حجم نسبتاً زیاد سرم را هم اضافه کرد که باعث میشود مقادیر ناچیز ترشح شده بسیار رقیق شود.
کلیات روش انجام سنجش ELISPOT
- ابتدا سلولها در چاهکهایی که توسط آنتیبادی به دام اندازنده (Capture antibody) پوشیده شدهاند قرار داده میشوند. (پس از کشت دادن سلولها یا حتی بدون کشت و مستقیماً پس از جداسازی از خون محیطی) و به مدت زمان معینی، به منظور اتصال ترشحات سلولها (به عنوان آنتیژن) به آنتیبادی پوشیده شده انکوبه میشوند.
- پس از اتصال ترشحات، به منظور حذف سلولها شستشو انجام میشود.
- در این مرحله آنتیبادی شناساگر (Detection antibody) کونژوگه شده به بیوتین اضافه میشود.
- آنزیم متصل شده به استرپتواویدین افزوده میشود. استرپتواویدین میل ترکیبی بالایی به بیوتین دارد و از این طریق کمپلکس کامل شکل میگیرد.
- افزوده شدن سوبسترا. با عملکرد آنزیم بر روی سوبسترا محصول رنگی تولید میشود و نهایتاً به وسیله دستگاه Elispot reader نقاط شناسایی میشوند. مراحل مختلف در شکل 1 نمایش داده شده است
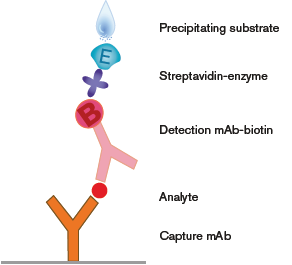
اصول ایمونوشیمیایی آزمون ELISPOT
اگرچه اصول تکنیک ELISPOT همانند روش الایزا است اما دو تفاوت عمده بین این دو تکنیک وجود دارد: در روش الایزا غلظت سایتوکاین اندازهگیری میشود در حالیکه در روش ELISPOT تعداد سلولهای ترشح کننده سایتوکاین شمارش میشوند، بنابراین باید توجه داشت این دو تکنیک را نمیتوان به جای یکدیگر به کار برد. ثانیاً الایزا روش سنجشی از نوع ایمونواسی است؛ بدین معنی که سلولها قبل از سنجش کشت داده نمیشوند در صورتی که سنجش Elispot تلفیقی از سنجشهای ایمونواسی و بیواسی است و سلولهای زنده میتوانند به طور مستقیم در پلیتهای Elispot کشت داده شوند.
عوامل مؤثر در اجرای آزمون ELISPOT
انجام روش ELISPOT به کیفیت 4 جزء بستگی دارد که در ادامه شرح داده خواهد شد.
1) آنتیبادیها (هر دو نوع آنتیبادی به دام اندازنده و شناساگر)
2) آنزیم کونژوگه شده
3) سوبسترای کروموژنیک
4) میکروپلیتها
از آنجا که فعالیت ترشحی سلولها به وسیلهی تعداد نقاط ارزیابی میشود، بنابراین هر چهار جزء باید مورد توجه قرار گرفته تا شکل گیری و تشخیص نقاط آسان باشد. باید توجه شود که نقاط به خوبی رنگآمیزی شوند و مرز بین نقاط قابل تشخیص باشند.
- آنتیبادیها
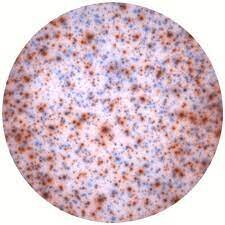
در آزمون ELISPOT آنتیبادی پوشاننده و شناساگر میتوانند شامل هر دو نوع آنتیبادی منوکلونال و پلیکلونال باشند. این دو نوع آنتیبادی میتوانند علیه آنتیژن کامل (آنتیبادی علیه پروتئین نوترکیب) و یا علیه قسمتی از آنتیژن (آنتیبادی علیه پپتید) باشند. نکته مهم در انتخاب آنتیبادی پوشاننده و شناساگر این است که این آنتیبادیها علیه اپیتوپهای مختلف (اپیتوپهای غیرهمپوشان) باشند. بنابراین استفاده از یک نوع آنتیبادی منوکلونال برای هر دو نوع آنتیبادی پیشنهاد نمیشود. مناسب بودن یک نوع آنتیبادی برای آزمونهای وسترنبلات، الایزا یا ایمونوهیستوشیمی به معنی مناسب بودن آن برای سنجشELISPOT نیست. تنها راه مورد اطمینان به منظور شناسایی نوع مناسب آنتیبادی آزمودن آن آنتیبادی در یک آزمون ELISPOT است. غلظت آنتیبادیهای پوشاننده بر اندازه، شدت رنگ نقاط و تفکیک مرز و رنگ زمینه مؤثر است (شکل 2).
شکل 2: تأثیر غلظت آنتیبادی پوشاننده (Capture antibody) بر اندازه نقاط و رنگآمیزی زمینه
در آزمون ELISPOT آنتیبادی شناساگر به بیوتین متصل میشود، زیرا با اتصال بیوتین به استرپتواویدین متصل به آنزیم نتیجتاً کمپلکس کامل ایجاد میشود. دلیل دیگر استفاده از بیوتین جلوگیری از واکنش متقاطع است. در صورتیکه آنتیبادی به صورت مستقیم به آنزیم کونژوگه شود و هر دو نوع آنتیبادی شناساگر و پوشاننده از یک گونه منشأ گرفته شده باشند (مانند موش)، آنتیبادیها (مثلاً ضد موشی) میتوانند به هر دو نوع آنتیبادی پوشاننده و شناساگر متصل شوند که مطلوب نیست. اگر آنتیبادی شناساگر به طور مستقیم به آنزیم کونژوگه شود به عنوان اتصال مستقیم (direct conjugation) شناخته میشود و در این مورد حساسیت کاهش مییابد.
کونژوگه آنزیمی
آنزیمهای HRP (Horse Radish Proxidase) و یا آلکالن فسفاتاز (AP) میتوانند به استرپتواویدین کونژوگه شوند و در آزمون Elispotمورد استفاده قرار میگیرند. PH مناسب آنزیم HRP حدود 7/6 است. این آنزیم در حضور هیدروژن پراکسید منجر به اکسیداسیون سوبسترا میشود نتیجتاً سوبسترا به دلیل از دست دادن الکترون محصول رنگی ایجاد میکند. مزیت استفاده از HRP نسبت به آنزیم آلکالن فسفاتاز این است که دارای سرعت واکنش بالاست (نقاط سریعتر پدیدار میشوند) ولی نقص آن این است که باعث افزایش رنگ زمینه میشود. برخلاف آنزیم HRP، PH مناسب آنزیم AP حدود 9-6/9 است. سرعت واکنش آن به صورت خطی است (نقاط آهستهتر پدیدار میشوند) به همین دلیل است که زمان انکوباسیون آنزیم AP با سوبسترای کروموژنیک طولانیتر است.
احتمال ایجاد رنگ زمینهای در صورت استفاده از آنزیم AP کمتر است. در یک آزمون ELISPOT که هر دو نوع آنزیم HRP و AP استفاده میشوند میتوان دو نوع سلول ترشح کننده را شناسایی کرد. اشکال اصلی سیستم چند آنالیتی این است که حساسیت برای شناسایی هر آنتیژن کاهش مییابد. در صورت سنجش همزمان IL-2 و IFNˠ (کف چاهک به وسیله دو نوع آنتیبادی پوشیده شده است) مشاهده شده است که تعداد نقاط به طور قابل ملاحظهای کمتر از زمانی است که هریک از دو سایتوکاین به صورت منفرد بررسی میگردند. زمانی که از دو نوع آنتیبادی پوشاننده در سنجش Elispot استفاده شود حساسیت آزمون کاهش مییابد که دلیل آن ناشناخته است و بررسیهای بیشتری برای یافتن راهحلهایی جهت افزایش حساسیت در سیستمهای چند آنالیتی موردنیاز است.
سوبسترای آنزیمی
صرفنظر از اینکه چه نوع آنزیمی مورد استفاده قرار میگیرد، سوبسترا باید بتواند رنگ قوی و پایداری ایجاد کند.
یکی از سوبستراهای آنزیم HRP، AEC (3-amino-9-ethylcarbazole, C14H14N2)است کـه نـقاط قـرمـز پـررنـگی ایـجاد مـینـمایـد. البتـه ایـن مـاده ناپایدار است و نقاطی که ایجاد میکنــــد پس از مدتی رنگ خـــود را از دســــــت میدهند. سوبســـــــــــــترای دیگر آنزیم HRP، DAB (diamino benzidine-C12H14N4) است که نقاط قهوهای رنگ کمرنگتری نسبت به سوبسترای AEC ایجاد مینماید. اگرچه این ماده نسبت به AEC پایدارتر است و نقاط ایجاد شده نیز پایدارترند ولی سمی و سرطانزاست.
یکی از رایجترین سوبستراها برای آنزیم آلکالن فسفاتاز مخلوطی از
( BCIP 5-bromo-4-chloro-3-indolylphosphate p-toluidine) و NBT (Nitroblue tetrazolium chloride) است که تشکیل نقاط مشکی- آبی پررنگی را میدهد. به دلیل پایداری بالای سوبسترای BCIP/NBT نقاط ماندگارند و پلیتهای آزمون میتوانند پس از گذشت سالها مورد آنالیز مجدد قرار بگیرند.
میکروپلیتها
جنس میکروپلیتها میتواند از دو نوع PVDF (polyvinylidene diflouride) و یا نیتروسلولز باشد. این پلیتها نسبت به پلیتهای پلاستیکی توانایی بالاتری در اتصال به آنتیبادی پوشاننده دارند (به دلیل سطح وسیعتر) شرکتهای زیادی تولید کننده این میکروپلیتها هستند ولی پلیتهایی مناسب هستند که نقاط ایجاد شده بر کف آنها راحتتر حذف میشوند.
آنالیز نتایج آزمونELISPOT
شمارش نقاط در آزمون ELISPOT: پس از اتمام آزمون، نقاط میتوانند به دو روش دستی یا کامپیوتری که از نقاط تصویربرداری میکنند، شمارش شوند. شمارش دستی به وسیله میکروسکوپ انجام میشود و مشکل و زمانبر است ولی به نظر میرسد دارای حساسیت بالاتری نسبت به روش کامپیوتری است و به محقق این امکان را میدهد تا بتواند نقطههای کمرنگ و بسیار کوچک را از نظر واقعی یا غیرواقعی بودن بررسی نماید. البته خطاهایی نیز ممکن است در روش شمارش دستی ایجاد شود، به عنوان مثال ممکن است نقاط بسیار کوچک مورد شمارش قرار نگیرند، در حالیکه دو نقطه نزدیک به هم ممکن است به عنوان یک نقطه شمارش شود.
در آنالیز کامپیوتری از هر چاهک عکسبرداری میشود. در این سیستم از اجزای بارداری (charged coupled divice) یا CCD به منظور آشکارسازی و عکسبرداری دیجیتال استفاده میشود. متأسفانه در این سیستم اندازه پیکسل )واحد کوچک تصويري به اندازه يک نقطه که با قرار گرفتن مجموع زيادي از آنها در کنار هم يک عکس يا صفحه تصويري تشکيل ميگردد) محدویتهایی در شناسایی و تفکیک نقاط بسیار کوچک و یا تفکیک نقاط نزدیک به هم دارد، بنابراین برای شمارش صحیح نیاز است اندازه پیکسلها، حداقل نصف اندازهی کوچکترین نقاط باشد. شکل 3 تصویر چاهک آزمون را پس از اتمام سنجش نشان میدهد.
شکل 3: تصویر چاهک آزمون ELISPOT سلولهای ترشح کننده IFNˠ (شکل سمت چپ). در شکل سمت راست سلول ترشح کنندهای وجود ندارد.
مشکلات آزمون ELISPOT
- رنگآمیزی: کیفیت رنگآمیزی مهمترین عامل در شمارش صحیح نقاط است. در رنگآمیزی ممکن است دو مشکل ایجاد شود: یکی در رنگآمیزی زمینه و دیگری در رنگآمیزی خود نقاط. رنگ زمینه به رنگی اطلاق میشود که هر قسمتی از کف چاهک را بپوشاند. رنگ زمینه به دو نوع اختصاصی و غیراختصاصی تقسیم میشود؛ رنگ زمینه اختصاصی در نتیجه اتصال اختصاصی سلولهای ترشح کننده به آنتیبادی پوشاننده است در نتیجه مولکولهایی که از این سلولها آزاد میشوند و طبیعتاً باید به این آنتیبادی متصل شوند، از آن جدا میشوند و فقط به قسمتهایی از کف چاهک متصل میشوند که سلول به آن قسمت متصل نشده باشد. رنگآمیزی اختصاصی هنگامی اتفاق میافتد که در مرحله انکوباسیون سلولها اختلالی ایجاد شود، بنابرین هنگامی که سلول به چاهک اضافه شد و سپس در انکوباتور قرار داده شد، نباید حرکت داده شود و زمان انکوباسیون باید به طور کامل طی شود. رنگ زمینه غیراختصاصی در نتیجه اتصال سایر اجزای آزمونELISPOT (آنتیبادی شناساگر، کونژوگه آنزیمی و سوبسترا) به آنتیبادی پوشاننده است. شناسایی عامل ایجاد این نوع رنگآمیزی به دلیل اینکه چندین عامل سبب ایجاد آن است، دشوار است. هر دو نوع رنگآمیزی اختصاصی و غیراختصاصی زمینه مانع از شمارش صحیح نقاط میشوند. راهحلی که برای کاهش و از بین بردن هر دو نوع رنگ زمینهای پیشنهاد میشود، استفاده از پوشش آلومینیومی است. این پوشش سبب میشود نقاط به صورت متقارن تقسیم شوند. دلیل اینکه پوشش آلومینیومی باعث کاهش رنگآمیزی زمینهای میشود ناشناخته است. به نظر میرسد این پوشش باعث پخش شدن حرارت به صورت یکنواخت در طی انکوباسیون در انکوباتور CO2 میشود.
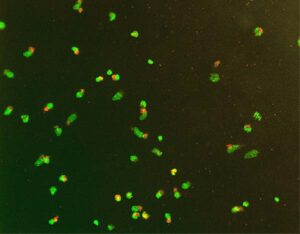
- سلولها: کیفیت رنگآمیزی به درصد زنده بودن سلولهای کشت داده شده نیز وابسته است. تعیین درصد سلولهای مرده از اهمیت خاصی برخوردار است زیرا تعداد زیاد سلولهای مرده (50-30 درصد) میتواند منجر به ایجاد رنگآمیزی زمینه شود که باعث عدم نمایش نقاط اختصاصی میگردد. در برخی موارد با اینکه تعداد سلولهای مرده کم است (مثلاً حدود 5 درصد) نقاط شکل نمیگیرند که به علت اپوپتوز است (شکل 4). راهکار کاهش اپوپتوز سلولها، ایجاد سوسپانسیون سلولی است، سپس آن را باید فریز کرد و در مایع ازت نگهداری نمود (فرایند Cryo preservation). این سلولها مانند سلولهای تکهستهای خون محیطی تازه قادر به ترشح IFNˠ هستند. استفاده از سلولهای منجمد شده در کارآزماییهای بالینی دارای مزایایی است. فرایند انجماد مانع از تغییر بیولوژیک نمونه که در یک زمان خاص جمعآوری شده است، میشود. همچنین این سلولها در ترشح برخی از سایتوکاینها فعالتر هستند.
شدت رنگپذیری به تعداد سلولهای قرار داده شده در چاهکها نیز بستگی دارد. تعداد بیش از حد سلولها در هر چاهک میتواند منجر به ایجاد رنگ شدید و رنگآمیزی اختصاصی زمینه گردد، بنابراین پیشنهاد میشود رقتهای متوالی سلولی (103،104،105،106 و…) از هر نمونه استفاده شود.
شکل 4: داخل سلولهای اپوپتوز شده در آزمون ELISPOT
- فرایند شستشو: هدف از شستشو، حذف سلولها و عوامل مداخلهگر و کاهش شدت رنگ زمینه است. شستشوی چاهکها به وسیله مایع phosphate-buffered saline) PBS) انجام میشود. در برخی موارد سلولها بسیار چسبنده هستند و حذف کامل آنها نیازمند استفاده از آنزیمهای جدا کننده است.
کاربرد بالینی آزمون ELISPOT
در زمینه کارآزماییهای بالینی، آزمون ELISPOT استفاده زیادی در موارد زیر دارد:
طراحی واکسن، تعیین نقشه اپیتوپیک سلولهای T ، تحقیقات در زمینه بیماری ایدز، مطالعه سرطان، عوامل عفونی، آلرژی، پیوند و بیماریهای اتوایمیون و بررسی اپوپتوز.
میتوان امیدوار بود که در آیندهای نه چندان دور، از این آزمون در تشخیصهای آزمایشگاهی بهره ببریم. به عنوان مثال در تشخیص بیماری سل فعال میتوان از این آزمون استفاده کرد که در مرحله کارآزمایی بالینی مثمر ثمر بوده است. در تشخیص این بیماری سنجشELISPOT حساستر و اختصاصیتر از آزمون رایج PPD است که در شناسایی بیماری سل نهفته کاربرد دارد. همچنین این آزمون در تشخیص بیماران مبتلا به آلرژی حساس به فلز نیکل نیز کاربرد دارد. این نکته در خور توجه است که به منظور استفاده از این تکنیک در روشهای روتین تشخیص آزمایشگاهی باید تغییراتی در انجام آزمون ایجاد نمود.
اول اینکه حجم نمونه مورد استفاده باید کمتر شود که این مسئله در مورد کودکان اهمیت بیشتری مییابد. ثانیاً اینکه دستگاه آنالیز با کاربرد آسانتر برای اپراتورها و پرسنل آزمایشگاهی طراحی شود. سوم اینکه برروی میکروپلیتها فضای کافی جهت چسباندن مشخصات بیماران وجود داشته باشد و چهارم اینکه سوبستراهایی که جهت ایجاد رنگ استفاده میشوند به اندازهی کافی پایدار باشند تا بتوان نمونهها را پس از گذشت مدت زمان طولانی، در صورت نیاز دوباره مورد آنالیز قرار داد.
نتیجهگیری
با توجه به مطالب ذکرشده میتوان با انجام اصلاحاتی، در آینده از این تکنیک به عنوان روش تشخیصی سودمندی در آزمایشگاهها استفاده نمود.
منابع:
- Achkar JM, Lawn SD, Moosa M-YS, Wright CA, Kasprowicz VO. Adjunctive tests for diagnosis of tuberculosis: serology, ELISPOT for site-specific lymphocytes, urinary lipoarabinomannan, string test, and fine needle aspiration. Journal of Infectious Diseases. 2011;204(suppl 4):S1130-S41.
- Arvilommi H. ELISPOT for detecting antibody‐secreting cells in response to infections and vaccination. Apmis. 1996;104(1‐6):401-10.
- Carvalho LH, Hafalla JC, Zavala F. ELISPOT assay to measure antigen-specific murine CD8+ T cell responses. Journal of immunological methods. 2001;252(1):207-18.
- Casey R, Blumenkrantz D, Millington K, Montamat-Sicotte D, Kon OM, Wickremasinghe M, et al. Enumeration of functional T-cell subsets by fluorescence-immunospot defines signatures of pathogen burden in tuberculosis. PloS one. 2010;5(12):e15619.
- Crotty S, Aubert RD, Glidewell J, Ahmed R. Tracking human antigen-specific memory B cells: a sensitive and generalized ELISPOT system. Journal of immunological methods. 2004;286(1):111-22.
- Currier JR, Kuta EG, Turk E, Earhart LB, Loomis-Price L, Janetzki S, et al. A panel of MHC class I restricted viral peptides for use as a quality control for vaccine trial ELISPOT assays. Journal of immunological methods. 2002;260(1):157-72.
- Czerkinsky CC, Nilsson L-Å, Nygren H, Ouchterlony Ö, Tarkowski A. A solid-phase enzyme-linked immunospot (ELISPOT) assay for enumeration of specific antibody-secreting cells. Journal of immunological methods. 1983;65(1):109-21.
- Díaz I, Mateu E. Use of ELISPOT and ELISA to evaluate IFN-γ, IL-10 and IL-4 responses in conventional pigs. Veterinary immunology and immunopathology. 2005;106(1):107-12.
- Favre N, Bordmann G, Rudin W. Comparison of cytokine measurements using ELISA, ELISPOT and semi-quantitative RT-PCR. Journal of immunological methods. 1997;204(1):57-66.
- Grant A, Palzer S, Hartnett C, Bailey T, Tsang M, Kalyuzhny AE. A cell-detachment solution can reduce background staining in the ELISPOT assay. Handbook of ELISPOT: Springer; 2005. p. 87-94.
- Janetzki S, Cox JH, Oden N, Ferrari G. Standardization and validation issues of the ELISPOT assay. Handbook of ELISPOT: Springer; 2005. p. 51-86.
- Kalyuzhny A, Stark S. A simple method to reduce the background and improve well-to-well reproducibility of staining in ELISPOT assays. Journal of immunological methods. 2001;257(1):93-7.
- Kalyuzhny AE. Handbook of ELISPOT: methods and protocols: Springer Science & Business Media; 2005.
- Kalyuzhny AE. Chemistry and biology of the ELISPOT assay. Handbook of ELISPOT: Springer; 2005. p. 15-31.
- Kalyuzhny AE. ELISPOT assay on membrane microplates. Protein Blotting and Detection: Springer; 2009. p. 355-65.
- Klinman D. ELISPOT Assay to Detect Cytokine‐Secreting Murine and Human Cells. Current Protocols in Immunology. 1994:6.19. 1-6.. 9.
- Larsson M, Jin X, Ramratnam B, Ogg GS, Engelmayer J, Demoitie M-A, et al. A recombinant vaccinia virus based ELISPOT assay detects high frequencies of Pol-specific CD8 T cells in HIV-1-positive individuals. Aids. 1999;13(7):767-77.
- Lehmann PV. Image analysis and data management of ELISPOT assay results. Handbook of ELISPOT: Springer; 2005. p. 117-31.
- Letsch A, Scheibenbogen C. Quantification and characterization of specific T-cells by antigen-specific cytokine production using ELISPOT assay or intracellular cytokine staining. Methods. 2003;31(2):143-9.
- Mashishi T, Gray CM. The ELISPOT assay: an easily transferable method for measuring cellular responses and identifying T cell epitopes. Clinical chemistry and laboratory medicine. 2002;40(9):903-10.
- Nordone SK, Stevens R, LaVoy AS, Dean GA. Feline Cytokine ELISPOT. Handbook of ELISPOT: Springer; 2005. p. 167-77.
- Okamoto Y, Nishida M. Dual-color ELISPOT assay for analyzing cytokine balance. Handbook of ELISPOT: Springer; 2005. p. 263-72.
- Rönnelid J, Klareskog L. A comparison between ELISPOT methods for the detection of cytokine producing cells: greater sensitivity and specificity using ELISA plates as compared to nitrocellulose membranes. Journal of immunological methods. 1997;200(1):17-26.
- Samaras V, Piperi C, Korkolopoulou P, Zisakis A, Levidou G, Themistocleous MS, et al. Application of the ELISPOT method for comparative analysis of interleukin (IL)-6 and IL-10 secretion in peripheral blood of patients with astroglial tumors. Molecular and cellular biochemistry. 2007;304(1-2):343-51.
- Schmittel A, Keilholz U, Thiel E, Scheibenbogen C. Quantification of tumor-specific T lymphocytes with the ELISPOT assay. Journal of immunotherapy. 2000;23(3):289-95.
- Slota M, Lim J-B, Dang Y, Disis ML. ELISpot for measuring human immune responses to vaccines. 2011.
- Smith JG, Liu X, Kaufhold RM, Clair J, Caulfield MJ. Development and validation of a gamma interferon ELISPOT assay for quantitation of cellular immune responses to varicella-zoster virus. Clinical and diagnostic laboratory immunology. 2001;8(5):871-9.
- Solares CA, Tuohy VK. ELISPOT determination of interferon-γ T-cell frequencies in patients with autoimmune sensorineural hearing loss. Handbook of ELISPOT: Springer; 2005. p. 253-60.
- Streeck H, Frahm N, Walker BD. The role of IFN-γ Elispot assay in HIV vaccine research. Nature Protocols. 2009;4(4):461-9.
- Sztajnbok F, Boechat NL, Ribeiro SB, Oliveira SK, Sztajnbok DC, Sant’Anna CC. Tuberculin skin test and ELISPOT/T. SPOT. TB in children and adolescents with juvenile idiopathic arthritis. Pediatric Rheumatology. 2014;12(1):17.
- Tanguay S, Killion JJ. Direct comparison of ELISPOT and ELISA-based assays for detection of individual cytokine-secreting cells. Lymphokine and cytokine research. 1994;13(4):259-63.
- Walsh PN, Friedrich DP, Williams JA, Smith RJ, Stewart TL, Carter DK, et al. Optimization and qualification of a memory B-cell ELISpot for the detection of vaccine-induced memory responses in HIV vaccine trials. Journal of immunological methods. 2013;394(1):84-93.
- Weiss AJ. Overview of membranes and membrane plates used in research and diagnostic ELISPOT assays. Handbook of ELISPOT: Springer; 2012. p. 243-56.
- Zuber B, Levitsky V, Jönsson G, Paulie S, Samarina A, Grundström S, et al. Detection of human perforin by ELISpot and ELISA: ex vivo identification of virus-specific cells. Journal of immunological methods. 2005;302(1):13-25.
https://www.mabtech.com/knowledge-center/assay-principles/elispot-assay-principle
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام