اهمیت ارزیابی D-β-Glucan-3-1 در تشخیص عفونتهای مهاجم قارچی
سید مرتضی حقگو1،2، اسماعیل مرتاض2،3
1 گروه بیوشیمی بالینی، دانشکده علوم پزشکی، دانشگاه تربیت مدرس
2 مرکز تحقیقات بیماریهای مزمن تنفسی، مرکز آموزشی، درمانی و تحقیقاتی سل و بیماریهای ریوی دکتر مسیح دانشوری
3 گروه ایمونولوژی پزشکی، دانشکده پزشکی، دانشگاه علوم پزشکی شهید بهشتی، تهران، ایران
خلاصه
شاخص D-β-Glucan-3-1 بهعنوان یک روش جدید و جایگزین در تشخیص و مراقبت مؤثر عفونتهای مهاجم قارچی مطرح میباشد. عفونتهای مهاجم قارچی برای مدت زمانی طولانی با مرگومیر قابلتوجه بیماران مبتلا به سرطان در بخشهای ایزوله، بیماران دریافتکننده پیوند و همچنین بیماران دچار نقص سیستم ایمنی در ارتباط بوده و از سوی دیگر نیاز به استفاده از روشهای تهاجمی؛ تشخیص عفونتهای مهاجم قارچی را دشوار نموده است. ارزیابی D-β-Glucan-3-1 که در آن نمونه با روشی غیرتهاجمی به دست میآید میتواند در تشخیص عفونتهای مهاجم قارچی و همچنین ارزیابی پاسخ به درمان سودمند واقع شود. یکی از محدودیتهای روش سنجش D-β-Glucan-3-1 برای تشخیص عفونتهای مهاجم قارچی، حساسیت و اختصاصیت ناکافی آن در هنگام مثبت بودن جواب تست میباشد درحالیکه هنوز دستورالعملهای رسمی در مورد استفاده از این روش وجود ندارد، این روش میتواند فرصتی ارزشمند برای ارزیابی بیماران در معرض خطر بالا فراهم نماید. در این مقاله، مروری کلی بر کاربردهای آزمایشگاهی و بالینی سنجــــــــــش سطح سرمی D-β-Glucan-3-1 خواهیم داشت.
مقدمه
عفونتهای مهاجم قارچی بهعنوان مشکلی مهم در بیماران دریافتکننده پیوند سلولهای بنیادی خونساز (HSC) و ارگانهای توپر (solid organs) مانند کبد، کلیه و ریه مطرح میباشد (1 و 2). علیرغم پیشرفتهای به وجود آمده در اقدامات درمانی، هنوز عفونتهای قارچی با مرگومیر بالای بیماران همراه است (3). در میان بیماران دریافتکننده پیوند، کاندیدا (Candida)، گونههای آسپرژیلوس (Aspergillus species) و برخی قارچهای رشتهای مانند فوزاریوم (Fusarium)، سدوسپوریوم (Scedosporium) و زیگومیستها (Zygomycetes) بهعنوان عوامل مهم ایجاد عفونتهای در نظر گرفته میشوند (1 و 2).
تشخیص عفونتهای قارچی به دلیل نیاز به نمونهبرداری از بافت و کشت آن و همچنین آزمایشهای بافتشناسی دیگر دشوار است و علاوه بر آن یافتههای بالینی و تصاویر رادیولوژی، حساسیت و اختصاصیت تشخیصی کافی را ندارند. سنجش شاخصهای زیستی مانند اجزای دیواره قارچی و D-β-Glucan-3-1، بهعنوان روشهای غیرتهاجمی مطرح میباشند که میتوانند در تشخیص عفونتهای قارچی مهاجم مفید واقع شوند.
ساختمان و ویژگیهای بیوشیمیایی D-β-Glucan-3-1
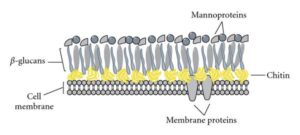
دیواره سلول قارچی علاوه بر اینکه در محافظت آنها نقش دارد، در تهاجم به بافتها نیز ایفای نقش میکند. عمدهترین جزء ساختاری دیواره قارچی پلیساکارید است و در مورد اکثر آنها شامل گلوکان (Glucan)، کیتین (Chitin) و مانان (Mannan) است (شکل 1). گلوکان مهمترین و فراوانترین پلیساکارید دیواره بسیاری از قارچهاست، درحالیکه دیواره سلولی مخمرها محتوی مقدار کمتری گلوکان نسبت به قارچهای رشتهای میباشد همچنین گلوکانها جزء اصلی و عمده دیواره قارچهای ساپروفیت (Saprophytic) و پاتوژن هستند. البته استثناهایی نیز در این مورد وجود دارد، برای مثال دیواره موکور (Mucor)، ریزوپوس (Rhizopus)، بلاستومیسس درماتیتیدیس (Blastomyces dermatitidis) و گونههای کریپتوکوکوس (Cryptococcus sp.) محتوی مقدار بسیار کمی از این پلی ساکارید است (9-4).
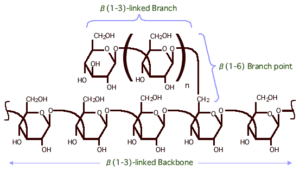
گلوکان غالباً متشکل از پلیمرهای گلوکز است که در یک آرایش خطی از طریق پیوندهای گلیکوزیدی کربنهای 1 و 3، با کونفیگوراسیون بتا، به یکدیگر اتصال یافتهاند تا اسکلت اصلی D-β-Glucan-3-1 به وجود بیاید (7). آنزیم مسئول ساخت این پلیساکارید D-β-Glucan-3-1 سنتاز میباشد. هر پلیساکارید از زنجیرهای به طول 1500 زیرواحد گلوکز تشکیل شده است که در بین این زنجیره شاخههایی با پیوند گلیکوزیدی 4-1 و 6-1 وجود دارد (شکل 2). شاخههای زنجیره پلیساکاریدی متنوع بوده و اختصاصی هر گونه است (7-4).
اگرچه D-β-Glucan-3-1 در ساختار دیواره قارچی بهعنوان یک ساختار نامحلول وجود دارد، در حضور خون یا دیگر مایعات، این ساختار به شکلهای مارپیچ منفرد (single helix)، مارپیچ سهتایی (triple helix) یا ساختارهای تصادفی (random coil) تبدیل میشود که موجب محلول شدن آن میگردد (4، 5، 7). گفته میشود که ساختار محلول D-β-Glucan-3-1 ممکن است با تعدیل سیستم ایمنی از طریق مهار فاگوسیتوز لوکوسیتی در ارتباط باشد (10). جزئیات مربوط به رهاسازی و کینتیک D-β-Glucan-3-1 محلول در گردش خون سیستمیک یا مایعات دیگر بدن، در بیمارانی که عفونت قارچی مهاجم دارند یا حضور این عفونت در آنها محتمل است، محدود میباشد (4).
شکل 1: اجزای دیواره سلولی قارچی. دیواره سلولی قارچی متشکل از یک غشای سلولی است که حاوی پروتئینهای مختلف است. یک لایه محافظ کیتین و همچـــــــــــنین گلوکان (عمدتاً D-β-Glucan-3-1) و مانوپروتئینها روی آن قرار دارند. دیواره سلولی در قارچهای مختلف محتوی مقادیر متفاوتی از گلوکان میباشد
شکل 2: ساختار اسکلت D-β-Glucan-3-1. پلیمری از مولکولهای گلوکز که با پیوندهای 3-1 به یکدیگر اتصال یافتهاند و شاخه جانبی که با پیوند 6-1 به اسکلت اصلی متصل شده، در این تصویر مشخص میباشد
اصول سنجش D-β-Glucan-3-1
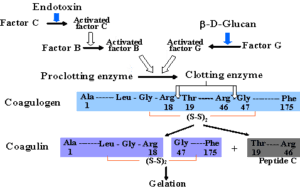
در سال 1956 گروهی پژوهشگر در ماساچوست مشاهده کردند که تزریق اندوتوکسین در جریان خون خرچنگ Limulus polyphemus منجر به شروع واکنش لخته شدن وسیعی میگردد (11). پس از مدتی مشخص شد که یک سلول شبهآمیبی متحرک (مشابه فاگوسیتها) در جریان خون Limulus polyphemus وجود دارد که حاوی فاکتور C بوده و مسئول آغاز آبشاری از واکنشهای لخته شدن میباشد. این مسیر هماکنون بهعنوان مسیر LAL (Limulus Amebocyte Lysate) شناخته میشود (شکل 3). فاکتور C یک زیموژن سرین پروتئازی میباشد که بهوسیله لیز سلولی از آمبوسیتها جدا شده است (13-11).
پیش از کشف LAL، تائید تجهیزات پزشکی و موادی که برای استفاده در انسان پیشنهاد میشد، نیاز به تست پیروژن (Pyrogen test) داشت (11). در پی کشف مسیر LAL، بسیاری از مواد و تجهیزات پزشکی برای تشخیص آلودگی باکتریایی توسط تست پیروژن معمول و مسیر کشف شده جدید آزمایش میشدند. در سال 1977، FDA (سازمان غذا و داروی آمریکا) استفاده از LAL بهعنوان تست پیروژن جایگزین برای ارزیابی مواد بیولوژیکی، داروهای داخل وریدی و تجهیزات پزشکی (مانند دریچههای قلب مصنوعی یا تجهیزات مورداستفاده در ارتوپدی) را تائید کرد.
در سال 1968، مشتق کربوکسی متیله بتاگلوکان که تحت بررسی بهعنوان یک عامل ضدسرطان قرار داشت، در عدم حضور آلودگی باکتریایی از طریق LAL سبب القای لخته شدن گردید (12). در پی این اتفاق، یک زیموژن سرین پروتئازی ثانویه به نام فاکتور G، بهعنوان آغازکننده آبشار لخته شدن LAL توسط این مشتق بتاگلوکان شناخته شد (12 و 13). سپس روشهای سنجش اختصاصی برای اندازهگیری بتاگلوکان قارچی، خصوصاً در نمونههای سرم، توسعه یافتند که اساس تمامی این روشها فعال کردن مسیر LAL بود (4 و 13) (شکل 3).
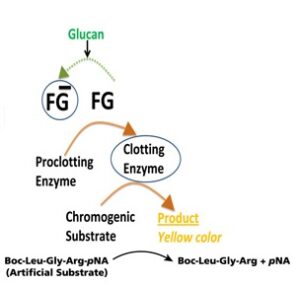
همانطورکه ذکر شد قسمت عمده بتاگلوکان محلول بهصورت مارپیچ سهگانه میباشد و مواجهه با معرف قلیایی ساختار آن را به مارپیچ تکرشتهای تغییر میدهد که برای واکنش LAL موردنیاز است (4). علاوه بر این، افزودن معرف قلیایی موجب کاهش احتمال به وجود آمدن نتایج مثبت و منفی کاذب میگردد که به ترتیب از طریق غیرفعال نمودن سرین پروئئازها و مهارکنندههای سرین پروتئازی توسط این معرف میسر میشود. لازم به توضیح است که این قبیل پروتئینها بهصورت طبیعی در سرم انسان حضور دارند. به دنبال انجام تیمار با معرف قلیایی، واکنش LAL با فعال شدن فاکتور G توسط بتاگلوکان تکرشتهای آغاز میشود (11 و 14)، سپس فاکتور G فعالشده یک پیشآنزیم لختهکننده (proclotting enzyme) را به فرم فعال تبدیل مینماید. فرم فعال آنزیم لختهکننده یک سوبسترای رنگی به نام p-nitroanilide را از انتهای یک پپتید صناعی (که جایگزین پروتئین تشکیلدهنده لخته اصلی شده) جدا میکند. p-nitroanilide در وضعیت اتصالیافته به پپتید بیرنگ میباشد، ولی جدا شدن آن از پپتید باعث ایجاد رنگ زرد میشود (شکل 4). درحالیکه واکنش اصلی LAL با تشکیل لخته پایان مییابد، اما روش بتاگلوکان LAL، یک روش مبتنی بر رنگسنجی است (11 و 14).
شکل 3: مسیر LAL. اندوتوکسین باکتریایی و D-β-Glucan-3-1 میتوانند با فعال کردن زیموژنهای سرین پروتئازی مربوطه موجب فعال شدن آنزیم لختهکننده و ایجاد لخته گردند
شکل 4: مسیر تغییریافتهLAL برای سنجش D-β-Glucan-3-1
D-β-Glucan-3-1 با فعال کردن فاکتور G موجب تشکیل شکل فعال آنزیم لختهکننده میگردد. آنزیم لختهکننده با برش دادن سوبسترایp-nitroanilide از انتهای پپتید منجر به ایجاد رنگ زرد میشود
کیتهای تجاری در دسترس برای ارزیابی D-β-Glucan-3-1
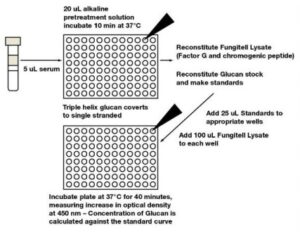
اخیراً پنج کیت تجاری برای ارزیابی D-β-Glucan-3-1 در دسترس قرار دارد که نام این محصولات و برخی مشخصات مربوطه در جدول 1 آمده است. از میان این پنج محصـــــــــــــــول تجاری کیتهایEndosafe-PTS glucan و β-glucan Test تنها برای اهداف تحقیقاتی استفاده شده و برای اهداف تشخیصی در بالین کاربرد ندارند. کیتهایی که برای تشخیص عفونتهای قارچی مهاجم مورداستفاده قرار میگیرند، محتوی فاکتور G و پپتید متصل به سوبسترای رنگی هستند که در حالت لیوفلیزه قرار دارند. بهطورمعمول 5-3 میلیلیتر خون برای جداسازی سرم کافی موردنیاز میباشد. نمونههای لیپیمیک، ایکتریک و همولیز به دلیل اینکه منجر به تداخل و تولید نتایج نادرست میشوند نباید برای این کار مورداستفاده قرار گیرند. در شکل 3 مراحل انجام آزمایش بهصورت مختصر برای کیت Fungitell نمایش داده شده است. این کیت در حال حاضر برای تشخیص عفونتهای مهاجم قارچی در آزمایشگاه فوقتخصصی ایمونولوژی و آلرژی بیمارستان مسیح دانشوری مورداستفاده قرار میگیرد.
| جدول 1: کیتهای در دسترس برای سنجش D-β-Glucan-3-1 | ||||
| Kit | Manufacturer | FDA Approved | Crab Species | Cut-off Value |
| Fungitell | Associates of Cape Cod (U.S.) | Yes | Limulus polyphemus (colormetric) | 80–60 pg/ml |
| Endosafe-PTS glucan | Charles River Laboratories (U.S.) | No | Limulus polyphemus (colormetric) | 1000–10 pg/ml |
| Fungitec G-MK | Seikagaku Biobusiness (Japan) | No | Tachypleus tridentalus (colormetric) | 20 pg/mL |
| β-glucan Test | Waco Pure Chemical Industries (Japan) | No | Tachypleus tridentalus (turbidimetric) | 11 pg/ml |
| BGSTAR β-glucan test | Maruha (Japan) | No | Tachypleus tridentalus (colormetric) | 11 pg/ml |
شکل 5: توصیف مختصری از مراحل سنجش D-β-Glucan-3-1 با استفاده از کیت Fungitell. ابتدا مقدار معینی از نمونهها و معرف قلیایی در چاهکهای مربوطه اضافه میشود تا پس از طی زمان انکوباسیون ساختار تکرشتهای از D-β-Glucan-3-1 ایجاد شود. در مرحله بعدی استانداردها افزوده شده و سپس محلول Fungitell (محتوی فاکتور G و سوبسترای رنگی) به همه چاهکها اضافه میشود. افزایش OD چاهکها در طی مدت 40 دقیقه در طولموج 450 نانومتر قرائت میشود و درنهایت غلظت گلوکان برحسب منحنی استاندارد محاسبه میشود
استفاده از D-β-Glucan-3-1 در پیگیری درمان و تشخیص عفونتهای مهاجم قارچی
تائید و استفاده از تست D-β-Glucan-3-1 در تشخیص عفونتهای مهاجم قارچی عرصه بالین را متحول نموده است. کیت اخیر تائیدشده توسط FDA، Fungitell است که برای سنجـــــــــــــــش سطح سرمی D-β-Glucan-3-1 میباشد و میتواند در تشخیص عفونتهای مهاجم قارچی کمککننده باشد. جدیدترین دستورالعملهای جامعه بیماریهای عفونی آمریکا برای مدیریت بالینی آسپرژیلوزیس و کاندیدیازیس سنجش D-β-Glucan-3-1 سرمی را در ارزیابی بیمارانی که برای طولانی مدت مشکوک به عفونت قارچی بودهاند، پیشنهاد میکنند، اما هنوز توصیهای برای استفادههای اختصاصی وجود ندارد (15 و 16)، با این وجود برای تولید نتایج دقیق در این تست، آزمایشگاه میبایست در انجام و کنترل کیفیت آن مهارت و تخصص لازم را داشته باشد. علاوه بر این، پزشکان بایستی با محدودیتهای این تست و همچنین استفاده مناسب از آن در مدیریت بالینی بیماران آشنا شوند. کنترلهای تجاری فعلاً برای ارزیابی کیفیت انجام این تست در دسترس نیستند، بنابراین آزمایشگاههایی که این تست را انجام میدهند بایستی در برنامههای جایگزین و مشابه شرکت نمایند. درحالیکه هنوز دستورالعملهای رسمی برای استفاده از D-β-Glucan-3-1 ارائه نشدهاند، بر اساس شواهدی که اخیراً در دسترس قرارگرفته است، میتوان از این روش استفاده نمود. در جدول 4 برخی توصیههای مهم که در هنگام استفاده از این روش برای تشخیص عفونتهای قارچی مهاجم باید موردتوجه قرار گیرد، آورده شده است. شواهد اخیر نشان میدهند که نتایج منفی این تست نمیتواند بهطور قطعی عدم تشخیص عفونت قارچی مهاجم را رد کند و نتایج مثبت هم بهتنهایی حساسیت و اختصاصیت کافی در تشخیص قطعی را ندارند (21-17).
| جدول 4: توصیههایی که هنگام استفاده از D-β-Glucan-3-1 بهتر است موردتوجه قرار گیرد |
| این تست بهتر است در کنار روشهای دیگر تشخیص عفونتهای قارچی مهاجم مورداستفاده قرار گیرد.
این تست بهتر است پیش از شروع درمان ضد قارچی انجام شود. برای بیمارانی که در معرض خطر بالا قرار دارند، بهتر است این تست دو بار در هفته انجام گیرد. برای ارزیابی پاسخ به درمان بهتر است هفتهای یکبار این تست انجام شود. اگر نتیجه تست مثبت باشد، پیش از پذیرفتن آن بهعنوان نتیجه مثبت واقعی، بهتر است با انجام آزمایش بر روی نمونه جدید یا تکرار آزمایش بر روی نمونه قبلی این نتیجه تائید شود. مطالعات بیشتر در مورد مفید بودن این تست برای ارزیابی نمونههایی غیر از سرم لازم میباشد. |
اگرچه تشخیص عفونتهای قارچی مهاجم توسط سنجش بتاگلوکان در بیمارانی که در معرض خطر بالا برای ابتلا به این عفونتها قرار دارند، منطقی میباشد، اما به نظر میرسد استفاده از این شاخص برای پیگیری درمان بیماران نیز ممکن است سودمند واقع شود. با این وجود تعداد دفعات سنجش و نقش این شاخص در پیگیری درمان بیماران تشخیص داده شده با عفونت مهاجم قارچی یا بیماران مشکوک، هنوز بهخوبی روشن نشده است (17 و 18).
در دسترس بودن یک روش سریع و آسان میتواند بهعنوان شاخصی جایگزین برای ارزیابی عفونتهای قارچی در جمعیتهای خاص مانند بیماران در معرض خطر بالا برای عفونت استفاده شود. مطالعات بیشتر برای تعیین مقادیر مرجع، تعداد دفعات انجام تست، قابلیت استفاده از نمونههای دیگر غیر سرم برای تشخیص عفونتهای قارچی مهاجم و ارزیابی پاسخ به درمان موردنیاز است.
منابع:
1) Neofytos D, Fishman JA, Horn D, et al. Epidemiology and outcome of invasive fungal infections in solid organ transplant recipients. Transpl Infect Dis. 2010;12:220–229.
2) Neofytos D, Horn D, Anaissie E, et al. Epidemiology and outcome of invasive fungal infection in adult hematopoietic stem cell transplant recipients: Analysis of Multicenter Prospective Antifungal Therapy (PATH) Alliance registry. Clin Infect Dis. 2009;48:265–273.
3) Person AK, Kontoyiannis DP, Alexander BD. Fungal infections in transplant and oncology patients. Infect Dis Clin North Am. 2010;24:439–459.
4) Mennink-Kersten MA, Verweij PE. Non-culture-based diagnostics for opportunistic fungi. Infect Dis Clin North Am. 2006;20:711–727.
5) Latgé JP. The cell wall: A carbohydrate armour for the fungal cell. Mol Microbiol. 2007;66:279–290.
6) Inoue SB, Qadota H, Arisawa M, et al. Signaling toward yeast 1,3-beta-glucan synthesis. Cell Struct Funct. 1996;21:395–402.
7) Bowman SM, Free SJ. The structure and synthesis of the fungal cell wall. Bioessays. 2006;28:799–808.
8) Miyazaki T, Kohno S, Mitsutake K, et al. Plasma (1–>3)-beta-D-glucan and fungal antigenemia in patients with candidemia, aspergillosis, and cryptococcosis. J Clin Microbiol. 1995;33:3115–3118.
9) Girouard G, Lachance C, Pelletier R. Observations on (1–3)-beta-D-glucan detection as a diagnostic tool in endemic mycosis caused by Histoplasma or Blastomyces. J Med Microbiol. 2007;56(Pt 7):1001–1002.
10) Brown GD, Gordon S. Immune recognition of fungal β-glucans. Cell Microbiol. 2005;7:471–479.
11) Novitsky TJ. Biomedical Applications of Limulus Amebocyte Lysate. Biology and Conservation of Horseshoe Crabs 2009; Part 2: 315–329.
12) Marty FM, Koo S. Role of (1–>3)-beta-D-glucan in the diagnosis of invasive aspergillosis. Med Mycol. 2009;47(suppl 1):S233-S240.
13) Hope WW, Walsh TJ, Denning DW. Laboratory diagnosis of invasive aspergillosis. Lancet Infect Dis. 2005;5:609–622.
14) Kedzierska A, Kochan P, Pietrzyk A, et al. Current status of fungal cell wall components in the immunodiagnostics of invasive fungal infections in humans: Galactomannan, mannan and (1–3)-β-D-glucan antigens. Eur J Clin Microbiol Infect Dis. 2007;26:755–766.
15) Walsh TJ, Anaissie EJ, Denning DW, et al. Treatment of aspergillosis: Clinical practice guidelines of the Infectious Diseases Society of America. Clin Infect Dis. 2008;46:327–360.
16) Pappas PG, Kauffman CA, Andes D, et al. Clinical practice guidelines for the management of candidiasis: 2009 update by the Infectious Diseases Society of America. Clin Infect Dis. 2009;48:503–535.
17) Pazos C, Pontón J, Del Palacio A. Contribution of (1–>3)-beta-D-glucan chromogenic assay to diagnosis and therapeutic monitoring of invasive aspergillosis in neutropenic adult patients: A comparison with serial screening for circulating galactomannan. J Clin Microbiol. 2005;43:299–305.
18) Persat F, Ranque S, Derouin F, et al. Contribution of the (1–>3)-beta-D-glucan assay for diagnosis of invasive fungal infections. J Clin Microbiol. 2008;46:1009–1013.
19) Racil Z, Kocmanova I, Lengerova M, et al. Difficulties in using 1,3-(beta)-D-glucan as the screening test for the early diagnosis of invasive fungal infections in patients with haematological malignancies: High frequency of false-positive results and their analysis. J Med Microbiol. 2010;59(Pt 9):1016–1022.
20) Pickering JW, Sant HW, Bowles CA, et al. Evaluation of a (1–>3)-beta-D-glucan assay for diagnosis of invasive fungal infections. J Clin Microbiol. 2005;43:5957–5962.
21) Ostrosky-Zeichner L, Alexander BD, Kett DH, et al. Multicenter clinical evaluation of the (1–>3) beta-D-glucan assay as an aid to diagnosis of fungal infections in humans. Clin Infect Dis. 2005;41:654–659.
22) Kawagishi N, Miyagi S, Satoh K, et al. Usefulness of beta-D glucan in diagnosing Pneumocystis carinii pneumonia and monitoring its treatment in a living-donor liver-transplant recipient. J Hepatobiliary Pancreat Surg. 2007;14:308–311.
عفونتهای قارچی در گیرندگان پیوند اعضاء جامد(2)
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام