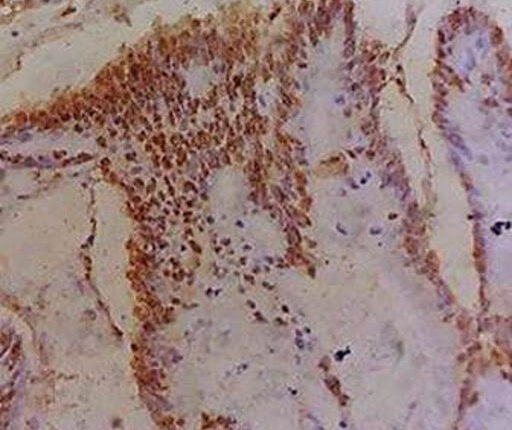
ALK (D5F3) با تفسیر به وسیله ایمونوهیستوشیمی
دکتر مصلائی
- موارد درخواست آزمایش
تعیین واجد شرایط بودن بیمار برای درمان مهار کننده ALK در افراد مبتلا به آدنوکارسینومای ریوی، به ویژه تومورهای فاقد جهشهای ژن EGFR و KRAS
- توضیح آزمایش
- شناسایی پروتئینهای فیوژن یا الحاقی ALK به وسیله ایمونوهیستوشیمی با استفاده از D5F3 کلون ALK بر روی بافت توموری FFPE
- کلون D5F3 نسبت به کلون ALK1 در شناسایی بیان پروتئین ALK در سرطان ریه، حساستر است.
- آزمایشهایی که باید مورد توجه قرار گیرند
تست بنیادی
- ALK (D5F3) با تفسیر به وسیله ایمونوهیستوشیمی
- آزمون غربالگری مؤثر و مقرون به صرفه برای تمامی پروتئینهای الحاقی ALK
تستهای مرتبط
- شناسایی جهش KRAS
- آزمون شناسایی جهش برای تعیین واجد شرایط بودن افراد مبتلا به آدنوکارسینوماهای ریوی به منظور دریافت درمان مهار کننده تیروزین کیناز (TKI)
- شناسایی جهش EGFR به وسیله تعیین توالی پیرو (Pyrosequencing)
- آزمون یگانه شناسایی جهش برای تعیین واجد شرایط بودن افراد مبتلا به آدنوکارسینوماهای ریوی به منظور دریافت درمان مهار کننده تیروزین کیناز (TKI)
- ترانسلوکاسیون EML4/ALK به وسیله RT-PCR
- به عنوان تک آزمون جهت شناسایی جهش برای تعیین واجد شرایط بودن افراد مبتلا به آدنوکارسینوماهای ریوی به منظور دریافت درمان مهارکننده ALK، توصیه نمیشود.
- پانل بازتابی جهش سرطان ریه
- به عنوان تست بازتابی برای تعیین واجد شرایط بودن افراد مبتلا به آدنوکارسینوماهای ریوی به منظور دریافت درمان مهار کننده ALK یا TKIs، توصیه نمیشود.
- این پانل شامل تست مقرون به صرفه و حساس ایمونوهیستوشیمی ALK نمیشود.
- الگوی بازتاب
- اگر جهش KRAS شناسایی نشود، سپس تست جهش EGFR انجام میگیرد.
- اگر جهش EGFR شناسایی نشود، تست ترانسلوکاسیون EML4/ALK انجام میگیرد.
- شناسایی جهش EGFR با بازتاب به ترانسلوکاسیون EML4/ALK به وسیله RT-PCR
- تست بازتابی برای تعیین واجد شرایط بودن افراد مبتلا به آدنوکارسینوماهای ریوی به منظور دریافت درمان مهارکننده ALK یا TKIs، توصیه نمیشود.
- این پانل شامل تست مقرون به صرفه و حساس ایمونوهیستوشیمی ALK نمیشود.
- الگوی بازتاب
- اگر جهش EGFR شناسایی نشود، تست ترانسلوکاسیون EML4/ALK انجام میگیرد.
مروری بر بیماری
شیوع بیماری
- سرطان ریه دومین سرطان شایع در ایالات متحده امریکاست.
- شایعترین دلیل مرگ و میر مرتبط با سرطان در زنان و مردان
مسائل مربوط به درمان
- سرطان ریه نسبت به عوامل شیمی درمانی قدیمی، کمتر پاسخ میدهد.
- 5 سال استفاده از این عوامل نتایج ملال انگیزی به همراه داشته است.
- بیماران انتخاب شده پاسخ بهتری به داروهای جدیدتر دادند.
- نرخ پاسخ تومور و نتایج بالینی بیمار در سرطان ریه سلول غیر کوچک (به ویژه زیر گروه آدنو)، ارتباط مستقیمی با وضعیت جهش تومور دارد.
- شامل جهشهای KRAS، ALK و EGFR میشود.
- بازآراییهای ALK (ALK Rearrangements)
- در حدود 7% از آدنوکارسینوماهای ریوی گزارش شده است.
- حدود 30% از بیماران جوان تر، مرد، غیر سیگاری یا سیگاری با مصرف اندک هستند.
- بازآراییهای ALK میزان پاسخ به ALK TKIs (برای مثال، کریزوتینیب) را پیشبینی میکنند.
- روشهای شناسایی بازآراییهای ALK
- RT-PCR: ممکن است که تمامی الحاق یا هم جوشیهای ALK را شناسایی نکند.
- FISH: بعلت وجود وارونگیهای کوچک در کروموزوم 2p (2p21 و 2p23)، تفسیر تکنیک FISH برای این بازآراییها چالش برانگیز است.
- ایمونوهیستوشیمی (IHC)، بیان پروتئین را شناسایی میکند.
- پروتئین شناسایی شده، جانشین الحاق یا همجوشی است.
- زمانی که این تست با PCR یا FISH مقایسه میشود، مؤثرتر و مقرون به صرفهتر است.
ژنتیک
ژن ALK
ساختار/ عملکرد
- نقطه انفصال یا شکست در اگزون 20 دومین کیناز سرطان ریه، با ژن شریک
- رایجترین شریک الحاق، EML-4 است.
- دیگر شرکای الحاق، ژنهای KIF5B، KLC1 هستند.
- الحاق ژن ALK با شریکش، الیگومریزاسیون مستقل از لیگاند ALK را میانجیگری میکند که منجر به فعال سازی کیناز ALK میگردد.
- اپیتوپ D5F3 درون C-ترمینال پروتئین ALK قرار گرفته و در تمامی جابجاییها یا ترانسلوکاسیونها حفظ میشود.
- تمامی ترانسلوکاسیونها باید با ایمونوهیستوشیمی شناسایی گردند.
- تفسیر آزمایش
نتایج مثبت
- هر درجهای از رنگآمیزی سیتوپلاسمیک بیشتر یا مساوی 10% سلولهای توموری، مثبت در نظر گرفته میشود.
- حضور این جهش میتواند پاسخ بیمار به مهارکننده ALK را پیشبینی کند.
- بیماران دارای این جهش معمولاً فاقد جهشهای ژنهای EGFR و KRAS هستند.
- محدودیتهای تست
- نتایج این تست باید در چارچوب دادههای مورفولوژیکی یا ریخت شناسی و دیگر دادههای مرتبط، تفسیر گردند.
- این تست را نباید به تنهایی برای تشخیص بدخیمی مورد استفاده قرار داد.
آنتی مولرین هورمون (Anti-Mullerian Hormone)
تکنیک الیزا برای تشخیص آنتی مولرین هورمون در سرم
- پیش زمینه بیماری
- AMH بوسیله سلولهای سرتولی در بیضههای جنین، تولید شده و عقب نشینی و پسرفت مجاری مولرین را القا میکند. در غیر این صورت به مجاری تولید مثلی زنانه تکامل مییابد. در جنس مذكر، سطوح سرمی AMH، در خلال چند ماه اولیه زندگی به اوج خود رسیده و تا سن بلوغ سطح آن بالا میماند. در جنس مؤنث، سطح AMH سرمی در زمان تولد غیر قابل تشخیص بوده و در زمان کودکی به صورت غیر قابل شناسایی یا کم باقی میماند. بازههای رفرانس یا مرجع برای دختران و پسران، همپوشانی ندارد. در پسرانی که بیضههای غیر قابل لمس دارند، سطح سرمی AMH در دو گروه کریپتورکیدیسم (پایین نیامدن بیضهها درون کیسه بیضه و ماندن در حفره شکمی) و آنورکی (فقدان مادرزادی یک یا هر دو بیضه)، متفاوت است.
- عمل اصلی تخمدان در زنان، تولید سلول اووسیت بالغ برای باروری است. فولیکولهای تخمدان به طور مداوم متحمل تمایز و بلوغ از مرحله پریموردیال یا بدوی به مرحله آنترال شده و این عمل تا زمانی که ذخیره فولیکولی پریموردیال در زمان یائسگی تمام شود، ادامه دارد. اکثر فولیکولهای آنترال دچار انحطاط میشوند. اما، تعداد اندکی در خلال سیکل قاعدگی بوسیله هورمون محرک فولیکول یا FSH انتخاب شده و برای تبدیل شدن به فولیکولهای پیش تخمک گذاری، بیشتر تکامل مییابند. در خلال هر سیکل قاعدگی، یک فولیکول پیش تخمک گذاری غالب، برای تولید یک اووسیت بارور، تخمک گذاری میکند.
- ذخيره تخمداني (OR) به تعداد و کیفیت فولیکولهای قادر به تولید اووسیت بارور گفته میشود. ذخيره تخمداني با افزایش سن کاهش مییابد و در سن یائسگی تمام میشود. عدم توانایی باروری در زنانی که در دهه سوم زندگی خود هستند، 5% و در زنانی که 35 سال یا بیشتر سن دارند، 30% کاهش مییابد. شیوههایی که میزان OR را تخمین میزنند، برای پیشبینی نتیجه احتمالی لقاح مصنوعی یا IVF یا دیگر فنآوریهای کمک باروری (ART)، مفید هستند.
- AMH توسط فولیکولهای پریآنترال و آنترال کوچک بیان میشود ولی توسط فولیکولهای بدوی پریموردیال یا فولیکولهای آنترال زمانی که بوسیله FSH انتخاب میشوند، بیان نمیگردند. سطح سرمی AMH بازتابی از تعداد فولیکولهای پریآنترال و آنترال است. مطالعات متعددی نشان دادهاند که از آنجا که AMH از سیکل قاعدگی مستقل است، بهترین مارکر برای OR میباشد. در آغاز 30 سالگی، سطح AMH به صورت خطی نسبت به سن کاهش مییابد و پس از یائسگی با اتمام OR، در سرم غیر قابل شناسایی میگردد.
- در سندرم تخمدان پلی کیستیک (PCOS)، تولید فولیکول در مرحله انتخاب FSH متوقف میشود و فولیکولهای پریآنترال و آنترال کوچک تجمع مییابند. سطح سرمی AMH در این افراد 2 تا 3 برابر بیشتر از افراد نرمال بوده و نشانگر افزایش تعداد فولیکولهای بیان کننده AMH است.
- مطالعه شیوع بیماری
- در ایالات متحده امریکا، 11/5% از زنان در سنین 15 تا 44 سال دچار اختلال در باروری هستند. حدود 15 تا 20% زوجها در سنین باروری با این مشکل ناباروری درگیر هستند.
- PCOS شایعترین دلیل ناباروری در زنان است.
- در سال 2006، مرکز کنترل بیماریها تخمین زد که تکنیکهای کمک باروری، باعث کمی بیش از 1% تولد زنده است. اغلب زنان (61%) در سنین 35 سالگی یا بیشتر از تکنیکهای کمک باروری استفاده میکنند.
- موارد درخواست آزمایش
- AMH، مارکری مفید برای پیشبینی OR و احتمال موفقیت IVF و دیگر تکنیکهای کمک باروری (ART) است.
- AMH برای تمایز میان کریپتورکیدیسم (پایین نیامدن بیضهها درون کیسه بیضه و ماندن در حفره شکمی) و آنورکی (فقدان مادرزادی یک یا هر دو بیضه) در پسرانی که بیضههایی غیر قابل لمس دارند، مفید است.
- سطوح AMH بالای بازه مرجع به عنوان PCOS تشخیص داده میشود.
- تفسیر
- نتایج باید با بازههای مرجع مربوط به سن و جنس مقایسه شوند.
- سطوح AMH بالای بازه مرجع در نوزادان دختر، نشان دهنده حضور بافتهای بیضه است.
- سطوح AMH بالای بازه مرجع (در زنان) به عنوان PCOS در نظر گرفته میشود.
- محدودیتها
- سطوح AMH میتواند به طور قابل ملاحظهای در میان افراد مختلف تفاوت کند.
- مواد و روشها
- این تست به روش ایمونواسی آنزیمی با تقویت 2 نقطهای (enzymatically amplified two-site immunoassay) انجام میشود.
- AMH توسط یک آنتیبادی که به میکروپلیت 96 خانه متصل است، گرفته شده و با آنتیبادی ثانویه بیوتینیلات و پراکسیداز استرپتاویدین- تربچه کوهی شناسایی میگردد.
- تستهای مرتبط
- از تستهای زیر نیز برای تخمین ذخیره تخمدان در روز 3 سیکل قاعدگی استفاده میشود:
- هورمون تحریک کننده فولیکول، سرم FSH
- استرادایول سرمی یا پلاسما در زنان بزرگسال پیش از یائسگی
- رفرانسها
- Broekmans FJ, et al. Anti-Mullerian hormone and ovarian dysfunction. Trends Endocrinol Metab 2008;19:340–7.
- Lee M, at al. Mullerian inhibiting substance in humans: normal levels from infancy to adulthood. J Clin Endocrinol Metab 1996;81:571–6.
- McGee EA and Hsueh AJ. Initial and cyclic recruitment of ovarian follicles. Endocr Rev 2000;21:200–14.
- Roudebush WE, Kivens WJ, Mattke JM. Biomarkers of ovarian reserve. Biomarker Insights 2008;3:259–68.
- Centers for Disease Prevention. Assisted Reproductive Technology (ART) 2007. Section 1. Overview. http://www.cdc. gov/art/ART2007/section1.htm (accessed on July 7, 2010).
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
برای دانلود باید وارد سایت شوید.
ورود / ثبت نام
ورود / ثبت نام