روش لوری در اندازهگیری پروتئینها
مراد رستمي: کارشناس ارشد بیوشیمی بالینی، دانشگاه علوم پزشكي جندي شاپور اهواز
معصومه جرفی: کارشناس ارشد میکروب شناسی، دانشگاه علوم پزشكي جندي شاپور اهواز
شايعترين روش اندازهگيري پروتئينها در كارهاي تحقيقاتي، روش لوري ميباشد. اين روش گروه فنل را در ريشه تيروزين مورد شناسايي قرار داده و داراي حساسيت 100-2 ميكروگرم در ميليليتر پروتئين است. از آن جائي كه روش لوري موجب تشخيص ريشه تيروزين در پروتئينها ميشود و تعداد ريشهاي تيروزين در بين پروتئينهاي مختلف تفاوت دارد، ضروري به نظر ميرسد كه از پروتئيني به عنوان استاندارد استفاده شود كه از نظر تعداد ريشههاي تيروزين با پروتئين موردنظر مشابه باشد.
نكته مهم ديگر در اندازهگيري پروتئين به روش لوري زمان دقيق انكوباسيون ميباشد؛ زيرا اختلاف در زمان انكوباسيون براي نمونههايي كه قرار است با اين روش اندازهگيري شوند، موجب توليد نتايجي ميشود كه تكرارپذير نيستند. روش لوري همچنين با طيف وسيعي از تركيبات از قبيل تريس (Tris) و اتيلن ديآمين تترا استيك اسيد (EDTA) كه هر دو از اجزاي شايع بافرها ميباشند و براي خالصسازي پروتئينهاي نوتركيب به كار ميروند، تداخل مينمايند. هر چند اثر اين عوامل را ميتوان با رقيق كردن نمونه كاهش داد.
مزاياي روش لوري
– حساسيت در محدوده وسيع
– رايجترين روش رفرانس براي اندازهگيري پروتئينها
– انجام در دماي اتاق
– 10-20 مرتبه حساستر از تشخيص با نور UV در طول موج 280 نانومتر
– قابليت انجام در ميكروپليت
– سرعت انجام آزمایش (2-1 ساعت)
– گستردگي استفاده در علم بيوشيمي
معايب روش لوري
– تداخل بسياري از مواد با اين روش
– پرزحمت بودن تهيه معرف Alkaline copper
– معرف تهيه شده در طي مدت زمان ذخيره موجب ايجاد كربنات شده كه با فعاليت نوري آن تداخل مينمايد.
– معرف بايد به صورت تازه و روزانه تهيه شود.
– طولاني بودن مدت زمان آزمايش
– ناپايداري معرف در مقابل نور
– تفاوت مقدار رنگ در پروتئينهاي مختلف
– نياز به تهيه استاندارد بسيار دقيق
– متناسب نبودن دقيق رنگ ايجاد شده با غلظت پروتئين
– تداخل با سوكروز، ليپيدها، برخي بافرها، مونوساكاريدها و هگزوزآمينها
– تداخل با غلظتهاي بالاي سولفات آمونيوم، تركيبات سولفهيدريل و فسفات
اصول آزمايش
در اين روش، نخستين مرحله واكنش بيوره ميباشد كه موجب احيا مس دو ظرفيتي (Cu2+) به مس يك ظرفيتي (Cu+) ميشود، سپس واكنش دوم از مس يك ظرفيتي براي احيای معرف Folin-Ciocalteu (فسفوموليبدات و فسفوتنگستات) استفاده مينمايد. اين محصول به موليبدنوم/تنگستن بلو احيا ميشود و در طول موج 750-500 نانومتر به روش كالريمتري قابل شناسايي است. حضور اسيدهاي قوي و آمونيوم سولفات با اين روش تداخل مينمايند.
در روش لوری، چون احيای مس رخ ميدهد بايد مطمئن شويم كه آب مقطر مورد استفاده در ظرف پلاستيكي نگهداري شده و از مصرف آب مقطري كه در ظرفهاي مسي نگهداري شده است، خودداري نماييم.
روش لوري با تكيه بر دو واكنش متفاوت پايهگذاري شده است. واكنش نخست تشكيل كمپلكس يون مس با پيوندهاي آميدي و ايجاد مس احيا شده در محلول قليايي ميباشد. اين واكنش كروموفور بيوره ناميده ميشود. واكنش دوم، احيا معرف Folin-Ciocalteu به وسيله ريشههاي تيروزين و تريپتوفان ميباشد. معرف
Folin-Ciocalteu احيا شده آبي رنگ بوده و از اين رو به وسيله اسپكتروفتومتر در طول موج 750-500 نانومتر اندازهگيري ميشود. واكنش بيوره به تنهايي حساسيت كافي را ندارد. استفاده از معرف
Folin-Ciocalteu براي تشخيص مس احيا شده، اندازهگيري پروتئين را نزديك به 100 مرتبه حساستر از واكنش بيوره به تنهايي ميسازد.
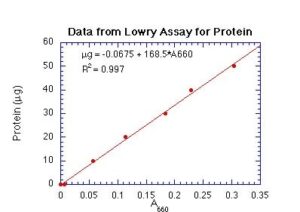
اين روش اندازهگيري نسبتاً حساس ميباشد اما نسبت به ساير روشهاي اندازهگيري پروتئينها، وقتگير بوده و مستعد تداخل تركيبات بسياري ميباشد. از جمله اين عوامل مداخلهگر به ريجنتها، كربوهيدراتها، گليسرول، تريسين، EDTA، تريس، تركيبات پتاسيم، تركيبات سولفهيدريل، تركيبات دي سولفيد، منيزيوم و كلسيم ميتوان اشاره نمود. اغلب اين عوامل مداخلهگر به طور رايج در بافرهاي تهيه پروتئينها به كار ميروند. اين مشكل يكي از محدوديتهاي استفاده از اين روش در اندازهگيري پروتئينها ميباشد. روش لوري به تغييرات محتواي ريشههاي تيروزين و تريپتوفان حساس است، بنابراين اگر در پي اندازهگيري پروتئيني هستيم كه حاوي تعداد غيرمعمول از ريشههاي اين دو اسيد آمينه ميباشد، استفاده از استاندارد مناسب ضروري است. منحني استاندارد در محدوده μg1-100 پروتئين، خطي ميباشد.
در روش اندازهگيري لوري، ميتوان طول موج را در محدوده 750-500 نانومتر انتخاب نمود. در بسياري از تحقيقات از طول موج 660 نانومتر استفاده ميشود. استفاده از ساير طول موجها به منظور كاستن از تأثير آلودگيها مثل تداخل كلروفيل در نمونههاي گياهي كه در طول موج 660 نانومتر تداخل مينمايند اما در طول موج 750 نانومتر تداخلشان از بين ميرود نيز شايع ميباشد.
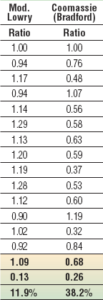
مقايسه نتايج اندازهگيري برخي پروتئينهاي مختلف با روش لوري و بيوره
روش اصلاح شده لوری
در سال 1951 Oliver H. Lowry روشي كالريمتري براي اندازهگيري پروتئينها ارائه كرد كه نسبت به روش اندازهگيري پيشين پروتئينها تغييراتي داشت و مقاله او به عنوان يكي از مقالاتي معرفي شد كه بيشترين استنادات به آن شده بود. روش اندازهگيري پروتئين اصلاح شده لوري از يك معرف پايدار به جاي دو معرف ناپايداري كه Dr. Lowry معرفي كرده بود استفاده مينمود. انجام روش اندازهگيري پروتئين اصلاح شده لوري آسان بود زيرا انكوباسيون آن در دماي اتاق انجام ميگرفت و حساسيت كافي را داشت به حدي كه ميتوانست پروتئين را در مقادير ميكروگرم در ميليليتر اندازهگيري نمايد.
مكانيسم واكنش
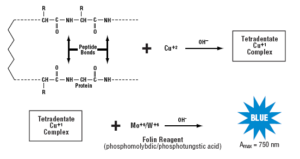
مكانيسم واقعي تشكيل رنگ در روش اندازهگيري پروتئين اصلاح شده لوري بطور كامل شناخته نشده است. واكنش توليد رنگ با پروتئينها در دو مرحله مجزا اتفاق ميافتد. در ابتدا پروتئين با سولفات مس قليايي در حضور تارتارات در طي ده دقيقه انكوباسيون در دماي اتاق واكنش ميدهند. در طي انكوباسيون، كمپلكس tetradentate copper از اتصال چهار پيوند پپتيدي با يك اتم مس تشكيل ميشود. كمپلكس tetradentate copper داراي رنگ آبي كمرنگ ميباشد كه اين واكنش، واكنش بيوره ناميده ميشود. پس از انكوباسيون، معرف فولين فنول (Folin phenol) اضافه ميشود. اعتقاد بر اين است كه افزايش شدت رنگ متعاقب انتقال الكترونها از كمپلكس tetradentate copper به كمپلكس فسفو موليبديك/فسفو تنگستيك اسيد (معرف فولين فنول) رخ ميدهد.
مكانيسم اندازهگيري پروتئين به روش اصلاح شده لوري
كمپلكس فسفو موليبديك/فسفو تنگستيك اسيد احيا شده كه در اين واكنش توليد ميشود داراي رنگ آبي پررنگ ميباشد. معرف فولين فنول تقريباً بلافاصله فعاليتش را پس از افزودن به محلول معرف كار قليايي نمونه از دست ميدهد. شدت رنگ آبي ايجاد شده در طي 30 دقيقه انكوباسيون در دماي اتاق به تدريج پررنگتر ميشود. به وسيله Lowry و همكاران و Legler و همكاران پيشنهاد شده است كه در طي 30 دقيقه انكوباسيون، بازآرايي كمپلكس ناپايدار رنگ آبي ايجاد شده اوليه منجر به كمپلكس رنگي آبي نهايي پايدار ميشود كه داراي جذب نوري بالاتري ميباشد.
در مورد پپتيدهاي كوچك، با افزايش اندازه پپتيد، مقدار رنگ نيز افزايش مييابد. حضور هر كدام از اسيد آمينههاي تيروزين، تريپتوفان، سيستئين، هيستيدين و آسپاراژين در اسكلت پپتيد يا پروتئين موجب افزايش شدت رنگ توليد شده ميشود، زيرا اين اسيدهاي آمينه موجب احيای اكيوالانهاي بيشتري از كمپلكس فسفوموليبديك/فسفو تنگستيك اسيد ميشوند. به استثناي اسيدهاي آمينه تيروزين و تريپتوفان، اسيدهاي آمينه آزاد با روش اندازهگيري پروتئين اصلاح شده لوري، ايجاد رنگ نميكنند، اگرچه اغلب پيوندهاي ديپپتيد قابل شناسايي هستند. در غياب پنج اسيد آمينه ذكر شده در بالا در ساختمان اسكلت پپتيدها، پروتئينهاي داراي ريشه پرولين، با اين روش، شدت رنگ كمتري توليد ميكنند كه ناشي از تداخل اين اسيد آمينه با تشكيل كمپلكس فسفو موليبديك/فسفو تنگستيك اسيد ميباشد.
مزاياي روش اصلاح شده لوري
رنگ آبي نهايي توليد شده در طول موج 750 نانومتر به صورت اپتيمم اندازهگيري ميشود؛ اگر چه ما ميتوانيم آن را در هر طول موجي بين 650 تا 750 نانومتر اندازهگيري نماييم كه در اينجا مقدار شدت رنگ، كمي پايينتر خوانده ميشود. بهتر است كه اندازهگيري شدت رنگ در 750 نانومتر انجام شود زيرا در ساير طول موجها، برخي مواد ديگر موجب جذب نور ميشوند. مقدار نور جذب شده در 750 نانومتر، مستقيماً با مقدار پروتئين در نمونه متناسب ميباشد اما منحنيي كه ايجاد ميشود كاملاً خطي نميباشد. اين روش نسبت به روش اندازهگيري پروتئينها بر پايه كوماسي بلو داراي تغييرات پروتئين- پروتئين كمتري ميباشد.
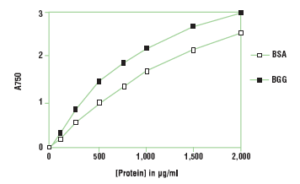
منحني استاندارد به دست آمده با BSA و BGG با روش اصلاح شده لوري (750 nm=λ )
هنگامي كه منحنيهاي استاندارد سرم آلبومين گاوي (BSA) و گاما گلبولين گاوي (BGG) با هم مقايسه ميشوند در روش اصلاح شده لوري كمتر از 15 درصد اختلاف در سيگنال توليد شده مشاهده ميشود، در حاليكه اين اختلاف در روش كوماسي (برادفورد) بيش از 30 درصد ميباشد.
معايب روش اصلاح شده لوري
اين روش در حضور دترجنتها و يونهاي پتاسيم ايجاد رسوب مينمايد. گاهي اوقات با سانتريفوژ نمونهها و اندازهگيري شدت رنگ ايجاد شده در محلول روئي نمونه ميتوان بر اين مشكل ايجاد شده در حضور يونهاي پتاسيم فائق آمد. اغلب سورفاكتانتها حتي در غلظتهاي بسيار پايين نيز موجب رسوب معرفها ميشوند. تنها مورد استثنا، سديم دودسيل سولفات (SDS) ميباشد كه در غلظتهاي تا يك درصد با معرفها رقابت مينمايد. عوامل شلاته كننده با اتصال مس تداخل نموده و مانع تشكيل كمپلكس پيوند پپتيد- مس ميشوند. تركيبات احيا كننده و تيولهاي آزاد نيز با احيای كمپلكس فسفو موليبديك/فسفو تنگستيك اسيد تداخل نموده و به محض افزودن معرفهاي اين روش، موجب ايجاد رنگ آبي شديد ميگردند.
نكات تكميلي
معرفهاي اين روش در دماي 26-18 درجه سانتيگراد به مدت يك ماه و براي نگهداري طولانيتر بايد در يخچال نگهداري شوند. نگهداري معرفها به مدت بيشتر از يك ماه در دماي اتاق ممكن است موجب ايجاد شدت رنگ كمتري شوند. معرفهاي نگهداري شده در يخچال بايد قبل از شروع كار به دماي اتاق رسانده شوند. استفاده از معرفهاي سرد در اين روش ممكن است موجب ايجاد جذب نوري پايينتري شوند. در اين روش بايد معرف فولين فنول دقيقاً پس از مدت زمان ده دقيقه به هر لوله افزوده شود.
معرف فولين فنول تقريباً بلافاصله پس از افزوده شدن، در PH قليايي معرف لوري غيرفعال ميشود، بنابراين لازم است كه دقيقاً پس از مدت زمان 10 دقيقه معرف فولين فنول به هر لوله افزوده شده و همزمان لولهها را بايد با تكان دادن مخلوط نمود. اين كار موجب ميشود كه در هر مرحله كار، تعداد نمونههايي كه با اين روش اندازهگيري ميشوند كمتر باشند. اگر فاصله ميان انجام دادن كارهاي هر لوله با لوله بعدي فقط 10 ثانيه اختلاف وجود داشته باشد، تنها قادر به اندازهگيري مقادير 60 لوله ميباشيم.
مقايسه نتايج اندازهگيري برخي پروتئينهاي مختلف با روش اصلاح شده لوري و برادفورد
:References
1- Noble J.E. and Bailey M.J.A. Quantitation of Protein. Methods Enzymol. 2009: 463;73–95.
2- Knight MI. and Chambers PJ. Problems associated with determining protein concentration: A comparision of techniques for protein estimations. Molecular Biotechnology. 2003: 23; 19-28.
3- Sapan CV., Lundblad RL. and Price NC. Colorimetric protein assay techniques. Biotechnol. Appl. Biochem. 1999: 29; 99–108.
4- Lowry OH., Rosebrough NJ., Farr AL. and Randall RJ. Protein measurement with the Folin phenol reagent. J. Biol. Chem. 1951: 193; 265–275.
5- Peterson GL. Determination of total protein. Methods Enzymol. 1983: 91; 95–121.
6- Markwell MAK., Haas SM., Tolbert NE. and Bieber LL. Protein determination in membrane and lipoprotein samples. Methods Enzymol. 1981: 72; 296–303.
7- Stoscheck CM. Quantitation of Protein. Methods in Enzymology. 1990: 182; 50-69.
https://medlabnews.ir/%d8%a7%d9%86%d8%af%d8%a7%d8%b2%d9%87%e2%80%8c%da%af%db%8c%d8%b1%db%8c-%d9%be%d8%b1%d9%88%d8%aa%d8%a6%db%8c%d9%86%e2%80%8c%d9%87%d8%a7/
https://www.ruf.rice.edu/~bioslabs/methods/protein/lowry.html
https://www.sciencedirect.com/topics/biochemistry-genetics-and-molecular-biology/lowry-protein-assay
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام