یافتههای آزمایشگاهی در بیماران بستری مبتلا به کووید ۱۹
دکتر حبیباله گلافشان
دکتر ناهید نصیری
اسماعیل خدمتی
دانشکده پیراپزشکی دانشگاه علوم پزشکی شیراز
در دو دهه گذشته سندرومهای حاد تنفسی در رابطه با ابتلا به خانواده کرونا ویروس (SARS-COV) و سندرم حاد تنفسی Middle Eastیا سندرم (MERS-COV) در مناطق اندمیک از حیوان به انسان منتقل گردید. در اواخر سال ۲۰۱۹ یکی دیگر از خانواده کرونا ویروس با قابلیت سرایت انسان به انسان کشف گردید که به آن ویروس کووید ۱۹ گفته شد و هماکنون ایجاد همهگیری (Pandemic) جهانی کرده و تحت عنوان SARS-COV-2 از آن یاد میشود. توالی ژنتیکی COV-2 دارای ۸۰ درصد توالی مشابه با SARS-COV و ۵۰ درصد تشابه با MERS است و جالب اینکه ۹۰ درصد تشابه ژنی با دو کرونا ویروس خفاش به نامهای bat-SL-CoVZ45 و bat-sl-coVZXC21 دارد.
ویروس کووید ۱۹ (SARS-COV-2) بهرغم تفاوت با سایر کرونا ویروسها برای ورود به سلـــــــول میــــزبان از گیــرنده مشــــــــترک ACE2 (Angiotensin converting enzyme) در سطح سلولها استفاده میکند.
پاسخ بدن در ابتلا به کووید ۱۹ از فرد به فرد متغیر است و بستگی به فاکتورهای مختلفی از قبیل سن، جنس، سیستم ایمنی، پروفایل HLA، تعداد گیرندههای ACE2، عوامل محیطی، بیماریهای زمینهای و فاکتورهای ناشناخته دیگر دارد. بیماری در غالب موارد بدون علائم و یا دارای علائم خفیف شبیه به سرماخوردگی است، ولی در تعدادی از بیماران (حدود ۱۵ درصد) بیماری شدت یافته و با تنگی نفس و علائم سیستمیک ظاهر میگردد و از این گروه تعدادی مبتلا به سندرم زجر تنفسی (ARDS)، انعقاد داخل عروقی منتشره، ترومبوز عروقی و شوک میشوند که در نهایت مرگ را به دنبال دارد.
در این نوشتار یافتههای آزمایشگاهی در حالتهای شدید و وخیم بیماری مطرح میگردد، زیرا حالت خفیف بیماری با تغییرات چشمگیر یافتههای آزمایشگاهی همراهی ندارد.
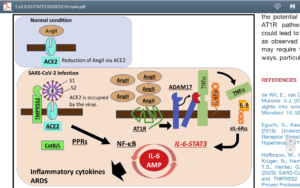
گیرنده ACE2 نقش مهمی در تعدیل التهاب دارد و با هیدرولیز و تجزیه آنژیوتانسین ۲ به مولکولهای بیخطر دیگر از افزایش فشارخون و اثرات مخرب آن میکاهد. بیان گیرنده ACE2 بهطور جبرانی در افراد با پرفشاری خون، بیماریهای قلبی- عروقی و بیماران دیابتی افزایش یافته و این موضوع بیانگر آسیبپذیری بیشتر این بیماران در تهاجم ویروس کووید ۱۹ است.
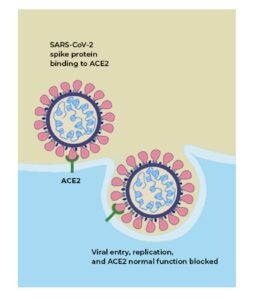
پیوند ویروس به گیرنده ACE2 و نهان شدن گیرنده توسط ویروس موجب میشود که ترمز آنژیوتانسین ۲ گرفته نشود و اثرات التهابی آن ظاهر گردد. بافتهای ریه، قلب، عروق، کلیه، کبد، گوارش و لایههای اپیتلیال بینی و دهان سرشار از گیرندهی ACE2هستند. حضور گیرندهی ACE2 در سطح لنفوسیتهای حوزه دهان و بینی هم گزارش گردیده و تصور میشود کاهش لنفوسیتها در ابتلا به کووید ۱۹ در ارتباط با اثرات تخریبی ویروس و طوفان سایتوکاینها باشد. وارد شدن ویروس کووید 19 به سلولهای بدن از طریق اتصال زائدههای پروتئینی s1 (spike protein) ویروس به میدان آنزیمی ACE2 در سطح سلول است که منجر به اندوسیتوز و ورود آنزیم و ویروس به داخل سلول میشود.
پیوند ویروس به گیرنده ACE2
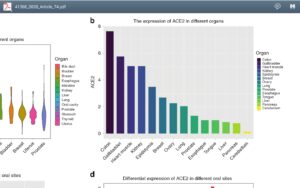
پروتئین S (spike protein)برای این پروسه احتیاج به آنزیم غشایی سلولهای میزبان دارد که دارای نقش سرین پروتئاز است و به نام TMPRSS2 شناخته میشود. اختلال در قندی شدن پروتئین S از ورود ویروس جلوگیری کرده و این موضوع اهمیت گلیکوزیله شدن پروتئینهای ویروس را نشان میدهد. ویروس کووید ۱۹ حدود ۱۰ تا ۲۰ برابر نسبت به ویروسهای دیگر این خانواده برای اتصال به ACE2 میل به پیوند دارد. بیان گیرنده ACE2 در نژادهای مختلف در مردان و زنان متفاوت است. بیان گیرندهی ACE2 بر سطح نورونهای کورتکس مغز و سلولهای glia آنها را آسیبپذیر در برابر تهاجم ویروس کووید ۱۹ میکند و از این رو از دست دادن نسبی یا کامل حواس بویایی و چشایی در بیماران در مراحل اولیه ابتلا، زنگ خطر محسوب میشود.
بیان گیرنده ویروس کووید 19 در ارگانهای مختلف
ارتباط گروه خون با ابتلا به کووید 19:
ارتباط گروه خونی با شدت بیماری کووید ۱۹ در حد یک نظریه است. این تئوری بیان میکند که آنتی A در گروه خونیهای B و O تا حدی از اتصال ویروس جلوگیری میکند و در این راستا گروه خونی O با داشتن IgG Anti A رل مؤثرتری نسبت به IgM Anti A در گروه B دارد.
سیستم گروه خونی دافی نقش مهمی در تعدیل کموکاینها در بدن دارد. این پرسش مطرح میگردد که آیا فقدان آنتیژنهای دافی میتواند موجب اثرات تخریبی بیشتر سایتوکاینها در ابتلا به کووید ۱۹ گردد؟ آنتیژنهای دافی گیرنده مالاریا بوده و افراد آفریقایی اغلب از نظر آنتیژنهای دافی منفی و مقاوم به مالاریا هستند.
به نظر میرسد که فعالیت سطح سرمی گیرندهی ACE2 در حفاظت در برابر تهاجم ویروس نقش دارد، زیرا با افزایش سطح پلاسمایی گیرنده موجب میشود که ویروس با گیرندههای آزاد در سرم پیوند داده و اتصال بافتی آن کم شود. سطح سرمی گیرندهی ACE2 ارتباط منفی با ایندکس جرمی بدن (body mass index)دارد. افزایش سطح سرمی در بچهها و خانمها ممکن است بیانگر ابتلای خفیفتر آنها باشد. فعالیت پلاسمایی آنزیم ACE2 قابلیت عبور از جفت نیز دارد.
آزمایش CBC در مبتلایان به کووید 19 با علائم متوسط تا شدید:
در طی زمان انکوباسیون که معمولاً بین یک تا ۱۴ روز است و در اوایل بیماری که علائم غیراختصاصی وجود دارد، شمارش لوکوسیت و شمارش مطلق لنفوسیت نرمال است یا اندکی کاهش دارد. ویروس کووید ۱۹ به دنبال وایرمی (viremia)، حملهور به ارگانهایی میشود که بیان بالایی از گیرندهی ACE2 از قبیل ریه، قلب و سیستم گوارش دارند.
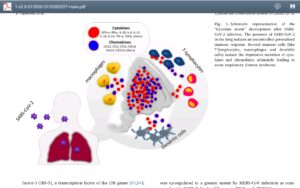
علائم بالینی حدود ۷ تا ۱۴ روز از شروع بیماری با افزایش سطح واسطههای التهابی و سیتوکاینها که به آن طوفان سایتوکاین گفته میشود، ظاهر و در این برهه کاهش شمارش لنفوسیتها مشاهده میگردد. به نظر میرسد که لنفوسیتها بهویژه در حفره دهانی و بینی دارای گیرنده ACE2 بوده و تهاجم مستقیم ویروس موجب نابودی آنها میگردد.
از طرف دیگر، طوفان سایتوکاینها با افزایش سطح اینترلوکینهای 6، 2 و 7 و G-CSF (فاکتور رشد محرک گرانولوسیتی)، پروتئین 10 القاشده ناشی از اینترفرون گاما،MCP1 ،Mip1-α و فاکتور نکروزکننده تومور (TNF) موجب آپوپتوز لنفوسیتها و در نتیجه کاهش شمارش آنها میگردد. این افزایش فعالیت در مواردی آتروفی ارگانهای لنفاوی مانند طحال را نیز به دنبال داشته است. اسیدوز لاکتیک که در بیماران مبتلا به سرطان مشاهده میشود میتواند از تکثیر لنفوسیتها جلوگیری کند و از این رو استعدادپذیری این دسته از بیماران مبتلا به کووید ۱۹ مطرح میگردد.
گیرنده ACE2 نقش مهمی در تعدیل التهاب دارد و با هیدرولیز و تجزیه آنژیوتانسین ۲ به مولکولهای بیخطر دیگر از افزایش فشارخون و اثرات مخرب آن میکاهد
در گزارش بر روی ۱۰۹۹ بیمار در چین حدود 83/2 درصد در بدو پذیرش دچار لنفوپنی،36/2 درصد ترومبوسیتوپنی و 33/7 درصد لکوپنی داشتهاند. اختلالات هماتولوژیکی در میان بیماران بدحال (Severe) نسبت به غیر بدحال چشمگیرتر بوده است؛ برای مثال 96/1 درصد لنفوپنی در برابر 80/4 درصد و 57/7 درصد ترومبوسیتوپنی در برابر 31/6 درصد و 61/1 درصد لوکوپنی در برابر 28/1 در صد گزارش شده است.
گفتنی است که ریسک سندرم حاد تنفسی (ARDS)در بیماران در طی دوران بستری ارتباطی مستقیم با افزایش شمارش نوتروفیلها و کاهش شمارش لنفوسیتها داشته است. در برخی از بیماران، کاهش شمارش لنفوسیتها با مشاهده شکلهای آتیپیک مانند پلاسماسیتوئید همراه بوده است. آنالیز فلوسایتومتری نسبت معکوس سلولهای+CD4+/CD8 را نشان نداده است. بههرحال ویروس کووید ۱۹ اختلال در لنفوسیتهای CD4 هلپر و Treg ایجاد کرده و سریع بدن را از سلولهای TCD8+ (cytotoxic) تخلیه میکند.
طوفان سایتوکاینها در رابطه با آسیب حاد ریوی
بیماری شدید کووید ۱۹ در بیمارانی که در بدو پذیرش و طی بیماری، کاهش شمارش لنفوسیت و یا کاهش نسبت لنفوسیت به کل گلبولهای سفید (lymphocyte/ WBC) را داشتهاند، مشاهده گردیده است. برعکس در بیمارانی که بهبود یافتهاند گرچه در روز هفتم از بیماری، کاهش شمارش لنفوسیت چندان چشمگیر نبوده ولی افزایش مجدد آن دیده شده است. از این رو شمارش سریال لنفوسیتها میتواند تا حدی نتیجه بیماری را پیشبینی کند.
بنا بر یک گزارش، بدترین پیشآگهی مربوط به بیمارانی بوده است که شمارش لنفوسیت کمتر از ۲۰ درصد در روزهای ۱۰ تا ۱۲ از شروع علائم و شمارش کمتر از ۵ درصد در روزهای ۱۷ تا ۱۹ داشتهاند.
مطالعات اخیر نشان داده است که آسیب قلبی در بیماران مبتلا به کووید ۱۹ همراه با افزایش مرگومیر است. این دسته از بیماران که آسیب میوکارد داشتهاند دارای افزایش بیشتر شمارش گلبولهای سفید، کاهش بیشتر لنفوسیتها و کاهش بیشتر پلاکتها نسبت به بیماران بدون آسیب میوکارد بودهاند.
تغییرات هماتولوژی، بیوشیمی، انعقادی و سایتوکاینها در ابتلا به کووید 19
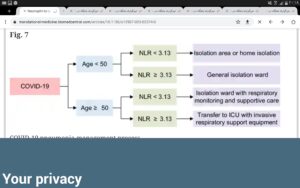
محاسبه نسبت توتروفیل به لنفوسیتها یا پارامتر NLR (درصد نوتروفیل به درصد لنفوسیت یا نسبت شمارش مطلق نوتروفیل به لنفوسیت) با توجه به سن، یکی دیگر از پارامترهای پیشآگهی در ابتلا به کووید ۱۹ است. بیماران با سن کمتر از پنجاه سال با NLR کمتر از 3/13 بهندرت دچار شدت بیماری شده و اغلب با قرنطینه خانگی درمان میگردند و بیماران این گروه سنی با NLR بیشتر یا مساوی 3/13 شانس کمتری برای حالت وخیم بیماری دارند، ولی نیاز به مراقبت بیشتری است.
بیماران با سن بیشتر از ۵۰ و پارامتر NLR کمتر از 3/13 شانس متوسط برای حالت بحرانی و نیاز به پیگیری وضعیت تنفسی و درمانهای حمایتی دارند، درحالیکه سن بالای ۵۰ سال با NLR بیشتر از 3/13 امکان وخیم شدن بیماری و نیاز به بخش ICU را به همراه دارد. نسبت نوتروفیل به لنفوسیت در افراد سالم 2/8 با دامنه 4/4-1/2 است.
شمارش مطلق لنفوسیتها در یک فرد سالم بین ۱۵۰۰ تا 4000 در هر میلیمتر مکعب است؛ برای مثال اگر گلبول سفید برابر 6000 و ۴۰ درصد آن لنفوسیت باشد، شمارش مطلق لنفوسیت برابر ۲۴۰۰ است. شمارش مطلق کمتر از ۱۵۰۰ را لنفوپنی گویند. بیماری وخیم کووید ۱۹ در گزارشها با شمارش مطلق لنفوسیتی ۴۰۰ تا ۷۹۰ در هر میلیمتر مکعب همراهی داشته است و در ۸۵ درصد بیمارانی که نیاز به ICU دارند با تظاهرات لنفوپنی همراه بوده است.
تغییرات دینامیک شمارش پلاکت:
شمارش پلاکت و تغییرات دینامیک آن میتواند در رابطه با درجه طوفان سایتوکاینها در کووید ۱۹ باشد. مشاهده شده است که اوج افزایش پلاکتها در حین درمان، ارتباط مستقیم با طول اقامت بیمار در بیمارستان دارد و این افزایش بیشتر در افراد مسن مشاهده شده است. با محاسبه نسبت پلاکت به لنفوسیت PLR (شمارش پلاکت به شمارش مطلق لنفوسیت) میتوان فاکتوری جهت شدت بیماری و نمایی از طوفان افزایش سایتوکاینها را مشاهده کرد.
گزارش شده است که تغییرات PRP و اختلاف آن در بدو پذیرش بیمار از افزایش آن در حین درمان دارای اهمیت بوده و چنانچه این اختلاف از عدد 126/7 فراتر رود (Δ PRP > 126.7) میتوان انتظار داشت که اقامت بیمار در بیمارستان طولانی خواهد بود.
یادآور میشود دامنه مرجع نسبت پلاکت به لنفوسیت در افراد سالم با میانگین ۱۳۷ و دامنه ۷۵ تا ۱۹۹ است.
شمارش نرمال پلاکتها بین 150 هزار تا ۴۵۰ هزار در هر میلیمتر مکعب است و چنانچه تعداد آن کمتر از ۱۵۰ هزار گردد، بیانگر ترومبوسیتوپنی است. بیماری کووید ۱۹ چنانچه با ترومبوسیتوپنی و افزایش D-dimer همراه گردد بیانگر استعداد به لختهپذیری است و نیاز به بخش ICU را در این بیماران مطرح میکند.
اختلالات انعقادی در ابتلا به کووید ۱۹ در بیماران با علائم شدید:
اختلال انعقادی در ابتلا به کووید ۱۹ از غیرطبیعی شدن خفیف تستهای آزمایشگاهی تا انعقاد داخل عروقی منتشره (DIC) و ایجاد ترومبوز و نارسایی چند ارگانی بروز میکند. افزایش سطح D-dimer در بدو پذیرش و یا افزایش سریال آن در طول دوران بستری نشانه وخامت بیماری و پیشرفت بیماری است. فعال شدن سیستمیک سایتوکاینها یا به عبارت دیگر طوفان واسطههای التهابی موجب فعال شدن فاکتورهای انعقادی میگردد. آسیب مستقیم ویروس به سیستم عروقی در ایجاد انعقادپذیری نقش مهمی دارد. درمان با هپارین یا داروهای فیبرینولیتیک ممکن است سودمند باشد. گفتنی است که نوتروفیلیا، افزایش D-dimer و LDH همراه با زجر تنفسی (ARDS) با پیشرفت بیماری به سوی مرگ همراهی دارد.
حادثههای ترومبوز در ابتلا به کووید ۱۹ شامل آمبولی ریوی، ترومبوز عروق عمقی (DVT)، سکته مغزی، انفارکتوس میوکارد و آمبولی سیستمیک شریانی است. پدیدههای ترومبوتیک در حدود ۲۵ تا ۳۰ درصد بیماران بستری در آیسییو گزارش شده است. در اغلب بیماران، علیرغم افزایش D-dimer، کاهش چشمگیر در پلاکت و فیبرینوژن مشاهده نمیگردد که این موضوع بیانگر افزایش پروتئینهای فاز حاد است. افزایش حاد فاکتور ۸ ممکن است زمان آزمایش PTT را بهرغم انعقاد داخل عروقی منتشره، نرمال یا نزدیک به نرمال نماید. افزایش تدریجی D-dimer با کاهش شمارش پلاکتها در کووید ۱۹ بیانگر DIC واضح و وخامت بیماری است.
سنجش اینترلوکین ۶، CRP و پروکلسیتونین در ابتلا به کووید 19:
سنجش سطح اینترلوکین ۶ و CRP بیانگر وسعت طوفان سایتوکاینها در ابتلا به کووید ۱۹ است و با شدت بیماری در ارتباط است. اینترلوکین ۶ یک سایتوکاین چندمنظوره است که تحت اثر اینترلوکین یک از کبد ترشح شده و نقش مهمی در پاسخ ایمنی و واکنشهای التهابی دارد.
پروتئین واکنشگر C یا CRP یک پروتئین فاز حاد است که تحت اثر اینترلوکین ۶ از کبد ترشح میشود و افزایش آن اخطاری برای واکنشهای التهابی در بدن است. در حالت طبیعی مقدار آن اندک است و قابل تشخیص نیست ولی در پروسههای التهابی میزان آن بهسرعت چند برابر میشود و گزارشها حاکی از آن است که درجه افزایش CRP مانند اینترلوکین ۶ بیانگر رها شدن سیستمیک سایتوکاینهاست و افزایش CRP>41 ممکن است بیانگر وخامت بیماری باشد.
پروکلسیتونین از سلولهای C تیروئید و سلولهای نورواندوکرین ترشح میشود و مقدار نرمال آن کمتر از 0/15 نانوگرم در سیسی است. افزایش بیشتر از 0/5 نانوگرم دارای اهمیت و بیشتر از 2 نانوگرم بیانگر التهاب یا عفونت شدید است. سطح پروکلسیتونین ممکن است بازتابی از طوفان سایتوکاینها یا ابتلا به عفونتهای میکروبی باشد. سطح پروکلسیتونین بالاتر از ۱۰ معمولاً در رابطه با شوک عفونی مشاهده میگردد. افزایش فریتین سرم نیز که بازتابی از پروتئینهای فاز حاد است در بیماران مشاهده گردیده است.
گازهای خون در ابتلا به کووید ۱۹ با علائم شدید:
علائم شدید ذاتالریه در ابتلا به کووید ۱۹ با افزایش تعداد تنفس بیشتر یا مساوی 30 در دقیقه، هایپوکسی با اشباع اکسیژن کمتر از ۹۳ درصد در حالت استراحت و نسبت PaO2/FiO2 ≤ 300 mmHg (فشار اکسیژن شریانی/ درصد اکسیژن در هوای تنفسی) همراه است.
آزمایشهای کبدی در ابتلا به کووید 19:
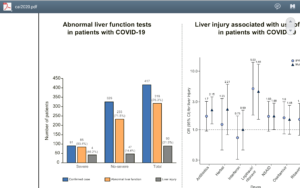
با در نظر گرفتن مقادیر Alt >40 و Ast >40 و GGT >49 و Alk.P >135 و T.Bili>17.1 به عنوان آزمایشهای غیرطبیعی، الگوی اختلالات کبدی در سه گروه هپاتوسلولار، کلستاتیک و الگوی مخلوط قرار میگیرند.
الگوی هپاتوسلولار با افزایش ۳ برابری آنزیمهای Alt و یا Ast از حد بالای نرمال است و بیماران گروه کلستاتیک دارای افزایش دو برابر بالای حد نرمال از آنزیمهای Alk.Pو یاGGT هستند. بیمارانی که همزمان افزایش آنزیمهای Alt و Ast و آنزیمهای Alk.PوGGT را داشتند، در گروه مخلوط قرار گرفتند.
آسیب کبدی (Hepatic injury) با افزایش سطح Alt و یا Astبیشتر از سه برابر حد بالای نرمال و آلکالین فسفاتاز وGGT و یا بیلیروبین بیشتر از دو برابر حد طبیعی تعریف گردیدند. در یک گزارش با مطالعه ۴۱۷ بیمار مبتلا به کووید 19، 76 درصد دارای اختلال در آزمایشهای کبدی و 21/5 درصد مبتلا به آسیب کبدی گزارش گردیدهاند. اختلالات کبدی اغلب در طول دوران بستری مشاهده شده است و استفاده از داروهای Lopinavir /Ritonavir احتمال آسیب کبدی را افزایش میدهد.
اختلالات تستهای کبد و آسیب کبد در مبتلایان به کووید 19
تشخیص آزمایشگاهی کووید 19 (Sars-COV-2 )
تشخیص بر اساس آزمایش مولکولی یا آزمایش نوکلئیک اسید (NAAT) است که توالی ویژهای از ویروس کووید ۱۹ با روش rRT-PCR تکثیر شده و مورد شناسایی قرار میگیرد. ویروس دارای ژنهای N و E و S و RdRP است. میانگین زمان انکوباسیون ویروس 2.5 با دامنه ۲ تا ۱۴ روز است.
گرچه ویروس در اکثر مایعات بدن از جمله خون و مدفوع یافت میشود، ولی سواب گرفتن از قسمت بینی حلقی (Nasopharyngeal) یا سواب NP بهتر از تهیه سواب از قسمت دهانی حلقی (Oropharyngeal) یا سواب OP است. در یک مطالعه در همهگیری ویروس در چین، نمونههای تهیهشده از بینی حلقی بازده ۶۳ درصد در مقابل ۳۲ درصد دهان حلقی داشته است. تهیه نمونه از سیستم تنفسی بهترین بازده را دارد.
چنانچه ضریب شک بالاست ولی جواب آزمایش منفی است، تهیه نمونه از قسمتهای تحتانی ریه با خلط تحریکی یا آسپیره سفارش میشود. نمونه بایستی در حرارت ۲ تا ۸ درجه و سریع به آزمایشگاه منتقل شود یا در محلول مخصوص حمل و نقل قرار گیرد و یا چنانچه تأخیر طولانی مدنظر است در منفی ۲۰ تا منفی 70 درجه نگهداری و روی یخ خشک حمل گردد. از فریز و آب کردن پیدرپی خودداری شود. نمونهگیری ضعیف، نمونهگیری در فاز اولیه بیماری، ارسال نامناسب نمونه به آزمایشگاه، فقدان کنترل کیفی در پرایمر و پروبهای درخواستی از موارد منفی کاذب آزمایش است.
آزمایش سرولوژی از نظر کووید ۱۹ نیاز به دو نمونه؛ یکی در هفته اول و دیگری ۲ تا ۴ هفته بعد دارد. اعضای خانواده کروناویروس دارای ۴ پروتئین ساختاری S (SPIKE)، M (Membrane)،E (envelope) و N یا نوکلئوکپسید هستند.
پروتئین S از دو زیرواحد S1 و S2 تشکیل شده است. میدان S1 به گیرنده میزبان اتصال یافته و میدان S2 فیوژن ویروس را به عهده دارد. آنتیژن N جزء ساختاری ساختمان مارپیچ نوکلئوکپسید است و رل مهمی در پاتوژنیسیته بیماری دارد. از آنتیژنهای S و N در روش الیزا برای تجسس آنتیبادیهای IgG و IgM استفاده میشود.
فاکتورهای مختلفی در ساخته شدن آنتیبادی علیه کووید ۱۹ از قبیل سن، جنس، پروفایل HLA، بیماریهای زمینهای نقش دارند و پرسشهایی از قبیل اینکه آیا همه افراد با کووید ۱۹ آنتیبادی میسازند؟ آیا آنتیبادیها حالت حفاظتی دارند؟ آیا واکنشهای متقاطع در آزمایش وجود دارد؟ آیا عیار آنتیبادی با عفونت مجدد در ارتباط است؟ هنوز مطرح است.
در گزارشهای مربوط به پاسخ سیستم ایمنی در برابر کووید ۱۹ سه نوع پاسخ آنتیبادی (Sero conversion) مشاهده شده است.
- تولید همزمان IgM و IgG
- تولید IgM و سپس IgG
- تولید IgG و سپس IgM
روند پاسخ ایمنی در ابتلا به کووید 19 در تعدادی از بیماران
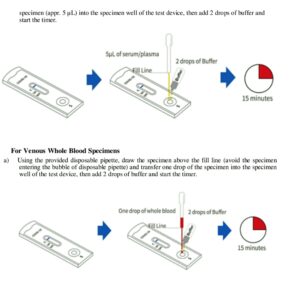
تشـــخیص ســـریع آنتــیبادی علیه کوویــــــــــد ۱۹ (SARS-COV-2 IgG/IgM) با تکنولوژی LFCI (Lateral Flow Chromatographic Immunoassay) در خون کامل یا سرم یا پلاسما صورت میگیرد.
این سنجش ایمنی از آنتی هیومن IgM آنتیبادی (IgM line)، آنتی هیومن IgG آنتیبادی (IgG line) و آنتیبادی علیه IgG موش که از بز تهیه شده (control line) استفاده میکند که بر روی نوار نیتروسلولز فیکس گردیدهاند. در این ابزار تشخیصی از پد حاوی آنتیژنهای SARS-COV-2 شامل زیرواحد پروتئین S1 و پروتئین نوکلئوکپسید که با تکنولوژی DNA تهیه شدهاند، استفاده میشود. آنتیژنها با نانوپارتیکلهای سوسپانسیون طلا (Colloid gold) کانژوگه شدهاند و این پارتیکلها کمتر از ۱۰۰ نانومتر قطر دارند و دارای رنگ قرمز هستند. پلاسما یا سرم در چاهک مخصوص ریخته شده و سپس با اضافه کردن بافر، چنانچه IgG یا IgM علیه آنتیژنهای کووید 19 وجود داشته باشند ایجاد کمپلکس کرده و این کمپلکسهای آنتیژن- آنتیبادی با حرکت موئینه در نیتروسلولز به راه میافتند. وقتی که کمپلکسهای ایمنی با خطوط IgM و IgG (anti human IgM/IgG) برخورد کردند، در همان جایگاه ساکن شده و ایجاد باند قرمز میکنند.
تکنولوژی LFCI (lateral flow chromatographic immunoassay)
ظاهر شدن باند قرمز در ناحیه کنترل و تغییر رنگ آن از آبی به قرمز بیانگر حجم مناسب نمونه و کارکرد صحیح ابزار سنجش است. اثرات هوک در این ابزار سنجش مشاهده گردید که با رقیق کردن سرم شدت رنگ قرمز بیشتر میشود. نمونههای مثبت بایستی با روشهای تأییدی دیگر چک گردند.
منابع:
- Gérard, C., G. Maggipinto, and J.M. Minon, COVID‐19 & ABO blood group: another viewpoint. British journal of haematology, 2020.
- Nickel, R.S., et al., Combination dose-escalated hydroxyurea and transfusion: an approach to conserve blood during the COVID-19 pandemic. Blood, 2020.
- Connors, J.M. and J.H. Levy, COVID-19 and its implications for thrombosis and anticoagulation. Blood, The Journal of the American Society of Hematology, 2020. 135(23): p. 2033-2040.
- Ciaglia, E., C. Vecchione, and A.A. Puca, COVID-19 Infection and Circulating ACE2 Levels: Protective Role in Women and Children. Frontiers in Pediatrics, 2020. 8: p. 206.
- Liu, F., et al., Prognostic value of interleukin-6, C-reactive protein, and procalcitonin in patients with COVID-19. Journal of Clinical Virology, 2020: p. 104370.
- Lee, J.S., et al., Reference values of neutrophil-lymphocyte ratio, lymphocyte-monocyte ratio, platelet-lymphocyte ratio, and mean platelet volume in healthy adults in South Korea. Medicine, 2018. 97(26).
- Wu, Y., et al., Relationship between ABO blood group distribution and clinical characteristics in patients with COVID-19. Clinica Chimica Acta, 2020.
- Salamanna, F., et al., Platelet functions and activities as potential hematologic parameters related to Coronavirus Disease 2019 (Covid-19). Platelets, 2020: p. 1-6.
- Cai, Q., et al., COVID-19: abnormal liver function tests. Journal of hepatology, 2020.
- Xu, H., et al., High expression of ACE2 receptor of 2019-nCoV on the epithelial cells of oral mucosa. International journal of oral science, 2020. 12(1): p. 1-5.
- Terpos, E., et al., Hematological findings and complications of COVID‐19. American journal of hematology, 2020.
- Khartabil, T., et al., A summary of the diagnostic and prognostic value of hemocytometry markers in COVID-19 patients. Critical reviews in clinical laboratory sciences, 2020: p. 1-17.
- Long, Q.-X., et al., Antibody responses to SARS-CoV-2 in patients with COVID-19. Nature medicine, 2020: p. 1-4.
- Henry, B.M., et al., Hematologic, biochemical and immune biomarker abnormalities associated with severe illness and mortality in coronavirus disease 2019 (COVID-19): a meta-analysis. Clinical Chemistry and Laboratory Medicine (CCLM), 2020. 58(7): p. 1021-1028.
- Schwartz, D.A., An analysis of 38 pregnant women with COVID-19, their newborn infants, and maternal-fetal transmission of SARS-CoV-2: maternal coronavirus infections and pregnancy outcomes. Archives of pathology & laboratory medicine, 2020.
- Iranian jounal of pathology,serology testing for sars cov 2 benefit and challenges,M.jalali Nadoushan,soha Ahmadi,P nadoushan
- Lippi, G. and M. Plebani, Laboratory abnormalities in patients with COVID-2019 infection. Clinical Chemistry and Laboratory Medicine (CCLM), 2020. 58(7): p. 1131-1134.
- Diaz, J.H., Hypothesis: angiotensin-converting enzyme inhibitors and angiotensin receptor blockers may increase the risk of severe COVID-19. Journal of Travel Medicine, 2020.
- Hirano, T. and M. Murakami, COVID-19: A new virus, but a familiar receptor and cytokine release syndrome. Immunity, 2020.
- Zhang, Z.-L., et al., Laboratory findings of COVID-19: a systematic review and meta-analysis. Scandinavian journal of clinical and laboratory investigation, 2020: p. 1-7.
- Tang, Y.-W., et al., Laboratory diagnosis of COVID-19: current issues and challenges. Journal of clinical microbiology, 2020. 58(6).
- Violetis, O.A., et al., COVID-19 Infection and Haematological Involvement: a Review of Epidemiology, Pathophysiology and Prognosis of Full Blood Count Findings. SN Comprehensive Clinical Medicine, 2020: p. 1-5.
- Yang, F., et al., Coagulation Dysfunction: A Hallmark in COVID-19. Archives of pathology & laboratory medicine.
- Coperchini, F., et al., The cytokine storm in COVID-19: an overview of the involvement of the chemokine/chemokine-receptor system. Cytokine & Growth Factor Reviews, 2020.
- Moore, J.B. and C.H. June, Cytokine release syndrome in severe COVID-19. Science, 2020. 368(6490): p. 473-474.
مارکرهای آزمایشگاهی COVID-19 خفیف و شدید
گایدلاینهای موقت IFCC در مورد پایش بیوشیمیایی و هماتولوژیکال بیماران COVID-19
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام