پاتوفیزیولوژی و یافتههای آزمایشگاهی کواگولوپاتی ناشی از کووید-19
اکبر درگلاله1، حسن مروتی2
1: گروه هماتولوژی و طب انتقال خون، دانشگاه علوم پزشکی ایران
2: مرکز تحقیقات واکسن و سرمسازی رازی
ویروس کرونای جدید یا SARS-CoV-2 که موجب بروز بیماری کووید-19 میشود، برای نخستین بار اواخر سال 2019 در ووهان چین گزارش شد. تاکنون بیماری در 216 کشور دنیا مشاهده شده و بیش از شش میلیون و پانصد هزار نفر را آلوده کرده و حدود چهارصد هزار نفر را به کام مرگ کشانده است. هرچند دانش ما در باب این بیماری بسیار اندک است، اما با کارهای علمی- تحقیقاتی، هر روز دریچهای نو از بیماری بر ما گشوده شده و دانش ما نسبت به این ویروس و بیماری ناشی از آن افزایش مییابد و به محققین کمک بیشتری میکند تا به سمت تشخیص و درمان بهتر بیماری گامهای استوارتری بردارند.
افراد مبتلا به کووید-19 علائم بالینی متنوعی بروز میدهند که شایعترین این علائم تب، سرفه، تنگی نفس و احساس ضعف است؛ اما علاوه بر این، گلودرد، مشکلات گوارشی، سردرد و از دست دادن حس بویایی و چشایی از دیگر علائم با شیوع نسبتاً بالا در این بیماران هستند. در کنار این علائم، بیمار ممکن است علائم با شیوع کمتر مثل خونریزی دستگاه گوارش، خونریزی مغزی و پورپورا را نیز بروز دهد. آشنایی با علائم بالینی بیماری میتواند به تشخیص بهموقع بیماری و در نتیجه شروع فرآیند درمان، کمک شایانی نماید. در کنار علائم بالینی، یافتههای آزمایشگاهی نیز نقش مهمی در شناسایی افراد مبتلا به کووید-19 داشته و علاوه بر نقش تشخیصی، این یافتهها میتوانند برای بررسی سیر بیماری و پیشآگهی این عفونت ویروسی نیز مورد استفاده قرار گیرند.
در بررسیهای آزمایشگاهی افراد مبتلا به کووید-19، یافتههای متعددی از جمله اختلالات هماتولوژیک غیرطبیعی از قبیل، لکوپنی، لکوسیتوز، لنفوپنی، نوتروفیلی، ترومبوسیتوپنی و بهصورت نادر ترومبوسیتوز را میتوان یافت، علاوه بر این در بررسیهای سیستم انعقاد، اختلالات انعقادی بهصورت شایع در این بیماران مشاهده میشود که اغلب مشاهده یافتههای انعقادی غیرطبیعی با پیشآگهی بد بیماری همراه هستند. افزایش D-dimer و FDP، افزایش زمان پروترومبین (PT)، افزایش و یا کاهش زمان ترومبوپلاستین نسبی فعالشده (APTT) از شایعترین یافتههای انعقادی در بیماران درگیر بیماری کووید-19 میباشند. اغلب بهطور مشخص افراد با یافتههای انعقادی غیرطبیعی نسبت به افراد فاقد این یافتهها بیماری شدیدتری را تجربه کرده و مرگومیر نیز در این افراد شایعتر است. ترومبوسیتوپنی یکی از یافتههای بسیار مهم در بیماران درگیر کووید-19 است که بررسیهای مختلف حاکی از این واقعیت است که حدود 20% بیماران مبتلا به کووید-19 دچار ترومبوسیتوپنی (<150×109 /L) میشوند و احتمال مرگ در افرادی که دارای ترومبوسیتوپنی پیشرونده هستند، بیشتر است؛ بهعنوان مثال خطر نسبی مرگ (the relative risk of death) در بیـــــماران با 150-100، 100-50 و 50-0 (×109/L)، به ترتیب 3.42 (95% CI 2.36-4.96)، 9.99 (95% CI 7.16-13.94) و 13.68 (95% CI 9.89-18.92) بوده و نرخ مرگومیر در این افراد به ترتیب 17/5%، 61/2% و 92/1% است؛ به عبارت دیگر میتوان گفت افرادی که شمارش پلاکت آنها کمتر از 50×109 /L است، کمتر از 10% شانس زندگی دارند. افزایش D-dimer در بیش از 50% بیماران مبتلا به کووید-19 دیده میشود، این در حالی است که در بیماران مبتلا به فرم شدید بیماری، این یافته انعقادی در بیش از 60% بیماران مشاهده میشود (جدول 1).
| جدول 1: پارامترهای انعقادی غیرطبیعی شایع در بیماران مبتلا به کووید-19 | ||
| پارامتر | تغییر غالب | تغییر غیر شایع |
| شمارش پلاکت | کاهش | افزایش |
| D-dimer | افزایش | – |
| FDP | افزایش | – |
| PT | افزایش | – |
| APTT | افزایش | کاهش |
| فیبرینوژن | افزایش | کاهش |
| VWF | افزایش | – |
| پلاسمین | افزایش | – |
علاوه بر یافتههای فوق، ترومبوسیتوپنی ناشی از هپارین (HIT)، سندرم آنتیفسفولیپید و پورپورای ترومبوسیتوپنی ایمیون (ITP) نیز در بیماران مبتلا به کووید-19 مشاهده شده است.
بهدلیل وجود یافتههای انعقادی غیرطبیعی متعدد در کووید-19، بسیاری از بیماران مبتلا به این بیماری، عوارض هموراژیک و بهخصوص ترومبوتیک مرگباری را تجربه میکنند و امروزه ترمبوز بهعنوان یکی از عوامل اصلی مرگومیر در این بیماران شناخته میشود.
سیستم هموستاز بدن بسان مثلثی است که از سه ضلع تشکیل شده است که اختلال در هریک از اجزاء این اضلاع میتواند فرد را مستعد خونریزی یا ترومبوز (لخته شدن خون) کند.
شکل 1: مثلث هموستاز
این مثلث از سه ضلع سیستم عروق، بخش سلولهای خونی و بخش غیر سلولی تشکیل شده است. اختلال در هر یک از این اجزاء میتواند فرد را مستعد ترومبوز یا خونریزی کند. در بیماری کووید-19 بخش قابلتوجهی از اجزاء مثلث هموستاز تحت تأثیر قرار میگیرند و به همین دلیل فرد مبتلا به این بیماری بخصوص موارد شدید بیماری، شدیداً مستعد عوارض ترومبوتیک است
اضلاع مثلث هموستاز از این قرارند:
1: سیستم عروق: که مهمترین بخش آن سلولهای اندوتلیال است.
2: سلولهای خونی: که شامل پلاکتها، گرانولوسیتها، لنفوسیتها و منوسیتهاست.
3: بخش غیر سلولی: که شامل فاکتورهای انعقادی، سیستم فیبرینولیز و … است.
اما اتفاقی که در زمان ابتلا به کووید-19 میافتد و در حال حاضر در مورد آن دانش نسبی وجود دارد شامل فعال شدن همزمان فاکتورهای انعقادی و سیستم فیبرینولیز است. علاوه بر این، پلاکتها بهعنوان سلولهای اصلی دخیل در فرایند هموستاز در بخش قابلتوجهی از بیماران کاهش مییابد. در کنار این اتفاقها سلولهای اندوتلیال عروق در بافتهای آسیبدیده از جمله ریه دچار آسیب شده و فاکتورها و عواملی را آزاد میکنند که موجب بروز ترومبوز در این بافتها میشوند. در واقع میتوان گفت سیستم هموستاز بهشدت تحت تأثیر بیماری کووید-19 قرار میگیرد و یکی از عوامل اصلی مرگومیر در افراد مبتلا به فرم شدید بیماری است.
باید توجه کرد که حتی اختلالات مربوط به سیستم هموستاز بدن اغلب مربوط به افرادی است که در بیمارستان بستری شده و تستهای انعقادی غیرطبیعی دارند و اغلب افراد مبتلا به کووید-19 هیچگونه علامتی دال بر اختلال در سیستم هموستاز ندارند؛ بنابراین آشفتگی در سیستم هموستاز را نمیتوان به تمام بیماران مبتلا به کووید-19 تعمیم داد. به همین دلیل توصیههای علمی کنونی، بر بررسی دقیق آزمایشگاهی بیماران کووید-19 نیازمند بستری تأکید دارند تا افراد مستعد ترومبوز شناسایی شده و بهدرستی مدیریت شوند؛ زیرا درصد قابلتوجهی از بیماران مبتلا به کووید-19 نیازمند بستری که آزمایشهای انعقادی اولیه غیرطبیعی دارند دچار اختلالات ترومبوتیک میشوند. از سوی دیگر، بخشی از این افراد ممکن است دچار خونریزی شوند یعنی هم امکان ترومبوز و هم احتمال خونریزی در برخی بیماران وجود دارد.
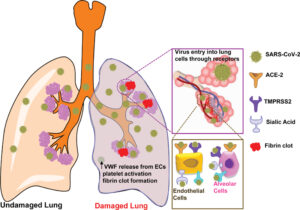
شکل 2: ترومبوز ریوی ناشی از کووید-19
در این حالت به دلیل آسیب سلولهای اندوتیلیال ریه، مقادیر زیادی فاکتور ونویلبراند و فاکتور بافتی آزاد میشوند که میتوانند موجب شروع روند انعقاد و بروز ترومبوز شوند. فاکتور ونویلبراند میتواند در مقادیر بالا ترشح شده و از اثر ADAMTS-13 در امان بماند و در نتیجه، اندازه بزرگ ملکولهای ونویلبراند آزادشده موجب القاء شدید تجمع پلاکتی شده و باعث بروز ترومبوز در ریه میگردند؛ ترومبوزی که میتواند شدیداً مرگبار بوده و مدیریت آن اغلب دشوار است
اما در ریه افراد مبتلا به فرم شدید کووید-19 که اغلب نیازمند بستری در بخش مراقبت ویژه میباشند چه اتفاقی رخ میدهد؟ بررسیهای اخیر حاکی از این واقعیت است که علت مستقیم یک سوم مرگهای ناشی از کووید-19 آمبولی ریوی است. علاوه بر این، در بیش از 50 درصد بیماران فوتشده نیز ترومبوز عمیق وریدی (DVT) مشاهده شده است. بررسیهای جدید نشان میدهند که علاوه بر آمبولی ریوی، در بیماران مبتلا به فرم شدید کووید-19 ممکن است ترومبوز ریوی نیز اتفاق بیافتد؛ یعنی آسیب سلولهای اندوتلیال در ریه موجب آزاد شدن مقادیر زیادی فاکتور ونویلبراند شده که این فاکتور موجب القای تجمع پلاکتها و در نتیجه ایجاد ترومبوز میگردد، به همین دلیل انجمن بینالمللی ترومبوز و هموستاز (ISTH) دستورالعملهای خاصی را جهت مدیریت این بیماران برای متخصصین امر منتشر کرده است.
منابع:
- Center for Systems Science and Engineering (CSSE) at Johns Hopkins University. (JHU). Coronavirus COVID-19 Global Cases. Available at: arcgis.com/apps/opsdashboard/index.html#/bda7594740fd40299423467b48e9ecf6. Accessed May 18, 2020.
- Zhang, J, Wang X, Jia X, et al., Risk factors for disease severity, unimprovement, and mortality of COVID-19 patients in Wuhan, China. Clin Microbiol Infect, 2020 (epub ahead of print). doi: 10.1016/j.cmi.2020.04.012.
- Cui D, Zhang A, Liu A, et al., Clinical findings in a patient with haemophilia A affected by COVID-19. Haemophilia 2020. [Epub ahead of print] . Doi: 10.1111/hae.14000
- Girolami A, Tezza F, Scapin M et al. Arterial and venous thrombosis in patients with von Willebrand’s disease: a critical review of the literature. J Thromb Thrombolysis 2006; 21: 175–178.
- Dorgalaleh A., Bleeding and bleeding risk in COVID-19. Semin Thromb Hemost 2020. In press
- Dorgalaleh A, Rashidpanah J. Blood coagulation factor XIII and factor XIII deficiency. Blood rev 2016;30(6):461-475.
- Wichmann D, Sperhake J, Lütgehetmann M. , et al; Autopsy Findings and Venous Thromboembolism in Patients With COVID-19: A Prospective Cohort Study. Ann Intern Med. 2020; [Epub ahead of print]. DOI: 10.7326/M20-2003.
- Tang N, Li D, Wang X and Sun Z. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J Thromb Haemost. 2020;18:844-847.
- Yang X, Yang Q, Wang Y, et al. Thrombocytopenia and Its Association with Mortality in Patients with COVID-19. J Thromb Haemost 2020 (epub ahead of print). Doi: 10.1111/JTH.14848
- Larsen JB, Pasalic L, Hvas A-M. Platelets in Coronavirus Disease 2019. Semin Thromb Hemost 2020;46(05): (in press) DOI: 10.1055/s-0040-1710006.
- Page MJ, Pretorius E. A champion of host defense: a generic large scale cause for platelet dysfunction and depletion in infection. Semin Thromb Hemost 2020;46(03):302–319
- Ruiz-Saez A. Occurrence of thrombosis in rare bleeding disorders., Semin Thromb Hemost, 2013, (39) 684-692
- Thachil J, Srivastava A, SARS-2 Coronavirus–Associated Hemostatic Lung Abnormality in COVID-19: Is It Pulmonary Thrombosis or Pulmonary Embolism? Semin Thromb Hemost 2020. DOI: 10.1055/s-0040-1712155
- Dorgalaleh A, Fariba R, Congenital bleeding disorders, in, Congenital bleeding disorders, diagnosis and management, Berlin: Springer; 2018. p. 27-53.
- Dorgalaleh A., Patients with congenital bleeding disorders appear to be less severely affected by SARS- CoV-2 ─ Inherited hypocoagulability overcoming acquired hypercoagulability of COVID-19?. Semin Thromb Hemost 2020. In press
اختلالات خونریزیدهنده ارثی و کووید-19
microRNAها در هموستاز و ترومبوز
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام