دکتر حبیب اله گلافشان
محمد اسماعیل خدمتی
دانشگاه علوم پزشکی شیراز
بخش سوم- کلیات
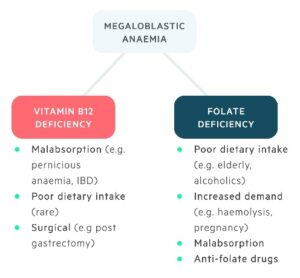
کمخونیهای غیرمگالوبلاستیک:
کمخونیهای غیرمگالوبلاستیک با MCV بالا دارای علل گوناگون هستند. در این حالت پیشسازهای گلبولهای قرمز مرفولوژی خاص مگالوبلاستیک نداشته و گلبولهای ماکروسیت مورفولوژی تخممرغی (ماکرواوالوسیت) ندارند.
میزان MCV در اغلب موارد بین ۱۰۰ تا ۱۱۰ فمتولیتر و به ندرت بیشتر از ۱۲۰ فمتولیتر میشود. در خونسازی شتابزده (Accelerated Erythropoiesis) که متعاقب خونریزی، همولیز ناگهانی رخ میدهد، انبوه رتیکولوسیتهای نارس به صورت گلبولهای پلیکرومازی وارد خون میگردند و از آنجا که حجم رتیکولوسیت ۲۵ درصد بیشتر از حجم RBC است منجر به افزایــــش MCV میشـود. (Shift Reticulocytosis)
مصرف مزمن الکل
ماکروسیتوز در دو سوم افرادی که مصرف دائم الکل دارند مشاهده میشود و بسیاری از آنها دارای کمخونی نیستند. ماکروسیتوز در افراد الکلی آنقدر شایع است که به عنوان آزمایش غربالی مصرف مستمر الکل به شمار میآید. ماکروسیتوز و کمخونی در افراد الکلی میتواند ناشی از کمبود اسید فولیک یا ناشی از سیروز الکلی و کمخونی شدید آنمی اسپورسل (Spur Cell) باشد.
کمخونی اسپورسل به صورت مرفولوژی آکانتوسیتوز با زائدههای بلند خاری نمایان میشود. الکل اثرات مستقیم سرکوبکننده نیز روی مغز استخوان دارد. چنانچه مصرف الکل قطع شود میزان MCV بعد از 2 تا 4 ماه نرمال میشود.
بیماریهای کبد:
انباشت چربیها و لیپوپروتئینهای غیرطبیعی روی غشای گلبولهای قرمز منجر به مورفولوژی ماکروسیت و آکانتوسیت میگردد. میزان MCV در نبود کمخونی مگالوبلاستیک در بیماریهای کبد به ندرت بیشتر از ۱۱۵ فمتولیتر میگردد. مرفولوژی تارگت و اکانتوسیت و استوماتوسیت در بیماریهای کبد شایع است. فیبروز کبد در سیروز کبدی منجر به بزرگ شدن طحال و کاهش شمارش پلاکت میشود و شدت کاهش پلاکت با درجه فیبروز کبد در ارتباط است و میتوان با استفاده از سریال شمارش پلاکت به وخیم شدن سیروز کبد پی برد. کمخونی همولیتیک اسپورسل نیز ممکن است در زمینه کبد رخ دهد که دارای پیشآگهی نامناسب است.
ماکروسیتوز با کاهش شمارش رتیکولوسیت گاهی در همراهی با کمخونیهای مختلف از قبیل کمخونی آپلاستیک، کمخونی فانکونی، سندروم مایلودیس پلاستیک و کمخونی دایاموند بلک فان مشاهده میشود که علت خاصی برای آن ذکر نگردیده است. تصویر پانسیتوپنی با ماکروسیتوز و کاهش شدید رتیکولوسیت بدون طحال و غدد لنفاوی بزرگ پیشنهاد دهنده کمخونی آپلاستیک است.
گاهی ماکروسیتوز ناشی از آرتیفکتهای آزمایشگاهی از قبیل آگلوتیناسیون سرد و کرایوگلوبولین است. لکوسیتوز شدید نیز با افزایش MCV همراه است زیرا هنگام شمارش گلبولهای قرمز توسط آنالیزورها، خون فقط در سرم فیزیولوژی رقیق میگردد.
پدیده تورم حاد گلبولهای قرمز با افزایش کاذب MCV همراه است؛ این حالت در بیماران دیابتی رخ میدهد. افزایش قند درون سلولی موجب جذب آب به داخل گلبول در محلول شمارش آنالیزور شده و MCV را افزایش میدهند. در این موارد البته کاهش MCHC رخ میدهد که بیانگر آبکی شدن هموگلوبین در درون گلبول قرمز است.
عبور همزمانی تودههای به هم چسبیده گلبولهای قرمز از روزنه سلولشمار در آگلوتینین سرد با افزایش کاذب MCV همراه است
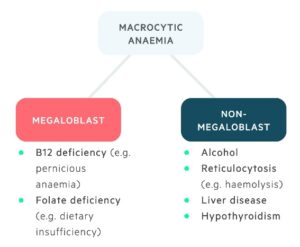
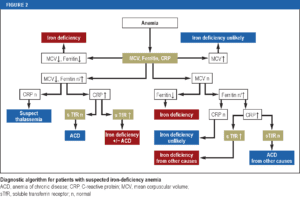
علتیابی کمخونیهای میکروسیتیک:
به کمخونی با MCV کمتر از ۸۰ میکروسیتیک گویند و مهمترین علت آنمی فقر آهن، سندرومهای تالاسمی مینور، کمخونی سیدروبلاستیک، هموگلوبینوپاتیها و آنمی بیماریهای مزمن است.
ترانسفرین منبع مهم آهن برای تولید گلبولهای قرمز است. در آنمی فقر آهن نهتنها منبع ذخیرهای ماکروفاژها کاهش مییابد بلکه اشباع ترانسفرین نیز کم میشود. به اشباع کمتر از ۱۶ درصد ترانسفرین با مرفولوژی میکروسیت و هایپوکروم خونسازی در کاهش آهن (Iron deficiency erythropoesis) گفته میشود.
در آنمی بیماریهای مزمن، آهن در ماکروفاژها احتباس یافته و کانالهای فروپورتین برای خروج آهن به علت افزایش سطح هپسیدین در دسترس نیستند. روی هم رفته آنمی فقر آهن و آنمی بیماریهای مزمن شایعترین کمخونیها هستند که ممکن است یافتههای همپوش آزمایشگاهی داشته باشند.
مرفولوژی میکروسیت و هایپوکروم در آنمی فقر آهن بسیار شدیدتر از آنمی بیماریهای مزمن است؛ کمخونی در بسیاری از موارد با مورفولوژی نرموکروم همراه است.
آهن سرم (SFe) بازتابی از میزان آهن است که به ترانسفرین متصل است. آهن سرم دارای نوسان روزانه و نوسان روز به روز بین ۱۰ تا ۴۰ درصد است. بیشترین مقدار آهن سرم در صبح و کمترین در غروب است و گمان میرود که تغییرات روزانه سطح هپسیدین از عامل مهم این نوسان باشد. با وجود تغییرات شدید روزانه در آهن سرم، پارامتر TIBC که بازتابی از سطح ترانسفرین است که به صورت ظرفیت پذیرش آهن مورد سنجش قرار میگیرد، دارای نوسان روزانه نیست. گفتنی است که سطح آهن سرم تحت اثر غذای اخیر قرار میگیرد و جای تعجب نیست که گاهی با نرمال بودن SFe و TIBC کاهش سطح فریتین مشاهده شود.
هر مولکول ترانسفرین میتواند با دو اتم آهن پیوند دهد و برای محاسبه اشباع ترانسفرین، میزان آهن سرم بر کل ظرفیت پذیرش آهن تقسیم شده و حاصل در عدد 100 ضرب میشود. توجه داشته باشید که ترانسفرین در بدن به صورت منو فریک، دای فریک و تهی از آهن (آپوترانسفرین) وجود دارد؛ پس از محاسبه آهن سرم به پلاسما آهن اضافه شده تا تمام ظرفیت آن پر شود و سپس میزان آهن ترانسفرین که بازتابی از سطح کل ترانسفرین است اندازهگیری میشود که در شرایط عادی بین ۲۵۰ تا ۴۰۰ میکروگرم در دسیلیتر است. میزان نرمال آهن سرم بین ۶۰ تا ۱۵۰ میکروگرم در دسیلیتر و میزان نرمال اشباع ترانسفرین بین ۲۰ تا ۴۵ درصد است.
سطح اشباع کمتر از ۱۶ درصد ممکن است هم در آنمی بیماریهای مزمن و هم در فقر آهن مشاهده شود؛ گرچه کاهش سطح اشباع در فقر آهن بیشتر بوده و مقادیر کمتر از ۵ درصد به طور قطع بیانگر آنمی فقر آهن است.
در آنمی فقر آهن افزایش سطح ترانسفرین که ظرفیتهای خالی آن توسط آهنی که در آزمایشگاه به نمونه اضافه شده پر شده و از این رو TIBC افزایش مییابد. برای مثال یک SFe برابر 20 و TIBC برابر ۵۰۰ در آنمی فقر آهن معادل اشباع ترانسفرین ۴ درصد است.
در آنمی بیماریهای التهابی سطح TIBC نرمال است یا کاهش دارد و از این رو TIBC پارامتری جهت جداسازی فقر آهن از آنمی بیماریهای مزمن است. سنجش فریتین بازتابی از سطح آهن ذخیرهای در بدن است و هر میکروگرم آن بیانگر ۸ تا ۱۰ میلیگرم آهن ذخیرهای است. سطح فریتین برخلاف سطح آهن سرم تحت اثر غذای اخیر قرار نمیگیرد و تغییرات روزانه هم ندارد.
فریتین در گروه پروتئینهای فاز حاد است و بیماریهای التهابی موجب افزایش آن میگردند. از طرف دیگر آسیبهای کبد موجب رها شدن فریتین از منابع ذخیرهای کبد به جریان خون میشود. افزایش سطح فریتین در بدخیمیها به ویژه بدخیمیهای بافت خونساز شایع است. برای دستیابی به ذخیره آهن گاهی از نمونهبرداری مغز استخوان و رنگآمیزی آسپیره مغز استخوان با رنگ آبی پروس برای مشاهده ذخایر آهن در ماکروفاژ ها و در نرموبلاست ها استفاده میشود. میزان آهن مغز استخوان از صفر تا 6+ درجهبندی شده است. مقدار نرمال آن 1+ تا 3+ است؛ در آنمی فقر آهن و پلی سیتمی ورا میزان ذخیره صفر و در آنمی بیماریهای مزمن 2+ تا 5+ و در کمخونیهای سیدروبلاستیک و تالاسمی 5+ تا 6+ است.
امروزه با در دسترس بودن سنجش گیرندههای محلول ترانسفرین و فریتین نیاز کمتری به آسپیراسیون مغز استخوان برای سنجش آهن است. گیرندههای محلول ترانسفرین در پلاسما بازتابی از تعداد گلبولهای قرمز هستهدار در مغز استخوان و هایپرپلازی رده اریتروئیدی است که نهتنها در آنمی فقر آهن بلکه در کمخونیهای همولیتیک افزایش مییابد. کاهش گیرندههای ترانسفرین در آنمی بیماریهای التهابی و کمخونیهای هایپوپلاستیک مانند کمخونی آپلاستیک مشاهده میشود.
سنجش پروتوپورفیرین روی
(Zinc Protopophyrin):
گلبولهای قرمز در شرایط نرمال اندکی پروتوپورفورین را بیش از مقدار لازم برای سنتز هیم تهیه میکنند که به آن پروتوپورفیرین آزاد (Free) گویند که در تمام عمر گلبول قرمز در گلبول باقی میماند. کاهش آهن در آنمی فقر آهن منجر به تجمع پروتوپورفیرین و پیوند آن با روی (Zn) رخ میدهد و از این رو سنجش پروتوپورفیرین روی (ZPP) پارامتری برای تشخیص فقر آهن به ویژه در مواردی است که امکان تستهای بیشتر وجود ندارد. سطح ZPP در مسمومیت با سرب هم افزایش مییابد.
ذخیره آهن کبدی:
در گذشته از بیوپسی کبد برای تعیین ذخیره آهن به ویژه در بیماریهای گرانباری آهن (Iron Overload) استفاده میشد. امروزه MRI با تکنولوژی T2*از راههای غیرتهاجمی برای ارزیابی میزان آهن ذخیرهای بدن است. یادآوری میشود که سطح فریتین بیشتر از ۲۰۰ در خانمها و بیش از ۳۰۰ در آقایان همراه با اشباع ترانسفرین بیشتر از ۵۵ درصد از تستهای غربالی برای سنجش گرانباری آهن است که با مثبت شدن نیاز به آزمایشهای تأییدی دارد. انباشت آهن در بافتهای بدن، ناشی از افزایش جذب را هماکروماتوز و افزایش آهن بدن ناشی از تزریق مکرر خون را هموسیدروز گویند. هر سیسی گلبول قرمز، یک میلیگرم آهن دارد.
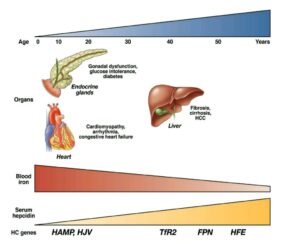
اشباع ترانسفرین 50≤ درصد، بهویژه بیشتر از 60 درصد، از آزمایشهای غربالگری برای هماکروماتوز است. گرانباری آهن موجب دیابت، سیروز، برنزگی پوست و نارسایی قلبی میشود. بیماران مبتلا به هماکروماتوز مستعد سرطان کبد هستند و شواهدی در دست است که رادیکالهای آزاد آهن موجب جهش در ژن سرکوبکنندهی تومور (P53) میشود. فریتین بازتابی از آهن ذخیره است که مقدار طبیعی آن 20 تا 200 میکروگرم در لیتر است. هر میکروگرم فریتین معادل 8 تا 10 میلیگرم آهن ذخیرهای است.
هماکروماتوز ارثی انواع گوناگونی به شرح زیر دارد:
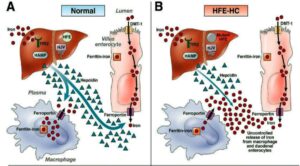
هماکروماتوز تایپ یک یا نوع کلاسیک: هماکروماتوز تایپ یک، ناشی از جهش ژن HFE روی کروموزوم شمارهی 6 است. این ژن نزدیک جایگاه ژن HLA است و با HLA-A3 بهشدت همراهی میکند و به میزان کمتری با HLA-B7 همراهی دارد.
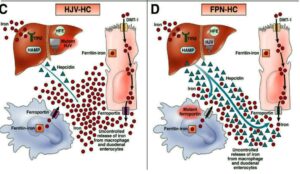
هماکروماتوز جوانی یا تایپ 2: هماکروماتوز جوانی با جهش در ژن هموجوولین (HJV) روی کروموزوم شمارهی یک (تایپ 2a) و یا جهش در ژن HAMP (Hepcidin) روی کروموزوم 19q (تایپ 2b) همراه است.
هماکروماتوز تایپ 3 با جهش در ژن گیرندهی ترانسفرین۲ (TFR2) روی کروموزوم 7q. هماکروماتوز تایپ 4 با جهش در ژن فروپورتین (FPN1) یا Slc40A1 روی کروموزوم 2q.
جهش در ژنهای هموجوولین و هپسیدین با کاهش دادن مقدار هپسیدین موجب فراهم شدن بیشتر کانالهای فروپورتین برای جذب آهن گردیده و گرانباری آهن از بدو جوانی ظاهر میشود.
مورفولوژی میکروسیت در اختلال سنتز هموگلوبین:
سندرمهای تالاسمی آلفا و بتا از علتهای مهم میکروسیتوز و هایپوکروم هستند. در سندرمهای تالاسمی فقدان یا کاهش بیان یک یا چند زنجیره هموگلوبین تعادل بین زنجیرهها را به هم زده و موجب کاهش سنتز هموگلوبین و در موارد شدید موجب رسوب زنجیرههای اضافی و همولیز میگردد. چهار ژن آلفا روی هاپلوتیپهای کروموزوم ۱۶ و دو ژن بتا روی هاپلوتیـــــپهای کروموزوم ۱۱ عهدهدار سنتز هموگلوبین A (α2 β2) هستند که حدود ۹۷ درصد هموگلوبین یک شخص بالغ را تشکیل میدهد.
چنانچه یک ژن بتا معیوب باشد به آن تالاسمی مینور بتا گفته میشود. در این حالت چنانچه جهش ژنی فرآوردهای نداشته باشد به آن به β0 و اگر حدود ۵ تا ۳۰ درصد فعالیت نرمال داشته باشد به آن +β گفته میشود. ژنوتیپهای ββ0 و +ββ شایعترین انواع تالاسمی مینور بتا هستند که با مورفولوژی میکروسیت و هیپوکروم بروز میکنند، ولی برخلاف فقر آهن، شمارش گلبول قرمز در اکثر موارد فراتر از 5/5 میلیون در میلیمتر مکعب بوده و پارامتر RDW که مقدار نرمال آن 1/2± 13/4درصد است نرمال است و یا تنها اندکی افزایش دارد.
در ژنوتیپهای شایع تالاسمی مینور بتا، میزان هموگلوبین A2 (α2 δ2) افزایش یافته و در غالب موارد بین 3/5 تا ۷ درصد متغیر است. البته مقادیر لب مرز 3/3 یا 3/4 نیز بایستی برای کنار گذاشتن تالاسمی مینور بتا با روشهای دقیقتری مانند اندازهگیری نسبت سنتز زنجیره آلفا به بتا مورد سنجش قرار گیرد. یادآوری میشود که افزایش اندک هموگلوبین A2 در کمخونیهای مگالوبلاستیک، هموگلوبینهای ناپایدار، پرکاری تیروئید و مصرف داروهای ضد ویروسی گزارش گردیده است.
در سندرمهای تالاسمی آلفا فقدان یک ژن آلفا بنام حامل خاموش و مقدار و فقدان 2 ژن آلفا تحت عنوان تالاسمی مینور آلفا و فقدان 3 ژن به نام هموگلوبین اچ نامگذاری شده است. در سندرومهای تالاسمی آلفا گرچه مرفولوژی مانند سندرمهای تالاسمی بتا میکروسیت و هایپوکروم است ولی هموگلوبین A2 افزایش نیافته و در بیشتر موارد برای تشخیص نیاز به سنجش نسبت زنجیره آلفا به بتا است.
افزایش پارامتر RDW دارای حساسیت بالای ۹۰ درصد برای فقر آهن است ولی اختصاصیت آن ۵۰ تا ۷۰ درصد است. در یک مرفولوژی نرموکروم و نرموسیت افزایش RDW ممکن است اولین نشانه فقر آهن باشد. امروزه از پارامتر RDW به غیر از تشخیص افتراقی کمخونیها به عنوان یک فاکتور پیشآگهی دهنده مستقل در پیشرفت بیماریهای مزمن مانند نارسایی کلیه و قلب و بسیاری از بیماریهای دیگر استفاده میشود که افزایش تدریجی آن صرفنظر از مرفولوژی گلبول قرمز بیانگر وخیمتر شدن بیماری است. برای مثال افزایش تدریجی RDW در نارسایی کلیه بیانگر کاهش بیشتر پاکسازی کلیه یا GFR است.
هرگونه میکروسیت و هایپوکرومی که به درمان آهن بیپاسخ باشد بایستی برای سندرمهای تالاسمی مورد بررسی قرار گیرد. چنانچه هموگلوبین A2 نرمال باشد بایستی با الکتروفورز کامل به دنبال افزایش هموگلوبین F یا پیدا کردن باند هموگلوبین لپور و یا هموگلوبین E باشیم.
افزایش ۵ تا ۲۰ درصدی هموگلوبین F در سندرم تالاسمی دلتا و بتا و باند ۱۰ تا ۱۵ درصد لپور در هتروزیگوت لپور رخ میدهد که همگی با مرفولوژی میکروسیت و هایپوکروم همراهی دارند. در برخی از کتابهای مرجع فرمولهایی جهت افتراق فقر آهن از سندرمهای ماینور تالاسمی ارائه شده که تنها جنبه آکادمیک داشته و برای افراد بالغ کاربرد دارد، زیرا میزان MCV تا ۱۰ الی ۱۵ سالگی متغیر بوده و افزایش MCV در حاملگی هم تا 4 فمتولیتر گزارش شده است. برخی از این فرمولها عبارتند از:
Mentzer Index = MCV/RBC
DF = MCV – RBC – (5 × Hb) – 3.4
در اندکس منتزنر مقادیر کمتر از ۱۲ احتمال تالاسمیهای ماینور و بیشتر از 14 فقر آهن و بین ۱۲ تا ۱۴ حد واسط است. در اندکس G & K مقدار کمتر از ۶۵ و در اندکس DF مقادیر کمتر از صفر احتمال تالاسمی مینور مطرح است. فقدان سه ژن آلفا با میکروسیت و هایپوکروم شدید (MCV< 60 FL) همراه است و به آن بیماری هموگلوبین اچ گفته میشود زیرا فقدان ژن آلفا موجب ایجاد تترامر های 4 β یا هموگلوبین اچ میشود.
گستره محیطی علاوه بر میکروسیت و هایپوکروم پویکیلوسیتهایی مانند گلبولهای دمدار (Tailed) و گلبول با دو نوکتیز (Horn) و با افزایش چشمگیر شمارش کاذب پلاکت همراه است. در برخی موارد آنالیزور پلاکت را به صورت +++ یا نزدیک به یک میلیون یا بیشتر از میلیون گزارش میکند ولی برآورد پلاکتی از روی گستره محیطی پلاکت نرمال یا حتی کمتر از نرمال است در این موارد سفارش میشود که رنگآمیزی حیاتی برای مشاهده مورفولوژی توپ گلف یا اچ بادی انجام شود.
کمخونی سیدروبلاستیک ناشی از اختلال در سنتز هیم منجر به کمخونی با مرفولوژی دایمورف (مجموعه نرموسیت و هایپوکروم) و یا میکروسیت میشود. افزایش آهن سرم و اشباع ترانسفرین در این کمخونی مشاهده شده و نکته مهم تشخیصی حضور سیدروبلاستهای حلقوی در مغز استخوان است، بدین مفهوم که گرانولهای آهن مانند یقه پیرامون هسته نرموبلاستها قرار گرفتهاند.
What Is Non-Megaloblastic Macrocytic Anemia? Causes And Symptoms

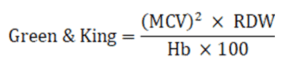
با سپاس بابت مطالب کاربردی
لطفا امکان دانلود رو هم فراهم کنید هر چقد تلاش میکنم کد ارسالی تایید نمیشود
باید صفحه کلید انگلیسی باشد