مروری بر روشهای تشخیص سرولوژیک بیماری توکسوپلاسموزیس (بخش دوم)
اسماعیل عباسی[1]، پیمان خضری[2]، شهرام خادم وطن[3]
1: گروه انگلشناسی و قارچشناسی، دانشگاه علوم پزشکی ارومیه، ارومیه، ایران
2: گروه انگلشناسی و قارچشناسی، دانشگاه علوم پزشکی ارومیه، ارومیه، ایران
3: دانشيار، گروه انگلشناسی و قارچشناسی، دانشگاه علوم پزشکی ارومیه، ارومیه، ایران
نویسنده مسئول: شهرام خادم وطن
khademvatan@yahoo.com
در شماره قبلی مطالبی درباره بیماری انگلی توکسوپلاسموزیس با عامل ایجادکننده توکسوپلاسما گوندی و مشکلات و عوارض ناشی از آن در گروهها و افراد مختلف، بهویژه در افراد با ایمنی ناکارآمد، مبتلایان به بدخیمیها، دریافتکنندگان عضو پیوندی و نیز خانمهای باردار و تعدادی از روشهای تشخیص بیماری نظیر روشهای مختلف سرولوژیک بیان شد. در ادامه به تعدادی دیگر از روشهای تشخیصی این بیماری تکیاختهای پرداخته میشود.
تلقیح به حیوان حساس آزمایشگاهی
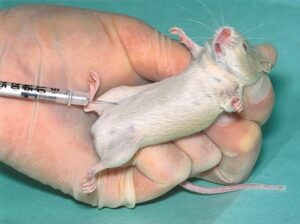
کشت توکسوپلاسما در تشخیص بیماری در اشخاص با نقص سیستم ایمنی و نیز در عفونت جنینی روشی سودمند میباشد. برای جداسازی، مواد موردنظر نظیر خون، مایعات و ترشحات آلوده بدن و یا نمونههای بافتی در محیط کشت سلولی، تخممرغ جنیندار و یا حیوانات آزمایشگاهی تلقیح میشود (شکل 1). اگر انگل از مایعات بدن جدا شود حکایت از وجود عفونت حاد دارد، ولی جداسازی
ارگانیسم از بافت، الزاماً به معنای وجود عفونت فعال نیست و وجود کیست بافتی را اثبات میکند. پس از اخذ نمونه، سرعت عمل بسیار مهم است چراکه در صورت تأخیر در انجام مراحل، احتمال مرگ انگل وجود دارد و افزودن فرمالین و انجماد نمونهها نیز مرگ انگل را به دنبال خواهد داشت. برای نگهداری کوتاهمدت، نمونهها باید در یخچال 4 درجه سانتیگراد قرار داده شوند(1).
شکل 1: نحوه انجام تزریق داخل صفاقی توکسوپلاسما گوندی به موش آزمایشگاهی
یکی از مراحل دشوار و مهم در مطالعات بیولوژی مولکولی تکیاختهها از جمله توکسوپلاسما گوندی، به دست آوردن انگل به میزان کافی و عاری از وجود سلولهای میزبان میباشد. کشت in vivo، نیاز به نگهداری حیوان آزمایشگاهی و امکانات مخصوص دارد که همیشه و همهجا در دسترس نیست. بهعلاوه، کشت سوشهای غیربیماریزا[4] و کندرشد در حیوان، منجر به تولید کیست نسجی گردیده و خالصسازی آن از چینیجاهای میزبان آسان نیست، با وجود روشهایی که برای خالصسازی کیستهای نسجی و برادیزوئیتها معرفی گردیده است، کشت سلولی توکسوپلاسما نیز از سالها پیش مورداستفاده قرار گرفته است و به نظر میرسد روش آسان و مفیدی برای تولید انگل بهمنظور تهیه DNA برای مطالعات مولکولی است. همینطور، برای بررسی حساسیت دارویی، تولید موتانهای انگل و تولید تاکیزوئیت برای استفاده در Dye test، ثابت گردیده که انگل توکسوپلاسما در کشتهای سلولی تکلایه[5]، بهتر از کشتهای سلولی معلق رشد میکند که احتمالاً به علت تماس آسانتر انگل به سلول و نفوذ راحتتر آن به داخل سلول میباشد. کشت سلولی سوشهای غیربیماریزا توکسوپلاسما، بهسادگی سوشهای بیماریزا[6] که بیشتر به فرم تاکیزوئیت است و بهخوبی رشد و تکثیر مینماید، نیست. توکسوپلاسما میتواند در انواع کشتهای سلولی تکلایه نظیر سلولهای L , Vero , HEP2 , MRC5, HEL(Human Embrionic Lung FibroblaST) تکثیر یابد (شکل 2) (2).
شکل 2: نمونهای از استفاده از محیطهای کشت سلولی در تحقیقات بر روی توکسوپلاسما گوندی
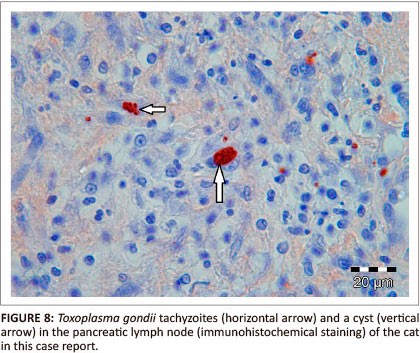
مشاهده تاکیزوئیت ها در گسترشهای مایع مغزی نخاعی، مغز استخوان، مغز، مایع آمنیوتیک و یا مشاهده آن در برشهای بافتی، دلالت بر وجود توکسوپلاسموزیس حاد خواهد داشت. هرچند تشخیص تاکیزوئیتها با روشهای متداول رنگآمیزی مشکل میباشد، ولی کاربرد روشهای ایمنوفلورسنت آنتیبادی و رنگآمیزی با روش پراکسیداز آنتیپراکسیداز[7] (PAP) درجه موفقیت در تشخیص را بالاتر خواهد برد و از حساسیت و ویژگی بالایی برخوردار است (3). تکنیک PAP برای مقاطع بافتی فیکس شده و جاسازیشده در پارافین و یا در مقاطع بافتی فیکس نشده، قابلاستفاده است و در یافتن انگل در سیستم اعصاب مرکزی بیماران مبتلا به ایدز کاربرد خوبی داشته است (شکل 3)(1) و بر خلاف تکنیک ایمنوفلورسنت آنتیبادی که به میکروسکوپ فلورسانس احتیاج دارد، با میکروسکوپ معمولی نیز قابلمشاهده است (4) .
شکل 3: تاکیزوئیتها در نوک پیکان افقی و یک کیست در نوک پیکان عمودی در رنگآمیزی بافتی
واکنش زنجیرهای پلیمراز PCR )[8] )
استفاده از واکنش زنجیرهای پلیمراز در تشخیص توکسوپلاسموزیس بهویژه در مواردی که روشهای معمول کارایی لازم را نداشته باشند و یا در مواردی که با خطرات بالقوه بیماری، نظیر توکسوپلاسموزیس چشمی، توکسوپلاسموزیس مغزی و یا در مورد بیماران با ایمنی ناکارآمد بسیار سودمند خواهد بود (5). این روشهای تشخیصی به دو دسته تقسیم میشوند:
روشهایی که به شناسایی DNA انگل در نمونههای بیولوژیکی و کلینیکی میپردازند نظیر PCR conventional،Nested PCR و Real – time PCR. گروه دوم شامل روشهای مولکولی نظیر PCR-RFLP ، Microsatellite analysis و Multilocus sequence typing of A single copy of a T.gondii DNA میباشد که این روشها عمدتاً جهت تعیین گونه به کار میروند (6).
روشهای تشخیص مولکولی توکسوپلاسموزیس معمولاً بر اساس آشکارسازی توالی ویژهای از DNA از طریق روشهای مختلف و اصولاً از نواحی بسیار حفاظت شده انجام میشود. نخستین روش برای آشکارسازی مولکولی توکسوپلاسما گوندی، با تکثیر سیکلهایی از توالی ژنی B1 در سال 1989 مرسوم شد و تاکنون دچار بهروزرسانی و پیشرفت زیادی شده است. هرچند عملکرد ژن B1 کاملاً مشخص نیست، ولی بهواسطه حساسیت و اختصاصیت بالای خود بیشترین کاربرد را در زمینههای تشخیصی و اپیدمیولوژیک دارد (5). در میان ژنهای توکسوپلاسما، از ژن B1 و نیز از ژنهای P30(SAG1) و قطعات 18S rDNA و ITS-1 بیشتر بهعنوان الگو انتخاب میشوند (7, 8).
آشکارسازی مولکولی توکسوپلاسما گوندی در مواقعی که احتمال وجود توکسوپلاسموزیس مادرزادی داده میشود در نمونههای مایع آمنیوتیک و یا نمونه خون اخذ شده از جنین و یا نوزاد قابل انجام است. همینطور در بیماران ضعف ایمنی از نمونه خون محیطی، خلط و مایع مغزی نخاعی در موارد توکسوپلاسموزیس چشمی و مغزی و نیز از نمونه مایع حاصل از شستشوی برونشها[9] (BAL) استفاده میشود(5).
یافتن DNA در نمونههای خون نوزاد از اهمیت بسیار بالای کلینیکی برخوردار است، چراکه شانسی برای یافتن DNA در عفونتهای اولیه وجود ندارد. به همین دلیل است که بیشترین استفاده از روشهای تشخیص مولکولی در مورد توکسوپلاسموزیس، به نوع مادرزادی آن مربوط میشود. گذشته از آن، جداسازی ارگانیسم از کشت سلولی حساسیت لازم را ندارد و جداسازی ارگانیسم از طریق بیوپسی به شش هفته زمان نیاز دارد(9).
در طول بیست سال گذشته یافتن DNA توکسوپلاسما گوندی در مایع آمنیوتیک اهمیت زیادی پیدا کرده است. چراکه تشخیص بهموقع عفونت جنینی و انجام اقدامات درمانی، منجر به کنترل مناسب عفونت خواهد شد (10, 11). مطابق نتایج مطالعهای که در 6 مرکز رفرنس اروپایی در مورد تشخیص جنینی توکسوپلاسموزیس مادرزادی انجام شد، مشخص شد که روش PCR مایع آمنیوتیک با حساسیت 81%، در مقایسه با روشهای بیواسی (58% حساسیت) و روش کشت سلولی (15% حساسیت) بیشترین حساسیت را داشت. ترکیب دو روش PCR و بیواسی حساسیت را تا 91% بهبود میبخشد و بهترین حالت را فراهم میسازد (12).
روشهای مولکولی در تشخیص توکسوپلاسموزیس چشمی نیز کاربرد روزافزونی پیدا کردهاند. نتیجه مطالعات متعدد نشان داده است که نتیجه تست مثبت PCR الزاماً با نتیجه مثبت تست سرولوژی که حکایت از سنتز موضعی آنتیبادی IgG دارد همراهی ندارد و بنابراین روش مولکولی یک روش تأییدی مهم قلمداد میشود (13).
توکسوپلاسموزیس مغزی بهویژه در بیماران با ایمنی ناکارآمد، در نتیجه فعال شدن مجدد توکسوپلاسموزیس مزمن ایجاد میشود و درصورتیکه درمان نشود عوارض وخیمی خواهد داشت. تشخیص قطعی با مشاهده تاکیزوئیتها در بیوپسی حاصل از بافت مغز حاصل خواهد شد ولی بهواسطه اینکه یک روش تهاجمی است، کاربرد زیادی ندارد. حالآنکه روش PCR، دارای جوابهای دقیق و سریع میباشد (5, 14). در مطالعهای که در برزیل در مورد توکسوپلاسموزیس مغزی در بیماران HIV مثبت انجام شد،27/4% (14 نفر از 51 نفر) از نمونههای مایع مغزی نخاعی این بیماران از نظر DNA توکسوپلاسما گوندی مثبت بودند (15).
در مجموع، ترکیبی از روشهای تشخیصی انگلشناسی و روش PCR تشخیص صحیح و بهموقع بیماری را بهویژه در موارد توکسوپلاسموزیس مادرزادی و توکسوپلاسموزیس مغزی در افراد با ایمنی ناکارآمد میسر میسازد (5).
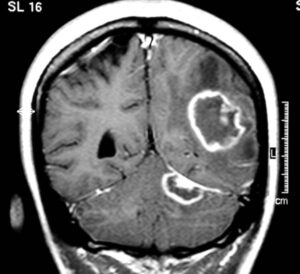
تکنیکهای تصویربرداری نظیر: Computed Tomography(CT)، Magnetic Resonance Imaging(MRI) و Ultra Sonography(US) هرچند روشهایی غیراختصاصی در تشخیص بیماری هستند، ولی قطعاً در جهت تسهیل تشخیص توکسوپلاسموزیس و پیگیری روند درمان قابلاستفاده میباشند. در مواقع مواجهه با آنسفالیت و آبسههای مغزی در بیماران مبتلا به توکسوپلاسموزیس با ایمنی ناکارآمد، میتوان از CT و MRI برای تعیین محل ضایعات استفاده کرد. CT اغلب برای غربالگری اولیه مناسب است، حالآنکه MRI بیشتر برای تعیین شدت آسیبزایی کاربرد دارد (شکل 4). در موارد مشکوک به توکسوپلاسموزیس مادرزادی از اولتراسونوگرافی برای تشخیص بیماری در جنین استفاده میشود و با استفاده از CT میتوان هیدروسفالی منتشر و کلسیفیکاسیون مغزی ناشی از توکسوپلاسموزیس در خردسالان را مشخص نمود (16).
شکل 4: استفاده از تکنیکهای تصویربرداری در تشخیص ضایعات مغزی توکسوپلاسموزیس
References:
- Hannah Akuffo ILm, Ewert Linder, Mats Wahlgren. Parasites of the Colder Climates. New York: Taylor & Francis; 2003. 132-48,257-335 p.
- اصغر ف. مقایسه سه نوع کشت سلولی برای تکثیر و نگهداری توکسوپلاسما گوندی در آزمایشگاه و تولید DNA. مجله تحقیقات علوم پزشکی زاهدان. 2004;6(2):9-15.
- Liesenfeld O, Montoya JG, Tathineni NJ, Brown BW, Cobb KL, Parsonnet J, et al. Confirmatory serologic testing for acute toxoplasmosis and rate of induced abortions among women reported to have positive Toxoplasma immunoglobulin M antibody titers. American journal of obstetrics and gynecology. 2001;184(2):140-5.
- تیزارد ا. ایمنی شناسی دامپزشکی. تهران: دانشگاه تهران; 1393. 261-84 p.
- Ivović V, Vujanić M, Živković T, Klun I, Djurković-Djaković O. Molecular detection and genotyping of Toxoplasma gondii from clinical samples. Toxoplasmosis–Recent Advances Science, Technology and Medicine open access publisher. 2012.
- Su C, Shwab E, Zhou P, Zhu X, Dubey J. Moving towards an integrated approach to molecular detection and identification of Toxoplasma gondii. Parasitology. 2010;137(01):1-11.
- Homan W, Vercammen M, De Braekeleer J, Verschueren H. Identification of a 200-to 300-fold repetitive 529 bp DNA fragment in Toxoplasma gondii, and its use for diagnostic and quantitative PCR. International journal for parasitology. 2000;30(1):69-75.
- Reischl U, Bretagne S, Krüger D, Ernault P, Costa J-M. Comparison of two DNA targets for the diagnosis of Toxoplasmosis by real-time PCR using fluorescence resonance energy transfer hybridization probes. BMC infectious diseases. 2003;3(1):1.
- Tlamçani Z, Lemkhenete Z, Lmimouni BE. Toxoplasmosis: The value of molecular methods in diagnosis compared to conventional methods. Journal of Microbiology and Infectious Diseases. 2013;3(02).
- Menotti J, Garin Y, Thulliez P, Sérugue MC, Stanislawiak J, Ribaud P, et al. Evaluation of a new 5′‐nuclease real‐time PCR assay targeting the Toxoplasma gondii AF146527 genomic repeat. Clinical Microbiology and Infection. 2010;16(4):363-8.
- Wallon M, Franck J, Thulliez P, Huissoud C, Peyron F, Garcia-Meric P, et al. Accuracy of real-time polymerase chain reaction for Toxoplasma gondii in amniotic fluid. Obstetrics & Gynecology. 2010;115(4):727-33.
- Foulon W, Pinon J-M, Stray-Pedersen B, Pollak A, Lappalainen M, Decoster A, et al. Prenatal diagnosis of congenital toxoplasmosis: a multicenter evaluation of different diagnostic parameters. American journal of obstetrics and gynecology. 1999;181(4):843-7.
- Okhravi N, Jones CD, Carroll N, Adamson P, Luthert P, Lightman S. Use of PCR to diagnose Toxoplasma gondii chorioretinitis in eyes with severe vitritis. Clinical & experimental ophthalmology. 2005;33(2):184-7.
- Vidal JE, Colombo FA, de Oliveira ACP, Focaccia R, Pereira-Chioccola VL. PCR assay using cerebrospinal fluid for diagnosis of cerebral toxoplasmosis in Brazilian AIDS patients. Journal of clinical microbiology. 2004;42(10):4765-8.
- Mesquita RT, Ziegler AP, Hiramoto RM, Vidal JE, Pereira-Chioccola VL. Real-time quantitative PCR in cerebral toxoplasmosis diagnosis of Brazilian human immunodeficiency virus-infected patients. Journal of medical microbiology. 2010;59(6):641-7.
- Liu Q, Wang Z-D, Huang S-Y, Zhu X-Q. Diagnosis of toxoplasmosis and typing of Toxoplasma gondii. Parasites & vectors. 2015;8(1):1.
[4] Avirulent
[5] Monolayer
[6] Virulent
[7] Peroxidase-Antiperoxidase
[8] Polymerase Chain Reaction
[9] Bronchoalveolar lavage
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام