اساس كار، کنترل کیفی و کالیبراسیون آنالیزورهای خون شناسی
قسمت اول
دکتر حبیباله گلافشان، عضو هیئت علمی دانشگاه علوم پزشکی شیراز
آناليزورهاي آزمايشگاه خون شناسي دستگاههايي هستند كه داراي بخشهاي هيدروليك و نوماتيك و الكترونيك ميباشند. برداشتن محلولها، برداشتن مقدار مشخص از نمونه، رقيق كردن نمونه و افزودن محلولهاي ليز كننده به خون توسط سيستمهاي هيدروليك صورت ميگيرد. ایجاد خلأ براي توليد فشار منفي برای باز و بسته كردن دريچههای دستگاه به عهده بخش نوماتيك (pneumatic) است. پردازش و تحليل اطلاعات توسط سيستم الكترونيكی صورت گرفته و توسط كامپيوتر به دادههای رايج هماتولوژي تبديل ميشود. آناليزورهاي نيمه اتوماتيك و تمام اتوماتيك قادر به اندازهگيري 8 تا 32 پارامتر هماتولوژي ميباشند.
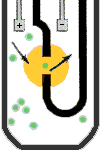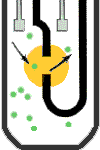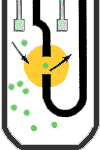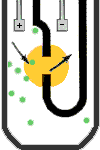
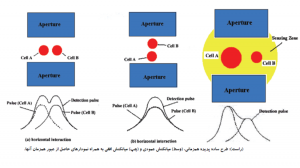
آناليزورهاي خون شناسي براي شمارش سلولي و افتراق سلولها از روشهاي تغيير در هدايت الكتريكي يا امپدانس روزنهای (aperture Impedance) و اصول نوري (اپتیک) بهره ميبرند. امپدانس روزنهاي از روشهاي بسيار رايج در شمارندههاي سلولي است كه نخستين بار در سال 1956 توسط والاش كولتر ابداع گرديد. گفتني است كه سلولهاي خوني در برابر امواج مستقيم الكتريسيته (DC) به عنوان عايق بيولوژيك عمل ميكنند. آناليزور براي شمارش سلولهاي خون آن را در چامبر شمارش با محلول ايزوتون كه هادی جريان الكتريسيته است رقيق ميكند.
در داخل چامبر شمارش، لولهاي استوانهاي قرار دارد كه از طريق يك روزنه(aperture) با چامبر شمارش در رابطه است. بین الكترود خارجي در چامبر و الكترود داخلي که در لوله استوانهاي است یک جريان الكتريكي پيوسته با فركانس پایین از طريق روزنه برقرار است. با نيروي مكش (خلأ) حجم خاصي از سوسپانسيون سلولي از چامبر شمارش به داخل لوله استوانهاي از طریق روزنه كشيده ميشود. فكر ميكنيد با عبور هر سلول از روزنه چه اتفاقي رخ ميدهد؟ هر سلول به تناسب حجم و اندازه خود در هنگام عبور از منطقه حساس شمارش (روزنه) ايجاد مقاومتي در هدايت جريان الكتريكي ميكند و يا به عبارت دیگر ايجاد يك پالس يا نبض الكتريكي ميكند.
در امپدانس روزنهاي هرسلول حین عبور از روزنه به تناسب حجم خود ایجاد مقاومت میکند.
ارتفاع و دامنه اين پالس الكتريكي یا تغییر ولتاژی متناسب با حجم سلول است. آناليزور هر پالس را به عنوان يك ذره يا سلول قلمداد ميكند و از اين رو نه تنها سلولها را شمارش كرده بلكه قادر است سلولهاي خون را بر اساس دامنه و ارتفاع پالسهاي الكتريكي طبقه بندي كند. آناليزور براي شمارش گلبولهاي سفيد همان كاري را ميكند كه ما براي شمارش گلبولهاي سفيد در آزمايشگاه انجام ميدهيم؛ بدين مفهوم كه خون با روش دستي در ملانژور گلبول سفيد با محلول تورك براي ليز كردن گلبولهاي قرمز رقيق ميشود. آناليزور براي شمارش گلبولهاي سفيد، نخست نمونه خون را رقيق كرده و به آن معرف لايزينگ (lysing) اضافه ميكند. معرف لايزينگ نه تنها گلبولهاي قرمز را ليز ميكند بلكه با تبديل هموگلوبين به سيانومت هموگلوبين اساس اندازهگيري اسپكتروفتومتري هموگلوبين را نيز فراهم ميكند.
آناليزور براي شمارش گلبولهاي قرمز و پلاكت از چامبر جداگانه استفاده ميكند و تنها خون را مانند روش دستي با ايزوتون رقيق ميكند ولي رقیق سازی خون در مقايسه با شمارش گلبول سفيد بمراتب بيشتر است.
بياد داشته باشيد كه در شرايط نرمال به ازاي هر 500 تا 700 گلبول قرمز تنها يك عدد گلبول سفيد در خون وجود دارد. اين از يك طرف و رقيق سازي بیشتر خون از طرف ديگر موجب ميشود كه هر چند گلبول سفيد در هنگام شمارش گلبولهاي قرمز ليز نشده باشد ولي خطاي قابل ملاحظه در شمارش گلبولهای قرمز ايجاد نميگردد. البته لکوسيتوز با شمارش گلبول سفيد بيشتر از 30000 یا 50000 نه تنها ايجاد خطا در شمارش گلبولهای قرمز ميكند، بلکه موجب افزايش حجم متوسط گلبول قرمز (MCV) ميشود.
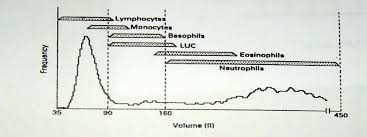
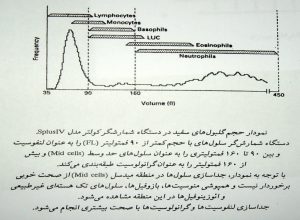
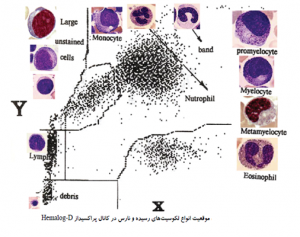
پالسهاي ايجاد شده از شمارش گلبولهاي قرمز و سفيد و پلاكت بر مبناي ارتقاع و دامنه پالس دسته بندي شده و به صورت نمودار توزيع فراواني يا هيستوگرام توزيع حجم ترسيم ميشوند. در اين نمودارها محور Y بيانگر تعداد نسبي سلولها و محور X بر اساس حجم سلول درجه بندي ميشود. در چامبر RBC/Plat پالسهاي زير 2 فمتوليتر (2fl) به عنوان آشغال و پالسهاي بین 2 تا 20 فمتوليتري به عنوان پلاكت و پالسهاي بين 36 تا 360 فمتوليتري به عنوان گلبول قرمز در نظر گرفته ميشوند. در چامبر WBC/Hb پالسهاي 90-35 فمتوليتري به عنوان سلولهاي كوچك سفيد يا لنفوسيت و پالسهاي بين 90 تا 160 فمتوليتر به عنوان سلولهاي مخلوط (Mixed cell) و پالسهاي بين 450-160 فمتوليتري به عنوان سلولهاي بزرگ يا نوتروفيل قلمداد ميگردند.
گفتني است كه سلولهاي منوسيت، بازوفيل، تعدادي از ائوزينوفيلها و لنفوسيتهاي آتيپيك و سلولهاي بلاست از نظر الكتريكي هم پالس بوده و به عنوان سلولهاي مخلوط طبقه بندي ميگردند. گفتني است كه گلبولهاي سفيد در حجم واقعي خود مورد آناليز قرار نميگيرند. بلكه معرف ليز كننده در حالي كه گلبولهاي قرمز را ليز كامل ميكند قادر به ايجاد کردن منفذهايي در غشاي گلبولهاي سفيد است كه موجب ميشود غشاي گلبولهاي سفيد روي هسته سلول مچاله گردد و در اين وضعيت آنها را مورد حجم سنجي قرار ميدهد.
ضريب همخواني در شمارش لنفوسيتها به طريقه دستي و دستگاهي حدود 85 درصد است كه بيانگر دقت مناسب در تشخيص اين سلولها و تكرار پذيري در شمارش است. گر چه ضريب همخواني براي گرانولوسيتها نیز قابل قبول است ولي براي سلولهاي مخلوط از همخواني قابل قبول برخوردار نيست. اينگونه آناليزورها كه گلبولهاي سفيد را در سه دسته كلاسه بندي ميكنند تحت عنوان آناليزوهاي 3diff يا سه قسمتي مشهورند.
در هیستوگرام سه قسمتی گلبولهای سفید حجمهای بین 35 تا 90 فمتولیتری به عنوان لنفوسیت و بین 90 تا 160 به عنوان سلولهای حد واسط و بین 160 تا 450 به عنوان گرانولوسیتها قلمداد میشود.
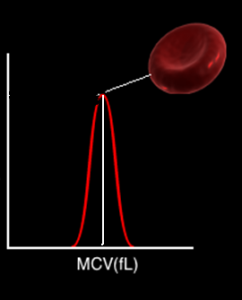
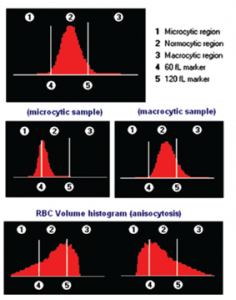
هيستوگرام گلبول قرمز در افراد سالم زنگولهاي شكل است و نقطه اوج آن بيانگر حجم متوسط سلولي است. رسم خط ميانه در هيستوگرام گلبولهاي قرمز محور X را در عدد MCV یا حجم متوسط گلبول قرمز قطع ميکند. توجه داشته باشيد كه با رسم خط ميانه در هيستوگرام، كل گلبولهاي قرمز به دو نصف تقسيم ميشود. پس گلبولي كه در رأس منحني زنگولهاي قرار ميگيرد گلبول قرمز نماينده است كه حجم آن برابر MCV است. در افراد نرمال مقدار MCV در محدوده 95-80 فمتوليتر قرار ميگيرد.
پهناي منحني زنگولهاي شكل بيانگر پراكندگي گلبول قرمز است و هر چه پهنتر باشد گلبولهاي قرمز داراي اختلاف اندازه بيشتري هستند. پهنای خطي كه از 20% فراواني هيستوگرام گلبول قرمز را قطع كند به عنوان شاخص RDW (Red cell distribution width)بر حسب SD (انحراف معيار) است كه در افراد نرمال 3±42 فمتوليتر است. بدين مفهوم كه اين مقدار از پهنا برحسب فمتوليتر كه تقاطع اين خط با هيستوگرام ايجاد كرده معادل تغييرات اندازه در 3SD يا سه انحراف معيار است.
رسم خط میانه محور X را در هیستوگرام حجم در مقدار MCV قطع میکند. پهنای خطی که از 20% فراوانی هیستوگرام حجم را قطع میکند به عنوان پارامتر RDW در نظر گرفته میشود که معادل (3SD) یا انحراف معیار میباشد. برای محاسبه RDW بر حسب CV مقدار 1SD بر MCV تقسیم شده و حاصل آن در عدد 100 ضرب میشود.
چنانچه مقدار يك انحراف معيار (يك SD) بر ميانگين حجم سلولي (MCV) تقسيم و حاصل در عدد 100 ضرب شود، مقدار RDW برحسب CV محاسبه ميگردد كه مقدار طبيعي آن 14/5- 11 درصد است. پارامتر RDW یا دامنه توزیع حجم بيانگر پراكندگي حجم گلبولهای قرمز است كه شاخصي براي انيزوسيتوز یا تغییرات اندازه است. پارامتر RDW بر حسب SD تفاوت حجم بزرگترین از کوچکترین گلبول قرمز را بر حسب فمتولیتر نشان میدهد.
از حاصل ضرب حجم متوسط سلولی (MCV) در شمارش گلبولهای قرمز، حجم فشرده گلبولهای قرمز(PCV) یا هماتوکریت بدست میآید. پارامتر (MCH) یا میانگین وزن هموگلوبین در گلبول قرمز از تقسیم میزان هموگلوبین (gr%) بر تعداد گلبولهای قرمز بر حسب میلیون و پارامتر MCHC از حاصل تقسیم هموگلوبین بر هماتوکریت بدست میآید.
عوامل مداخل كننده در آناليزورهاي امپدانسي
ابعاد روزنه برای شمارش گلبولهاي سفيد معمولاً داراي قطر 100 و طول 50 ميكرون و مربوط به شمارش گلبولهاي قرمز و پلاكت داراي قطر 50 و طول 70 ميكرون است. طول بلندتر باعث كمك به تمركز جريان سلولي در وسط روزنه جهت دستيابي بهتر براي شمارش و تحلیل دقیقتر از حجم سلولي جهت ترسيم هيستوگرام است. مهمترين عوامل مداخلهگر در آناليزورها عبارتند از :
- پديده عبور همزماني (Coincidence error):
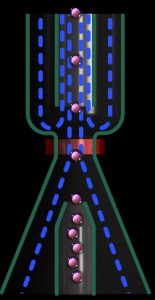
عبور همزمان چند سلول از روزنه ايجاد يك نبض الكتريكی پهن ميكند كه به عنوان يك سلول بزرگ شمرده ميشود. خطاي عبور همزمان در آگلوتيناسيون سرد و لكوسيتوز و پرخوني افزايش مييابد كه نتيجه آن كاهش كاذب شمارش سلولي است. عبور همزمان دو سلول در يك ستون افقي از روزنه ايجاد نبض M شكل و عبور در ستون عمودي ايجاد نبض تك موج پهن میکند. در برخي از آناليزورها يك فرمول تصحيح براي عبور همزماني با توجه به رقت نمونه و قطر روزنه تعبيه شده است.
عبور همزمان سلولها از روزنه شمارش موجب تولید موج M شکل یا موج ناهنجار بزرگ و پهن میگردد.
- عبور غير مركزی سلولها از روزنه (aperture off):
حجم سنجي دقيق يك سلول زماني صورت ميگيرد كه سلول، درست از مركز روزنه عبور كند. عبور سلول از كنارههاي روزنه و يا حركت غير محوري ايجاد پالسهاي ناهنجار ميكند.
- پديده گردابي يا بازگردشي (pulse recirculation):
امكان دارد كه خروج سلول از روزنه با حركت گردابي و نزديك شدن دوباره سلول به روزنه همراه شود كه فرايند آن توليد پالسهايي با دامنه كوتاه شبيه پالسهاي پلاكتي و در نتيجه افزايش كاذب پلاكتها خواهد بود. برخي از آناليزورها با استفاده از جريان جاروب کننده كه در پشت ناحيه حساس روزنه قرار دارد سلولهاي شمرده شده را از ناحیه روزنه دور ميكنند.
پديده گردابي يا بازگردشي
براي كاهش پديده عبور همزماني و بازگردشــي از تكنولوژي تمركز هيدروديناميك يا از مايع غلاف (sheath fluid) استفاده ميشود. مايع شيت داراي دانستيه بالا بوده و مانند غلافي مسير عبور سوسپانسيون را از روزنه احاطه ميكند و از اين رو موجب ميشود كه سلولها در يك حركت خطي (Laminar flow) از مركز روزنه عبور كنند.
منابع خطا در شمارش گلبولهای سفيد
لكوسيتوز كاذب
گلبولهای قرمز مقاوم در برابر محلول لايزينگ دستگاه موجب افزايش كاذب شمارش گلبولهاي سفيد هم به روش دستي و هم دستگاهي ميگردند. چنانچه گلبول قرمز ليز نگردد در آناليزور به عنوان لنفوسيت قلمداد ميگردند و از اين رو با شمارش افتراقي معكوس كه درصد لنفوسيت بسيار بيشتر از نوتروفيل است همراه ميگردد. ليز نشدن كامل RBC در موارد گوناگوني رخ ميدهد كه مهمترين آنها عبارتند از: حضور گلبولهاي قرمز هستهدار، تجمع پلاكتها كه در آناليزور به عنوان يك گلبول سفيد تلقي ميگردد، گلبولهاي F دوران جنيني- نوزادی، پلاكتهاي ژيانت، هموگلوبينوپاتيها، تارگت سل در بيماريهاي كبدي كه سطحي آغشته از چربي دارند، كرايوگلوبولين و پاراپروتئينها، هيپرليپيدمي و حضور شيلوميكرون، شيزونت و گامت مالاريا.
كرايوگلوبولينها در سرما يا حرارت اتاق رسوب كرده و ممكن است به صورت ساختارهاي كريستالي، ژلهاي، آمورف، ذرات کروی آزاد و فاگوسيت شده در گستره محيطي مشاهده شوند. اين پروتئينها در بيماريهاي خود ايمن و اختلالات لنفوپروليفراتيو و بیماریهای ویروسی بويژه هپاتيت C مشاهده ميگردند.
واکنش رولكس به علت اينكه در رقيق كنندههاي آناليزور از هم باز ميشود معمولاً موجب خطا نميگردد، ولي بندرت آگلوتينينهاي سرد قوي ممكن است لیز نشده و با لكوسيتوز كاذب همراه باشند. گفتني است كه اكثر مواردي كه با لكوسيتوز كاذب همراهي دارند موجب افزايش كاذب هموگلوبين و كدورت محلول درابكين هم ميگردند و جالب است كه با اين پديدهها و خطاهاي آزمايشگاهي ممكن است گاهي بتوان يك هموگلوبيتوپاتي ناشناخته را تشخيص داد.
خطاي انتقال (carry – over) نيز امكان لكوسيتوز کاذب يا نرمال شدن سطح لكوسيت در بيمار مبتلا به لكوپني را بدنبال دارد. در اين حالت چنانچه نمونه يك بيمار مبتلا به لكوسيتوز به آناليزور داده شود و بعد يك نمونه لكوپني مورد آناليز قرار گيرد آلودگي چامبر شمارش با گلبولهاي سفيد نمونه قبلي به علت شستشوي ناكافي دستگاه موجب انتقال گلبولهای سفید به نمونه بیمار مبتلا به لکوپنی میگردد. توجه داشته باشید که عمل شستشوی دستگاهها برای تمام نمونهها یکسان است.
در حالتی که نمونه دارای لکوسیتوز شدید است بایستی دستگاه را چندین بار شستشو داد و سپس نمونه بعدی را مورد آزمایش قرار داد.
لكوپني كاذب
- از مهمترين علتهاي لكوپني كاذب ميتوان به خطاي خطي بودن (Linearity) اشاره كرد. بدين مفهوم كه گاهي شمارش زياد گلبولهاي سفيد خارج از محدوده خطي بودن آناليزور است كه در اين حالت بايستي نمونه را يك به دو یا یک به سه با سالین رقيق كرد و به دستگاه داد.
- سلولهاي اسماج و ائوزينوفيلهاي ترد و شكسته شده به عنوان سلول شمرده نميشوند.
- مانده شدن خون و از هم پاشيده شدن گلبولهاي سفيد
- اورمي ممكن است موجب افزايش يا كاهش كاذب گلبولهاي سفيد شود.
- لكوآگلوتينين يا تجمع گلبولهاي سفيد به واسطه آتو آنتيباديها
منابع خطا در شمارش گلبولهاي قرمز
- پلاكتهاي ژيانت در آستانه شمارش RBC قرار ميگيرند.
- لكوسيتوز شديد باعث افزايش شمارش RBC وافزایش کاذب MCV ميشود، توجه داشته باشيد كه گلبولهای سفيد در هنگام شمارش گلبولهاي قرمز لایز نمیشوند.
- كرايوگلوبين و هيپرليپيدمي به صورت ذرات سلولی شمرده میشوند.
- ميكروسيتوز شديد موجب كاهش شمارش گلبول قرمز و شمرده شدن آنها بجاي پلاكت ميگردد.
- پديده آگلوتيناسيون سرد موجب كاهش كاذب شمارش گلبولهاي قرمز به علت عبور همزماني ميشود.
- هموليز با کاهش چشمگیر گلبولهای قرمز همراهی دارد.
منابع خطا در شمارش پلاکتها
شمارش پلاکتی آنالیزور بایستی با تخمین شمارش پلاکتی از روی گستره محیطی همراه شود و این ناشی از منابع خطای جدی در شمارش پلاکتی آنالیزور میباشد. ذرات غیر سلولی از قبیل اجسام هاولژولی، شیلومیکرون، کرایوگلوبولین و اجسام هاینز در آستانه شمارش پلاکتی آنالیزور قرار میگیرند. توجه داشته باشید که ذرات بین 2 تا 20 فمتولیتری به عنوان پلاکت قلمداد میگردند.
میکروسیتوز شدید و حضور گلبولهای شکسته با افزایش کاذب شمارش پلاکت همراه است. بیشترین افزایش کاذب پلاکتی در بیماری هموگلوبین اچ رخ میدهد. هر وقت مرفولوژی میکروسیت هیپوکروم با افزایش کاذب شمارش پلاکتی در حدود میلیون همراه بود ولی گستره محیطی تعداد نرمال پلاکت را نشان دهد اقدام به تست توپ گلف برای هموگلوبین اچ کنید و چه جالب که با یک خطای آزمایشگاهی در شمارش پلاکت یک هموگلوبینوپاتی مهم تشخیص داده میشود.
حضور قطعات سیتوپلاسمی گلبولهای سفید به ویژه در شیمی درمانی موجب افزایش کاذب پلاکت میگردد. ممکن است در کمخونیهای الیپتوسیتوز همولیتیک و پیروپویی کیلوسیتوز ارثی و سوختگی حجم متوسط سلولی برخی از گلبولهای قرمز در آستانه 30 تا 50 فمتولیتر قرار گیرد و هم بجای پلاکت شمرده شوند.
گلبولهای شکسته همراه با کاهش پلاکت علامت چند بیماری مهم از قبیل انعقاد داخل عروقی منتشره (DIC)، ترومبوسیتوپنی ترومبوتیک (TTP) و سندرم همولیتیک اورمیک (HUS) است. اگر تصحیح شمارش پلاکتی آنالیزور که به علت گلبولهای شکسته افزایش کاذب دارد با گستره محیطی چک نشود تمام موارد اورژانس فوق که در صورت عدم تشخیص تهدید مرگ دارند ممکن است تشخیص داده نشوند.
برخی از آنالیزورهای پیشرفته براساس RNA و گرانول که در پلاکت وجود دارد آنها را از گلبولهای شکسته جدا میکنند؛ برای مثال در برخی آنالیزورها پارامتری بنام PLT-O گزارش میشود که شمارش واقعی پلاکتها را با سیستم نوری و براساس گرانولهای موجود انجام داده و آنرا از شیزتوسیت بدون گرانول جدا میکند.
افزایش نامتناسب ضد انعقاد به نمونه خون موجب تورم پلاکتی میگردد، پلاکت متورم شده با ترکیدن و تولید پارههای پلاکتی موجب میشود که هر پاره پلاکت بجای پلاکت شمرده شده و موجب افزایش کاذب آن گردد.
ترومبوسیتوپنی کاذب شایعتر از ترومبوسیتوز کاذب است و از مهمترین علتهای آن حضور ذرات ریز لخته در خون، پدیده اقماری پلاکتها و تجمع خوشهای شکل پلاکتها ناشی از فعال شدن آتوآنتیبادیهای پلاکتی در حضور ضد انعقادEDTA است.
پلاکتها در پدیده اقماری به دور یک نوتروفیل یا منوسیت یا لنفوسیت به واسطه آنتیبادی حلقه زده و توسط آنالیزور مورد شمارش قرار نمیگیرند. پلاکتها در پدیده تجمعی به صورت دستجات چند تایی در سراسر گستره محیطی مشاهده میشوند. هر تجمع توسط آنالیزور به عنوان یک گلبول سفید شمرده میشود و از این رو موجب افزایش کاذب گلبولهای سفید و کاهش شمارش پلاکت میگردد.
پلاکتهای درشت و ژیانت مانند در ابتلا به ترومبوسیتوپنی ایمونولوژیک یا سندرم برنارد، آنومالی مایهگلین و اختلالات لنفوپرولیفرایتو ممکن است در آستانه شمارش گلبول قرمز قرار گرفته و به عنوان پلاکت شمرده نشوند.
میزان حجم متوسط پلاکتی(MPV) تا یک ساعت بعد از نمونهگیری در ضد انعقاد EDTA افزایش یافته و پس از آن بین یک تا سه ساعت پایدار بوده و دوباره با گذشت زمان افزایش مییابد. آنالیزورهای امپدانس مقدار MPV را بیشتر از آنالیزورهای اپتیک گزارش میکند. تورم پلاکت در EDTA موجب بزرگ شدن اندازه در سیستمهای امپدانس شده در حالی که شفاف شدن سلول بر اثر تورم موجب کاهش پراکنش نور و گزارش حجم کمتر آن در سیستمهای اپتیک میشود. رسم خط میانه هیستوگرام حجم پلاکتی را روی محور X در عدد MPV یا حجم متوسط پلاکتی قطع میکند.
میانگین حجم گلبول قرمز (Mean cell volume)
چنانچه یک گلبول قرمز را از میان گلبولهای قرمز بدن به عنوان نماینده گلبولها انتخاب کنید و آنرا مورد حجم سنجی قرار دهید به پارامتر حجم متوسط گلبول قرمز یا MCV دست یافتهاید.
در آنالیزورهای خون شناسی مقدار MCV از روی هیستوگرام حجم گلبولهای قرمز بدست میآید. هیستوگرام حجم یک منحنی زنگولهای شکل است که در آن محور y بر حسب فراوانی و محور X بر حسب حجم بر مبنای فمتولیتر تقسیم بندی شده است. رسم خط میانه در هیستوگرام حجم محور X را در مقدار MCV قطع میکند. آنالیز حجم گلبولهای قرمز توسط 256 کانال صورت میگیرد؛ بدین مفهوم که اطلاعات دیجیتالی عبور هر سلول از روزنه توسط تحلیلگرهای ارتفاع پالس پردازش میشود و بدین ترتیب هیستوگرامهای توزیع حجمی گلبولهای قرمز و سفید و پلاکت ترسيم میگردد. (256 کانال تحلیلگر پالس جهت آنالیز و رسم هیستوگرام RBC و WBC و 65 کانال تحلیل پالس جهت آنالیز پلاکتها و رسم هیستوگرام آن است).
دامنه پالسهای RBC در محور X از حجم 35 فمتولیتر تا 200 فمتولیتر قرار میگیرد. ذرات 20-2 فمتولیتری به عنوان پلاکت و بزرگتر از 36 فمتولیتر به عنوان گلبول قرمز شمارش میشوند. توجه داشته باشید که دامنه و ارتفاع پالسهای الکتریکی توسط تحلیلگرها و تبدیل کنندههای آنالیزور بر حسب حجم (فمتولیتر) تفسیر شده و هیستوگرام توزیع حجمی ترسیم میگردد. در هر کانال محدوده مشخصی از ارتفاع و دامنه مورد پردازش قرار گرفته و اطلاعات بدست آمده از مجموع 256 کانال به صورت هیستوگرام ترسیم میشود.
با هیستوگرام حجم میتوان جمعیت گلبولهای میکروسیت و ماکروسیت و یا جمعیت دو شکلی را در میان گلبولهای قرمز مشاهده کرد.
برای محاسبه دامنه پراکندگی گلبولهای قرمز خطی که هیستوگرام حجم را در 20% فراوانی (Frequency) قطع کند معادل 3SD (سه انحراف معیار) در نظر گرفته میشود. پهنای هیستوگرام با رسم این خط برابر RDW یا دامنه تغییرات حجم بر مبنای انحراف معیار یا SD (standard deviation) میباشد، سپس مقدار یک SD بر MCV تقسیم شده و حاصل در عدد 100 ضرب میشود که نتیجه آن پارامتر RDW بر حسب CV یا ضریب تغییرات دامنه حجم است که مقدار نرمال آن 14/5-11/5 درصد است و بیشتر از 14/5 درصد بیانگر تغییرات اندازه (anisocytosis) است.
علل افزایش کاذب MCV در آنالیزورها
- مانده شدن خون EDTAدار در حرارت اتاق موجب تورم و افزایشFL 6 حجم متوسط سلولی در 24 ساعت میگردد.
- پدیده آگلوتیناسیون سرد با چسباندن گلبولهای قرمز به یکدیگر موجب افزایشMCV و MCH و MCHC میگردد.
- میکروسیتوز شدید با قرار دادن گلبولهای قرمز بسیار کوچک در آستانه شمارش پلاکتی موجب افزایش پلاکت و افزایش MCV به علت حذف گلبولهای کوچک از جمعیت گلبولهای قرمز و شمارش آنها بجای پلاکت میشود.
- لکوسیتوز شدید (بیشتر از 30 تا 50 هزار) موجب خطا در اندازهگیری MCV میشود. گفتنی است که در حالت نرمال نسبت گلبولهای قرمز به سفید 500 تا 700 به یک است و از طرف دیگر به علت رقیقتر شدن سوسپانسیون گلبولهای قرمز، شمارش گلبولهای قرمز تحت اثر تعداد گلبولهای سفید قرار نمیگیرد.
توجه داشته باشید که شمارش گلبولهای قرمز و پلاکت در محلول ایزوتونیک بدون اضافه کردن محلول لایزینگ صورت میگیرد و افزایش گلبولهای سفید موجب میشود که دستگاه در کانال RBC/PIT با شمارش گلبولهای سفید بجای RBC موجب افزایش کاذب حجم متوسط سلول (MCV) گردد.
- کاهش انعطاف پذیری گلبولهای قرمز موجب افزایش MCV میشود. یکی از پارامترهای مهم در محاسبه حجم متوسط گلبول در حین عبور از روزنه، فاکتور شکل و مقدار هموگلوبین گلبول است. گلـبولهـای غـیر سـیال مـثل اسـفروسـیت انعطاف پذیر نبوده و با ایجاد مقاومت بیشتر مورد حجم سنجی بیشتری قرار میگیرند. گلبولهای قرمز بسیار هایپوکروم به علت کشیده شدن بیشتر در حین عبور از روزنه مورد حجم سنجی کمتری قرار میگیرند.
- پدیده تورم حاد با افزایش MCV و کاهش MCHC همراه اســت. ایـــــــــن حالت در موارد هیپراسمولاریتی از قبیل دیابت، اورمی و هیپرناترمی رخ میدهد. برای مثال قند خون بیشتر از 400 یا 500 میلیگرم در دسیلیتر با نفوذ به درون گلبولهای قرمز موجب هیپراسمولار شدن محیط داخل گلبول میشود. وقتی این گلبولها در محیط ایزوتونیک دستگاه رقیق می شوند، عبور ناگهانی آب به درون گلبولها موجب تورم حاد و افزایش MCV میگردد.
- رسوب تدریجی پروتئین در اطراف روزنه دستگاه موجب تنگ شدن دریچه و افزایش مقاومت بیشتر با عبور سلول از روزنه تنگ شده میگردد، از این رو شستشوی روزانه دستگاه با شوینده دستگاه (Cell cleaner) که دارای ترکیبات هیپوکلریت سدیم است ضروری است.
- افزایش املاح ضد انعقاد با ایجاد محیط هیپراسمولار و یا با چروکیده کردن و بیآب کردن گلبول موجب تغییرات ناگهانی حجم سلول در آنالیزورها میگردند.
در سایتوگرام آنالیزورهای اپتیک سایتوگرام اریتروسیتی که بر اساس MCV وMCHC به 9 مربع تقسیم شده است. در شرایط نرمال، سایتوگرام اریتروسیتها فقط در مربع وسط قرار گرفته و از روی سایتوگرام پارامترهای توزیع حجم محاسبه میشود.
افتراق سلولها در آنالیزورهای خون شناسی
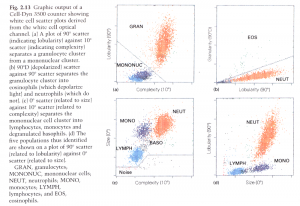
روش امپدانس الکتریکی قادر به طبقه بندی سلولها براساس تغییرات هدایت در جریان مستقیم الکتریسیته (DC) است و سلولهای خون در برابر این امواج مانند عایق بیولوژیک عمل میکنند. در حالیکه جریان الکترومغناطیس یا رادیوفرکانس(RF) از سلول عبور کرده و تحت اثر محتویات داخل سلول مانند هسته و گرانولها قرار میگیرد، با برقراری امواج DC و RF (جریان مستقیم و امواج رادیو فرکانس) بین الکترودهای داخل و خارج در چامبر شمارش میتوان به اطلاعات درونی سلول و حجم آن در حین عبور از ناحیه حساس روزنه پی برد. سلولها حین عبور از روزنه موجب تغییـــر ظرفیت (کاپاسیتانس) الکتریکی شده (Electrical capacitance) که متناسب با محتویات درون سلولی است. با بکارگیری همزمان تکنولوژی امپدانس و ظرفیت الکتریکی به طور همزمان میتوان طبقه بندی 5 قسمتی از لکوسیتها را داشت.
با بکار گیری همزمان امواج الکتریسيته مستقیم و امواج رادیو فرکانس میتوان سلولها را حین عبور از روزنه برای حجم و محتویات درون سلولی آنالیز و طبقه بندی کرد.
تکنولوژی الکترواپتیک (electro – optic) بر اساس واکنش متقابل نور و ماده استوار است. هنگامی که یک پرتو نور به سلولی برخورد کند. پدیدههای زیر که هرکدام در رابطه با یک ویژگی از سلول است رخ میدهد.
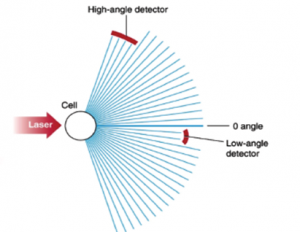
- بازتابش نور در زاویه تابش (Reflection) یا پراکنش نور در زاویه صفر درجه نسبت به نور تابشی در رابطه با حجم و اندازه سلول است.
- تغییر جهت و شکست نور در ارتباط با محتویات درون سلولی بوده که با سنجش پراکنش نور در زوایای دیگر صورت میگیرد. (Refraction and diffraction)
- نور جذب شده توسط سلول تابع محتویات و یا رنگ پذیری سلول برای یک رنگ مخصوص است.
- بازتابش نور تابشی با طول موج متفاوت (فلوئورسانس)
در آنالیزورهای بر پایهی اصول اپتیک از پرتو نور لامپ تنگستن– هالوژن و یا یک لیزر مانند لیزر نئون هلیوم استفاده میشود. با توجه به اینکه نور لیزر مونوکروماتیک (تک رنگ) و دارای حداقل واگرایی است در افتراق سلولها بسیار مناسب است.
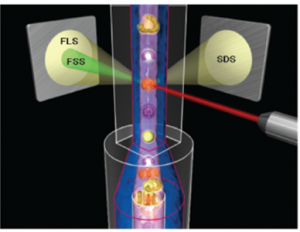
با استفاده از تکنولوژی اپتیک، اطلاعات هر سلول هنگام عبور از مقابل پرتو نوری از نظر اندازه، وضعیت هسته و گرانولها مورد پردازش قرار میگیرد. با انتقال دادهها روی محور x و y و یا انتقال سه بعدی دادهها میتوان پراکنش نگار سلولها را ترسیم کرد. در واقع هر سلول مانند یک نقطه با توجه به پردازش دادهها دارای ویژگیهای مختلف روی محورهای مختصات X و Y میگردد.
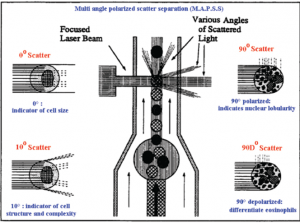
در تکنولوژی اپتیک سلولهای خونی در مراحل گوناگون با رقیق کنندهها، معرفهای لایزینگ، معرفهای رنگ آمیزی، سورفکتانتها و شویندهها و رنگهای فلورکروم مجاور شده و سپس به صورت سوسپانسیون سلولی در میآید. سوسپانسیون سلولی به صورت تک ردیف و جریان پیوسته از لوله باریک شیشهای کوارتز یا کانال فلوسل عبور میکند و هر سلول حین عبور با پرتو لیزری یا غیر لیزری برخورد میکــــــــند. آشکارسازهای ویژه جهت اندازهگیری بازتابش نور در زوایای گوناگون تعبیه شده است. تحلیل اطلاعات آشکارسازها به صورت پراکنش نگار(Scatter gram) روی صفحه مانیتور ظاهر میشود. پراکنش نور در زاویه صفر درجه یا پراکنش در زاویه تابش (Forward scatter) متناسب با اندازه سلول و پراکنش در زاویه 10 درجه با ساختار و پیچیدگی سلول، پراکنش در زاویه 90 درجه (Side scatter) با لوبولاریتی سلول و پراکنش نور دپلاریزه در زاویه 90 درجه با تعداد ائوزینوفیلهای خون در رابطه است.
با تکنولوژی پراکنش نور در زوایای مختلف برای جداسازی سلولها(MAPSS) میتوان به افتراق 5 قسمتی لکوسیتها دست یافت. در این تکنولوژی اطلاعات هر سلول هنگام عبور از مقابل پرتو نوری از نظر اندازه، وضعیت هسته و گرانولها مورد پردازش قرار میگیرد. با انتقال دادهها روی محور x و y و یا انتقال سه بعدی دادهها میتوان پراکنش نگار سلولها را ترسیم کرد. در واقع هر سلول مانند یک نقطه با توجه به پردازش دادهها دارای ویژگیهای مختلف روی محورهای مختصات X و Y میگردد.
آنالیزورهای مبتنی بر تکنولوژی VCS به صورت همزمان هر سه تکنولوژی امپدانس یا حجم سنجی (V)، ظرفیت الکتریکی (C) و تکنولوژی پراکنش نور (S) را بکار میبرند. پرتو نور لیزر به گلبولهای قرمز نه تنها حجمسنجی را انجام میدهد بلکه با سنجش شکست نور در زاویه 15-5 درجه تراکم درون سلولی هموگلوبین (MCHC) را مستقیماً بدست میآورد.
سوسپانسیون سلولی به صورت تک ردیف و جریان پیوسته از لوله باریک شیشهای کوارتز یا کانال فلوسل عبور میکند و هر سلول حین عبور با پرتو لیزری یا غیر لیزری برخورد میکند.
سنجش مستقیم MCHC را به صورت حروف معکوس CHCM نشان میدهند و مفهوم آن این است که برخلاف سایر آنالیزورها که از طریق فرمول محاسبه میشود در اینجا به طور مستقیم بدست آمده است. البته آنالیزور، پارامتر MCHC را با فرمول هم محاسبه کرده و با CHCM برای کنترل کیفی مقایسه میکند.
در آنالیزورهای تکنیکون با بکارگیری کانال پراکسیداز و کانال بازوفیل، لوبولاریتی گلبولهای سفید از هم متمایز میشوند. ائوزینوفیل و نوتروفیل و منوسیت به ترتیب دارای بیشترین خاصیت پراکسیداز در سیتوپلاسم هستند. گفتنی است که بازوفیلها در PH بسیار اسیدی و ائوزینوفیل در pH بسیار قلیایی در مقابل لیز شدن بیشترین مقاومت را دارند، در حالی که بقیه سلولها بسرعت لیز میشوند و از این رو براساس حجم سنجی پس از مجاورت خون با PH اسیدی و یا قلیایی میتوان این دو سلول را از هم جدا کرد. گرانولهای ائوزینوفیل و آلودگی گلبولهای قرمز با انگل مالاریا موجب دپلاریزه کردن نور شده و راهی برای افتراق ائوزینوفیل و اعلام خطر برای انگل مالاریا باز میکند.
گرانولهای بازوفیل دارای هپارین هستند و با این ویژگی پذیرای رنگهایی مانند آلسینبلو و یا آسترابلو میباشند که با سنجش جذب نور توسط سلول پس از رنگ آمیزی میتوان آنها را شناسایی کرد.
هنگام کار با آنالیزورها هیچگاه تهماندههای محلولهای قبلی را به محلول جدید اضافه نکنید. معرفها بایستی دارای سریال ساخت بوده و از شرکتهای معتبر تهیه شوند.
در تکنولوژی MAPSS یا سنجش پراکنش نور پلاریزه در زوایای مختلف میتوان سلولهای خونی را طبقه بندی کرد. گفتنی است که پراکنش نور دپلاریزه در زاویه 90 درجه با تعداد ائوزینوفیلها در رابطه است.
https://en.wikipedia.org/wiki/Hematology_analyzer
ورود / ثبت نام








خوب