پیشرفتهای جدید در درک مکانیسمهای بیماریزایی قارچهای فرصت طلب
قسمت چهارم
دکتر محمد قهری – آزمایشگاه تشخیص طبی رسالت
دکترای علوم آزمایشگاهی بالینی – PhD قارچ شناسی پزشکی
کریپتوکوکوس نئوفرمنس- قاتلی زیر پوشش قندی! (The suger-coated Killer)
همانند گونههای آسپرجیلوس گونههای کریپتوکوک به فراوانی در محیط اطراف ما، در خاک، بر روی درختان و در فضولات پرندگان یافت میشوند. برخلاف آسپرجیلوسها گونههای کریپتوکوک مخمرهای بازیدیومیست هستند که در نتیجه شکل و ریختی کاملا متمایز از هایفی قارچهای رشتهای نظیر آسپرجیلوس فومیگاتوس دارند. عفونتهائی که توسط گونههای کریپتوکوک ایجاد میشوند متقارن با افزایش جهانی جمعیت بیماران ایمیونوکامپرومایزد در طی دو دههی گذشته زیاد شدهاند و این افزایش بویژه با اپیدمی ایدز مرتبط بوده است. بهترین تخمینها از عفونتهای کریپتوکوک قبل از اپیدمی ایدز در حد 0/8 مورد در هر یک میلیون نفر در سال بوده است. در طول مدت اوج اپیدمی ایدز در ایالات متحده انسیدانس کریپتوکوکوزیس بطرز فوقالعادهای در حد 5 مورد در هر 100000 جمعیت در نواحی شهری افزایش یافت و در ممالک کمتر توسعه یافته که از اپیدمی ایدز رنج میبردند میزان شیوع در بیماران ایدزی در حد 15 الی 45 درصد گزارش گردید.
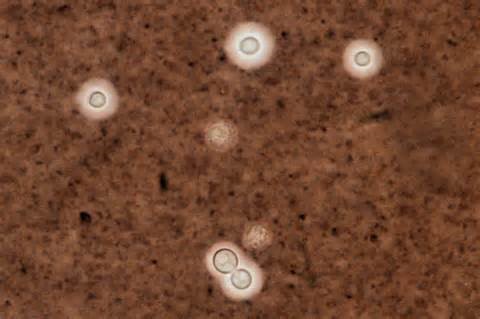
سلولهای مخمری کپسولدار در آزمایش مرکب چین
اخیرا یک طغیان (outbreak) از کریپتوکوکوزیس در جزیره ونکوور در کانادا رخ داد. آنچه که در این واقعه به بحث حاضر مربوط میشود این است که بیماران و حیوانات مبتلا هیچگونه آبنرمالیتهی آشکاری در عملکرد سیستم دفاعی خود نشان نمیدادند، این مطلب نشاندهندهی این مسئله است که این استرین از کریپتوکوک (که اکنون بعنوان یک گونه ی مجزا تحت عنوان C. gatti شناخته میشود و نام قبلی آن C. neoformans var. gatti بوده است) قادر به ایجاد بیماری در میزبان با ایمنی شایسته (immunocompetent) است و بنابراین دارای فاکتورهای ویرولانس کلاسیک میباشد. این یافته به این باور عمومی که پاتوژنهای قارچی فرصتطلب در فاکتورهای کلاسیک ویرولانسی تکامل نیافتهاند اشارهی مستقیم دارد. در جهت مبارزه با این پاتوژن قارچی پدیدار شدهی مهم کوششها و تلاشهای بنیادی و فراوانی انجام شده است که با استفاده از ابزارهای ملکولی مکانیزمهای پاتوژنز کریپتوکوک بررسی شود. برخلاف آسپرجیلوس فومیگاتوس یک سیکل جنسی تعریف شده برای کریپتوکوکوس نئوفرمنس قابل دسترسی است تا مطالعات ژنتیکی را بتوان بعمل آورد و علاوه بر این دستکاری ملکولی قارچ نسبتاً ساده (straightforward) و در مقایسه با آسپرجیلوس فومیگاتوس موفقیتآمیز است. چندین توالی ژنومی در حال حاضر در دسترس است و یا اینکه در راه تکمیل آن برای استرینهای متنوع کریپتوکوکوس نئوفرمنس و گونهی جدید C. gatti هستیم. بنابراین برای روشن ساختن خصیصهی بیماریزائی (virulence attributes) گونههای کریپتوکوک در سطح ملکولی پیشرفت زیادی بعمل آمده است و برخی اکنون کریپتوکوکوس نئوفرمنس را بعنوان یک ارگانیسم مدل برای مطالعهی پاتوژنزیس قارچی در انسان در نظر میگیرند. مطالعات بر روی مکانیزمهای پاتوژنزیس کریپتوکوکوس نئوفرمنس سه ویژگی یا خصیصه ی بیماریزائی(virulence attributes) اساسی را روشن و آشکار کرده است: 1- قابلیت رشد در دمای بالا (37 الی 39 درجه ی سانتیگراد)، 2- تشکیل یک کپسول پلیساکاریدی خارج سلولی و 3- سنتز ملانین.
تعداد زیادی از ژنها و مسیرهای تنظیمی پیچیده بصورت ماشینوار (mechanistically) در توانا ساختن کریپتوکوکوس نئوفرمنس برای بیماریزائی از طریق سه مکانیسم فوقالذکر سهیم هستند. بعلاوه چندین مطالعهی مروری عالی وجود دارند که بر روی این جنبههای پاتوژنزیس ثابت شدهی کریپتوکوک بحث کردهاند. در بحث حاضر در مورد مکانیزمهای پاتوژنز قارچی در پستانداران، ما برروی مطالعاتی که برای درک تکامل و منابع بالقوهی پاتوژنزیس قارچی انسان به تازگی در مورد کریپتوکوک انجام شده تمرکز خواهیم کرد.
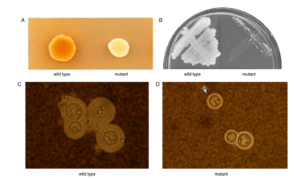
تصویر شماره 1: خصیصههای ویرولانسی کریپتوکوکوس نئوفرمنس. (A): تشکیل ملانین بوسیلهی کریپتوکوکوس نئوفرمنس. فقدان تشکیل ملانین در استرین موتانت که در مدل موشی کریپتوکوکوزیس ویرولانس تضعیف شده داشته است. (B): رشد کریپتوکوکوس نئوفرمنس در دمای بالا، کاهش رشد در دمای 37 درجه سانتیگراد در استرین موتانت یافته. (C and D): تولید کپسول در کریپتوکوکوس نئوفرمنس و کاهش قابل توجه تولید کپسول در استرین موتانت یافته
میزبانان جایگزین بعنوان مخزن برای فشار انتخابی که منجر به توسعه و ماندگاریِ خصیصهی بیماریزائی میشود
در حالیکه مکانیزمها و ماندگاری (persistence) ویرولانس در پاتوژنهای قارچی گیاهان عموماً بخوبی پذیرفته شده است، ما هنوز این پدیده را در مورد پاتوژنزیس قارچی انسان درک نکردهایم. واضح است که قارچهای معینی دارای آنچه که دیگران و ما تحت عنوان “خصیصهی بیماریزائی” نامیده ایم با یک “ترکیب بیماریزا” (virulence composite) هستند که اجازه میدهند که این قارچها در پستانداران بیماری ایجاد نمایند. به تازگی شواهد و مدارکی جمع شده است که مطرح میکند که واکنشهای متقابل قارچی با دیگر میکروارگانیسمها در محیط میتواند تا حدی توضیح دهندهی تکامل و استمرار و ماندگاری مکانیزمهای پاتوژنزیس قارچی در پستانداران باشد. از طرق مختلف کریپتوکوکوس نئوفرمنس یک مدل یگانه و ایدهآل برای تحقیق این فرضیه است. برخلاف آسپرجیلوس فومیگاتوس، عفونتهای کریپتوکوکوس نئوفرمنس میتواند بصورت خفیف و پنهان بوده و درون ماکروفاژها در افراد با ایمنی شایسته باقی بماند. کپسول پلیساکاریدی بدواً مسئول توانائی کریپتوکوکوس نئوفرمنس برای باقی ماندن درون ماکروفاژها است و هنگامیکه دفاعهای ایمنی میزبان دچار دگرگونی میشود، پخش شدن و پراکندن (shedding) کپسول به داخل واکوئلهای ماکروفاژ سیتوتوکسیسیتهی سلول میزبان را القاء میکند. بنابراین سوالی پیش می آید: چگونه کریپتوکوکوس نئوفرمنس این توانائی را که در داخل ماکروفاژ باقی مانده و تکثیر شود را بدست آورده است هنگامیکه نیازی نیست که چرخهی زندگی خودش را کامل کند؟ برای پاسخ به این سوال steenbergen et al در مشاهدات اولیه دیده بودند که کریپتوکوکوس نئوفرمنس براحتی توسط یک پروتوزوآی خاکزی فاگوسیته میشود بصورت قابل توجهی آمیبها و ماکروفاژها بسیاری از خواص بیولوژیک را بین خود تسهیم (share) میکنند از جمله توانائی فاگوسیتوز ذرات جدا شده در واکوئلها و آنزیمهای لیزوزومال ترشحی برای اینکه ذرات بلعیده شده را هضم کنند. Steenbergen و همکارانش این فرضیه را مطرح کردند که واکنشهای متقابل با پروتوزوآهای ساکن خاک منجر به توانائی کریپتوکوکوس نئوفرمنس شده است که بصورت یک پاتوژن اختیاری داخل سلولی درآید. مشخص شد که آمیب خاکزی آکانتامبا کاستلانی (Acanthamoeba castellanii) به راحتی سلولهای کریپتوکوکوس نئوفرمنس را میبلعد. مسئلهی مهم این است که سویهی وحشی کریپتوکوکوس نئوفرمنس قادر به تکثیر در داخل سلول آمیب است بطوریکه منجر به افزایش در تعداد وزیکولهای حاوی پلیساکارید گردیده و نهایتا موجب مرگ سلول آمیب میشود. یک استرین موتانت کریپتوکوکوس نئوفرمنس که در تولید کپسول نقص داشته است قادر به زنده ماندن در درون سلول آمیب بعد از فاگوسیتوز نبوده است. این استرین فاقد کپسول نیز بوسیلهی ملانیزاسیون توانسته در مقابل آمیب از خود محافظت نماید. بطور قابل توجه ساکارومایسس سرویسیه (مخمر نان غیرپاتوژن) و کاندیدا آلبیکنس (پاتوژن فرصت طلب کومنسال انسانی) در مقابل فاگوسیتوز A. castellanii تاب مقاومت را ندارند.
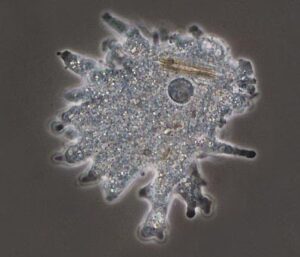
آکانتامبا کاستلانی
این نتایج از این فرضیه حمایت میکنند که خصیصههای ویرولانسی کریپتوکوکوس نئوفرمنس نظیر تولید کپسول و تولید ملانین ممکن است از طریق فشارهای انتخابی (selection pressures) که از کنش و واکنشهای محیطی با آمیبهای خاکزی منتج شده بوجود آمده باشد. این فرضیه بوسیلهی نشان دادن خصیصههای ویرولانسی کریپتوکوکوس نئوفرمنس که برای پاتوژن بودن در نماتود مدلی بنام Caenorhabditis elegans (که یک نماتود غیرانگلی و خاکزی با بدنی شفاف و بطول یک میلیمتر است که از باکتریها و مخمرهای موجود در خاک تغذیه میکند) و نیز برای پاتوژن بودن برای آمیب آزاد خاکزی موسوم به Dictyostelium discoideum (که بعنوان مدل در تحقیقات مربوط به فرآیند فاگوسیتوز مورد استفاده قرار میگیرد) ضروری است بیشتر نشان داده شده است. استرینهای کریپتوکوکوس نئوفرمنس که در حضور Dictyostelium discoideum رشد کردهاند در مقایسه با استرینهائی از کریپتوکوکوس نئوفرمنس که به تنهائی رشد داده شده اند ویرولانس بیشتری داشتهاند. استرینهای هایپرویرولانت در شرائط آزمایشگاهی افزایش تولید کپسول و ملانیزاسیون را نشان دادند که قویاً مطرح کنندهی واکنش با ارگانیسمهای خاکزی میباشند که بسرعت ویرولانس کریپتوکوکوس نئوفرمنس را تغییر میدهند.
caenorhabditis elegans
این قابلیت انعطاف و شکلپذیری فنوتیپیک برای تغییر خواص در پاسخ به شرائط محیطی در کریپتوکوکوس نئوفرمنس ممکن است رابطهی مستقیمی با ایجاد ویرولانس در پستانداران داشته باشد. بعنوان مثال طغیان اخیر کریپتوکوکوزیس در جزیره ونکوور کانادا بصورت آشکار در افراد و حیوانات دارای ایمنی شایسته رخ داده است. آنالیز ملکولی ایزوله های C. gattii در ونکوور نشان داده است که جمعیت اولیه کلونال بوده است. (alpha mating type با یک نوع ملکولی VGII)
Dictyostelium Discoideum
به نظر می رسد که 2 استرین جفت شده (mated) و استرینهای رکومبینانت (موجود دارای صفات متشکل جدید) حاصله دارای ویرولانس بیشتری در حیوانات بوده است مشابه با استرینی که موجب بیش از 90% از عفونتهای گزارش شده در این طغیان بودهاند. سوالی که باید پاسخ داده شود این است که چگونه و چه موقع این استرین C. gattii در توانائی برای عفونی کردن میزبانان با ایمنی شایسته تکامل یافته است؟
یک فرضیه جایگزین وجود دارد که بیان میکند که در سیستم ایمنی افراد مبتلا چیزی منحصر به فرد (unique) وجود دارد که هنوز معلوم نشده که چرا به این استرینها اجازهی ایجاد بیماری میدهد. اگرچه همانطور که در مورد آزمایشات مربوط به Dictyostelium دیده میشود گونههای کریپتوکوکوس میتوانند به تغییرات صورت گرفته در محیط پاسخ دهند و ویرولانس خود را تغییر داده یا بصورت فنوتیپیک موجب سویچ زدن مرفولوژی کلنی خود شوند در حالیکه مکانیسمها برای این انعطافپذیری فنوتیپیکی در حال حاضر معلوم نشده است. فرضیهای مطرح شده که یک حادثهی رکومبینانت ژنتیکی تازه در یک دودمان (clade) بارور غیر عادی از C. gattii است که تولید بازیدیوکونیدیها را افزایش داده و یا آشیانهی اکولوژیکی محیطی تغییر یافته مسئول طغیان جزیرهی ونکوور است. بنابر این فشارهای انتخابی محیطی ممکن است ویرولانس گونههای کریپتوکوکوس را افزایش دهد. این فشارهای انتخابی ممکن است بوسیلهی واکنشهای مخمری و پاسخ به میکروارگانیسمهای خاک مشتق شده و به ماندگاری خصیصههای ویرولانسی در جمعیتهای انتخاب شده منجر شده، افزایش برخورد با میزبان ایمنوکامپرومایزد و توانائی ایجاد تنوع ویرولانسی در جمعیت مخمری از طریق رکامبیناسیون جنسی نیز پدید میآید. مطالعات ژنتیک جمعیتی و مکانیستیک بیشتر بدون شک به روشنتر شدن تکامل خصیصههای ویرولانسی مربوط به ملانین کمک میکنند و گونههای کریپتوکوک مدل ایدهآلی برای اینچنین مطالعات هستند.
بیماریزایی قارچی: جایگاه کنونی کجاست و در آینده به چه جایگاهی دست خواهیم یافت؟
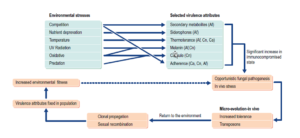
در مطالب گفته شده در این بخش به نظر می رسد که در ارتباط با “بیماریزایی قارچی در انسان” ظاهراً یک فاکتور ویرولانس قارچیِ مشخص (magic bullet) ممکن است مطرح نباشد. بر خلاف این تصور بیماریزایی قارچی در انسانها اصولاً یک پدیده چند فاکتوری است که شامل واکنشهای پیچیده بین پاتوژنهای قارچی مهاجم و میزبان، جهت ایجاد بیماری میباشد. این موضوع با مثالهایی برای درک ویژگیهای ویرولانسی پاتوژنهای مهم قارچی انسان سادهتر خواهد شد. برای مثال توانایی ایجاد یک کپسول پلیساکاریدی متراکم برای بیماریزایی کریپتوکوکوس نئوفورمنس ضروری است اما در آسپرژیلوس فومیگاتوس و کاندیدا آلبیکنس اینگونه نیست و توانایی ایجاد هایف مهاجم برای آسپرژیلوس فومیگاتوس ضروری است اما برای کریپتوکوکوس نئوفورمنس یا کاندیدا آلبیکنس ضروری نمیباشد. به هر حال آشکار است که صفتهای خاصی از قبیل رشد در دمای بدن پستانداران، مقاومت به استرس اکسیداتیو و توانایی دریافت مواد غذایی از میزبان پستاندار برای تهاجم قارچ به میزبانهای پستاندار لازم است. نهایتاً وضعیت سیستم ایمنی میزبان، فاکتور تعیین کنندهی مهمی در ایجاد بیماری قارچی میباشد. این حقیقت بیان میکند که اکثریت پاتوژنهای قارچی انسان در “فاکتورهای ویرولانس” به معنای رایج کلمه تکامل نیافتهاند. در عوض قارچ های خاصی ویژگیهای ویرولانس خود را که احتمالاً برخاسته از فشارهای انتخابی در محیطهای اکولوژیک قارچ میباشد تجمیع مینماید. این ویژگیهای ویرولانس به این قارچها اجازه میدهند که در محیطهای اکولوژیک طبیعیشان موفق شوند و در میزبانهای دچار نقص سیستم ایمنی ایجاد بیماری کنند. در تصویر شماره 2 یک مدل احتمالی برای تکامل بیماریزایی قارچی در انسان ارائه داده شده است. در این مدل این احتمال را که افزایش تماس بین قارچ و افراد دچار نقص سیستم ایمنی در طول زمان موجب افزایش توانایی این قارچها برای ایجاد بیماری در افراد دارای سیستم ایمنی شایسته شده باشند در نظر گرفته شده است. در حالی که بروز کریپتوکوکوس در جزیره ونکوور میتواند بیان کند این موضوع پذیرفتی است، فقدان ویرولانس کاندیدا آلبیکنس و همراهی نزدیک آن با انسان این احتمال را رد میکند. هنوز مکانیسمهای ژنتیکی و تولید مثلی منحصر به فرد استفاده شده توسط قارچها برای ایجاد تنوع ژنتیکی یک فاکتور مهم و قابل توجه میباشد.
با توجه به اینکه در این بخش روی میزبان تمرکز نشده است، واضح است که ریسک فاکتورهای اصلی تعیین کننده بروز عفونتهای قارچی انسان وابسته به سیستم ایمنی وی (میزبان) میباشد. دو فاکتور اصلی در عفونتهای قارچی مهاجم وجود دارد که قابل چشمپوشی نیست. اول به استثنای کومنسالیسم برخی از مخمرها و همچنین سازگاری برخی از درماتوفیتهای انسان دوست، قارچها از انسان به عنوان بخشی از چرخه زندگی خود استفاده نمیکنند. در حقیقت عفونت قارچی یک مواجهه تصادفی است که به ندرت منجر به انتقال و برگشت مجدد قارچ به محیط میشود و اغلب اوقات از نظر چرخهی تکاملی به مرگ قارچ ختم میشود. به هر حال قارچها در فساد ترکیبات زیستی دخیل هستند و بدین منظور دارای ابزارهائی برای فساد مواد آلی غیر زنده میباشند. پیشرفتهای اخیر در تکنولوژیهای پزشکی توانسته سیستم ایمنی موثر و کارآمد برخی از میزبانها را منسوخ کرده و آنها را برای ایجاد عفونتهای قارچی مستعد نماید. دوم اینکه ما باید صراحتاًَ این موضوع را بیان کنیم که همانند کلنیسینها با قارچهائی سروکار داریم که توانائی تغییراتی در فرآیندهای هوموستاتیک میزبان و به عبارت دیگر ایجاد بیماری را دارند.
از دیدگاه ما بیماری قارچی ارتباط مستقیم با سیستم ایمنی میزبان دارد. بیماری قارچی زمانی اتفاق میافتد که تعادل سیستم ایمنی میزبان بر هم میخورد، یا بی کفایت و نامناسب می شود (invasive mycoses) و یا خیلی افزایش پیدا میکند(immune reconstitution syndrome; IRS). آشفتگی در سیستم ایمنی میتواند از منابع مختلفی ایجاد شود. اولاً زودرسی یا نابهنگامی موجب میشود که برخی میزبانان گیر بیفتند. ثانیاً نقائص سیستم ایمنی ذاتی و اکتسابی باعث گریختن قارچ از سیستم ایمنی میشود. نقائص ایمنی ذاتی در عملکرد گرانولوسیتها از قبیل نقص میلوپراکسیداز و بیماری گرانولوماتوز مزمن بترتیب به کاندیدا و آسپرژیلوس اجازه ایجاد بیماری میدهند. نقائص اکتسابی سیستم ایمنی میتواند در موارد ایاتروژنیک و یا بعلل طبیعی رخ دهد. برای مثال شیمیدرمانی سرطان، نوتروپنی شدید ایجاد میکند و به عنوان یک فاکتور خطر برای عفونتهای قارچی مهاجم محسوب میشود. با کاهش تعداد سلولهای خونی و موکوزیت همراه آن واضح است که شمارش کلی و مطلق نوتروفیلها به کمتر از mm3/500 بیمار را در معرض خطر برای عفونت قارچی قرار میدهد و بدون درمان نوتروپنی داروهای ضد قارچی به تنهایی موجب بهبود بیمار نخواهند شد. همچنین با وجود تعداد طبیعی نوتروفیلها میتوانیم با استفاده از دوزهای زیاد کورتیکواستروئیدها در طول بیماری گرافت علیه میزبان و بیماری بافت همبند پاسخهای سیستم ایمنی را مهار کنیم. بعلاوه همانطور که کاربردهای مونوکلونال آنتیبادی از قبیل infliximab و alemtuzumab افزایش مییابند مواردی از بیماریهای قارچی مهاجم آشکار خواهند شد. همراه با رخدادهای ایاتروژنیک سرکوب کننده ایمنی اکتسابی، دنیا در گیرودار اپیدمی HIV باقی مانده است. با وجود موفقیتهای بسیار در درمانهای ضد ویروسی، تخریب ویروسی سیستم ایمنی با کاهش تعداد سلولهای CD4 به کمتر از mm3/200 و ظهور کاندیدیازیس دهانی با کاهش تعداد سلول به کمتر از mm3/100 همراه با ظهور پنوموسیستیس، کریپتوکوکوزیس و سایر بیماریهای قارچی آندمیک میباشد. بنابراین کاملاً واضح است که سیستم ایمنی سلولی کارآمد برای دفاع علیه عفونتهای قارچی مهاجم ضروری میباشد. سرانجام با فهم بیشتر از ژنوم انسان، ما پلیمورفیسمهایی را در ژنهای سیستم ایمنی اختصاصی انسان که احتمالا با ریسک بیشتر برای عفونتهای قارچی مرتبط هستند را کشف خواهیم کرد. این مطالعات ممکن است به شرح “میزبان نرمال” با یک عفونت قارچی مهاجم مانند مورد مربوط به جزیره ونکوور کمک نمایند و یا افراد در معرض خطر قارچهای شایع را به گروههای پر خطر و کم خطر طبقهبندی کند.
همانطور که پاسخ ایمنی برای حفاظت از تهاجم قارچی یا حذف قارچ مهاجم مهم است واضح است که تغییر سریع پاسخ ایمنی در میزبان میتواند ایمنی بسیار شدیدی را ایجاد کند. این حالت immune reconstitution syndrome یا IRS نامیده میشود و میتواند همراه با عفونت قارچی و یا هنگام کنترل آن ایجاد شود. برای مثال در طول اجرای HAART در یک بیمار مبتلا به HIV و بیماریهای قارچی یا دریافت کننده پیوند عضو و بیماریهای قارچی و تغییر دادن داروی ضد رد پیوند همانطور که قارچ در حال حذف شدن است، پاسخ شدید سیستم ایمنی میتواند با تعداد فراوان سلولهای التهابی در موضع عفونت به میزبان آسیب بزند.
واضح است که با وجود گامهای بزرگی که در عرصه کشف داروهای ضد قارچی (محصولات لیپیدی آمفوتریسین B ، آزولهای وسیعالطیف و اکینوکاندینها) برداشته شده است، آشنایی بیشتر با پاتوژنهای قارچی و مکانیسمهای بیماریزایی آنها برای توسعه درمانهای نوین و استراتژیهای پیشگیری کننده از مقاومتهای ضد قارچی ضروری میباشد. همانطور که ما در حال فهم جزئیات پیچیده مکانیسمهای پاتوژنهای قارچی انسان هستیم درک این موضوع مهم است که تمام ویژگیهای بیماریزایی اساسی آنها به شکلی قوی در ارتباط با قدرت و تغییر پاسخ ایمنی میزبان اعم از سدهای ساختاری ساده تا فاکتورهای ذاتی و فاگوسیتهای حرفه ای و نهاتاً تنظیم سیستم ایمنی اکتسابی میباشند. همانطور که توانایی ما در موفقیت در درمان بیمارانی که در گذشته به عنوان بیماریهای تهدید کننده زندگی محسوب میشدند در حال افزایش است، بروز عفونتهای قارچی انسان، ابتلاء و مرگ و میر ناشی از آنها به طرز برجستهای در حال افزایش میباشد. همانطور که ما درک بهتری از چگونگی کلونیزاسیون این ارگانیسمها و ایجاد بیماری در بیماران دارای نقص سیستم ایمنی بدست میآوریم توانایی ما برای فائق آمدن بر این عفونتهای قارچی تهدید کننده زندگی افزایش خواهد یافت.
Af: Aspergillus fumigatus; Cn: Cryptococcus neoformans; Ca: candida albicans.
تصویر شماره 2: مدل تکامل ویژگیهای ویرولانسی پاتوژنهای قارچی انسان. این مدل امکان مواجه شدن قارچ در محیط اکولوژیک طبیعی را با عوامل استرس بیان میکند. این استرسها فشارهای انتخابی میباشند که منجر به توسعه ویژگیهایی در قارچ برای فائق آمدن به این استرسها میشود. بنابراین در مواجهه با بیماران نقص ایمنی این ویژگیها به قارچهای خاصی اجازه ماندگاری در انسانها را میدهند. واکنشهای بین قارچ و میزبان میتواند منجر به پروسه های تکاملی در شرایط In vivo شود که پتانسیل این را دارند که در جمعیت قارچها از طریق تولید مثل جنسی و یا تکثیر کلونال تثبیت شوند. این ویژگیها ممکن است برای قارچ جهت کلونیزاسیون روی میزبان گاهی به شکل یک امتیاز باشد.
منبع:
Anaissie E J. , McGinnis M R., Pfaller M A. Clinical Mycology. CHURCHILL LIVINGSTONE 2009, Elsevier Inc. Chap: 2
پیشرفتهای جدید در درک مکانیسمهای بیماریزایی قارچهای فرصت طلب (3)
پیشرفتهای جدید در درک مکانیسمهای بیماریزایی قارچهای فرصت طلب
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام