پلاسمودیوم فالسیپاروم (Plasmodium falciparum)
و پروتئین Knob
گردآوری و تألیف:
دکتر احمد مردانی
استادیار مؤسسه آموزشی و پژوهشی طب انتقال خون
|
Abbreviations: IRBCs (infected red blood cells) KAHRP (knob-associated histidine-rich protein) PfHRP-1 (Plasmodium falciparum histidine-rich protein-1) KP (knob protein) PfEMP-1 (Plasmodium falciparum-infected erythrocyte membrane protein-1) PfEMP-2 (Plasmodium falciparum-infected erythrocyte membrane protein-2) PfEMP-3 (Plasmodium falciparum-infected erythrocyte membrane protein-3) RESA (ring-infected erythrocyte surface antigen) MESA (mature parasite-infected erythrocyte surface antigen) ICAM-1 (intercellular adhesion molecule-1) PECAM-1 (platelet/endothelial cell adhesion molecule-1) HS (heparan sulfate) HRP (histidine-rich protein) HARP (histidine-alanine rich protein) PfHRP-2 (Plasmodium falciparum histidine-rich protein-2) SHARP (small histidine-alanine rich protein) PfHRP-3 (Plasmodium falciparum histidine-rich protein-3) SP (signal peptide) |
پلاسمودیوم فالسیپاروم (Plasmodium falciparum) تکیاخته انگلی درون گلبولی است که سبب رخداد شدیدترین شکل مالاریای انسانی میگردد. اکثر مرگومیرهای ناشی از ابتلا به مالاریای فالسیپاروم به علت قابلیت تجمع این انگل در ارگانهای داخلی بدن است. تجمع گلبولهای قرمز آلوده به مراحل رشد کرده انگل پلاسمودیوم فالسیپاروم در عروق (sequestration)، منجر به بروز اختلالاتی از جمله مالاریای مغزی (cerebral malaria) میشود که علت اصلی مرگومیر ناشی از ابتلا به مالاریای فالسیپاروم است. این تجمع یک پدیده cytoadherence با واسطه knobs است [1].
به برجستگیهای فنجانی شکل که در سطح گلبولهای قرمز آلوده (IRBCs) به تروفوزوئیت (trophozoite) و شیزونت (schizont) پلاسمودیوم فالسیپاروم تشکیل میشود، knobs میگویند. اندازه knobs، 60-100 نانومتر بوده و حاوی مواد electron dense میباشند. ظهور آنها در سطح گلبولهای قرمز آلوده در مرحله تروفوزوئیت در حال رشد (growing trophozoite) شروع میشود و با رسیده شدن انگل تعداد آنها افزایش مییابد (شکل 1)، بنابراین، گلبولهای قرمز آلوده به شیزونت رسیده (mature schizont) حاوی حداکثر تعداد knobs و تروفوزوئیت جوان (young trophozoite) فاقد knobs میباشد. علاوه بر پلاسمودیوم فالسیپاروم، چندین انگل مالاریای دیگر قادر به تشکیل knobs در سطح گلبولهای قرمز آلوده هستند (جدول 1)، امّا مشخصهها و ویژگیهای آنها از گونهای به گونه دیگر متفاوت است [8-3]. حضور knobs در سطح گلبولهای قرمز آلوده، غشاء گلبولی را به یک فعالکننده مسیر فرعی کمپلمان تبدیل مینماید [9] و همچنین سبب سختی غشاء گلبولهای قرمز میشود. به دلیل عدم انعطافپذیری غشایی، گلبولهای قرمز آلوده دارای knobs توانایی عبور از عروق باریک و همچنین تشکیل رولو (rouleaux) را از دست میدهند [10].
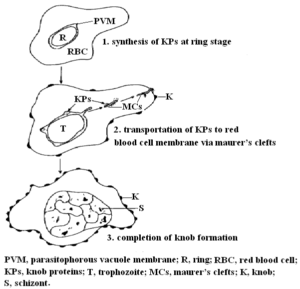
شکل 1: نمایش شماتیک مراحل تشکیل knobs [2]
جدول 1: مشخصهها و ویژگیهای knobs انگلهای مالاریا [2]
| Cross-reactive knob components | Knob components | Cytoadherence and sequestration | Knob inducing | Host | Parasite species |
| ND | ♦ | Yes | Yes | Human | P. falciparum |
| ND | ND | No | Yes | Human | P. malariae |
| ND | ND | No | Yes | Monkey | P. brasilianum |
| ND | ND | No | Yes | Monkey | P. fieldi |
| ND | ND | No | Yes | Monkey | P. simiovale |
| ND | ND | Yes | Yes | Monkey | P. coatneyi |
| ND | ND | Yes | Yes | Monkey | P. fragile |
♦ Several proteins identified; ND, not determined.
چندین مولکول مشتقشده از انگل و گلبولهای قرمز میزبان در تشکیل knobs شرکت میکنند؛ یکی از آنها، پروتئین KAHRP است که به آن PfHRP-1 و یا KP نیز میگویند [2،11]. این پروتئین 105-85 کیلودالتونی توسط مراحل اولیه (تروفوزوئیت جوان) چرخه غیرجنسی انگل پلاسمودیوم فالسیپاروم سنتز میشود و سپس از طریق Maurer’s clefts به غشاء گلبولهای قرمز آلوده به مراحل رشدکرده انگل منتقل میگردد [2،12،13] (شکل 1).
علاوه بر KAHRP، پروتئینهای اسکلتی گلبول قرمز از قبیل اسپکترین (spectrin)، اکتین (actin) و انکیرین (ankyrin) و تعدادی از پروتئینهای انگلی شامل PfEMP-1، PfEMP-2، PfEMP-3، RESA و MESA در تشکیل knobs دخیل هستند [16-14]. ثابت شده است که پروتئین KAHRP با پروتئینهای اسکلتی گلبول قرمز و همچنین PfEMP-1 در ارتباط میباشد [19-17] (شکل 2).
ساختمان اولیه KAHRP متشکل از سه domain مشخصشده بر اساس شاخص hydropathy است که عبارتند از [23-21]:
- N-terminal histidine-rich domain یا region I
- central lysine-rich domain یا region II
- C-terminal decapeptide repeat domain یا region III
در انسان region II و region III هر دو ایمونوژنیک بوده و دارای واحدهای پپتیدی تکراری هستند، امّا فقط region III متغیر و متنوع است [23]. اختلاف قابلتوجه بین این دو domain، وجود یک ناحیه باندشونده اسپکترین- اکتین در region II است که در تمامی ایزولههای مطالعهشده بدون تغییر بوده است [2،13،24]. بر اساس بررسیهای انجامشده، region III پروتئین KAHRP متنوعترین domain این پروتئین است، در حالیکه دو domain دیگر تقریباً بدون تغییر میباشند [23،25،26].
شکل 2: نمایش شماتیک عوامل دخیل در تشکیل knobs و ارتباط آنها با هم و با گیرندههای موجود در سطح سلولهای اندوتلیال عروق میزبان [20]
پروتئین KAHRP ترکیب اصلی knobs را تشکیل میدهد و وجودش برای تشکیل knobs ضروری است [29-27]. موقعیت این پروتئین در knobs، زیرغشایی (submembranous) بوده و به سمت کناره سیتوپلاسمیک ساختمان knobs قرار دارد [21،30-28]. بررسیهای انجامشده با میکروسکوپ الکترونی نشان داده است که knobs واسطه پدیده cytoadherence بین گلبولهای قرمز آلوده و سلولهای اندوتلیال عروق میزبان هستند [2]. از آنجایی که موقعیت KAHRP زیرغشایی است، مسلماً نمیتواند بهطور مستقیم در این اتصال شرکت نماید، بنابراین مولکول و یا مولکولهای موردنظر بایستی در سطح knobs مستقر باشند. از طرفی سلولهای اندوتلیال نیز بایستی دارای گیرندههایی (receptors) برای لیگاندهای موجود در سطح knobs باشند.
آنتیژن PfEMP-1 مستقر در سطح خارجی knobs [31]، توانایی اتصال به گیرندههای شناساییشده موجود در سطح سلولهای اندوتلیال عروق میزبان شامل CD36 یا OKM5، کندرویتین سولفات A (CSA)، ICAM-1، PECAM-1 یا CD31، ترومبوسپوندین (TSP) و HS را دارد [35-32] (شکل 2). این اتصال و تماس توسط آنتیبادیهای ضد گلبولهای قرمز آلوده دارای knobs (K+ IRBCs) گونه همولوگ از همان منطقه جغرافیایی مهار میشود [36،37]، در حالی که آنتیبادیهای ضد گلبولهای قرمز آلوده بدون knobs (K– IRBCs) اثر مهاری بر این اتصال ندارند [38]. این نشان میدهد که مولکولهای cytoadherence آنتیژنیک هستند و فقط روی گلبولهای قرمز آلوده دارای knobs بیان میشوند. سنتز چنین آنتیژنهایی در کشتهای طولانی مدت کاهش مییابد، چرا که از نظر آماری ظرفیت اتصال گلبولهای قرمز آلوده دارای knobs بهطور معنیداری کاهش پیدا میکند [36].
در غیاب KAHRP، گلبولهای قرمز آلوده به انگل توانایی اتصال به سلولهای اندوتلیال عروق میزبان را ندارند [27]. علاوه بر این، مشخص شده که انگلهای بدون knobs ایجاد شده در شرایط آزمایشگاهی (کشتهای طولانی مدت) قدرت بیماریزایی خود را از دست میدهند [11،12]. پروتئین KAHRP یکی از اهداف درمان مولکولی است؛ بنابراین، مواد بلوکهکننده تشکیل knobs در درمان مالاریای فالسیپاروم مفید خواهند بود [39].
آنتیبادیهای ضد آنتیژنهای knobs در طی عفونت مالاریای فالسیپاروم تولید میشوند، بنابراین مجاور کردن گلبولهای قرمز آلوده دارای knobs (K+ IRBCs) با سرم hyperimmune از اتصال آنها به سلولهای اندوتلیال عروق میزبان ممانعت میکند. این سرم همچنین قادر است گلبولهای قرمز آلوده تجمعیافته را به گردش خون بازگرداند (آزادسازی)، در نتیجه پارازیتمی یا حضور انگل در خون (parasitemia) بهطور معنیداری کاهش مییابد [36،37،40]. با این وجود، مهار cytoadherence توسط سرم hyperimmune همیشه با تیتر بالای آنتیبادی توتال (total antibody) در ارتباط نیست [41]. این میتواند فقط به سبب وجود آنتیبادیهای اختصاصی باشد که قادر به مهار cytoadherence هستند. بررسیهای انجامشده بر روی آنتیبادیهای ضد KAHRP این موضوع را تأیید مینماید [42].
مالاریای مغزی، مهمترین عارضه ابتلا به مالاریای فالسیپاروم است که در اغلب موارد به مرگ منتهی میشود. رخداد این عارضه کشنده ممکن است ناگهانی و حتی اولین علامت بیماری باشد. سردرد شدید از علائم معمول مالاریای مغزی است که متعاقب آن خوابآلودگی، پریشانی و اغمای تحریکناپذیر تظاهر مینماید. مشخصترین علامت مالاریای مغزی، اغما است که ظن بر وجود آن ضرورت شروع فوری درمان با کینین (Quinine) و یا کینیدین (Quinidine) داخل وریدی را ایجاب میکند. در افراد بهبودیافته از این عارضه ممکن است اختلالات و عوارض سیستم اعصاب مرکزی باقی بماند. لازم به ذکر است که چند مورد مالاریای مغزی ناشی از ابتلا به مالاریای ویواکس گزارش شده است [43].
برخلاف باکتریها و ویروسها، در چرخه زندگی انگلهای مالاریا مراحل مختلفی وجود دارد که در هر مرحله چندین آنتیژن جدید بیان میشود. تاکنون چهار نوع پروتئین غنی از هیستیدین (HRP) در انگلهای مالاریا شناسایی شده که همه آنها در مراحل خونی غیرجنسی بیان میشوند. یکی از آنها در P. lophurae و بقیه (سه) در پلاسمودیوم فالسیپاروم شناسایی شده است [44] (جدول 2). اولین بار در سال 1974، Kilejian نشان داد که انگل مالاریای پرندگان (P. lophurae) پروتئینی دارد که مقادیر بالایی از هیستیدین (73 درصد) را داراست و آن را پروتئین غنی از هیستیدین نامید [45،46]. این پروتئین در گرانولهای سیتوپلاسمیک انگل که در مرحله داخل گلبولی غالب میباشند، قرار دارد [47].
تاکنون سه پروتئین غنی از هیستیدین در پلاسمودیوم فالسیپاروم شناسایی و بررسی شده است که عبارتند از [44،50-48]:
- پروتئین غنی از هیستیدین مرتبط با knob (KAHRP) یا پروتئین knob (KP) یا PfHRP I یا PfHRP-1
- پروتئین غنی از هیستیدین- آلانین محلول (soluble HARP) یا PfHRP II یا PfHRP-2
- پروتئین غنی از هیستیدین- آلانین کوچک (SHARP) یا PfHRP III یا PfHRP-3
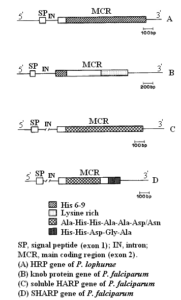
هر چهار پروتئین غنی از هیستیدین شناسایی شده در انگلهای مالاریا، ایمونوژنیک بوده و ژن آنها توسط یک اینترون (intron) به دو اگزون (exon) تقسیم میشود. اولین اگزون، پپتید سیگنالی (SP) و دومین اگزون، بخش عمدهای از پروتئین را کد میکند (شکل 3) [44].
جدول 2: مشخصهها و ویژگیهای پروتئینهای غنی از هیستیدین انگلهای مالاریا [44]
| Serological cross-reactivity | Histidine (%) | Size mol. Wt (Da) | Protein | Source | |||
| Anti-SHARP | Anti-soluble HARP | Anti-KP | Anti-HRP | ||||
| + | + | + | + | 73 | 43000 | HRP | P. lophurae |
| ־ | ־ | + | + | 8 | 62183 | KP | P. falciparum |
| + | + | ־ | + | 35 | 35138 | Soluble HARP | P. falciparum |
| + | + | ־ | + | 30 | 21208 | SHARP | P. falciparum |
برخلاف پروتئین KP، پروتئینهای PfHRP-2 و PfHRP-3 توسط تمامی مراحل داخل گلبولی پلاسمودیوم فالسیپاروم بدون knob (knobless) و دارای knob (knobby) سنتز میشوند [44،48]. عملکرد این دو پروتئین غنی از هیستیدین- آلانین دقیقاً مشخص نشده است. به دلیل فقدان شباهت بین توالیهای نوکلئوتیدی و آمینواسیدی پروتئینهای غنی از هیستیدین- آلانین و KP، واکنش سرولوژی متقاطع بین آنها دیده نمیشود (جدول 2). این در حالی است که سطح بالای همانندی بین توالیهای نوکلئوتیدی و آمینواسیدی دو پروتئین غنی از هیستیدین- آلانین، یکی بودن ژن اجدادی آنها را مطرح مینماید [44،51،52]. لازم به ذکر است که ژن کدکننده پروتئین PfHRP-1 روی کروموزوم شماره دو قرار دارد [53].
شکل 3: نمایش شماتیک ساختمان ژنهای غنی از هیستیدین (HRP) انگلهای مالاریا [44]
References:
- Miller L. Distribution of mature trophozoites and schizonts of Plasmodium falciparum in the organs of Aotus trivirgatus, the night monkey. Am J Trop Med Hyg 1969; 18:860-865.
- Sharma YD. Knobs, knob proteins and cytoadherence in falciparum malaria. Int J Biochem 1991; 23:775-789.
- Smith DH, Theakston RDG. Comments on the ultrastructure of human erythrocytes infected with P. malariae. Ann Trop Med Parasit 1970; 64:329-330.
- Aikawa M, Rabbege JR, Wellde BT. Junctional apparatus in erythrocytes infected with malarial parasites. Z Zellforsch U Mikruskop Anal 1972; 124:72-75.
- Sterling CR, Aikawa M, Nussenzweig RS. Morphological divergence in a mammalian malarial parasite: the fine structure of P. brasilianum. Proc Helminthol Soc Washington 1972; 39:109-129.
- Trager W, Rudzinska MA, Bradbury PC. The fine structure in P. falciparum and its host erythrocytes in natural malaria infection in man. Bull Wld Hlth Org 1966; 35:883-885.
- Desowitz RS, Miller LH, Buchanan RD, Permpanich B. The sites of deep vascular schizogony in P. coatneyi malaria. Trans R Soc Trop Med Hyg 1969; 63:198-202.
- Fremont HN, Miller LH. Deep vasculature schizogony in P. fragile: organ distribution and ultrastructure of erythrocytes adherent to vasculature endothelium. Am J Trop Med Hyg 1975; 24:1-8.
- Stanley HA, Mayes JT, Cooper NR, Reese RT. Complement activation by the surface of Plasmodium falciparum infected erythrocytes. J Mol Immunol 1984; 21:145-150.
- Langreth SG, Reese RT, Motyl M, Trager W. P. falciparum: loss of knobs on the infected erythrocytes surface after long-term cultivation. Exp Parasitol 1979; 48:213-219.
- Kilejian A. Characterization of a protein correlated with the production of knob-like protrusions on membranes of erythrocytes infected with Plasmodium falciparum. Proc Natl Acad Sci USA 1979; 76:4650-4653.
- Kilejian A, Sharma YD, Karoui H, NasLund L. Histidine-rich domain of the knob protein of the human malaria parasite Plasmodium falciparum. Proc Natl Acad Sci USA 1986; 83:7938-7941.
- Kilejian A, Rashid MA, Aikawa M, Aji T, Yang YF. Selective association of a fragment of the knob protein with spectrin, actin and the red cell membrane. Mol Biochem Parasitol 1991; 44:175-182.
- Cooke BM, Wahlgren M, Coppel RL. Falciparum malaria: sticking up, standing out and out-standing. Parasitol Today 2000; 16:416-420.
- Cooke BM, Mohandas N, Coppel RL. The malaria-infected red blood cell: structural and functional changes. Adv Parasitol 2001; 50:1-86.
- Cooke BM, Mohandas N, Coppel RL. Malaria and red blood cell membrane. Semin Hematol 2004; 41:173-188.
- Oh SS, Voigt S, Fisher D, Yi SJ, LeRoy PJ, Derick LH, Liu S, Chishti AH. Plasmodium falciparum erythrocyte membrane protein 1 is anchored to the actin-spectrin junction and knob-associated histidine-rich protein in the erythrocyte skeleton. Mol Biochem Parasitol 2000; 108:237-247.
- Magowan C, Nunomura W, Waller KL, Yeung J, Liang J, Van Dort H, Low PS, Coppel RL, Mohandas N. Plasmodium falciparum histidine-rich protein 1 associates with the band 3 binding domain of ankyrin in the infected red cell membrane. Biochem Biophys Acta 2000; 1502:461-470.
- Waller KL, Cooke BM, Nunomura W, Mohandas N, Coppel RL. Mapping the binding domains involved in the interaction between the Plasmodium falciparum knob-associated histidine-rich protein (KAHRP) and the cytoadherence ligand P. falciparum erythrocyte membrane protein 1 (PfEMP1). J Biol Chem 1999; 247:23808-23813.
- http://www.bioch.ox.ac.uk/aspsite/research/brochure/vakonakis/image001.png
- Ardeshir F, Flint JE, Matsumoto Y, Aikawa M, Reese RT, Stanley H. cDNA sequence encoding a Plasmodium falciparum protein associated with knobs and localization of the protein to electron-dense regions in membranes of infected erythrocytes. EMBO J 1987; 6:1421-1427.
- Sharma YD, Kilejian A. Structure of the knob protein (KP) gene of Plasmodium falciparum. Mol Biochem Parasitol 1987; 26:11-16.
- Rashid MA, Yang YF, Kiljian A. Expression, partial purification and immunogenecity of fragments of knob protein of Plasmodium falciparum. Mol Biochem Parasitol 1990; 38:48-56.
- Kant R, Sharma YD. Allelic forms of the knob associated histidine-rich protein gene of Plasmodium falciparum. FEBS Lett 1996; 380:147-151.
- Triglia T, Stahl HD, Crewther PE, Scanlon D, Brown GV, Anders RF, Kemp DJ. The complete sequence of the gene for the knob-associated histidine-rich protein from Plasmodium falciparum. EMBO J 1987; 6:1413-1419.
- Hirawake H, Kita K, Sharma YD. Variations in the C-terminal repeats of the knob-associated histidine-rich protein of Plasmodium falciparum. Biochemica et Biophysica Acta 1997; 1360:105-108.
- Crabb BS, Cooke BM, Reeder JC, Waller RF, Caruana SR, Davern KM, Wickham ME, Brown GV, Coppel RL, Cowman AF. Targeted gene disruption shows that knobs enable malaria-infected red cells to cytoadhere under physiological shear stress. Cell 1997; 18:287-296.
- Culvenor JG, Langford CJ, Crewther PE, Saint RB, Coppel RL, Kemp DJ, Anders RF, Brown GV. Plasmodium falciparum: identification and localization of a knob protein antigen expressed by a cDNA clone. Exp Parasitol 1987; 63:58-67.
- Pologe LG, Pavlovec A, Shio H, Ravetch JV. Primary structure and subcellular localization of the knob-associated histidine-rich protein of Plasmodium falciparum. Proc Natl Acad Sci USA 1987; 84:7139-7143.
- Taylor DW, Parra M, Chapman GB, Stearns ME, Rener J, Aikawa M, Uni S, Aley SB, Panton LJ, Howard RJ. Localization of Plasmodium falciparum knob-associated histidine-rich protein 1 in the erythrocyte skeleton under knobs. Mol Biochem Parasitol 1987; 25:165-174.
- Baruch DI, Pasloske BL, Singh HB, Bi X, Ma XC, Feldman M, Taraschi TF, Howard RJ. Cloning the P. falciparum gene encoding PfEMP1, a malarial variant antigen and adherence receptor on the surface of parasitized human erythrocytes. Cell 1995; 82:77-87.
- Baruch DI, Rogerson SJ, Cooke BM. Asexual blood stages of malaria antigens: cytoadherence. Chem Immunol 2002; 80:144-162.
- Barnwell JW, Asch A, Nachman RL, Yamaya M, Aikawa M, Ingravallo P. A human 88-kDa membrane glycoprotein (CD36) functions in vitro as a receptor. J Clin Invest 1989; 84:765-772.
- Barragan A, Spillmann D, Carlson J, Wahlgren M. Role of glycans in Plasmodium falciparum infection. Biochem Soc Transact 1999; 27:487-493.
- Berendt AR, Simmons DL, Tansey J, Newbold CL, Marsh K. Intercellular adhesion molecule-1 is an endothelial cell adhesion receptor for Plasmodium falciparum. Nature 1989; 341:57-59.
- Udeinya IJ, Miller LH, McGregor IA, Jensen JB. Plasmodium falciparum strain specific antibody blocks binding of infected erythrocytes to amelanotic melanoma cells. Nature 1983; 303:429-431.
- Singh B, Looareesuwan S, Mathai E, Warrell DA, Hommel M. Plasmodium falciparum: inhibition/reversal of cytoadherence of Thai isolates to melanoma cells by local immune sera. Clin Exp Immunol 1988; 72:145-150.
- Howard RJ, Barnwell JW, Rock EP, Neequaye J, Ofori-Adjei D, Maloy WL, Lyon JA, Saul A. Two approximately 300 kDa P. falciparum proteins at the surface membrane of infected erythrocytes. Mol Biochem Parasitol 1988; 27:207-224.
- Crabb RJ, Andrutis AT, Leech JH, Ellis WY, Cohen LA, Kirk KL. Inhibitory effects of histidine-analogues on growth and protein synthesis by Plasmodium falciparum in vitro. Biochem Pharmacol 1986; 35:1589-1596.
- David PH, Hommel M, Miller LH, Udeiya IJ, Oligino LD. Parasite sequestration in P. falciparum malaria: spleen and antibody modulation of cytoadherence of infected erythrocytes. Proc Natl Acad Sci USA 1983; 80:5075-5079.
- Singh B, Monsigny M, Hommel M. Amino-sugars inhibit the in vitro cytoadherence of P. falciparum infected erythrocytes to melanoma cells. Mol Biochem Parasitol 1987; 23:47-53.
- Carlson J, Holmquist G, Taylor DW, Perlmann G, Wahlgren M. Antibodies to a histidine-rich protein (PfHRP1) disrupts spontaneously formed P. falciparum erythrocytes rosettes. Proc Natl Acad Sci USA 1990; 87:2511-2515.
- ادریسیان غـلامحسین، رضائیان مصطفی، قربانی مهـدی، کشاورز حسین، محبعلی مهـدی. تــکیاختهشناسی پزشکی. انتشارات دانشگاه علوم پزشکی تهران، چاپ اول، 1386.
- Sharma YD. Genomic organization, structural and possible function of histidine-rich proteins of malaria parasites. Int J Biochem 1988; 20:471-477.
- Kilejian A. A unique histidine-rich polypeptide from the malaria parasites, Plasmodium lophurae. J Biol Chem 1974; 249:4650-4655.
- Kilejian A, Liao TH, Trager W. Studies on the primary structure and biosynthesis of a histidine-rich polypeptide from the malaria parasites, Plasmodium lophurae. Proc Natl Acad Sci USA 1975; 72:3057-3059.
- Kilejian A. Does a histidine-rich protein from Plasmodium lophurae have a fuction in merozoite penetration? J Protozool 1976; 23:272-277.
- Howard RJ, Uni S, Aikawa M, Aley SB, Leech JH, Lew AM, Wellems TW, Rener J, Taylor DW. Secretion of a malarial histidine-rich protein (PfHRP-II) from Plasmodium falciparum-infected erythrocytes. J Cell Biol 1986; 103:1269-1277.
- Stahl HD, Kemp DJ, Creuther PE, Scanlon DB, Woodrow G, Brown GV, Biano AE, Anders RF, Coppel RL. Sequence of a cDNA encoding a small polymorphic histidine and alanine-rich protein from Plasmodium falciparum. Nucleic Acids Res 1985; 13:7837-7846.
- Wellems TE, Rock EP, Maloy WL, Taylor DW, Howard RL. Histidine-rich proteins in Plasmodium falciparum: An update and prospective. In: Molecular Strategies of Parasite Invasion. UCLA Symposia on Molecular and Cellular Biology (Agabian N, Goodman H, Nogueira N, eds.), Vol. 42, pp. 47-58, Alan R. Liss. Inc., New York.
- Leech JH, Barnwell JW, Aikawa M, Miller LH, Howard R. Plasmodium falciparum malaria: Association of knobs on the surface of infected erythrocytes with a histidine-rich protein and the erythrocyte skeleton. J Cell Biol 1984; 98:1256-1264.
- Wellems T, Howard RJ. Homologous genes encode two distinct histidine-rich proteins in a cloned isolate of Plasmodium falciparum. Proc Natl Acad Sci USA 1986; 83:6065-6069.
- Corcoran LM, Forsyth KP, Bianco AE, Brown GV, Kemp DJ. Chromosome size polymorphisms in Plasmodium falciparum can involve deletions and are frequent in natural parasite populations. Cell 1986; 44:87-95.
روش لوری در اندازهگیری پروتئینها
تکنیکهای بررسی برهمکنشهای پروتئین- پروتئین در تحقیقات پروتئومیکس
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام