مروری بر ویتامین ها و اختلالات ناشی از کمبود و یا افزایش آنها
مراد رستمي: کارشناس ارشد بیوشیمی بالینی، دانشگاه علوم پزشكي جنديشاپور اهواز
معصومه جرفی: کارشناس ارشد میکروب شناسی، دانشگاه علوم پزشكي جنديشاپور اهواز
مواد غذایی موردنیاز بدن به 2 دستهی درشتمغذیها (Macronutrients) و ریزمغذیها (Micronutrients) تقسیمبندی میشوند. درشتمغذیها مانند کربوهیدراتها، لیپیدها، پروتئینها و … به مقادیر زیاد در جیره غذایی لازم هستند. ریزمغذیها به مقادیر کم (در حد میلیگرم و یا میکروگرم) در جیره غذایی لازم هستند و خود به دو دسته ویتامین ها و مواد معدنی تقسیم میشوند. ریزمغذیها در تولیدمثل، مقاومت به بیماریها، سلامتی به ویژه مادران و کودکان، افزایش قوه یادگیری و … نقش دارند. بیماریهای انگلی و عفونتها میتوانند موجب کاهش سطح ریزمغذیها در بدن شوند. ریزمغذیها را میتوان از طریق غذاها و یا مکملها دریافت نمود. کاهش سطح ریزمغذیها (Micronutrient deficiencies; MNDs) موجب کاهش سطح ایمنی بدن میشود.
| انواع مواد غذایی | نیاز روزانه | مثال | ||
| درشتمغذیها | کربوهیدراتها | |||
| لیپیدها | ||||
| پروتئینها | ||||
| ریزمغذیها | ویتامینها | محلول در آب | ویتامینهای خانواده B و C | |
| محلول در چربی | ویتامینهای A، D، E و K | |||
| مواد معدنی | میکرومینرالها | نیاز روزانه کمتر از 100 میلیگرم | I, Cu, Co, F, Mn, Cr, Se, Zn, Mo, Fe | |
| ماکرومینرالها | نیاز روزانه بیشتر از 100 میلیگرم | Ca, P, Na, K, Cl, Mg | ||
ویتامین ها
ویتامین ها، موادی از ترکیبات آلی هستند که به مقدار بسیار کم در جیره غذایی لازم میباشند. نام ویتامین نخستین بار در سال 1912 توسط سی. فونک (C. Funk) برای معرفی آمینهای زیستی، پیشنهاد شد. او با تخلیص ترکیبی آمیندار از برنج، آن را ویتامین (Vitamine) به معنی “آمین حیاتی” یا “آمین لازم برای زیست” نامید که این ماده، امروزه به ویتامین تیامین (B1) معروف است. پس از مطالعات بسیار در زمینه جداسازی و تخلیص انواع این ترکیبات، مشخص شد که همه این مواد، ترکیب آمیندار نبوده و لذا حرف e از آخر کلمه Vitamine، حذف و نام ویتامین (Vitamin) برای معرفی کلیه ترکیبات ضروری برای رشد و نمو، که بدون وجود آنها انجام اکثر واکنشهای بیوشیمیایی امکانپذیر نیست، به آنها اطلاق گردید.
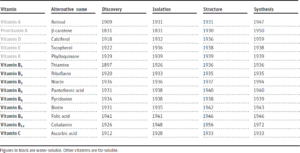
تاریخچه کشف ویتامین ها
طبقهبندی ویتامین ها
ویتامین ها به دو دسته محلول در آب و محلول در چربی، تقسیم میشوند که هر دو گروه، از نظر غذایی دارای ارزش یکسان میباشند. ویتامین های محلول در آب، به دلیل شرکت در واکنشهای آنزیمی، کوآنزیم نیز هستند. ویتامینها در سلولهای اکثر موجودات گیاهی، جانوری و میکروارگانیسمها وجود دارند. تمام ویتامین ها برای همه ردههای موجودات، لازم نیستند؛ مثلاً ویتامین C که در انسان، خوکچه هندی و میمون ضروری است، در برخی از موجودات، به علت وجود آنزیمهای لازم جهت سنتز آنها در بدن، نیازی به وجود آنها در جیره غذایی نیست.
| ویتامینهای محلول در آب | ویتامینهای محلول در چربی |
| بجز خاصیت حلالیت خود، مشترکات شیمیایی ناچیزی با یکدیگر دارند | تمامی این ویتامینها از خانواده ترپنها بوده و لذا از ایزوپرن مشتق میشوند |
| به راحتی جذب و دفع میشوند | جذب و دفع پیچیدهتری دارند |
| عموماً در بدن ذخیره نمیشوند | میزان ذخیرهسازی بالایی دارند |
| مصرف بیش از حد آنها در اکثر موارد، مسمومیتهای مشکلساز ایجاد نمیکند | مسمومیت با مقادیر بالای این گروه از ویتامینها، عموماً دردسرساز است |
مصرف بیش از حد ویتامینها موجب عارضه هیپرویتامینوز (Hypervitaminosis) و کاهش میزان آنها در جریان خون، موجب عارضه آویتامینوز (Avitaminosis) میشود.
ویتامین های محلول در آب
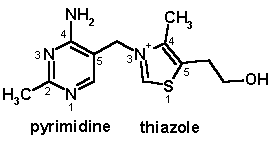
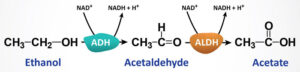
1- تیامین (B1):
این ویتامین در پوشش بیرونی دانهها و بسیاری از گیاهان یافت میشود. غلات، منابع بسیار غنی از این ویتامین هستند. نخستین بار به عنوان عامل اصلی ضد بیماری بریبری (Beriberi) کشف شد. میزان RDA آن برای مردان 1/2 و برای زنان 1/1 میلیگرم میباشد.
تیامین پیروفسفات (TPP)، شکل کوآنزیمی این ویتامین میباشد که در دکربوکسیلاسیون اکسیداتیو و ترانسکتولاسیون نقش دارد. جایگاه فعال TPP، کربن شماره 2 حلقه تیازول بوده که میتواند به راحتی پروتون از دست داده و به صورت یون کربانیون درآید.
کمبود آن موجب بریبری (بریبری کودکان، بریبری خشک و بریبری مرطوب)، ادم (مرطوب)، بیاشتهایی، کاهش وزن، بیحسی (Apathy)، کاهش حافظه کوتاه، گیجی (Confusion)، تحریکپذیری، ضعف عضلانی و قلب بزرگ (Enlarged heart) میشود. کمبود B1 در الکلیها شایع است.
برای ارزیابی کمبود تیامین، از فعالیت ترانسکتولازی گلبولهای قرمز و غلظت ادراری و خونی آن استفاده میشود.
2- ریبوفلاوین (B2):
ریبوفلاوین یا ویتامین B2، توسط گیاهان سبز و بسیاری از باکتریها و قارچها سنتز میشود. جانوران توانایی سنتز این ویتامین را ندارند و بنابراین باید در جیره غذایی آنها حضور داشته باشد. بافت جگر یکی از منابع مهم جانوری ریبوفلاوین است. ریبوفلاوین از نظر ساختاری شامل یک قند 5 کربنی به نام D- ریبیتول و یک مشتق فلاوین است. این ویتامین به شکلهای کوآنزیمی FMN و FAD وجود داشته و در واکنشهای اکسیداسیون و احیاء شرکت مینماید. ریبوفلاوین رنگدانهای فلورسنت است که در برابر گرما نسبتاً پایدار است، اما در حضور نور مرئی تخریب میشود. میزان RDA آن برای مردان 1/3 و برای زنان 1/1 میلیگرم میباشد.
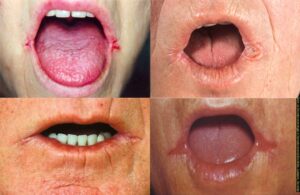
کمبود ویتامین B2 موجب احتقان (Hyperemia)، ادم غشاهای موکوسی دهان، کیلوزیس (Cheilosis) (زخمی شدن و پوستهریزی خشک در سطح لبها و گوشه دهان)، شقاق مخاط دهان (Angular stomatitis)، التهاب زبان (Glositis)، زبان سرخابی (magenta tongue)، درماتیت سبوروئیک و آنمی نرموکرومیک- نرموسیتیک میشود.
به علت حساسیت بالای این ویتامین به نور مرئی، احتمال کمبود آن در نوزادان دچار هیپربیلیروبینمی که تحت نوردرمانی هستند، وجود دارد.
از فعالیت گلوتاتیون ردوکتاز گلبولهای قرمز، برای ارزیابی وضعیت ریبوفلاوین استفاده میشود.
3- نیکوتین آمید (B3):
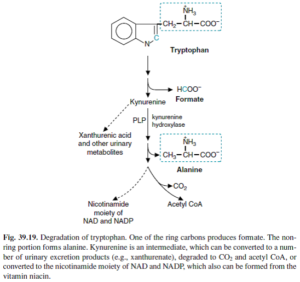
این ویتامین که به نیاسین نیز معروف است، در گیاهان و جانوران به وفور یافت میشود. فرآوردههای گوشتی، منابع بسیار غنی این ویتامین هستند. حدود دو سوم نیاز ما به این ویتامین از تریپتوفان تأمین میشود. میزان RDA آن برای مردان 16 و برای زنان 14 میلیگرم میباشد. میزان UL آن نیز 35 میلیگرم است.
نیکوتین آمید نیز به شکلهای کوآنزیمی NAD و NADP وجود دارد که در واکنشهای اکسیداسیون- احیاء نقش دارند.
نیاسین از اسیدآمینه تریپتوفان در بدن نیز تولید میشود.
کمبود نیاسین موجب پلاگر میشود که علائم آن راشهای پیگمانته در نواحی در معرض نور خورشید بدن (Dermatitis) به ویژه صورت و دستها، اسهال و دمانس میباشد. برای ایجاد سندروم پلاگر، فرد باید دچار فقر غذایی شدید از نظر نیاسین و تریپتوفان شود که این کمبود همزمان، اغلب در جمعیتهایی محقق میشود که غذای اصلی آنها ذرت باشد. نیاسین موجود در ذرت به صورت متصل و غیرقابل دسترس است که تنها با اضافه کردن قلیا به دانههای ذرت آزاد میشود. وابستگی غذایی به ذرت خوشهای (Sorghum) نیز موجب پلاگر میشود، اما در این مورد کمبود تریپتوفان مشکلساز نیست، بلکه محتوای زیاد لوسین با مهار آنزیم کینولینات فسفوریبوزیل ترانسفراز (QPRT) که از آنزیمهای کلیدی تبدیل تریپتوفان به NAD+ است، دردسرساز میشود.
B6 در مسیر ساخت NAD+ از تریپتوفان، نقش کوآنزیمی دارد، لذا کمبود ویتامین B6 میتواند موجب تشدید پلاگر شود. داروهایی مانند ایزونیازید (با اتصال به B6 و تسریع دفع آن)، سندروم کارسینوئید بدخیم (تبدیل بخش عمده تریپتوفان به سروتونین) و بیماری هارتناپ (اختلال در جذب اسید آمینه تریپتوفان) میتوانند از شرایط ایجادکننده پلاگر باشند.
اسید نیکوتینیک در دوزهای بالا میتواند با کاهش آزادسازی اسیدهای چرب از بافت چربی و در نتیجه، کاهش ساخت لیپوپروتئینهای حاوی کلسترول (LDL، IDL و VLDL)، به عنوان دارویی برای کاهش میزان کلسترول پلاسما مورد استفاده قرار گیرد. البته دریافت مقادیر بالای اسید نیکوتینیک میتواند به کبد آسیب برساند.
4- ویتامین B6:
جگر، آناناس، گوشت، سبزیجات و تخممرغ، منابع خوبی از ویتامین B6 میباشند.
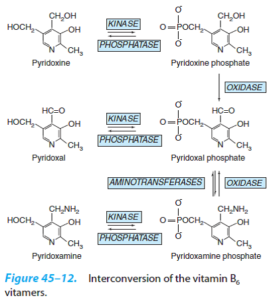
ترکیبات پیریدوکسال، پیریدوکسامین و پیریدوکسین به ویتامین گروه B6 تعلق دارند. ویتامین B6 دارای توزیع فراوان در طبیعت میباشد. شکل کوآنزیمی این ترکیبات، دارای گروه فسفات میباشد. پیریدوکسال فسفات (PLP)، در کاتالیز واکنشهای مربوط به متابولیسم اسیدهای آمینه نقش دارد. از مهمترین آنزیمهای مربوط به این کوآنزیمها، آمینوترانسفرازها را میتوان نام برد. گروه فعال این کوآنزیمها، بخش آلدئیدی پیریدوکسال و یا بخش الکلی پیریدوکسین میباشد. PLP با اتصال به آنزیم فسفریلاز، در گلیکوژنولیز همکاری دارد. فسفریلاز عضلانی ممکن است تا 80- 70 درصد کل ویتامین B6 بدن را با خود همراه داشته باشد.
میزان RDA آن برای مردان و زنان 1/3 میلیگرم میباشد. میزان UL آن نیز 100 میلیگرم است.
کمبود ویتامین B6 موجب التهاب پوست و اختلالات دستگاه عصبی میشود. کمبود ویتامین B6 در شیردهی، الکلیسم و یا در طی درمان با ایزونیازید ممکن است ایجاد شود. در الکلیها، متابولیسم اتانول به استالدئید موجب تحریک تجزیه این کوآنزیم میشود.
ایزونیازید با اتصال به ویتامین B6 و تسریع دفع آن، باعث کاهش B6 میشود. کمبود ویتامین B6 موجب افزایش دفع یکی از متابولیتهای تریپتوفان به نام گزانتورنات در ادرار میشود.
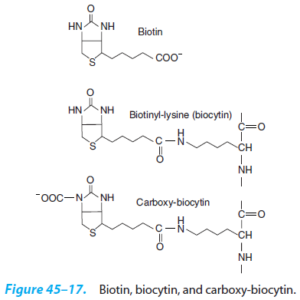
5- بیوتین (H):
بیوتین (H)، توزیع گستردهای در میان غذاهای طبیعی دارد. بخش زیادی از نیاز روزانه ما به این ویتامین، از طریق باکتریهای همزیست رودهای (نرمال فلور) تأمین میگردد و لذا کمبود آن عمدتاً ناشی از کمبود غذایی نبوده و در اغلب موارد، مشکلی در مصرف و بکارگیری آن وجود دارد. آویدین (Avidin) موجود در سفیده تخممرغ که یک پروتئین ناپایدار در برابر حرارت میباشد، با ایجاد یک اتصال محکم به بیوتین، مانع جذب آن در روده میشود.
شکل کوآنزیمی بیوتین، یک گروه پروستتیک است که به طور کووالانسی به وسیله پیوند آمیدی به گروه آمینو ε یک واحد لیزین اختصاصی آپوآنزیم متصل میشود. کمپلکس ویتامین با گروه لیزیل، بیوسیتین (Biocytin) نامیده میشود. بیوسیتین واکنشهای کربوکسیلاسیون را کاتالیز میکند.
فقدان کامل آنزیم هولوکربوکسیلاز سنتتاز که بیوتین را به جزء لیزین پروتئین حامل بیوتین متصل مینماید، باعث کمبود ثانویه عملکرد ویتامین بیوتین شده و موجب ایجاد کمبودهای متعدد فعالیت کربوکسیلازی میشود. میزان RDA بیوتین برای مردان و زنان 30 میکروگرم میباشد.
کمبود بیوتین موجب افسردگی، توهم، درد عضلانی و درماتیت میشود. در موارد کمبود عملکرد ویتامین بیوتین، سوبسترای آنزیمهای وابسته به بیوتین (لاکتات، β- متیلکرومات، β- هیدروکسی ایزووالرات و β- هیدروکسی پروپیونات) را میتوان در ادرار یافت.
6- اسید پانتوتنیک (B5):
این ویتامین در طبیعت بسیار فراوان است. شکلهای کوآنزیمی اسید پانتوتنیک، کوآنزیمآ (CoA) و پروتئین حامل آسیل (ACP) میباشند. CoA از اتصال یک ترکیب تیولدار (Cysteamine) β- مرکاپتواتیل آمین به انتهای اسیدی و یک ترکیب نوکلئوتیدی به انتهای هیدروکسیل آن حاصل میشود. این کوآنزیم در واکنشهای استیلاسیون شرکت میکند. در اثر اتصال عامل استیل به کوآنزیمآ، استیل کوآنزیمآ به وجود میآید که در انجام فرآیندهای متابولیسمی نقش بسیار مهمی دارد. میزان RDA پانتوتنیک برای مردان و زنان 5 میلیگرم میباشد.
کمبود اسید پانتوتنیک به علت توزیع گسترده آن در غذاهای گوناگون نادر است. کمبود اسید پانتوتنیک موجب توقف رشد و بروز اختلالاتی در دستگاه گوارش و کلیهها میشود. سندروم “پای در حال سوختن” (Burning foot syndrome) (Grierson-Gopalan syndrome) را به کمبود این ویتامین نسبت میدهند.
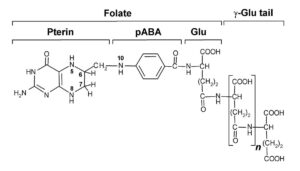
7- اسید فولیک:
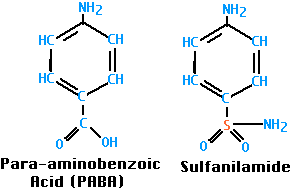
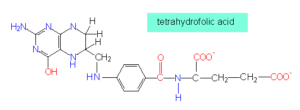
اسید فولیک نخستین بار از برگ اسفناج به دست آمد و نام آن از کلمه “فولیوم” به معنی برگ، گرفته شده است. فولاسین یک اصطلاح عمومی است که به اسید فولیک و سایر موادی که دارای فعالیت بیوشیمیایی اسید فولیک هستند، اطلاق میگردد. اسید فولیک از 3 بخش اصلی شامل یک مشتق پتریدینی، پاراآمینوبنزوئیک اسید (PABA) و اسید گلوتامیک ساخته شده است. اسید فولیک در گیاهان به صورت کنژوگه با یک گلوتامات و در کبد به صورت کنژوگه با پنتاگلوتامیل نگهداری میشود. میزان RDA فولات برای مردان و زنان 400 میکروگرم میباشد.
داروهای سولفونامیدی با رقابت با PABA، موجب کاهش تولید اسید فولیک در باکتری و مرگ آنها میشود.
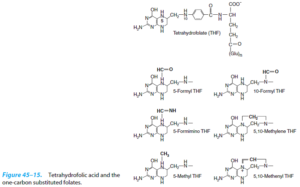
شکل کوآنزیمی اسید فولیک، حالتی است که به N5، C6، C7 و N8 آن، هیدروژن متصل شده باشد که این ترکیب، تتراهیدروفولات (THF یا HF4) نام دارد. مشتقات غذایی اسید فولیک توسط آنزیمهای رودهای به فرم منوگلوتامیل فولات شکسته شده و جذب میشوند. بخش عمدهای از این ترکیب توسط آنزیم فولاتردوکتاز سلولهای رودهای با کمک NADPH، تبدیل به تتراهیدروفولات میگردد.
THFدر واکنشهای آنزیمی به عنوان حامل حدواسط یک ترکیب کربنی مانند -CH2، -CHO، -CH=NH و … عمل مینماید. N5 و N10 گروههای فعال ملکول هستند که با اتصال ترکیبات فوق به خود، آنها را از ترکیبی به ترکیب دیگر منتقل نموده و یا از ترکیبی برمیدارند.
سرین به عنوان منبع اصلی واحدهای یک کربنی، در ارتباط با TH4، گروه متیلن خود را به TH4 داده و آن را به N5 و N10– متیلن تترا هیدروفولات که نقشی محوری در متابولیسم واحدهای یک کربنه برعهده دارد، میتواند به فرم متیل احیا شود و در تبدیل هموسیستئین به متیونین با عمل کوآنزیمی ویتامین B12 شرکت نماید. N5 و N10– متیلن تتراهیدروفولات میتواند به فرم متنیل اکسید شود که از هیدراته شدن آن، فرمهای N10– فرمیل تتراهیدروفولات و یا N5– فرمیل تتراهیدروفولات حاصل میآید.
N5– فرمیل تتراهیدروفولات ساختاری پایدار بوده و به اسید فولینیک مشهور است. از این فرم اسید فولیک میتوان برای برای تجویز دارویی فولات احیا شده استفاده نمود.
کمبود فولات موجب آنمی مگالوبلاستیک میشود. اسید فولیک برای متیلاسیون و تولید زیرواحدهای DNA مانند تیمین ضروری میباشد و از این رو، کمبود آن امکان تقسیم سلولی را از بین میبرد و در نتیجه، سلولها افزایش حجم پیدا کرده و امکان تقسیم پیدا مینمایند.
مهارکنندهای آنزیم فولاتردوکتاز نیز در واقع شرایط کمبود اسید فولیک را ایجاد میکنند. تریمتوپریم با مهار اختصاصی فولات ردوکتاز باکتریایی، باعث مرگ باکتریهای گرم منفی میگردد و لذا نقش آنتیبیوتیکی دارد.
متوترکسات با تأثیر بر فولاتردوکتاز انسانی، امکان تقسیم سلولهای سرطانی را از آنها میگیرد. با توجه به تعاملات ویتامین B12 و فولات در واکنش متیونینسنتاز، کمخونی ناشی از کمبود ویتامین B12 را میتوان با مصرف فولات اضافی در غذا درمان نمود، اما هموسیستئینوری، متیلمالونیک اسیدوری و یا اختلالات عصبی بدین گونه درمان نمیشوند.
تجویز روانه 400 میکروگرم اسید فولیک در حوالی دوره لقاح به میزان قابلتوجهی احتمال بروز نقایص لوله عصبی مانند اسپینابیفیدا را کاهش میدهد.
8- ویتامین B12 (کوبالامین):
ویتامین B12 منحصراً در سلولهای جانوری و میکروارگانیسمها یافت شده و سلولهای گیاهی، فاقد آن هستند. حیوانات گوناگون با ایجاد همزیستی رودهای با این میکروارگانیسمها، این ویتامین را کسب مینمایند و لذا اجزاء غذایی حاصل از آنها و به ویژه کبد این حیوانات حاوی متیلکوبالامین، آدنوزیلکوبالامین و هیدروکسیکوبالامین میباشند. ساختار این ویتامین شامل حلقهای پیچیده (حلقه کورین) است که شباهت بسیار به حلقه پورفیرینی دارد؛ با این تفاوت که در مرکز آن، یون کبالت (Co) قرار دارد و به علت این که سیانید (CN)، یکی از کوئوردیناتهای کبالت را اشغال میکند، به سیانوکوبالامین نیز معروف است. فرم تجاری ویتامین B12 به صورت سیانوکوبالامین در دسترس میباشد. میزان RDA آن برای مردان و زنان 2/4 میکروگرم میباشد.
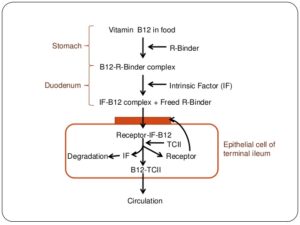
جذب ویتامین B12 در انسان پیچیده است. ویتامین B12 در غذا به صورت متصل به پروتئینها وجود داشته که در حضور غلظت بالای هیدروکلریک اسید معده، از آنها جدا میگردد. این روند، منجر به تشکیل ویتامین B12 آزاد شده که بلافاصله به مخلوطی از گلیکوپروتئینها که به وسیله غدد معدی و بزاقی ترشح میشـــــــــوند، متصل میگردد. این گلیکوپروتئینها، R-binders (haptocorrins) نامیده میشوند که ویتامین B12 را از دناچوراسیون شیمیایی در معده، محافظت میکنند. سلولهای پاریتال (parietal cells) (کناری) معدی که مسئول ترشح HCL هستند، گلیکوپروتئینی به نام فاکتور داخلی (Intrinsic factor;IF) نیز ترشح میکنند. IF به ویتامین B12 متصل شده و سرانجام آن را برای جذب شدن آماده مینماید.
در pH اسیدی معده، تمایل (Affinity) IF برای ویتامین B12 پایین بوده؛ در حالی که این تمایـــــــــل برای R-binderها بالا میباشد. هنگامی که محتویات معده وارد دئودنوم میشوند، R-binderها تا حدودی به وسیله پروتئازهای پانکراتیک هضم شده و ویتامین B12 متصل به آنها، آزاد میگردد. چون pH دئودنوم نسبت به pH معده، خنثیتر است، IF در این pH دارای تمایل بالایی برای ویتامین B12 بوده و با اتصال به ویتامین B12، R-binderها نیز آزاد میگردند. کمپلکس B12-IF به انتهای روده باریک رسیده که در آن جا توسط فاگوسیتوز به وسیله رسپتورهای ایلئوم اختصاصی جذب میگردد. پس از جذب در روده، ویتامین B12 به یکی از پروتئینهای پلاســـما به نام ترانسکوبالامین (Transcobalamin; TC) متصل میشود. ترانسکوبالامین II (TC-II) برای انتقال ویتامین به بافتها و TC-I برای ذخیره آن در کبد کاربرد دارد. ویتامین B12، تنها ویتامین محلول در آب است که در کبد ذخیره میگردد.
در شکل کوآنزیمی ویتامین B12، عامل سیانید به وسیله گروه 5-داکسیآدنوزین جایگزین میگردد. کوآنزیم B12 بسیار ناپایدار بوده و در مجاورت نور و یا در حضور سیانید، به شکل ویتامینی خود تبدیل میگردد. نقش اصلی این کوآنزیم، شکستن ملکول و ایجاد جایگزینی درون آن در واکنشها است.
متیلکوبالامین و دزوکسیآدنوزیلکوبالامین، کوآنزیمهای فعال B12 میباشند. ویتامین B12 پس از انتقال در خون به صورت هیدروکسیکوبالامین وارد سیتوزول سلولها شده و در آن جا به متیلکوبالامین تبدیل میشود و یا وارد میتوکندری شده و به 5-دزوکسی آدنوزیلکوبالامین تبدیل میشود.
دزوکسیآدنوزیلکوبالامین، کوآنزیم تبدیل متیلمالونیلکوآ به سوکسینیلکوآ میباشد. در این واکنش، پروپیونات در نهایت به سوکسینیلکوآ (یکی از اعضای چرخه کربس) تبدیل شده که در فرآیند گلوکونئوژنز دارای اهمیت میباشد.
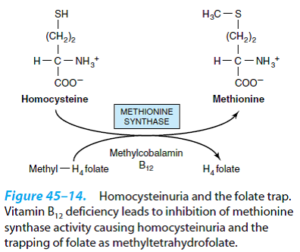
متیلکوبالامین، کوآنزیم دو واکنش توأم 1- تبدیل هموسیستئین به متیونین و 2- تبدیل متیل تتراهیدروفولات به تتراهیدروفولات میباشد. در این واکنش، گروه متیل کوآنزیم متیلکوبالامین به هموسیستئین منتقل شده و به این ترتیب متیونین ساخته میشود. از طرفی، کوبالامین با برداشت متیل از N5– متیلتتراهیدروفولات، آن را به تتراهیدروفولات تبدیل میکند. بدین ترتیب، ذخایر متیونین حفظ شده و تتراهیدروفولات برای ساخت پورینها، پیریمیدینها و اسیدهای نوکلئیک به کار میرود.
کمبود ویتامین B12 منجر به آنمی مگالوبلاستیک میشود که در این حالت، ساخت DNA مختل شده و لذا تقسیم هسته با وجود رشد سیتوپلاسمی، روی نمیدهد. کمبود ویتامین B12 موجب مهار فعالیت متیونین سنتاز (و عدم تبدیل هموسیستئین به متیونین) و هموسیستئینوری و به دام افتادن متیل تتراهیدروفولات میشود. کمبود نسبی متیونین و نقص در متیلاسیون میتواند منجر به نقایص عصبی شود. همچنین در کمبود B12، به دلیل اختلال در تبدیل متیل مالونیلکوآ به سوکسینیلکوآ، متیلمالونیک اسیدوری به وجود میآید.
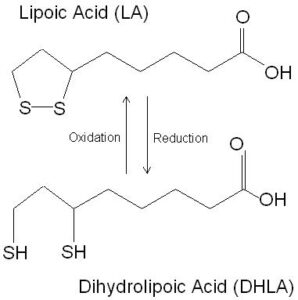
8- اسید لیپوئیک (Thioctic acid; Lipoic acid):
اسید لیپوئیک یک ویتامین کاذب است که به علت نقش کوآنزیمی خود در این گروه قرار میگیرد. این ترکیب توسط بدن تولید شده و نیازی به وارد شدن از طریق رژیم غذایی به بدن نیست. در ساختار اسیدلیپوئیک، 2 گروه تیول (-SH) شرکت دارند که میتوانند به دو شکل اکسید و احیاء دیده شوند. شکل کوآنزیمی آن از اتصال ویتامین به یک واحد لیزیل آپوآنزیم حاصل میشود. این کوآنزیم در واکنشهای انتقال گروه آسیل شرکت میکند.
9- اسید آسکوربیک:
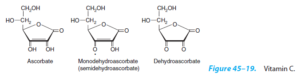
اسید آسکوربیک یا ویتامین C در بافتهای همه جانوران و گیاهان عالی وجود دارد. در اکثر پستانداران، ویتامین C از گلوکز تولید میشود، اما در پریماتها و از جمله انسان و نیز در تعداد دیگری از حیوانات، فقدان آنزیم گولونولاکتون اکسیداز مانع از تولید ویتامین C میگردد. این ویتامین به عنوان کوفاکتور برخی آنزیمها مانند پرولینهیدروکسیلاز عمل کرده و موجب تولید 4-هیدروکسیپرولین میشود. هیدروکسیپرولین از اسیدهای آمینه نادر است که به مقدار زیاد در ساختار کلاژن وارد میشود.
اسید آسکوربیک به عنوان دهنده هیدروژن و احیا کننده در واکنشهای اکسیداسیون- احیا شرکت میکند.
برخی از فعالیتهای اسید آسکوربیک در زیر آورده شده است:
1- ساخت کلاژن (برای هیدروکسیلاسیون پرولین و لیزین)
2- تجزیه تیروزین: (اکسیداسیون پاراهیدروکسی فنیل پیروات به هموژانتیزات با کمک مس و مرحله بعدی تجزیه، با کمک هموژانتیزات دیاکسیژناز و آهن که هر دو نیازمند ویتامین C هستند.)
3- تولید اپینفرین از تیروزین (برای فعالیت دوپامین β-هیدروکسیلاز)
4- تولید اسیدهای صفراوی (برای فعالیت 7-α-ردوکتاز)
5- تولید هورمونهای استروئیدی در قشر غده فوقکلیه
6- جذب آهن
7- نقش آنتیاکسیدانی عمومی
ویتامین C در موارد زیر نقش دارد:
- ضروری برای استخوانها، دندانها و لثهها
- کمک به بهبود زخم
- تقویت سیستم ایمنی و مبارزه علیه عفونتهای باکتریال
مادران باردار (نیاز به افزایش جذب آهن و تقویت سیستم ایمنی) و کودکان (تقویت سیستم ایمنی)، ویتامین C بیشتری نیاز دارند. میزان RDA آن برای مردان 90 و برای زنان 75 میلیگرم میباشد. میزان UL آن نیز 2 گرم میباشد.
کمبود اسید آسکوربیک موجب اختلالاتی در سنتز کلاژن و بیماریهای بافت همبند میشود. کاهش شدید ویتامین C موجب اسکوروی (Scurvy) میشود. در کمبود ویتامین C و به دلیل اختلال در ساخت کلاژن ممکن است علائم کبودی و خونریزیهای زیرپوستی، ضعف عضلانی، مفاصل متورم و دردناک، خونریزی لثهها و متورم شدن آنها، سستی دندانها، به آسانی سرماخوردن، شکستگی استخوانها، بهبودی کند زخمها و شکستگیها، از دست دادن اشتها، ضعف، خستگی و تحریکپذیری مشاهده شود. اسکوروی با مصرف میوهها و سبزیهای تازه درمان میشود. اندوخته طبیعی ویتامین C برای جلوگیری از اسکوروی، تا 4- 3 ماه کافی میباشد.
ویتامینهای محلول در چربی
1- ویتامین A:
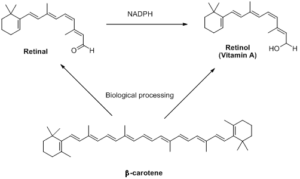
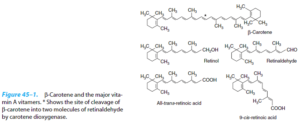
ویتامین A یا رتینول یک ترکیب ایزوپرنوئیدی است که در بینایی و کنترل رشد و نمو نقش دارد. این ویتامین در گیاهان یافت نمیشود، بلکه بسیاری از گیاهان حاوی ترکیبات ایزوپرنی به نام کاروتنوئید هستند که در بدن جانوران به ویتامین A تبدیل میشود. اعمال عمده ویتامین A در بدن توسط فرمهای رتینول، رتینال و اسید رتینوئیک انجام میگیرد. β- کاروتن، پروویتامین ویتامین A میباشد. β- کاروتن رنگدانهای زرد بوده و شامل دو ملکول رتینال چسبیده از سر آلدئیدی زنجیرهها به همدیگر میباشد. β- کاروتن مصرف شده در غذا از طریق آنزیم β- کاروتن دیاکسیژناز، تجزیه اکسیداتیو میگردد و تبدیل به دو ملکول رتینال میگردد. رتینال در مخاط روده با کمک آنزیم رتینالدئیدردوکتاز و با مصرف NADPH، احیا شده و به رتینول تبدیل میشود.
میزان RDA آن برای مردان 900 و برای زنان 700 میکروگرم میباشد. میزان UL آن نیز3000 میکروگرم میباشد.
ویتامین A در کبد ذخیره شده و برای آزاد شدن به پروتئینهایی خاص متصل میگردد. ویتامین A در کبد، به صورت استری در نوعی لیپوسیت موسوم به سلولهای ستارهای که در فضای اطراف سینوزوئیدهای کبدی قرار دارند، ذخیره میشود. رتینول برای انتقال به بافــتها، ابتدا هیدرولیز شده و سپس به یک پروتئین حامل به نام پروتئین متصل به آپورتینول (Aporetinol-binding protein;RBP) متصل میشود. به ترکیب ویتامین A و RBP، “هولو RBP” اطلاق میگردد. سلولها با برداشت هولو RBP، ویتامین A را از آن استخراج مینمایند و رتینول پس از ورود به سلولهای غیرکبدی به پروتئین متصلشونده به رتینول (Cellular retinol binding protein) متصل میشود.
مسمومیت با ویتامین A زمانی ایجاد میشود که ظرفیت RBP پلاسما اشباع شود و سلولها در معرض رتینول آزاد قرار گیرند. غلظت بالای ویتامین A دارای اثر تراتوژنیک میباشد، بنابراین باید در طی دوران بارداری از مصرف موادی مانند جگر که دارای مقادیر بالایی از ویتامین A هستند، خودداری نمود. کودکان 6 ماهه تا 6 ساله به منظور رشد سالم نیاز بیشتری نسبت به سایر گروهها به ویتامین A دارند.
رتینول متصل به CREB و همچنین اسید رتینوئیک، دارای گیرندههایی در هسته بوده و احتمالاً در کنترل بروز برخی از ژنها مؤثر هستند، لذا این دو فرم از ویتامین A همانند استروئیدها رفتار میکنند. اسید رتینوئیک در ساخت فسفولیپیدهای سورفاکتانت دخالت دارد.
در سلولهای بینایی، 11-سیسرتینال با اوپسین ترکیب شده و ردوپسین را میسازد. جذب نور توسط ردوپسین، فرآیندهای فتوشیمیایی را فعال کرده و موجب ایزومریزاسیون 11-سیسرتینال به ترانسرتینال و جدایی اپسین میشود. این واکنش با ایجاد تغییرات در شکلهای فضایی و با دخالت نوعی G-پروتئین به نام ترانسدوسین و تجزیه cGMP، موجب کاهش نفوذپذیری غشاء به Na+ و در نتیجه، افزایش پلاریزاسیون غشاء سلولهای شبکیه شده و زمینهساز ایجاد یک پیام عصبی میگردد. ایجاد پیام عصبی در سلولهای شبکیه، مکانیسمی متفاوت با دیگر نرونها دارد.
اسید رتینوئیک در ساخت گلیکوپروتئینها شرکت مینماید. رتینوئیدها و کاروتنوئیدها دارای فعالیت ضدسرطانی هستند.
کمبود ویتامین A (VAD) موجب شبکوری، کوری نسبی یا کامل، کراتینیزه شدن و افت ترشحات بافتهای مخاطی، خشکی چشم و تضعیف سیستم ایمنی میشود. کمبود ویتامین A در کودکان، آنها را در مقابل عفونتهای شایع دوران کودکی مانند سرخک، مالاریا، آنفلوانزا، سرماخوردگی و اسهال، حساستر میسازد. کودکان دارای VAD، میزان مرگومیر بیشتری در نتیجه کاهش سطح ایمنی بدن دارند. این کودکان دارای وزنگیری کمتر، رشد کم و کاهش آهن بدن میباشند. زنان حامله دارای VAD نیز با وزنگیری پایین در طی حاملگی و تولد نوزادان با وزن کم، درگیر هستند. زنان HIV مثبت دارای VAD، احتمال بیشتری در انتقال ویروس HIV به نوزادان خود دارند.
اثر آنتیاکسیدانی β- کاروتن بیشتر مربوط به مکانهایی است که فشار سهمی O2 پایینی دارند.
2- ویتامینD:
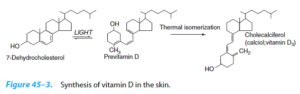
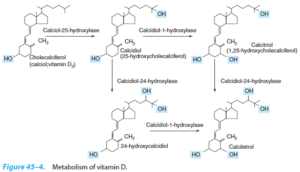
این ویتامین در روغن ماهی، زرده تخممرغ و جگر به خوبی یافت میشود. ویتامین D علاوه بر ساختار ایزوپرنوئیدی، دارای ساختار استروئیدی نیز میباشد. در انسان، مهمترین شکل ویتامین D که در جذب کلسیم و فسفر شرکت میکند، ویتامین D3 (کولهکلسیفرول) و D2 (ارگوکلسیفرول) است. ویتامین D3 در پوست از 7-دهیدروکلسترول تحت اثر نور UV ساخته میشود.
پس از سنتز و یا جذب از طریق رودهها، در کبد و سپس در کلیهها هیدروکسیله شده و به شکل فعال خود، 1 و 25-دیهیدروکسی کوله کلسیفرول (D3)، تبدیل میشود.
میزان RDA ویتامین D برای مردان و زنان 5 میکروگرم (در غیاب نور خورشید) میباشد. میزان UL آن نیز 50 میکروگرم است.
ویتامین D همانند ویتامین A، اعمال خود را با فعال کردن ژنهای خاصی در هسته انجام میدهد. ویتامین D در تمایز سلولی و عملکرد سیستم ایمنی هم تأثیرگذار است.
کمبود ویتامین D موجب رشد نابهنجار استخوانها و ایجاد ریکتز در کودکان، راشیتیسم در بزرگسالان و پوکی استخوان در خانمها و افراد مسن میشود.
مشخصه هیپرویتامینوز D، غلظت زیاد کلسیم خون و کلسیفیکاسیون بافتهای نرم میباشد.
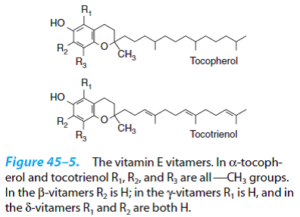
3- ویتامین E:
ویتامین E یا توکوفرول، نخستین بار از روغنهای گیاهی جدا شد و نام آن از کلمه یونانی Tokos به معنی “جوانی” گرفته شده است. ویتامین E دارای خاصیت آنتیاکسیدانی بوده و از اکسیداسیون اسیدهای چرب اشباع نشده در مجاورت اکسیژن، جلوگیری مینماید. ویتامین E دارای فرمهای مختلفی (α، β، γ، δ و …) بوده که فرم α- توکوفرول، بیشترین توزیع طبیعی و بالاترین فعالیت زیستی را در میان دیگر فرمهای آن دارا میباشد.
میزان RDA ویتامین E برای مردان و زنان 15 میلیگرم میباشد. میزان UL آن نیز 1 گرم است.
ویتامین E دارای اثر همافزایی با سلنیوم میباشد. اثر آنتیاکسیدانی ویتامین E بیشتر مربوط به مکانهایی است که فشار سهمی O2 بالایی دارند. کمبود ویتامین E موجب کمخونی و اختلالات جنسی میشود.
4- ویتامین K:
ویتامین K به 3 شکل K1، K2 و K3 دیده میشود و مهمترین اثر آن در مکانیسم انعقاد خون میباشد. از آن جایی که این ویتامین در سلولهای باکتریایی و گیاهی نیز وجود دارد، به نظر میرسد که دارای فعالیتهای دیگر نیز باشد.
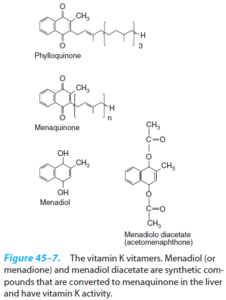
K1 (فیلوکینون): فرم اصلی ویتامین K در گیاهان است.
K2 (مناکینون): در بافتهای حیوانی وجود دارد و توسط باکتریهای رودهای تولید میشود.
K3 (منادیون): فرم صناعی ویتامین K میباشد (این فرم از ویتامین K، محلول در آب است و برای جذب آن نیازی به نمکهای صفراوی نیست). اگرچه ویتامین K در کبد ذخیره میشود، اما محتوای کبدی آن اندک بوده و میزان آن به سرعت کاهش مییابد.
میزان RDA ویتامین K برای مردان 120 و برای زنان 90 میکروگرم میباشد.
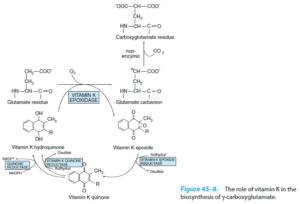
ویتامین K به عنوان کوفاکتور آنزیم کربوکسیلاز، با γ- کربوکسیلاسیون پیشسازهای پروتئینی تعدادی از فاکتورهای انعقادی (II، VII، IX و X)، زمینه تولید پروتئینهای بالغ را فراهم میسازد.
وارفارین به عنوان آنتاگونیست ویتامین K عمل نموده و با مهار واکنش اپوکسیدردوکتاز، مانع تشکیل فرم کینون میشود و بدینترتیب، موجب افزایش زمان پروترومبین (PT) میشود. کاهش ویتامین K موجب افزایش PT میشود. دریافت اضافی ویتامین E میتواند به عنوان آنتاگونیست ویتامین K عمل کند.
افزایش مصرف ویتامین E میتواند موجب افزایش PIVKA-II (proteins induced by vitamin K absence–factor II) شود که به عنوان یک شاخص عملکردی ویتامین K در پروتئینهای وابسته به ویتامین K کبدی میباشد.
کمبود ویتامین K بیشتر در کودکان تازه متولد شده اتفاق میافتد، زیرا ویتامین K به خوبی از غشای جفت عبور نمیکند. نوزادان، در سنتز رودهای ویتامین K نیز به دلیل نقص فلور رودهای، مشکل دارند. به طور معمول یک دوز 1-0/5 میلیگرمی ویتامین K به نوزاد تزریق میشود. در سندرمهای سوءجذب چربی و بویژه هنگام مصرف آنتیبیوتیکها به علت از بین رفتن فلور طبیعی روده بزرگ، کمبود ویتامین K ممکن است اتفاق افتد.
منابع:
1-Tietz Textbook of Clinical Chemistry and Molecular Diadnosis. 2006; 4th Edition.
2- Henrys Clinical Diagnosis and Management by Laboratory Methods. 2007; 21st Edition.
3 – Wendy Aineson and Jean Brickell. Clinical Chemistry; A Laboratory Perspective. 2007; 1st Edition.
4- Arneson W, Brickell J. Clinical chemistry; a laboratory perspective. 2007.
5- Pagana KD and Pagana TJ. Diagnostic and laboratory test refrence. 2005; 7th Edition.
6- Van Leeuwen AM, Kranpitz TR and Smith L. Laboratory and diagnostic tests with nursing implications. 2006 ; 2nd Edition.
7- Wilson DD. Manual of laboratory and diagnostic tests. 2008.
8-Cavanaugh BM. Nurses manual of laboratory and diagnostic tests. 2003; 4th Edition.
9-Rodwell VW, Bender DA, Botham KM, Kennelly PJ and Weil PA. Harpers illustrated biochemistry. 2015; 30th Edition.
https://en.wikipedia.org/wiki/Vitamin
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام