انواع تکنیک « واکنش زنجیرهای پلیمراز (PCR)»
و انواع آنزیمهای DNA پلیمراز مقاوم به حرارت
علیرضا صادقی تفرشی1، شیما یزدان دوست1، فتانه توسلیان2
1- دانشجوی دکتری تخصصی بیوشیمی، دانشکده علوم پایه، واحد علوم و تحقیقات، دانشگاه آزاد اسلامی، تهران، ایران
2- دانشجوی دکتری تخصصی ایمونولوژی پزشکی، دانشکده پزشکی، دانشگاه تربیت مدرس، تهران، ایران
چکیده:
واکنش زنجیرهای پلیمراز (PCR)، یک تکنیک آسان و سریع برونتنی (in vitro) است که برای تکثیر قطعات DNA هدف بکار میرود. در این تکنیک برای تکثیر قطعات DNA از آنزیمهای DNA پلیمراز استفاده میشود. بهمنظور افزایش کارآیی این تکنیک، امروزه انواع مختلفی از این تکنیک مورد استفاده محققان قرار میگیرد. همچنین آنزیمهای DNA پلیمراز مقاوم به حرارت مختلفی در این تکنیک مورد استفاده قرار میگیرند. در این مقاله پس از مرور کوتاهی بر اصول روش PCR، انواع PCR و آنزیمهای DNA پلیمراز مقاوم به حرارت مختلف مورد استفاده در PCR مورد بررسی قرار میگیرد.
واکنش زنجیرهای پلیمراز (PCR)
PCR:
واکنش زنجیرهای پلیمراز[1] که به اختصار PCR نامیده میشود، تکنیکی است که با استفاده از آن میتوان در مدت زمان کوتاهی قطعه خاصی از مولکول DNA را در شرایط آزمایشگاه میلیونها بار تکثیر نمود. تنوع و سرعت تکنیک PCR، روشهای تشخیص مولکولی را متحول نموده و کاربردهای زیادی را محقق نموده است که در دوران پیش از PCR امکانپذیر نبودهاند.
تاریخچه PCR :
مخترع تکنیک PCR، بیوشیمیست امریکایی به نامKaryMullis است که این روش را جهت تکثیر DNA معرفی کرد. به دلیل اهمیت این اختراع و کاربردهای فراوان آن در علم ژنتیک و بیولوژی مولکولی، او جایزه نوبل شیمی را در سال 1993 دریافت نمود.
اجزای واکنش PCR :
- DNA الگو (هدف)[2]
- پرایمرها شامل Forward Primer/Reverse Primer
- نوکلئوتیدها (dNTPs)
- آنزیم DNA پلیمراز مقاوم به حرارت
- یون منیزیم(Mg2+) که بهصورت MgCl2 عرضه میشود.
- بافر[3]
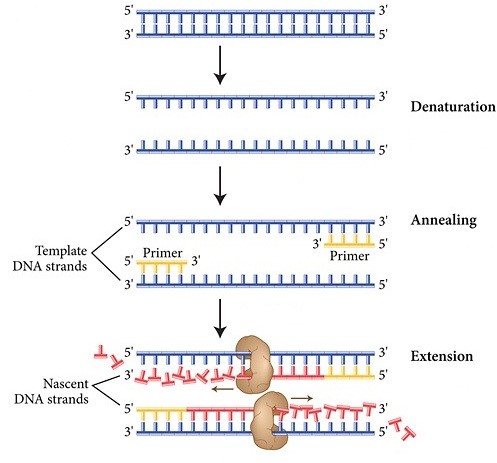
مراحل PCR:
- مرحله واسرشتگی[4]: این مرحله شامل بازشدن DNA دورشتهای و تبدیل آن به DNA تکرشتهای توسط حرارت است. (°98-94 سانتیگراد به مدت 30-20 ثانیه)
- مرحله اتصال[5]: این مرحله شامل اتصال پرایمرها به DNA تکرشتهای است. (° 65-50 سانتیگراد به مدت 40-20 ثانیه)
- مرحله گسترش یا طویل شدن[6]: در این مرحله یک آنزیم DNA پلیمراز مقاوم به حرارت با استفاده از DNA الگو و نوکلئوتیدها باعث طویل شدن پرایمرها شده و رشته جدید DNA سنتز میشود. درجه حرارت این مرحله
- (سانتیگراد °80-75) و مدت زمان این مرحله به آنزیم DNA پلیمراز و طول رشته DNA الگو بستگی دارد.
بعد از این سه مرحله، سیکل اول PCR تمام میشود، سیکلهای بعدی تکرار سیکل اول است که در طی هرسیکل رشته DNA مضاعف میشود. هر واکنش PCR معمولاً بین 30 تا40 سیکل است. محصول نهایی PCR را بهطور کلی آمپلیکون[7] به معنی ماده تقویتشده یا آمپلیفایشده میگویند.
جهت اطمینان از اینکه محصول PCR همان توالی مدنظر بوده، از الکتروفورز بر روی ژل استفاده میشود. در این روش جهت مشخص کردن قطعه DNA با وزن مولکولی مشخص و موردنظر از DNA Ladder (یک مخلوط DNA با اندازههای مشخص) استفاده شده و قطعه موردنظر در الکتروفورز از روی اندازه مولکولی استاندارد مشخص میگردد، سپس رنگآمیزی قطعات DNA (توسط اتیدیوم بروماید) انجام شده و در معرض پرتوهای فرابنفش (UV) قرار میگیرند و درنهایت باندها (قطعات DNA) بهصورت رنگی مشاهده میشوند.
|
شکل 1- مراحل واکنش زنجیرهای پلیمراز (PCR). |
انواع PCR
Multiplex PCR: در این روش، در يك واکنش PCR از چندین جفت پرايمر اختصاصي جهت تكثير چندين توالي هدف در يك زمان استفاده ميشود، بنابراین با این تکنیک ميتوان با آزمایشهای كمتر و زمان کوتاهتر اطلاعات بيشتري را جمعآوری كرد.
انواع Multiplex PCR
- واكنش PCR با يك الگو: در این روش يك DNA الگو در طولش با چندين جفت پرايمر اختصاصی جهت تكثير نواحي مخصوص جفت ميشود.
- واكنش PCR با چند الگو: در میکروبشناسی باليني با استفاده از این روش در عفونتهاي مخلوط امكان شناسايي چندین عامل بيماري در يك نمونه بهطور همزمان وجود دارد. با پرايمرهاي مختلف و ويژه به جستجوي عوامل مختلف پرداخته ميشود و پي به منشأ عفونت ميبرند. به علت اینکه در این تكنيك از چندين جفت پرايمر استفاده میشود، رعایت نكات زیر ضروری است:
- 1- بايد پرايمرها را بهگونهای طراحي كرد كه دماي ذوب (Tm) يكساني داشته باشند و یا اختلاف دماي ذوب پرايمرها بیش از 3 تا °C5 نباشد.
2- اختصاصيت پرايمرهاي طراحیشده براي توالي هدف مهم است.
PCR نامتقارن[8]: هدف از بهکارگیری اين روش توليد DNA تکرشتهای است. در اين روش يكي از پرايمرها به تعداد كمتر و پرايمر دیگر به تعداد بيشتر به محيط واكنش PCR اضافه میشود تا جایی که اين نسبت به 1:50 يا 1:100 میرسد. در حدود 20 چرخه ابتدايي PCR محصول دو رشتهاي توليد ميگردد، اما پس از آن به دليل تمام شدن پرايمر با غلظت كمتر، در چرخههاي بعدي PCR، فقط يك رشته از DNA الگو تكثير ميشود. پس از پايان PCR، چند نسخه DNA دو رشتهاي و تعداد زياديDNA تک رشتهای از ژن موردنظر ايجاد خواهد شد. از DNA تک رشتهای برای تعیین توالی DNA[9] استفاده میشود.
ARMS- PCR (Amplification Refractory Mutation System PCR): اين روش براي تشخيص موتاسيونهاي نقطهاي بكار میرود و جهت تشخيص اللهاي طبيعي و جهشیافته طراحي شده است. واكنش PCR با استفاده از يك DNA الگو و در دو لوله جداگانه انجام ميشود كه يكي از آنها حاوي پرايمر جهشیافته و ديگري حاوي پرايمر طبيعي است. در هر واکنش پرايمر مشترك به همراه يكي از دو پرايمر اختصاصي الل مورد استفاده قرارميگيرد (تفاوت اللهای طبیعی و جهشیافته در یک نوکلئوتید در انتهای َ3 پرایمر است). چنانچه بسپارش (پليمريزاسيون) در لوله حاوي پرايمر طبيعي انجام شود، نشاندهنده فقدان جهش نقطهاي در باز موردنظر است و اگر بسپارش در لوله حاوي پرايمر جهشیافته انجام شود، نشاندهنده حضور جهش نقطهاي در باز موردنظر است. از این روش جهت تشخیص بیماریهای ژنتیکی قبل از تولد نظیر سیستیک فیبروزیس، فاویسم و … استفاده میشود.
این روش نامهـــــــــــای دیگری نیز دارد از جمله Amplificatin Multation Assay PCR) Mismatch) MAMA-PCR و
Allele-Specific-PCR
RT-PCR (Reverse Transcription PCR): در این روش الگوی اولیه RNA است. ازآنجاكه آنزیم DNA پليمراز قادر به استفاده ازRNA بهعنوان الگو نیست، ابتدا با استفاده از آنزيم رونوشتبردار معکوس [10] (RT)از الگوي RNA، مكمل آن يعني cDNA سنتز ميشود و سپس cDNA بهوسیله تكنيك PCR تكثير مييابد. آنزيم نسخهبردار معكوس در این روش از ویروس Avian myeoloblastosis (AMV) بهدست ميآيد. كاربرد اين آنزيم به دليل حساس بودنش به حرارت پايين بوده ولي با كشف باكتريای به نام ترموس ترموفيلوس[11] اين روش بهبود يافت. اين باكتري DNA پليمراز مقاوم به حرارتی به نام Tth را توليد میکند که در حضور يون منگنز (+Mn2 ) داراي فعاليت نسخهبرداري معكوس است و در دمايC° 70 توسط اين آنزيم از روي RNA، cDNA ساخته ميشود، سپس منگنز اضافي توسط اتيلن گليكول تترااستيك اسيد [12](EGTA) حذف ميشود و اين آنزیم از DNAاي كه خود ساخته، استفاده و آن را تكثير ميكند. براي تكثير ماده ژنتيكي ويروسهاي RNAدار مثل HIV و هپاتیت C از اين روش استفاده شده و سپس از این توالی بهعنوان شناساگر استفاده میشود.
PCR) Inverse PCR معکوس): در این روش هدف تكثير قطعهاي ازDNA است كه هيچ اطلاعي در مورد توالي پايانههاي آن در دست نيست ولي توالي قسمتي از يك ناحيه دروني آن مشخص است. براي تکثیر این DNA، ابتدا DNA تحت تأثیر یک آنزيم محدودکننده[13] مناسب قرار میگیرد (از آنزيم محدودکنندهای استفاده میشود که در درون توالی شناختهشده جایگاه برش نداشته باشد). DNA توسط آنزيم محدودکننده، هضم آنزیمی میشود و قطعات مختلف ایجاد میگردد. سپس برای اتصال مجدد قطعات از آنزیم لیگاز[14] استفاده میشود و DNA حلقوي بهدست میآید. در مرحله بعد از آنزیم محدودکنندهای استفاده میشود که توالی شناختهشده ما را برش دهد؛ بنابراین توالی ناشناخته بین دو توالی شناختهشده قرار میگیرد، سپس پرایمرهای مناسب برای توالی شناختهشده طراحی میشود و واکنش PCR انجام گردیده و ژن موردنظر تکثیر مییابد.
PCR) Nested PCR داخلي): در این روش از دو جفت پرايمر استفاده ميشود، بهطوریکه جفت دوم در بین جفت اول جاي ميگيرد و دو بار واکنش PCRانجام میشود. ابتدا جفت پرایمر اول اضافه ميشود که ناحیه وسیعی از DNA موردنظر را تکثیر میکند، سپس محصول PCR بهعنوان الگو در اختیار جفت پرايمر دوم (پرایمرهای داخلی یا Nested) كه مكمل قسمت داخليتر قطعه DNA موردنظر است قرار ميگيرد و PCR دوم انجام میشود. محصول PCR دوم کوتاهتر و اختصاصیتر است. این روش براي افزايش حساسيت و دقت PCR است، یعنی چنانچه در PCR اول، محصولات غیراختصاصی وجود داشته باشند، مرحله دوم PCR باعث تکثیر اختصاصی توالي هدف و حذف محصولات غيراختصاصي ميشود.
Long PCR: از این روش برای تکثیر قطعات DNA بیشتر از kb10 استفاده میشود. برای انجام این نوع PCR به علت اینکه طول قطعات DNA بزرگ است باید از آنزیم DNA پلیمرازی استفاده شود که خاصیت ‘5 →’3 اگزونوکلئازی (تصحیح خطا[15]) داشته باشد (مانند آنزیم Pfu). آنزیم Taq پلیمراز به علت اینکه قدرت بسپارش خوبی دارد، Processivity بالایی دارد، دمای بالا را خوب تحمل میکند و نسبت به آنزیمهای DNA پلیمراز دیگر ارزانتر است و بهعنوان یک آنزیم DNA پلیمراز متداول در واکنشهای PCR استفاده میشود، اما این آنزیم خاصیت ندارد و به همین دلیل چنانچه از این آنزیم در Long PCR استفاده کنیم باید در کنار آن از آنزیمی مثل آنزیم Pfu نیز استفاده کرد (معمولاً به نسبت ۱۸۰ به ۱ مخلوط میشوند). آنزیم Taq پلیمراز (180) برای بسپارش و آنزیم Pfu (1) برای تصحیح خطا استفاده میشوند.
Hot-Start PCR: این روش برای جلوگیری از تولید اتصالات غیراختصاصی در مراحل اولیه PCR است. مرحله آغاز[16] در این روش شامل گرم کردن مواد در دمای حدود (°C94-98) است که معمولاً 2-1 دقیقه به طول میانجامد. این مرحله در مواردی بکار میرود که آنزیم DNA پلیمراز مورد استفاده جهت انجام فعالیت نیاز به گرم شدن دارد. این گرم کردن اولیه باعث میشود که باندهاي غیراختصاصی مثل پرایمر-پرایمر یا الگو-پرایمر قبل از انجام اولين سیکل PCR ايجاد شود که میتواند بهعنوان سوبسترا برای آنزیم DNA پلیمراز عمل کند و در نهایت باعث تولید محصولات غیراختصاصی شود. سادهترين روش براي جلوگيري از اتصالات اوليه غيراختصاصي و بهتركردن شرايط اتصال صحيح پرايمر، استفاده از روش Hotstart است که جدا کردن یک ترکیب مهم PCR (ترجیحاً آنزیم DNA پلیمراز) تا زمان رسيدن به دماي بالا است. این عمل را میتوان به صورتهای زیر انجام داد:
- Hot start با استفاده از آنتیبادی: در این روش آنتیبادی ضدآنزیم DNA پلیمراز را به واکنش PCR اضافه میکنند، درنتیجه فعالیت پلیمرازی آنزیم DNA پلیمراز مهار میشود. هنگامیکه دمای واکنش به ۹۴ درجه رسید آنتیبادی دناتوره میشود و دوباره آنزیم DNA پلیمراز فعال میگردد.
- Hot start با استفاده از موم[17]: در این حالت تمام اجزاء واکنش PCR که شامل DNA الگو، پرایمرها، نوکلئوتیدها، MgCl2 و بافر است را به میکروتیوبها اضافه میکنند، سپس یک عدد از گلولههای مومي با نام wax را به میکروتیوبها اضافه كرده و واكنش در يك ترموسايكلر در دماي°C75-80 به مدت 10-5 دقيقه نگهداري ميشود تا موم ذوب شود سپس میکروتیوبها تا زیر °C35 سرد ميشوند تا موم مجدداً جامد شود و يك لايه محافظ بر روي مواد اولیه واكنش تشكيل شود، در مرحله آخر آنزیم DNA پلیمراز بر روي لايه موم ريخته میشود و سپس واکنش PCR را آغاز میکنند. در دمای ۹۴ درجه این موم بخار شده و آنزیم DNA پلیمراز با مخلوط واکنش تماس پیدا میکند.
Touch down PCR: این روش برای جلوگیری از تولید محصولات غیراختصاصی در PCR است. در این روش دمای Annealing را °C10 افزایش داده و سپس به PCR برنامه میدهند که به ازای هر 2 سیکل یک درجه دما را کاهش دهد؛ بنابراین چنانچه باندهای غیراختصاصی وجود داشته باشند در درجه حرارت بالا جدا میشوند و بدین ترتیب از تولید محصولات غیراختصاصی جلوگیری میشود.
Booster PCR: این روش زمانی استفاده میشود که مقدار نمونه DNA الگو کم است. از آنجا که در واکنش PCR باید میزان DNA الگو و پرایمرها متناسب باشند، اگر مقدار DNA الگو در واکنش PCR کم باشد باعث میشود که در طول واکنش، DNA الگو سریع تمام شده و در نتیجه باندهای غیراختصاصی (دایمر-پرایمر) ایجاد میگردد که در نهایت باعث تولید محصولات غیراختصاصی میشود. برای جلوگیری از این حالت ابتدا مقدار کمی از پرایمرها را به محیط واکنش PCR اضافه میکنند، بعد از اینکه چند سیکل از PCR انجام شد و مقدار DNA الگو افزایش یافت، بقیه پرایمرها را به محیط واکنش PCR اضافه میکنند، بنابراین با این روش هم کمبود DNA الگو جبران میشود و هم از تولید محصولات غیراختصاصی در PCR جلوگیری میگردد.
Miniprimer PCR: در این روش از یک نوع آنزیم DNA پلیمراز جدید بنامTbr استفاده میشود که منبع آن باکتری Thermusbrockianus است. این آنزیم DNA پلیمراز قادر است به پرایمرهای کوچک (9 یا 10 نوکلئوتیدی) متصل شود، در حالی که دیگر آنزیمهای DNA پلیمراز مثل آنزیم Taq پلیمراز به پرایمرهای بزرگتری متصل میشوند که حدود 30-18 نوکلئوتید دارند؛ بنابراین با استفاده از آنزیم Tbr پرایمرهای کوچکتری را میتوان طراحی کرد و از این روش برای تکثیر توالیهای حفاظتشده DNA استفاده میشود.
RFLP-PCR (Restriction Fragment Length Polymorphism PCR): در این روش ابتدا ژن موردنظر توسط تکنیک PCR تکثیر مییابد، سپس محصولات PCR را تحت تأثیر آنزیم محدودکننده مناسب قرار میدهند تا هضم آنزیمی انجام شود (آنزیم جایگاههای خاصی از ژن را برش میدهد و بدین صورت قطعاتی با طولهای مختلف ایجاد میشود). در مرحله بعد الکتروفورز قطعات بر روی ژل انجام شده و سپس قطعات توسط ایتدیوم بروماید رنگآمیزی و در معرض نور UV قرار میگیرند. در نهایت قطعات بهصورت باندهای رنگی مشاهده میشوند که این باندها بازتابی از مولکول DNA یک فرد است و از این روش در پزشکی قانونی (تعیین هویت)، تعیین روابط والدین و فرزندی و تعیین روابط خویشاوندی استفاده میشود.
Real- time PCR: در اين روش يك ماده فلوئورسنت طي واكنش، متناسب با ميزان محصولات هر سيكل آزاد ميشود و ميزان فلوئورسانس آن توسط دتكتور شناسايي و ثبت ميگردد و بدين ترتيب ميزان DNA تكثيرشده طي يك سیکل تا سیکل بعدي را ميتوان اندازهگیری كرد، بنابراين ميزان محصول در هر سیکل قابلردیابی است در حالی که در روشهای دیگر PCR، محصول پس از پايان واكنش و الكتروفورز مشخص ميشود. Real-time PCR را میتوان به صورتهای زیر انجام داد:
- Real-time PCR با استفاده از رنگهای فلوئورسنت مانند Ethidium Bromide، SYBR Green، Eva Green و Acridin Orange.
- Real-time PCR با استفاده از پروبهای فلورسانت مانند TaqMan Probe و Beacons Probe.
SYBR Green: همزمان با دو رشتهاي شدن DNA، سايبرگرين به شیار کوچک[18] DNA متصل شده و با جذب طولموج 498 نانومتري، نور 522 نانومتري را ساطع میکند. با افزايش مقدار محصول PCR، رنگ بيشتري متصل میشود و ميزان فلورسانس افزايش مییابد، پس ميزان فلورسانس متناسب با مقدار DNA دو رشتهاي در واكنش است.
TaqMan Probe: یک پروب توالی 30-20 نوکلئوتیدی است که در آزمایشگاه بهگونهای طراحی و سنتز میشود که مکمل DNA موردنظر باشد. پروبها معمولاً يك رنگ فلوئورسنت گزارشگر[19] در انتهای َ5 و يك رنگ خاموشکننده[20] در انتهای َ3 دارند و وقتي در فاصله مولكولي نزديكي قرار دارند بازتابشي در دستگاه ثبت نميشود و تنها زمانی سیگنال میدهد که پروب با فعالیت اگزونوکلئازی شکسته شود. پروب حدود چند باز بعد از انتهاي َ3 يكي از پرايمرها طراحي ميشود. آنزيم DNA پلیمراز در حین تکثیر، پس از نزديك شدن به پروب با استفاده از خاصیت اگزونوکلئازی′5 به َ3 خود، پروب را کافت (ليز)[21] میکند و در نتيجه رنگ فلوئورسنت از عامل خاموشکننده جدا شده و باعث ايجاد فلوئورسانس ميگردد.
از رنگهای فلوئورسنت گزارشگر میتوان به[22]FAM و از رنگهای خاموشکننده میتوان به TAMRA[23] اشاره کرد.
Beacons Probe: این پروب دارای یک رنگ فلوئورسنت و یک رنگ خاموشکننده است که در دو انتها قرار میگیرند. این پروبها به شکلی طراحی میشوند که در محلول ساختار سنجاقسری (لوپی شکل) گرفته و رنگ فلوئورسنت و رنگ خاموشکننده در کنار هم قرار بگیرند. این پروب در مرحلۀ هیبریداسیون با ژن هدف جفت میشود و در این حالت دو انتهای پروب از یکدیگر فاصله میگیرند و رنگ فلوئورسنت و رنگ خاموشکننده از هم جدا شده و باعث ايجاد فلوئورسانس ميگردد و سیگنال ایجاد میشود.
جدول 1- مشخصات بعضی ترکیبات فلوئورسنت مهم مورد استفاده در Real-time PCR
|
انواع آنزیمهای DNA پلیمراز مقاوم به گرما، مورد استفاده در PCR
آنزیم Taq پلیمراز:
مزایا:
(1) قدرت پلیمریزاسیون خوبی دارد.
(2) Processivity بالایی دارد.
(3) دمای بالا را خوب تحمل میکند.
(4) نسبت به آنزیمهای DNA پلیمراز دیگر ارزانتر است و بهعنوان یک آنزیم DNA پلیمراز متداول در واکنشهای PCR استفاده میشود.
معایب:
(1) آنزیم خاصیت ‘3→ ‘5 اگزونوکلئازی یا تصحیح خطا ندارد.
(2) قطعاتی با دنباله آدنینی تولید میکند.
(3) نیمهعمر آن کم است.
(4) Taq پلیمراز تا حدودی مستعد تخریب پروتئولیتیک است. توصیه میشود که Taq فقط بعد از تیمار دمایی آغازی مخلوط واکنشی PCR اضافه شود زیرا بیشتر پروتئازها در طول مرحله آغازی پروتکل معمولی PCR دناتوره میشوند.
(5) Taq پلیمراز توسط بسیاری از ترکیبات آزمایشهای بیوشیمیایی و بیولوژی مولکولی و ترکیباتی که در پروتکلهای ایزولاسیون DNA بهکار میروند، مهار میگردد.
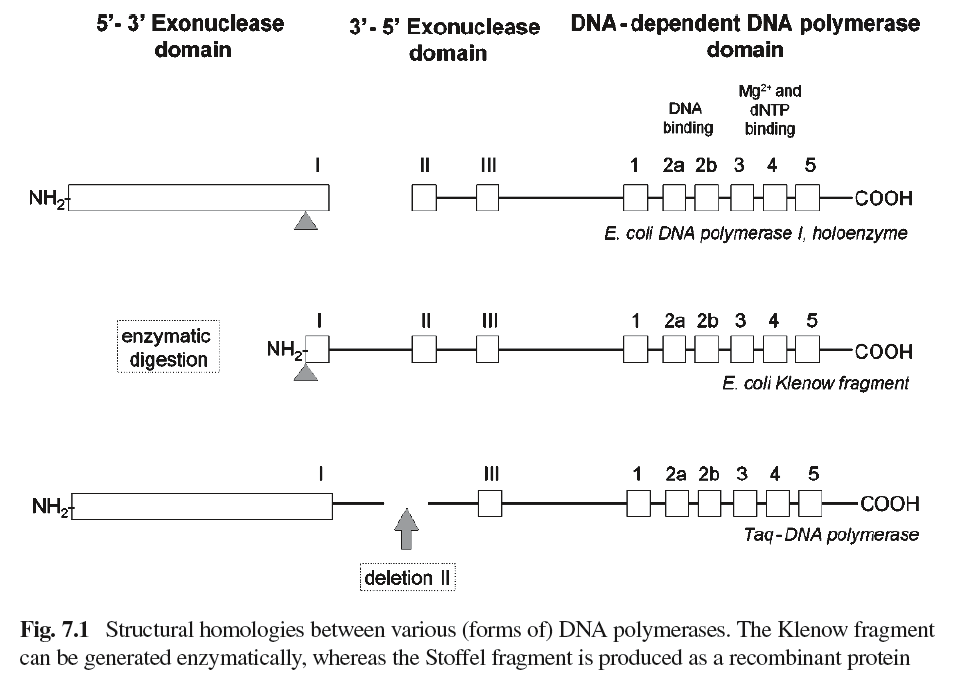
Ampli-Taq®: پرکاربردترین آنزیم DNA پلیمراز برای واکنش PCR است که امروزه بهوفور با برندهای مختلف در بازار مواد بیولوژیک یافت میشود. این آنزیم نوع نوترکیب DNA پلیمراز Taq است و در Ecoli تولید میگردد. این Taq نوترکیب درواقع فقط شامل قطعه استافل[24] از Taq طبیعی است.
آنزیم DNA پلیمرازTaq یک پروتئین 92 کیلو دالتونی است که دارای 832 اسیدآمینه است. قطعه استافل قسمتی از DNA پلیمرازTaq است که یک پروتئین 61 کیلودالتونی است و 289 اسیدآمینه انتهای N ترمینال Taq طبیعی را ندارد و بهصورت یک پروتئین نوترکیب در Ecoli تولید میشود. قطعه استافل فاقد فعالیت اگزونوکلئازی ‘5 به ‘3 در مقایسه با Taq طبیعی است، عدم فعالیت اگزونوکلئازی 5’به 3’موجب تکثیر مؤثر الگوهای حلقوی مانند DNA پلاسمیدی است.Ampli-Taq® نسبت به Taq طبیعی مقاومت دمایی بالاتری دارد (دو برابر)، بنابراین جهت تکثیرDNA های با درصد GCبالاتر و دارای ساختمان ثانویه پیچیده مناسبتر است، به بیان دیگر از آنجاکه برای باز شدن ساختارهای ثانویه پیچیده، به دما و زمان بیشتری نیاز است، Taq نوترکیب به دلیل مقاومت دمایی بالا گزینه مناسبی محسوب میشود. از طرفی Ampli-Taq® به علت کوچکسازی نسبت به Taq طبیعی، سرعت تکثیر DNA آن نیز بیشتر است (حدود سه برابر).
شکل 2- هومولوژیهای ساختاری میان شکلهای مختلف DNA پلیمرازها
قطعه کلینو (Klenow fragment) میتواند بهصورت آنزیماتیک تولید شود در حالی که قطعه استافل
(Stoffel Fragment) بهصورت یک پروتئین نوترکیب (ریکامبینانت) تولید میگردد
AmpliTaq Gold™ DNA Polymerase: یک مدیفیکاسیون شیمیایی Taq پلیمراز، فعالیت آنزیماتیک آن را در دمای پایین غیرفعال میکند ولی این مدیفیکاسیون در دمای بالا میتواند برداشته شود که نتیجه آن فعالسازی Taq پلیمراز برای شروع PCR است. این مدیفیکاسیون شیمیایی برگشتپذیر وابسته به دمای پروتئینTaq منجر به تولید فراورده تجاری به نامAmpliTaq Gold™ بهعنوان یک آنزیم Hot Start PCR شده است.
مدیفیکاسیون ژنتیکی: بعضی پلیمرازهای مدیفیه شده ژنتیکی بهصورت یک کونفورماسیون ساختاری غیرفعال فولد میشوند و بعد از یک تیمار دمایی به یک کونفورماسیون فعال آنزیمی re-organize میشوند؛ مانند آنزیمهای Thermo-start (ABGene) و Proofstart (Qiagen).
در پلیمرازهای مهارشده در جایگاه فعال توسط آنتیبادیهای مونوکلونال اختصاصی، مرحله گرمایی آغازی، آنتیبادی اتصالی در سطح جایگاه فعال پلیمراز را دناتـــــــــوره میکند؛ مانند: TaqStartAntibody (ClonTech)، Taq Platinum (Life Technologies)، RedHot DNA Polymerase (ABIgene)، JumpStart(Sigma)) و Fast Start Taq (Roche) .
Klentaq: در واقع Klentaq1 آنالوگ قطعه کلینو در Taq پلیمراز است، پایدارترین شکل شناختهشده Taq در برابر گرما است و فاقد فعالیت اگزونوکلئازی یا اندونوکلئازی بوده ولی فعالیت پلیمرازی خود را دارا است.
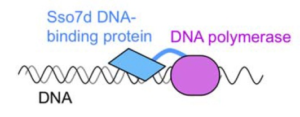
Domain tagging: یک استراتژی جدید برای تشدید Processivity و بهبود عمل Taq متصل کردن آن به یک Thermostable DNA binding protein است که آن را Domain tagging مینامند. اتصال کووالانسی دمین پلیمرازی با Sso7d DNA binding protein از Sulfolobus solfataricus قدرت Processivity را در Taq افزایش میدهد. یک پروتئین مشابه که برای چنین روشی به کار رفته است عبارت است از: Sac7d از Sulfolobus acidocaldarius.
شکل 3- Sso7d (DNA binding protein از S. Solfataricus) با پلیمراز Pfu فیوز شده و این عمل processivity بالایی برای آنزیم ایجاد میکند
KOD: پایداری گرمایی آن 12h در 95 درجه است و در نتیجه در دمای بالای دناتوراسیون (98 درجه) بکار میرود. سرعت Elongation آن 7.8-6 kb بر دقیقه و بسیار سریعتر از دیگر DNA پلیمرازهای معروف دیگر است. Fidelity آن قابل مقایسه با دیگر B-typeDNA پلیمرازها بوده ولی بسیار بهتر از Taq است. KOD فعالیت اگزونوکلئازی ′5→′3 دارد.
Tli (Vent™): از Thermococcus litoralis ایزوله شده است.Vent™ فعالیت تصحیح اشتباه (پروف ریدینگ) نوکلئازی ′5→′3 دارد که منجر به Fidelity بالا میگردد. Vent™ در مقایسه با دیگر پلیمرازها نیمهعمر بسیار بالایی دارد؛ نزدیک به 2h در دمای 100 درجه که از Taq بسیار بهتر و از Pfu بهتر است.Vent™ بهویژه برای شرایط واکنش سنتز DNA در دمای بالا مفید است.
Pfu: این آنزیم از آرکیباکتریوم دریایی هایپرترموفیلیک Pyrococcus furiosus ایزوله شده است. ویژگی مهم Pfu، Fidelity بالای آن است. فعالیت پروف ریدینگ اگزونوکلئازی ′5→′3 دارد که یکی از دلایل Fidelity بالای این آنزیم است. Pfu(exo-) نیز بهصورت تجاری در دسترس است. فعالیت آن از نظر اگزونوکلئازی ′5→′3 منفی است. در این حالت پرایمر تخریب نمیشود ولی فعالیت اگزونوکلئازی از دست رفته،Fidelity را 40 برابر کاهش میدهد.
Phusion DNA Polymerase: چنانکه پیشتر اشاره شد، یک استراتژی موفقیتآمیز برای تولید DNA پلیمرازهای بهبودیافته Domain Tagging است. مثال برای استراتژی Tagging تولید فراورده تجاریPhusion DNA Polymerase اســـت که یک فیـــــــوژن پروتئین از Pfu وDNA binding protein Sso7d (از S. Solfataricus) است. Sso7d افینیته بالایی نسبت به DNA دارد و وقتیکه DNA پلیمراز Pfu فیوز شده، سنتز DNA را در امتداد رشته DNA الگو آغاز مینمایـــد، آنزیم را بــــــــر روی DNA نگه میدارد. Phusion DNA polymerase سرعت Extension پایین Pfu را جبران میکند در حالی که Fidelity بالای آن را حفظ میکند. این آنزیم انجام PCR با Processivity بسیار بالا و دقیق را میسر نموده و امروزه بهطور گسترده مورد استفاده است.
Tfl و Tth: در واقع Tfl از Thermus flavus و Tth از Thermus thermophilis HB8 ایزوله شدهاند. Tfl تقریباً همان ویژگیهای Taq را دارد این مطلب شامل Tth هم میشود، بهاستثنای زمان نیمهعمر آنکه کوتاهتر است. Tth در حضور یونهای Mn2+ فعالیت رونوشــــتبرداری معکوس (ریورس ترانسکریپتازی) داشــــــــــته و بدین طریق آمپلیفیکاسیـــــــون PCR از تارگتهای RNA را میسر میســـازد و در Reverse Transcription PCR (RT-PCR) بهکار میرود.
UlTma™: از Thermotoga maritime متعلق به دمین باکتریها و متعلق به خانواده ترماتوگاسه[25] بهدست میآید. این باکتری بین دمای 50 تا 90 درجه رشد میکند و تنها یوباکتریای است که در چنین دمایی رشد میکند (فقط آرکیاها میتوانند در چنین شرایطی رشد کنند). فعالیت پروف ریدینگ اگزونوکلئازی ′5→′3 داشته و فعالیت اگزونوکلئازی ′3→′5 ندارد. شرایط واکنشی و Fidelity آن شبیه بهTaq است.
نتیجهگیری
در سالهای اخیر بهمنظور افزایش کارآیی و اختصاصیت روش پایهای PCR، مدیفیکاسیونها و روشهای متنوعی از این تکنیک ایجاد شده است که میتوان از آنها برای مقاصد گوناگون استفاده نمود، همچنین طی دوران گسترش ژنومیکس، کاربرد آنزیمهای DNA پلیمراز مقاوم به حرارت بسیار افزایش یافته است. هر یک از این پلیمرازها ویژگیهای متفاوتی دارند که مربوط به خاستگاه و ویژگیهای ژنتیکی آنها است. انتخاب منطقی آنزیم پلیمراز مناسب برای PCR بستگی به کاربرد آن دارد که باید بهدقت مورد توجه قرار گیرد. این مقاله میتواند برای محققانی که از PCR استفاده میکنند مورد استفاده قرار گیرد. البته باید توجه داشت که ارزیابی دقیق شرایط بهینه برای بیشتر فرایندهای PCR ضروری است.
منابع:
- Terpe, Kay. “Overview of thermostable DNA polymerases for classical PCR applications: from molecular and biochemical fundamentals to commercial systems.” Applied microbiology and biotechnology 97, no. 24 (2013): 10243-10254.
- Ishino, Sonoko, and Yoshizumi Ishino. “DNA polymerases as useful reagents for biotechnology–the history of developmental research in the field.” Frontiers in microbiology 5 (2014): 465.
- Hernandez-Rodriguez, P. and Ramirez, A.G., 2012. Polymerase chain reaction: types, utilities and limitations. In Polymerase Chain Reaction. InTech.
- van Pelt-Verkuil, E., A. Van Belkum, and J. P. Hays. “Principles and technical aspects of PCR amplification2008.”
- Yamagami, Takeshi, Sonoko Ishino, Yutaka Kawarabayasi, and Yoshizumi Ishino. “Mutant Taq DNA polymerases with improved elongation ability as a useful reagent for genetic engineering.” Frontiers in microbiology 5 (2014): 461.
- Rittié, Laure, and Bernard Perbal. “Enzymes used in molecular biology: a useful guide.” Journal of cell communication and signaling 2, no. 1-2 (2008): 25-45.
- Akin Yilmaz, Hacer Ilke Onen, Ebru Alp and Sevda Menevse, 2012. Real-Time PCR for Gene ExpressionAnalysis In Polymerase Chain Reaction. InTech.
[1]Polymerase Chain Reaction
[2]DNA Template
[3]Buffer
[4] Denaturation Step
[5] Annealing step
[6] Extension/Elongation step
[7]Amplicon
[8]Asymmetric PCR
[10]Reverse Transcriptase
[11]Thermus thermophilus
[12] Ethylene glycol tetraacetic acid
[13]Restriction enzyme
[14] Ligase
[15]Proofreading
[16] Initialization step
[17]Wax
[18]Minor groove
[19]Reporter
[20]Quencher
[21] Lysis
[22]Fluorescin acronym
[23]Tetramethylrhodamine acronym
[24]Stoffel Fragment
[25]Thermatogaceae
مقدمهای بر تکنیک واکنش زنجیرهای پلیمراز و انواع آن
مقدمهای بر تکنیک PCR در زمان واقعی و انواع آن
روشهای عملی در Time PCR – Real قسمت5
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام

![]Polymerase Chain Reaction](https://medlabnews.ir/wp-content/uploads/2021/08/Polymerase-Chain-Reaction.jpg)