واکنشهای نامطلوب تزریق خون در نگاه میکروسکوپی
دکتر حبیبالله گلافشان
عضو هیئت علمی دانشگاه علوم پزشکی شیراز
مقدمه
در طول تاریخ بشر، خون بهعنوان مادهای جادویی و شفابخش مطرح بوده است و ازآنجاکه بر این باور بودهاند که شخصیت و توانایی از راه خون منتقل میشود، اقدام به جمعآوری خون پهلوانان در میدان نبرد و نوشیدن آن میکردند. در تمدن قدیم مخلوط خون و روغن بهعنوان مرهم جهت التیام زخم بکار میرفت. تاریخ ترانسفیوژن از تزریق خون حیوان به انسان برای درمان اختلالات روانی خبر میدهد و باور بر این بود که میتوان حرکات جنونآمیز را با تزریق خون گوسفند که حیوانی مطیع و رام است درمان نمود و البته بیمار را آرام میکرد زیرا که منجر به مرگ فرد میگردید!!!.
نخستین گزارش مربوط به تزریق خون انسان به انسان احتمالاً در سال 1492 به امید جوانسازی و درمان بیماری پاپ اینوسنت هشتم (Pop Innocent VIII) میباشد، که از خون سه پسر جوان استفاده شد ولی منجر به مرگ پاپ و پسرها گردید. کوشش برای گسترش تزریق خون در اوایل سال 1800 توسط بلاندل (James Blundell) صورت گرفت که علیرغم نبود دانش گروههای خونی در 50% موارد موفقیتآمیز بود. کشف گروه خونی سیستم ABO در سال 1900 توسط کارل لاند اشتاینر راه را برای تزریق خونسازگار هموار ساخت.
واکنشهای نامطلوب ترانسفیوژن را میتوان به دو گروه ماکروسکوپی و میکروسکوپی طبقهبندی کرد. واکنشهای نامطلوب ماکروسکوپی دارای علائم بالینی، آزمایشگاهی و رادیولوژی تعریف شده است که پارهای از آنها به شرح زیر میباشد:
- افزایش بار گردش خون (TACO)
- آسیب حاد ریوی مرتبط با تزریق خون (TRALI)
- واکنشهای آلرژیک
- واکنشهای حاد همولیتیک و تأخیری
- واکنش تبزای غیرهمولیتیک
- واکنشهای کاهنده فشارخون
- بیماریهای مسری
- پورپورای بعد از تزریق خون
- واکنش گرافت
واکنشهای میکروسکوپی تزریق خون و فراوردههای آن در رابطه با دستکاری سیستم ایمنی، اختلال در گردش مویرگی و اثرات سرما بر خون نگهداری شده میباشد. پیشرفت آنالیزورهای چند پارامتری فلوسایتومتری مسائل جدیدی در رابطه با اهدای خون مطرح ساخته است و همه این عوارض ماکروسکوپی و میکروسکوپی یادآور این نکته مهم است که مصرف خون باید بجا و تحت کنترل باشد.
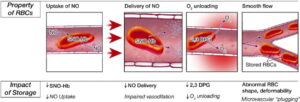
تزریق خون و فراوردههای آن گرچه نجاتبخش و در مواردی اجتنابناپذیر است ولی تزریق نابجای آن با خطراتی که در بردارد تهدیدکننده زندگی است؛ برای مثال چنانچه بیماری با هموگلوبین 10 گرم درصد برای یک عمل جراحی بستری گردد و به وی سرم فیزیولوژی یا محلول قندی تزریق شود، هموگلوبین به 8 گرم درصد افت میکند چون یک گرم بر اثر تغییر وضعیت ایستاده به خوابیده افت داشته و یک گرم دیگر ناشی از رقیق شدن خون به علت تزریق محلولهای وریدی است و در این حالت ممکن است تقاضای غیرضروری دو واحد خون گردد. عمر نگهداری خون در نگهدارنده 1CPD-A در دمای 4 درجه 35 روز و در محلولهای افزاینده (AS solution)42 روز است. حدود 70% از گلبولهای قرمز بایستی پس از 24 ساعت از تزریق، در گردش خون بیمار باقی بماند؛ بدین مفهوم که 30% گلبولهای قرمز بهصورت لاشهی مرده یا دارای تغییرات مرفولوژی شدید گردیده که طعمه ماکروفاژها شده و نتیجه آن کاهش کارآمدی قدرت فاگوسیتوز در برابر عوامل عفونی میباشد. میزان همولیز گلبولهای قرمز باید کمتر از 0/8درصد در پایان روز نگهداری باشد. نگهداری خون در 4 درجه سرعت متابولیسم را کاهش داده و تخلیه گلبولهای قرمز از ATP موجب بروز تولید مرفولوژی اکینوسیت و اسفروسیت میشود. پس از 7 روز از نگهداری خون در 4 درجه، کاهش 2,3 DPG منحنی رهاسازی اکسیژن را به سمت چپ منحرف کرده و اکسیژن کمتری در اختیار بافتها قرار میگیرد. ظاهر شدن مولکولهای چسبان و آنتیژنهای نهفته در سطح گلبولها و افزایش میل چسبندگی گلبولها به یکدیگر موجب اختلال گردش مویرگی میگردد. گرچه بسیاری از این تغییرات ظرف 24 ساعت پس از تزریق خون برطرف میشود ولی تزریق در ساعات اولیه اثرات زیادی روی گردش مویرگی، اکسیژنرسانی، سیستم انعقادی و سیستم ایمنی دارد. رها شدن پروتئینها، RNA و لیپیدهای محلول از گلبولهای سفید و پروتئولیز آنها موجب ایجاد حالت انعقاد پذیری میشود و تعجبی ندارد که پدیدهی ترومبوآمبولی با تزریق خون گزارش شده است. روشهای پروتئومیکس(Proteomics) و ترانسکریپتومیکس (Transcriptomics) حضور بیش از 200 نوع پروتئین و RNA رهاشده را در کیسه خون و پلاکت نشان داده است. تزریق خون موجب اقامت بیشتر بیمار در بخش ICU، افزایش مدتزمان بستری و وابستگی بیشتر به دستگاه تنفس (ventilator) میگردد.
گلبولهای قرمز با نگهداری در 4 درجه به علت کاهش سرعت متابولیسم و تخلیه ATP دارای ضایعات دوران نگهداری از قبیل مورفولوژی اکینو-اسفروسیت، اختلال در پمپ سدیم پتاسیم و نشت پتاسیم میگردند. کاهش اکسید نیتریک در خون نگهداری شده، با انقباض عروقی و کاهش 2,3 DPG با کاهش اکسیژنرسانی و نمایان شدن مولکولهای چسبان با تجمع گلبولهای قرمز با اختلال در گردش مویرگی بهویژه در 24 ساعت اول تزریق همراه میگردد
خطر عفونتهای بعد از جراحی از قبیل عفونت زخم، دستگاه ادراری، ذاتالریه، عفونت خونی و آبسه با تزریق خون و حتی با شدت کمتری با تزریق خون کملوکوسیت نیز مشاهده شده است. در یک متاآنالیز افزایش خطر عفونت بعد از جراحی ساده با فاکتور 3/45 و بعد از جراحی بیماران ترومایی 5/3 برابر در مقایسه با بیمارانی که خون دریافت نکرده بودند، نشان داده شده است. آسیبپذیری، نارسایی چندارگانی، وابستگی به ونتیلاتور و اقامت بیشتر در ICU در گروهی که تزریق خون داشتهاند بیشتر بوده است. آمار افزایش خطر گسترش تومور، کاهش مدتزمان بهبودی و افزایش متاستاز در بیمارانی که جراحیهای خاص به دلیل سرطانهای مختلف داشتهاند، در مقایسه با گروهی که تزریق خون نداشتهاند، نشان داده است. تزریق خون در جراحیهای دستگاه گوارش، استحکام آناستوموز معده و روده را کاهش داده و موجب نشت از محل آناستوموز میشود. ترانسفیوژن در بیمارانی که خونریزی گوارش دارند امکان خطر خونریزی دوباره را افزایش میدهد و این به علت رقیق شدن فاکتورهای انعقادی و پلاکتها میباشد. با تزریق یک حجم خون (حدود 10 کیسه در بزرگسالان) فاکتورهای انعقادی و پلاکت به 35% مقدار اولیه افت میکند. برای مثال چنانچه پلاکت بیماری 60000 باشد و 10 کیسه خون دریافت کند، پلاکت به 20000 افت میکند، ازاینرو بنا به استانداردهای جدید سعی میشود که در ترانسفیوژن ماسیو از خونی شبیه به خون کامل به بیمار تزریق شود، برای مثال تزریق خون، پلاسما و پلاکت به نسبت 1:1:1 انجام شود تا خطر مرگومیر کاهش یابد.
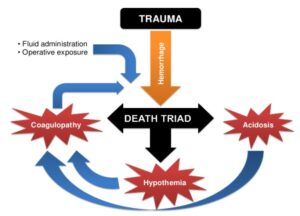
اسیدوز و کاهش درجه حرارت بدن و اختلال در سیستم انعقادی سه عامل مهم مرگومیر در بیماران ترومایی است که به آن سهتایی مرگآور گفته میشود. گرم کردن خون، تزریق همزمان گلبول قرمز با پلاسما و پلاکت و تصحیح حجم گردش خون در جلوگیری از بروز سهتایی مرگآور اهمیت فراوان دارد
ترانسفیوژن در نوزادان بهویژه نوزادان نارس با عوارضی مانند بیماریهای مزمن ریوی، رتینوپاتی، آسیبهای اکسیداتیو و انتروکولیت نکروزان همراه بوده است. افزایش سطح هورمونها و فاکتورهای رشد در کیسه خون اهداکننده چندین برابر میزان طبیعی هورمونهای یک نوزاد است و این افزایش سطح، عوارضی مانند آنژیوژنز و واسکولاریته بیشتر شبکیه و در نتیجه رتینوپاتی را به دنبال دارد. تزریق پلاکت در بیماری که آنتیبادی ضدپلاکتی دارد بایستی با احتیاط صورت گیرد و گفتنی است که بیماری ITP که در آن تخریب ایمونولوژیک پلاکتها صورت میگیرد از موارد استعداد به لختهپذیری (Hypercoagulablity) به دلیل حضور پارتیکلهای پلاکتی میباشد که توانایی فعالسازی سیستم انعقاد را دارا هستند. همچنین تزریق پلاکت در مبتلایان به TTP (ترومبوسیتوپنی پورپورای ترومبوتیک) و HIT (ترومبوسیتوپنی ناشی از هپارین) قدغن است. افت PH کیسه پلاکت به کمتر از 6/2 موجب تخلیه گرانولهای پلاکتی شده و با رها شدن هیستامین و مواد اثرگذار بر عروق (vasoactivator) عوارض ناگواری در پی دارد. پلاکتها دارای گیرنده برای هورمون ترومبوپوئتین (TPO) میباشند، ازاینرو تزریق نابجا و بیشازحد فراوردهی پلاکت با جذب TPO موجب به تعویق افتادن بهبودی از ترومبوسیتوپنی میگردد.
امروزه عارضهی نامطلوب آسیب حاد ریوی در گروه مقدم واکنشهای مرگآور است. تزریق پلاسما و در درجهی دوم پلاکت و در آخر گلبول قرمز در بروز این عارضه نقش دارند. گرچه استفاده از پلاسمای جنس مذکر تا حدودی در کاهش این عارضه موفقیتآمیز بوده است ولی به نظر میرسد که فراوردههای کنسانتره و شستهشده بهویژه برای تزریق به کودکان مناسبتر باشد.
واکنشهای گرافت و کایمریسم
واکنشهای نامطلوب گرافت (TA-GVHD) و میکروکایمریسم ناشی از تزریق خون (TA-MC) به علت حضور لنفوسیتهای اهداکننده در گردش خون بیمار رخ میدهند و با اشعه دادن کیسه خون و پلاکت و یا با بکارگیری تکنولوژی کاهش پاتوژنها قابل پیشگیری هستند، در هر دو روش تخریب DNA موجب جلوگیری از تکثیر سلولی میگردد.
واکنش گرافت
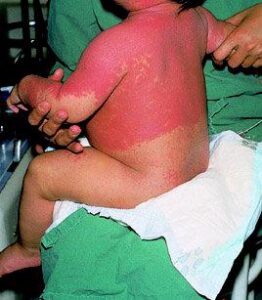
چنانچه لنفوسیتهای زنده در کیسه خون یا فراورده پلاکتی و یا گرانولوسیتی توسط سیستم ایمنی بیمار نابود نشوند، پدیده کشنده گرافت با علائم درماتیت، اسهال، هپاتیت و کمخونی اپلاستیک با پانسایتوپنی در سه تا سی روز پس از تزریق آغاز شده و در مدت 3 هفته موجب مرگ میشود. تب و ظاهر شدن بثورات پوستی ماکولاپاپولا که از نواحی مرکزی بدن شروع و به دست و پا سرایت میکند از نشانههای نخست سندرم گرافت است. تهاجم لنفوسیتهای اهداکننده به بافتهای پوست، کبد، مغز استخوان و گوارش موجب مرگومیر 100% است. گرچه با علائم بالینی میتوان سندرم گرافت را تشخیص داد ولی چنانچه انتظار آن نمیرود میتوان تشخیص را با روشهای مولکولی از قبیل یافتن DNA یا لنفوسیتهای اهداکننده در خون یا نمونه بافتی مورد تأیید قرارداد.
تابش 2500 راد اشعه گاما با سزیم 137 یا کبالت 60 و یا تابش اشعه X به فراوردههای خونی موجب تخریب DNA و ناتوانی لنفوسیتها برای تکثیر و تهاجم در بدن بیمار میگردد.
فاکتورهایی که خطر واکنش گرافت را به دنبال دارد:
- تزریق فراوردههای تازه و دوزاژ لوکوسیتی فراورده
- درجه سازگاری آنتیژنهای بافتی
- تزریق داخل رحمی و تعویض خون
- شرایط بالینی بیمار
کاهش ارثی ایمنی سلولار، لنفوم هوچکین، شیمیدرمانی با آنالوگهای پورین (فلودارابین، کلادریبین، دِاکسی کوفورمایسین)، درمان با آنتی CD52، کودکان با نواقص ارثی قلب و بیماران مبتلا به کمخونی اپلاستیک که با گلبولین ضدلنفوسیتی درمان میشوند بایستی خون و پلاکت اشعهدیده جهت جلوگیری از واکنش گرافت را دریافت دارند. توجه داشته باشید که خون تازه و فراوردههای تازهی پلاکتی و گرانولوسیتی حاوی لنفوسیت بیشتری است، زیرا تعدادی از لنفوسیتها در خون مانده شده اپوپتوز میشوند. شانس سندرم گرافت در حالتی که اهداکننده برای آنتیژنهای HLA هموزیگوت و بیمار دارای یک هاپلوتیپ مشترک با اهداکننده باشد بیشتر است، زیرا در این صورت لنفوسیتهای اهداکننده برای بیمار غریبه محسوب نشده و امکان تکثیر و تهاجم لنفوسیت اهداکننده به بافتهای بیمار را فراهم میکند. گفتنی است که هر فراوردهای که امکان تشابه HLA دارد بهجز فراورده سلول مادر بایستی مورد تابش اشعه گاما یا X قرار گیرد، فراوردههای خونی از اقوام درجه اول و دوم در این گروه قرار دارند.
واکنش گرافت بهطور شایع در مواردی که بیمار یک هاپلوتیپ مشترک HLA با اهداکننده که ازنظر HLA که هموزیگوت باشد رخ میدهد. این پدیده تشابه HLA در میان بستگان درجه اول دیده میشود
واکنش گرافت ناشی از تهاجم لنفوسیتهای اهداکننده به بافتهای گوارش، پوست، کبد و مغز استخوان است که مرگ در سه هفته پس از بروز علائم بالینی را به همراه دارد. تب و ظاهر شدن راشهای پوستی در سطح سینه و شکم و کف دستها از علائم نخست است که پس از سه تا سی روز از تزریق خون یا فراوردههای پلاکتی و یا گرانولوسیتی مشاهده میشود
اگرچه فیلتر کردن فراوردههای خونی با لوکوتراپ شانس بروز سندرم گرافت را کاهش میدهد ولی مانع آن نمیگردد. تزریق فراورده گرانولوسیتی بیشترین امکان واکنش گرافت را دارد چون بهصورت تازه مصرف میشود و از طرف دیگر بیماران متقاضی این فراورده دچار ضعف ایمنی و نوتروپنی میباشند. کودکانی که عمل جراحی قلب دارند ازآنجاکه ممکن است نواقص قلبی در زمینهٔ کمبود ایمنی ناشناخته مانند سندرم دیجورج باشد، ازاینرو بایستی فراورده اشعهدیده را دریافت دارند. تمام فراوردههای سلولی مانند گلبولهای قرمز، پلاکت، گرانولوسیت و پلاسمای تازه منجمدنشده دارای سلولهای T زنده بوده و نیاز به اشعه دادن جهت جلوگیری از واکنش گرافت است. گفتنی است در ژاپن به علت تشابه HLA در میان غیربستگان با آمار 1:847 تمام فراوردههای خونی سلولی را برای تمام بیماران مورد تابش اشعه گاما (Universal Irradiation) قرار میدهند.
میکروکایمریسم (microchimerism):
میکروکایمریسم به حالتی اطلاق میشود که سلولهای غیربومی که ژنتیک آنها غیر از شخص است توسط تزریق فراوردههای سلولی خون یا پیوند بافت و یا حاملگی بهصورت طولانیمدت (حتی تا 60 سال) در بدن باقی مانده و حدود کمتر از 5 درصد از لوکوسیتها را دربرگیرد. گفتنی است که در دو روز اول پس از تزریق، حدود 99/9 درصد از لنفوسیتهای فراوردههای سلولی از گردش خون بیمار با ایمنی سالم، پاک میگردند. بیشترین شیوع ایجاد میکروکایمریسم در بیماران ترومایی در رابطه با تزریق خون گزارش شده است، گرچه در آنمی داسی شکل و تالاسمی هم گزارش گردیده است. تشخیص آزمایشگاهی میکروکایمریسم از طریق یافتن DNA دهنده در میان انبوه DNA بیمار و با روشهای مولکولی مانند Real Time PCR و یا یافتن کروموزوم Y در خانمی که از اهداکننده مذکر خون دریافت کرده است، میباشد. در رابطه با پدیده میکروکایمریسم اگرچه تاکنون عوارضی گزارش نشده است ولی امکان ابتلا به بیماریهای اتوایمیون در آینده مورد پرسش است. تداخل در آزمایشهای مولکولی و ژنتیکی با روشهای حساس آزمایشگاهی، برای مثال یافتن پلیمورفیسمهای اضافی HLA اهداکننده در خون بیمار از این موارد است. به نظر میرسد که میکروکایمریسم نوع ناقصی از واکنش گرافت باشد که توسط سیستم ایمنی تحت کنترل درآمده و از تهاجم لنفوسیتها به بافت جلوگیری شده است.
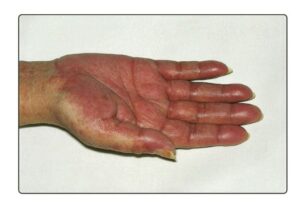
اریترودرم بعد از جراحی (Post Operative Erythroderma) POE
اریترودرم بعد از جراحی یا POE گونهای از تظاهر سندرم گرافت ( TA-GVHD) میباشد که برای بار نخست در ژاپن به دنبال جراحی قلب در بیماری که فراورده خونی دریافت کرده بود، مشاهده گردید و ازآنجاکه در جمعیت ژاپنیها تشابه HLA با شیوع بالا یافت میشود به نظر میرسد که درجاتی از تشابه HLA موجب بروز پدیده اریترودرم و بثورات جلدی متعاقب تزریق خون و فراوردههای سلولی آن میگردد و از آن پس واکنش گرافت متوقف میشود. با توجه به اینکه کمبود ایمنی در بیماران مبتلا به اریترودرم مشاهده نشده است، ازاینرو امکان دارد که سیستم ایمنی موفق به متوقف کردن واکنش گرافت شده است.
تزریق خون و لنفوسیتهای مونوکلونال B در اهداکننده
پیشرفت آنالیزورهای چندپارامتری فلوسایتومتری این امکان را فراهم ساخته است تا بتوان تعداد اندک از لنفوسیتهای مونوکلونال B را در گردش خون افراد سالم که هیچگونه علائم بالینی ندارند مشخص کرد. لنفوسیتوز مونوکلونال یا MBL (Monoclonal B Lymphocytosis) بر اساس آستانه شمارش 500 عدد لنفوسیت مونوکلونال B در میلیمتر مکعب، در دو دسته H-MBL (>500/ µl) و L-MBL (<500/ µl) طبقهبندی میگردد. حروف H و L به مفهوم High و Low میباشند.
MBL با شمارش پایین را نیز لنفوسیتوز مونوکلونال اسکرین (Screening MBL) مینامند. گزارشها از شیوع MBL بسیار متغیر است و از 2% در افراد 40 تا 60 سال و 6 تا 8 درصد در افراد بالای 60 سال در جمعیت نرمال گزارش شده است. شیوع MBL در اقوام درجه یک فرد مبتلا به لوسمی مزمن لنفوسیتیک 12 تا 18 درصد حتی در سنین بین 16 تا 40 سالگی نیز گزارش شده است. MBL در سه دسته به شرح زیر طبقهبندی میگردد:
1- شبیه به CLL (لوسمی مزمن لنفوسیتیک) با مارکرهای +CD5+، CD23،
2- شبیه به لوسمی مزمن لنفو سیتیک آتیپیک با مارکر +CD5
3- شبیه به سلولهای لنفوم مارژینال با مارکر –CD5
گفتنی است که H-MBL (Clinical MBL) شبیه لوسمی مزمن لنفوسیتیک در مرحله صفر طبقهبندی Rai قرار میگیرد و درواقع یک پیشبدخیمی بهسوی تبدیل به CLL است. گرچه استــــفاده از خون فیلتر شده (LR-RBC) انتقال لنفوسیتهای مونوکلونال را به بیمار کاهش میدهد ولی گزارشها از شیوع بیشتر لوسمی مزمن لنفوسیتیک و لنفوم غیرهوچکین در گیرندگان خون این مسئله را مطرح کرده است که آیا اسکرین اهداکنندگان ازنظر MBL ضروری است یا خیر؟ آیا انتقال لنفوسیتهای مونوکلونال B به افراد با ضعف ایمنی پرخطر است؟ آنچه منطقی به نظر میرسد این است که L-MBL ممکن است روند طبیعی سیستم ایمنی در رابطه با سن باشد، ولی گرفتن پیوند از شخص با H-MBL یا پذیرفتن آنها بهعنوان دهندهی خون یا سلول مادر خونساز طبق جدول زیر سفارش نمیشود.
برگرفته از کتاب خونشناسی ویلیامز، 2016
دستکاری سیستم ایمنی با تزریق خون و فراورده آن
یک پاسخ ایمنی مناسب نیاز به تنظیم ظریف تمام اجزای سیستم ایمنی دارد. لنفوسیتهای T کمکی +CD4 آنتیژن را از طریق کمپلکس آنتیژن بافتی (MHC) کلاس 2 که روی سلولهای محدودی مانند سلولهای B و ماکروفاژها وجود دارد، شناسایی میکنند، درحالیکه لنفوسیتهای Tسیتوتوکسیک آنتیژنها را از طریق کمپلکس MHC کلاس یک که روی سلولهای هستهدار وجود دارد مورد شناسایی قرار میدهند.
پاسخ TH1 موجب تکثیر سلولهای +CD4 و رها شدن اینترلوکین 2، اینترفرون گاما و فعالیت ماکروفاژها میگردد، درحالیکه فعالیت TH2 با ترشح اینترلوکینهای 4،5،6 و 10 موجب تحریک سلولهای B و ترشح آنتیبادی میشود. تزریق خون و فراوردههای سلولی آن موجب آلوایمونوزاسیون، تحملپذیری (Tolerance) و سرکوب ایمنی میشوند. توجه داشته باشید که سازگاری سیستم MHC یا آنتیژنهای بافتی لوکوسیتها در تزریق خون در نظر گرفته نمیشود و از طرفی در روند یک پاسخ ایمونولوژیک، سلولهای ارائهدهنده آنتیژن از قبیل سلولهای دندریتیک و ماکروفاژها با ارسال علائم و سیگنالهای تحریکی سیستم ایمنی را فعال میکنند، ولی آنچه در تزریق خون اتفاق میافتد سردرگمی سیستم ایمنی است که بهطور ناگهانی انبوه آنتیژن را از طریق گردش خون دریافت میکند و نتیجه آن اپوپتوز سلولهای T و بیپاسخی (anergy) سیستم ایمنی است. آنتیژنهای لوکوسیتی بهویژه آنتیژنهای رها شده از سلولهای مرده لوکوسیتی بهطور عمده موجب تحریک سلولهای TH2 که نتیجه آن تولید آنتیبادی است میشود و این در حالی است که فعالیت TH1 و رها شدن اینترلوکین 2 و اینترفرون گاما و فعالیت ماکروفاژها کاهش مییابد.
ترانسفیوژن با آسیب به تکثیر سلولهای T، برهم زدن نسبت CD4:CD8 و کاهش دادن سایتوکاینهای TH1 و فعالیت ماکروفاژها و سلولهای کشنده طبیعی موجب واکنشهای تریم (TRIM) یا دستکاری در سیستم ایمنی میگردد. در لغت تریم حروف TR به مفهوم Transfusion Related و IM به مفهوم دستکاری در ایمنی یا Immuno modulation است. درجه واکنشهای تریم وابسته به تعداد لوکوسیتهای فراورده است، گرچه استفاده از خون فیلتر شده (LR-RBC) واکنشهای تریم را بهطور چشمگیری خاموش میکند ولی بهطور کامل مانع آن نشده است.
در تهیه فراورده پلاکتی برای کاهش آلودگی با فلورهای پوستی، 20 تا 30 سیسی خون اهداکننده از شروع خونگیری وارد کیسه انحرافی و از آن پس وارد کیسه اصلی میگردد. استفاده از فیلترهای لکوتراپ که در مسیر تعبیه شده است نهتنها شانس سرایت ویروس CMV را کاهش میدهد بلکه موجب کاهش پدیده رفراکتوری به تزریق پلاکت و کاهش بروز تب و لرز میشود
گفتنی است که واکنشهای تریم ممکن است موجب جلوگیری از سقط مکرر خودبهخود و بهبودی برخی از بیماریهای اتوایمیون مانند بیماری کرون (Crohn) گردد، از سوی دیگر واکنشهای TRIM ناشی از تزریق خون، شانس عفونتهای جراحی، عود تومور و سنتز آنتیبادی علیه HLA و آنتیژنهای ناسازگار گروه خونی را افزایش میدهد. ترانسفیوژن با واردکردن لاشههای ریز سلولی به گردش خون، سیستم ماکروفاژی رتیکولواندوتلیال در سراسر بدن را مشغول فاگوسیتوز این ذرات کرده و فرصت بهتری برای تکثیر و عفونتزایی میکروبها در میان این طوفان آنتیژنی فراهم میکند.
فراورده گلبول قرمز و پلاکت فیلتر شده با لوکوتراپ با برداشت 3 لگاریتم از گلبولهای سفید دارای کاهش خطر انتقال ویروس سیتومگال است. بنا به استانداردهای AABB تعداد گلبولهای سفید کیسه فیلتر شده باید کمتر از 5× و یا بنا به استانداردهای اروپا کمتر از 1× باشد. با روش فیلتراسیون شانس سرایت ویروس CMV در بیماران با کاهش ایمنی که از نظر ویروس سرونگاتیو بودهاند از 25 تا 30% به صفر تا 2/5% افت کرده است. شانس سرایت ویروس CMV از اهداکنندگان سرونگاتیو حدود 1/3% است، ازاینرو فیلتراسیون با در نظر گرفتن شیوع 2/4% در مقابل 1/3%، نقش مهمی در کاهش سرایت ویروس CMV که مخزنش درون گلبولهای سفید است، داشته است. از افراد سرونگاتیوی که در خطر مرگومیر ناشی از انتقال ویروس سیتومگال به علت ترانسفیوژن هستند میتوان به تزریق خون داخل رحمی به جنین، نوزاد با وزن کمتر از 1250 گرم، کاهش ایمنی ارثی، گیرندگان پیوند سلول مادر یا پیوند بافت توپر از اهداکننده سرونگاتیو، اشاره کرد.
با برداشت گلبولهای سفید از فراوردههای خون میتوان از تحریک ایمنی علیه آنتیژنهای HLA، از انتقال ویروس CMV، از سرکوب ایمنی، از بروز سندرم گرافت و از بروز واکنشهای تبزا جلوگیری کرد
گفتنی است که فراورده گلبول قرمز و پلاکت کملوکوسیت 75 تا 95% از موارد واکنش تبزای غیرهمولیتیک را کاهش داده است و این به علت کاهش ترشح سایتوکاینهای IL-1، IL-6، IL-8 و TNF در طول دوران نگهداری است. فراورده فیلترشده شانس سرایت ویروس هرپس و EBV را نیز کاهش میدهد. برای هر بیماری که طولانیمدت نیاز به تزریق پلاکت دارد بایستی از اولین ترانسفیوژن اقدام به تزریق فراوردههای کملوکوسیت گردد در غیر این صورت تولید آنتیبادی علیه آنتیژنهای HLA موجب پدیده رفراکتوری یا بیپاسخی به تزریق پلاکت میشود و تزریق پلاکت به علت حضور آنتیبادیهای ضد HLA بیاثر میشود. تزریق خون فیلتر شده با لکوتراپ عوارض ناشی از جراحی قلب را کاهش داده است.
واکنشهای غیر عفونی انتقال خون
اندیکاسیون تزریق خون و فرآوردههای خونی در بیماران مبتلا به سرطان
واکنش تبزای غیرهمولتیک ناشی از انتقال خون (FNHTR)
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام