FISH
مروری بر روش هیبریداسیون فلوئورسانس درجا
شاهین اسعدی دانشجوی ژنتیک مولکولی – دکتر مهدی قیامی راد (میکروبیولوژیست ) استادیار دانشگاه
1- چشم انداز و تاريخچه هيبريداسيون درجا[1]
پس از اثبات اينكه تعداد كروموزومهاي سلولهاي سوماتيك انساني 46 عدد ميباشد
(Levan و Tjio، 1956 و Ford و همكارانش، 1956) و نيز كشف ارتباط تريزومي 21 با سندرم داون (Lejeune و همكارانش، 1959)، روشهاي تشخيص سيتوژنتيك در كارهاي باليني روزمره وارد شد. پيشرفت بعدي سيتوژنتيك پس از بوجود آمدن روشهاي باندينگ كروموزومي بود (Casperson و همكاران، 1968) كه تعيين يكايك كروموزومهاي انساني را ميسر ساخت و به اين صورت كوچكترين انحرافات كروموزومي را معين نمود. دقت تجزيه و تحليل سيتوژنتيك بطور عمده به گسترش پرومتافازي و باندينگ وابسته است كه ميزان آن Mb2-5 است و ميتواند ناهنجاريهاي كوچك كروموزومي مثل (13q13) del در سندرم رتينوبلاستوما و (15q13) del براي سندرم Prader-Willi را مشخص كند.
اولين گزارش در مورد روش هيبريداسيون توسط Mamur و Lane در سال 1961 صورت گرفت و آنها نشان دادند كه ملكولهاي DNA ميتوانند تحت شرايط كنترل شدهاي از هم گسيخته شوند و سپس به يكديگر متصل گردند. به علت اينكه پيوندهاي هيدروژني ضعيفتر از باندهاي كوالان موجود در ساختمان DNA هستند، در اثر حرارت دو رشته DNA از يكديگر گسسته ميشود، بدون اينكه بازها از ستون اصلي يا Back bone قند– فسفات جدا شود؛ وقتي دوباره شرايط به حـــــالت عادي مثل دماي كمتر از دماي ذوب[2] برگردد، رشتههاي موجود دوباره به همديگر ميپيوندند. از هم بازشدگي دو رشته يا واسرشت شدن[3] و دوباره پيوند شدن[4] دو رشته DNA بستگی به ميزان GCهاي DNA و نيز PH محيط دارد.
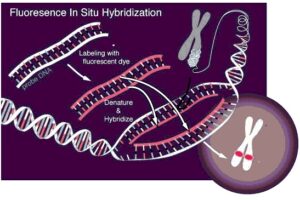
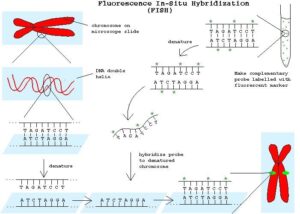
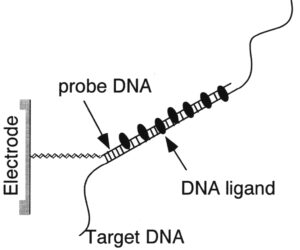
چنانكه در مرحله دوباره پيوند شدن فقط دو رشته مكمل DNA وجود داشته باشد، پيوند شدن بطور كامل صورت ميگيرد اما چنــانكه ترادفي از اسيدهاي نوكلئيك -كه بنام پروب Probe يا نشانگر مطرح است- حضور داشته باشد، ميتواند به قسمت خاصي از ملكول اصلي DNA كه مكمل آن است هيبريد شود. (شكل 1-1)
شكل 1-1: نقش پروب در شناساندن جايگاه خاص روي ژنوم
در سال 1969 Gall، Paradue و نيز John و همكارانش، روش هيبريداسيون درجا ايزوتوپيك[5] را ابداع كردند. اين روش كه اغلب روش مستقيمي جهت مطالعه محل قرارگيري تواليهاي DNA روي كروموزوم بود به عنوان يك روش روزمره در جهت تعيين نقشه ژني، در بسياري از آزمايشگاهها در دهه 1970 ميلادي مطرح بود.
اولين بار در سال 1981، Gerhard و همكارانش و نيز Malcolm و همكارانش و همچنين Harper و همكارانش امكان جايگزيني تواليهاي تك كپي از ژنهاي منفرد را توسط روش هيبريداسيون درجا ايزوتوپيك نشان دادند.
با پيشرفتهاي ايجاد شده در دهه 1980 توسط Rapp و همكارانش 1990 هيبريداسيون درجا غير راديواكتيو جهت حل برخي از محدوديتهاي مواد راديواكتيو معرفي شد. در اين روش، پروب ايزوتوپيك نشاندار شده، با هاپتنهاي غير راديواكتيوي كه توسط روشهاي ايمنولوژيكي و با استفاده از آنتيباديهاي اختصاصي هاپتن شناسايي ميشد، جايگزين گرديد.
آنتيباديها با آنزيمها و رنگهاي فلورسانت[6] (Fluorescent dyes) واكنش نشان ميدادند.
هيبريداسيون فلورسانس درجا[7] (FISH) ابتدا توسط Landegent و همكارانش
(1984) معرفي شد و طي چند سال بطور فزايندهاي رشد كرد. دلايل متعدد اين پيشرفت، سرعت قابل توجه، بهبود ميزان دقت سيگنال و پيشرفت ابزارهاي اپتيكي براي تجزيه و تحليلهاي دو بعدي و سه بعدي از نمونههاي نشاندار شده است. FISH امروزه انقلابي در ژنتيك انساني ايجاد نموده است و در علوم پايه، سرعت مطالعات ژنومي را بطور بسيار محسوس بالا برده است و در تهيه نقشه ژني، نقش حائز اهميتي دارد. از نظر تشخيصي، FISH باعث تعيين و شناسايي آنوماليهاي پاتولوژيكي كروموزومي درسرطان شناسي (Nederlof و همكاران 1989، Arnoldus و همكاران 1990 و Smith و همكاران 1991) و همچنين ناهنجاريهاي مادرزادي (Kuwane و همكاران 1991) و انحرافات تك ژني (Ried و همكاران 1990) ميشود.
هيبريداسيون درجاي فلورسانس با بهرهگيري از پروبهاي اختصاصي كروموزومي ميتواند تعداد نسخههاي كروموزومهاي معيني را در هستههاي اينترفازي مشخص كند.(Lichter و همكاران، 1988 و Pinkel و همكاران، 1988) و اين روش اصطلاحاً بنام سيتوژنتيك اينترفازي ناميده ميشود. مهمترين مزيت اين روش، عدم نياز به كشت سلولي و در نتيجه حصول نتيجه در عرض دو روز است. اين روش، داراي كاربردهاي مهمي براي تجزيه و تحليل آنوپلوئيدي موجود در كروموزومهاي جنين با استفاده از سلولهاي مايع آمنيوتيك كشت نشده است.
امروزه پتانسيل روش FISH توسط تشخيص همزمان پروبهاي چندگانه كه هر كدام با هاپتن جداگانهاي نشاندار ميشوند، افزايش مييابد. تعداد ترادفهايي كه بطور همزمان ميتواند در يك آزمايش هيبريداسيون ساده شناسايي گردد، ميتواند بوسيله نسبت نشاندار كردن، افزايش يابد. سيستمهاي ديجيتالي تصويري، مثل دوربين CCD با قابليتهاي پردازش تصوير عالي، ميزان حساسيت تشخيص و پتانسيل FISH چند رنگي را در سيتوژنتيك باليني بهبود ميبخشد.
2-1- مباني مقدماتي هيبريداسيون فلوئورسانس درجا:
هيبريداسيون درجا (ISH) عبارتي است كه جهت توضيح هيبريداسيون كروموزومها و كروماتين در طي سيكل سلولي توسط پروبهاي نشاندار شده اسيدهاي نوكلئيك بكار ميرود. روند روش بدين گونه است كه وقتي DNAي دو رشتهاي حرارت ميبيند، رشتهها از هم باز ميشوند. اگر دما كاهش يابد، رشتهها مجدداً به همديگر متصل شده و اصطلاحاً Anneal ميشوند (شكل 2-1 و 3-1). حساسيت ISH وابسته به متغيرهاي ذيل است:
الف- كيفيت بافت مورد نظر و ملكول هدف براي هيبريداسيون (اعم از DNA يا RNA)
ب- نوع پروب بكار رفته و خاصيت پروب نشاندار شده و حساسيت روش بكار رفته جهت تشخيص سيگنال
ج- اثر شرايط هيبريداسيون
د- حساسيت و ميزان دقت روشهاي مشاهده
شكل 2-1: نمايش شماتيك مراحل انجام FISH بر روي گسترشهاي اينترفاز و متافاز
3-1- تهيه نمونه: روش FISH ميتواند براي تشخيص اختلالات كروموزومي بر روي انواع مختلفي از نمونهها؛ از سلولهاي اينترفازي و متافازي حاصل از كشت سلولهاي خون محيطي گرفته تا سلولهاي آمنيوسيت جنيني كشت داده نشده و تومورهاي توپر مورد استفاده قرار گيرد.
اغلب نمونههاي مورد نياز براي FISH نمونههايي هستند كه روي لامهاي ميكروسكوپي قرار دارند، اما نمونههاي سلولي موجود در سوسپانسيون نيز بطور موفقيت آميزي توسط برخي از محققين (Trask و همكاران در 1988) براي FISH استفاده گرديدهاند.
سلولهاي كشت داده شده يا نمونههايي كه براي تهيه سلولهاي اينترفازي مورد استفاده قرار ميگيرند، ابتدا با محلول هيپوتونيك آماده ميشوند. اين آماده سازي، سلولها را متورم ميكند و كروموزومها را جهت فيكس كردن از هم جدا كرده و آماده ميسازد. غلظت پائيني از محلول هيپوتونيك ميتواند سلولهاي اينترفازي را بخوبي متورم كند و اين كار جهت مشاهده سيگنالهاي چند رنگي بسيار حائز اهميت است، زيرا فضاي كافي براي مشاهده هدفهاي مورد نظر در سلولهاي كشت داده نشده اينترفازي مورد نياز است. سلولهاي بدست آمده بايستي پس از قرار گرفتن در محلول هيپوتونيك، مراحل فيكس كردن را بگذرانند. ثبوت يا فيكساسيون باعث ميشود مورفولوژي بافت به حالت طبيعي باقي مانده و حداقل ميزان اسيدهاي نوكلئيك از دست برود.
مورفولوژي و نفوذپذيري نمونهها، نقش مهمي در آزمايشهاي هيبريداسيون درجا دارند. يك رابطه ملكولي بين ميزان ثابت نمودن و نفوذپذيري بافت وجود دارد. فيكس كردن زياد نمونهها ممكن است شكل كروموزومها يا سلولها را به خوبي حفظ كند، اما دسترسي پروب و مواد تشخيصي را كاهش ميدهد. متانول و اسيداستيك (به نسبت 1:3) كاربرد وسيعتري نسبت به ساير فيكساتيوهاي ديگر مثل گلوتارآلدئيد يا فرمالدئيد در روش FISH دارند، زيـــــرا آنها نفوذ پذيري بافت را بطور قابل ملاحظهاي كاهش نميدهند (Leith و همكاران در سال 1994)، نمونهها روي لامهاي آزمايشگاهي از نوع نمونههاي متافازي يا اينترفازي فيكس ميشوند.
اين لامها بايستي كاملاً عاري از هر گونه چربي يا لك باشند زيرا در آن صورت كروموزومها يا هستههاي آماده شده، نميتوانند به خوبي روي لامها بچسبند و در طي روند هيبريداسيون In Situ كنده شده و گم ميشوند. لامها همچنين ممكن است با يك ماده چسبندهاي پوشانده شود تا ميزان چسبندگي مواد فيكس شده را افزايش دهد، اين مرحله زماني بسيار حائز اهميت است كه اندازه نمونه، محدود بوده و با اين كار در هنگام شستشو و مراحل تشخيص، مانع از جدا شدن نمونه شود. ماده (APES) Aminopropyl-triethoxysilane –3 به عنوان يك ماده چسبنده، باعث بهبود كيفيت سلولها و بافت ميشود.
جهت از بين بردن RNAي سيتوپلاسمي و RNAي هستهاي از Rnase-A استفاده ميشود و اين عمل باعث جلوگيري از اتصالات غير اختصاصي ايجاد شده با پروب ميشود. استفاده از آنزيم جهت از بين بردن پروتئينها (مثل پروتئيناز K) نيز ميتواند دسترسي پروبها و مواد تشخيص را آسانتر نمايد. اگر نفوذ مواد مشكل باشد، ميزان غلظت آنزيم ميتواند افزايش يابد، اما اگر مورفولوژي سلول يا كروموزوم پايين باشد بايستي ميزان غلظت كاهش يابد.
استفاده از پاك كنندهها جهت پاك كردن سطح غشاء ليپيدي در اطراف DNAي هدف است. پروتئاز نيز جهت افزايش دسترسي پروب به DNA توسط تجزيه پروتئينهايي كه در اطراف اسيدهاي نوكلئيك هدف ميباشد، مفيد بوده، اما موفقيت استفاده از پروتئاز در نمونههاي متافازي كم است، زيرا آنها به كروموزومها چسبيده و مورفولوژي هستهها را تغيير ميدهند. گزيلن و استون نيز جهت پاك كردن برخي از اجرام زايد ديگر بكار ميرود.
Figure 1-3: Schematic
4-1- پروبها (Probes):
پروب يك قطعه اختصاصي براي هيبريداسيون In Situ است. خالص بودن، اندازه و نيز ميزان اختصاصي بودن يك پروب نقش اساسي در تعيين سيگنالهاي بوجود آمده در روش هيبريداسيون درجا دارد.
ترادفهاي DNA معمولاً با استفاده از پروبهاي DNA مشخص ميشوند، در حالي كه براي تشخيص RNA ميتوان از پروبهاي DNA يا RNA استفاده كرد، بهترين طول براي پروبهاي هيبريداسيون درجا حدود 100 تا bp 300 است. پروبهاي كوتاهتر داراي ثبات پائينتر در هيبريداسيون و پروبهاي طويلتر (خصوصاً بيش از Kb1) ممكن است مشكلات نفوذ در بافت داشته باشند.
در عمل، تكنولوژي نوتركيبي DNA قادر به كلونينگ و تخليص ترادف DNA است
پروبهاي با طول كوتاه معمولاً بطور شيميايي ساخته ميشوند، اما اغلب پروبها، قطعات كلون شده DNAي طبيعي هستند. تكنولوژي DNA نوتركيب امروزه دسترسي به قطعات DNA مورد نظر براي تحقيقات ملكولي را آسان كرده است. قطعات DNA بعد از كلون شدن در سيستمهاي ميكروبي به مدت چندين سال در دماي °70- سانتیگراد و در گليسرول 20-15% ميتوانند نگهداري شوند.
سلولهاي ميزبان واجد DNAي پروب را ميتوان در محيط كشت مناسب كشت داد و سپس DNAي استخراج شده را بعد از نشاندار كردن به عنوان پروب مورد استفاده قرار داد.
از هر 80 ميليليتر سلول ميزبان كشت داده شده حدود 200-100 ميكروگرم DNAي پروب (بسته به نوع و اندازه ناقل) حاصل ميشود. البته كيتهاي جداسازي DNA امروزه، بطور آماده جهت جدا كردن DNAي پلاسميد و كاسميد قابل دسترسي هستند.
5–1– تشخيص همزمان ترادفهاي چندگانه:
شناسايي چندين رنگ از پروبهاي نشاندار شده متفاوت، نياز به تركيب دو يا چند سيستم تشخيصي جهت استفاده در يك منطقه هيبريداسيون واحد دارد. اين روش بر اين نظر متكي است كه هر هاپتني ميتواند به يك آنتيبادي اختصاصي متصل شود و با يك نوع رنگ فلورسنت شناسايي گردد. در آزمايش FISH دو رنگي، مخلوطهاي تشخيصي حاوي آنتيباديهايي اختصاصي براي هر ماده نشاندار كننده (Label) است كه بطور مختلفي با رنگهاي فلوروكروم متصل ميشوند. وقتي سه مورد از فلوروفورهاي قابل شناسايي موجود هستند ترادفهاي مجزاي DNAي كروموزومي ميتواند بطور همزمان توسط تركيب فلوروفورهاي اختصاصي با سه پروب نشاندار شده مختلف شناسايي گردد (Nederlof و همكاران 1989).
تعداد ترادفهايي كه ميتواند بطور همزمان در يك آزمايش شناسايي شود توسط تشخيص پروبهاي مخلوط شده نسبي و نشاندار شده نسبي، با يك سيستم تشخيصي دوگانه و يا چندگانه افزايش مييابد. در اين روش ترادفها با پروبهاي ياد شده توليد علائم (سيگنال) با رنگهاي حد واسط، رنگهاي اصلي ايجاد ميكنند. با استفاده از سه سيستم تشخيصي و نشاندار شده، تعداد سيگنالهاي قابل شناسايي بطور همزمان ميتواند سير صعودي داشته باشد.
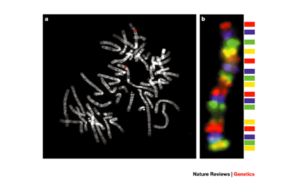
در تحليل روش FISH چند رنگي، براي تمام 22 جفت كروموزوم سوماتيك و كروموزومهاي جنسي توأماً 24 پروب رنگي كامل بكار رفته كه از طريق طيفي قابل تشخيص هستند.
بوسيله FISH تكرنگي جابجاييهاي مبهم و پيچيده بين دو قطعه و نوعي جابجايي نادر insertion و نشانگرهاي يك منبع نامشخص فوراً تشخيص داده ميشود.
در FISH دو رنگي، دو پروب كه به طور متفاوت رنگآميزي و نشاندار شدهاند (مثلاً با بيوتين يا ديگوگزي ژنين) با غلظتهاي درست و مناسب در هم آميخته ميشوند تا توأماً به عنوان DNA پروب يك FISH به كار روند.
مشاهده همزمان بيش از 2 هدف ممكن است با آميختن بيش از يك نشان در مقداري پروب، با نسبتهاي متفاوت و پيوند پروب نشاندار شده به طور متفاوت با هدفهاي ويژه محقق شود.
كاريوتايپينگ طيفي و شناسايي فوري هر يك از كروموزومها در مرحله متافاز امروزه از معمولترين كاربردهاي FISH چند رنگي ميباشد.
در اين روشها 24 پروب كروموزومي رنگي و 5 فلوروكروم در يك طرح نشاندار تركيبي بكار ميرود. (يعني براي اجراي طرح، نشاندار نمودن 24 پروب كروموزومي از 5 رنگ فلورسنتي استفاده ميشود) كه هر يك از 22 كروموزوم اتوزومي و x و y را به طور متفاوت نشاندار ميكند.
6-1- رنگآميزي زمينه و مشاهده (Counterstaining & Visualization):
به دنبال مراحل تشخيص، نمونهها بايد براي مشاهده با سيستمهاي مناسب آماده گردند. در روشهايي كه آنزيم در آنها نقش دارد، اسلايدها با يك معرف رنگي روشاول پوشانده شده و توسط ميكروسكوپ نوري مشاهده ميگردند، اما سلولهايي كه با آنتيباديهاي متصل شونده به فلوروسنت شناسايي ميگردند با يك ماده رنگ كننده زمينهاي مناسب بايد رنگآميزي شوند.
استفاده از ماده رنگ كننده زمينهاي، مشاهده آسان گسترههاي متافازي و هستههاي اينترفازي را تسهيل ميبخشد. DAPI (4 و 6 – دي آمينو – 2 – فنيل ايندول) يك رنگ زمينهاي آبي است كه ميتواند به همراه رنگهاي فلوروسانت سبز (FITC) و قرمز (Rhodamin و يا Texas Red) بكار رود.
Propidium Iodied (قرمز) يك رنگ زمينهاي ديگر است كه بطور مجزا مورد استفاده قرار ميگيرد و يا به همراه DAPI جهت مشاهده سيگنالهاي سبز استفاده ميشود. Propidium Iodied ميتواند قسمتي از زمينه سبز را روي كروموزومها يا هستهها بپوشاند و كيفيت نمونهها را افزايش دهد، بنابراين در سيستمهاي مرتبط با Texas Red و Rhodamin، سلولها نميتوانند توسط Propidium Iodied رنگ بپذيرند، چون سيگنالهاي قرمز بوسيله رنگ زمينهاي قرمز ناشي از Propidium Iodied پوشيده خواهند شد.
Citifluor يك ماده مرسوم جهت جلوگيري از محو شدن سيگنالها در مقابل ماده زمينهاي توسط نور فلوروسانت است.
محلهاي هيبريداسيون بوسيله فلوروكرومها و توسط يك ميكروسكوپ اپيفلوروسنس و فيلترهاي اختصاصي براي مشاهده فلوروكرومهاي آبي (جهت DAPI)، سبز (جهت FITC) و قرمز (جهت Rhodamin, Propidium Iodied و Texas Red) بكار ميرود. ميكروسكوپ تصويربرداري ديجيتال Digital imaging microscopy ميتواند جهت بهبود تشخيص سيگنالهاي ايجاد شده، در مقايسه با ميكروسكوپ معمولي بكار گرفته شود. ماده قابل تشخيص بوسيله چشم، مشخص و فوكوس شده و سپس تصوير بوسيله يك دوربين ثبت گرديده و روي مونيتور ظاهر ميشود.
اين سيستم داراي مزيتها و قابليتهاي تجزيه و تحليل تصاوير و بهبود كيفيت آنهاست. امروزه سيستم حساسي بنــــــــام دوربين (Charged Coupled device) CCD در دسترس قرار گرفته است كه اين سيستم اجازه تشخيص سيگنالهاي فلوروسانت كه با چشم معمولي قابل مشاهده نيستند را ميدهد، اما اين سيستم براي آزمايشگاههاي تشخيصي ضروري نيست. يكي از كاربردهاي اصلي سيستمهاي تصويربرداري ديجيتالي، توليد رنگهاي كاذب پس از هيبريداسيون نشاندار كردن نسبي[8] است كه اجازه ميدهد تا تفاوتهاي موجود بين رنگهاي حد واسطي كه با چشم معمولي به سختي تشخيص داده ميشود، بوضوح از هم مشخص گردد.
7-1- سيتوژنتيك سرطان:
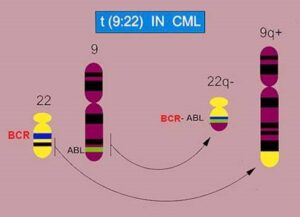
اولين گزارش در مورد سيتوژنتيك سرطان در سال 1960 توسط Nowell و Hungerfod و به هنگام كشف يك ماركر كوچك كاريوتايپي به عنوان كروموزوم فيلادلفيا (Ph)Philadelphia Chromosom در بيماران با لوسمي ميلوئيدي مزمن[9] كشف شد. اين اولين ناهنجاري كروموزومي ثابت در يك سرطان انساني بود. در دو دهه اخير، مطالعات FISH پيشرفتهاي چشمگيري را در تشخيص ناهنجاريهاي موجود در سلولهاي متافازي و اينترفازي لوسمي موجب شده است.
لوسمي ميلوئيد مزمن يك نوع ناهنجاري مربوط به توده سلولهاي بنيادي است كه با ازدياد توليد سلولهاي مغزاستخوان در تمامي مراحل تمايز همراه است و اغلب در افراد ميانسال مشاهده ميشود. CML براي اولين بار در قرن نوزدهم شناخته شد و مطالعات انجام گرفته روي موارد باليني و مورفولوژيك آن متمركز گرديده است.
در حدود 20-15% لوسميها در افراد بزرگسال مربوط به CML است. اين بيماري در افراد مذكر بيش از افراد مؤنث اتفاق ميافتد (نسبت 1:1/3).
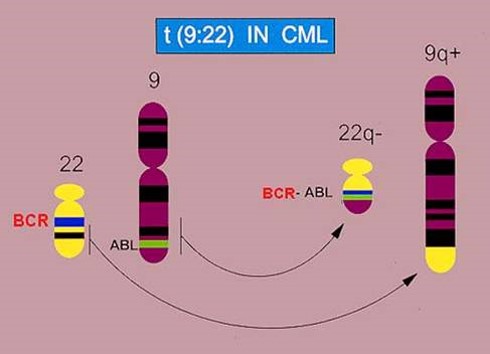
در اوايل كشف اين بيماري، امكان تعيين اينكه كروموزومهاي كوچك گروه G در تشكيل كروموزوم فيلادلفيا دخيل هستند ميسر نبود، بنابراين با پيشرفت روش Banding در دهه 1970 مشخص گرديد كه كروموزوم فيلادلفيا در حقيقت يك جابجايي يا Translocation بين كروموزوم 9 و 22 است t(9;22)(q34;q11).
در طي دهه 1980 يك سري تحقيقات نشان داد كه پروتوانكوژن ABLروي كروموزوم 9 بصورت جابجايي دوجانبه (Reciprocall Translocation) روي كروموزوم 22 و در نزديكي ناحيه ژن BCR قرار ميگيرد.
8-1- كاربرد FISH تك رنگي، دو رنگي و چند رنگي در تشخيص لوسميها:
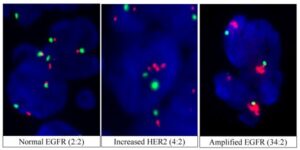
روش FISH در اشكال مختلف تك رنگي، دو رنگي و چند رنگي (شكل 7-1، 8-1 و 9-1) كاربرد وسيعي در تحقيقات و نيز در تشخيص بيماريهاي ژنتيكي دارد (جدول 1-1).
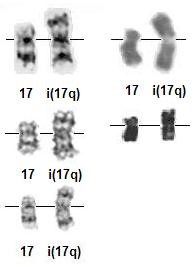
Nakagawa و همكارانش در سال 1992 حذف بازوي P كروموزوم 17 را در CML با استفاده از اين روش نشان دادند.
در اين حالت يك ايزوكروموزوم شماره 17 يا (q17)I بوجود آمده بود كه با استفاده از پروب سانترومري a-satellite، اختصاصي براي كروموزوم 17 شناخته شد.
نمای شماتیک از ایزوکروموزومی بازی بلند کروموزوم 17
شکل 7-1: نمای شماتیک از FISH تک رنگی
شکل 8-1: نمای میکروسکوپیک FISH دو رنگی
شکل 9-1: نمای شماتیک FISH چند رنگی
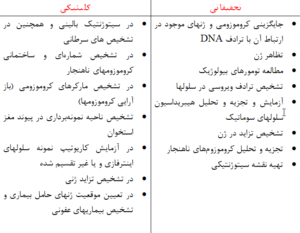
جدول 1-1: كاربرد هيبريداسيون فلورسنس درجا از نظر باليني و تحقيقاتي
علاوه بر همه اين مسائل، مطالعه بازآراييهاي كروموزومي بوسيله روشهاي FISH تك رنگي و چند رنگي امكان پذير است (كارهاي Kibbelaar و همكارانش در سال 1992).
:REFERENCES
- Brown T.A.(2010):Gene Cloning & DNA analysis,6thBlackwell science.
Albrts B.& Johanson A.and et al.(2002):Molecular Biologhy of the Cell.4th edn.NEW YORK:Garland science Publications.
- Bernard R.G.& Pasternak J.J.(2003):Molecular Biologhy,3rdWashington:ASM Press.
- Weaver R.F.(2002):Molecular Biologhy,2ndBoston:Mc Grow- Hill.
- Winter P.C.& Hickey G.I.et al.(1998):Genetics,Bios scientific publication.
- Nessbaum R.L.et al.(2001):Genetics in Medicine,6thW.B.Saunders Company.
- McPherson M.J.Moller S.G.(2001):PCR.New York Bios scientific publication.
- Gen X,Benjamin Lewin.com
WWW.Biotechnologhy in medicine.com
WWW.Genetic engineering Williams,Jeff G.com
- Old R.W.& Primrose S.B.(1994): principles of Gene Manipulation: an introducation to Genetic Engineering,5thBlackwell science.
- Watsin J.D., Gilman M., Witkowski J. and Zoller M. (1999): Recombination DNA.2nd New York:W.H.freeman.
- Kahl G.(2001): the Dictionary of Gene Technology,2ndWiley-VCH publication.
- Zhang HG,Hsu HC,Yang PA,Yang X,Wu Q,Liu Z, Yi N,and Mountz JD Identification of multiple genetic loci that regulate adenovirus gene therapy. Gene Therapy 2004
[1]. In Situ Hybridization (ISH)
[2] . Melting temperature
[3] . Denaturation
[4] . Reassociation
[5] . Isotopic In Situ Hybridization
[7] Fluorescence in situ hybridization (FISH)
[8] . Ratio-labelling
[9] . Chronic Myeloid Leukemia
https://www.frontiersin.org/articles/10.3389/fcell.2016.00089/full
https://medlabnews.ir/%d9%be%d8%a7%d9%86%d9%84-%d9%84%d9%88%da%a9%d9%85%db%8c-%d9%84%d9%86%d9%81%d9%88%d8%a8%d9%84%d8%a7%d8%b3%d8%aa%db%8c%da%a9-%d8%ad%d8%a7%d8%af-%da%a9%d9%88%d8%af%da%a9%d8%a7%d9%86-all-%d8%a8%d9%88/
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام