ادامه مبحث نانوبیوسنسورها: آیندهای برای تشخیص بیماریها
دکتر رضا میرنژاد ( دانشیار دانشگاه) – وهاب پیرانفر (کارشناس ارشد)
نانوبیوسنسورهای طبیعی
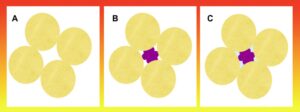
ساختار نانومواد به صورتی است که میتواند به عنوان یک زندان سه بعدی عمل کند. این مواد میتوانند درک جدید از بیوفیزیک پروتئینها و ساختارهای آن را ارائه کنند. این درک جدید به ما کمک می کند که در مورد حمل و نقل پروتئینها در مسیرهای پرتراکم سیتوپلاسم، مطالعات جدیدی را طراحی نمائیم. در گذشته تمام مشاهدات ما بر اساس عملکرد های In vitro صورت گرفته است که به نظر میرسد در حالت In vivo، عملکرد این پروتئینها به صورت دیگر، انجام میپذیرد. غلظتهای بالای پروتئینها، اسیدهای نوکلئیک و قندهای پیچیده در سلول باعث ایجاد محدودیتهایی برای اندازه مولکولهای کوچکتر میشود. این ساختارهای بزرگ را امروزه ” Macromolecular crowding ” مینامیم. غلظت این مولکولها در سیتوپلاسم به بیشتر از 400 گرم بر لیتر میرسد که به این معنی است که 40 – 5 درصد از حجم کل فیزیکی توسط این مولکولها اشغال میگردد. بخشی حتی بزرگتر از حجم کل سلول نیز محاسبه شده است که برای مولکولهایی در این اندازه بسیار جالب است ( شکل 1).
شکل 1: تصویری از تئوری تراکم مولکولی یا “Macromolecular crowding ” را نشان میدهد
Macromolecular crowding نظریهایست که پیشتر توسط محققین به عنوان “The excluded volume effect” شناخته شده بود که اساسیترین ویژگی آن، جلوگیری از جنبش ماکرومولکولها بود. تراکم ماکرومولکولی وقتی بوجود میآید که غلظت بالایی از مولکولهای محلول، باعث کاهش حجم حلال میشوند. در نتیجه فضایی در این ماکرومولکولها ایجاد شده که میتواند مولکولهای دیگری را داخل خود قرار دهد (B). این فضا خود باعث افزایش غلظت موثر است. همچنین غلظت بالای ماکرومولکولها میتواند دسترسی دیگر مولکولها به حلال را نیز محدود کند. این پدیده “The excluded volume effect” نامیده میشود که به نوبه خود باعث تغییر در نرخ تعادل و ثابت تعادل واکنش میشود.
اهمیت این فضای بین ماکرومولکولی چیست؟
تمایل برقراری پیوند و همین طور نرخ خود شکلدهی (Self-assembly) میتواند با توجه به نرخ تعادل این محدوده فضایی تغییر کند. تراکم این محدوده عامل بسیار مهمی است که باید در مطالعات In vitro در نظر گرفته شود. همچنین برای شناخت سلولها و سازکار آنها در محیط In vivo تکنیکهای متفاوتی مانند توموگرافی (Cryoelectron tomography) و برچسب فلورسنت استفاده میشود. نتایج استفاده از این تکنیکها، مطابق تئوری Macromolecular crowding است. به طور خلاصه این بدان معنی است که بیوشیمی که در یک لوله آزمایش آنرا اندازه میگیریم به هیچ عنوان مطابق اندازهگیریهای درون سلولی نمیباشد. بنابراین ضروری است که برای اندازهگیری غلظتهای دقیق ماکرومولکولها و بررسی واکنش آنها با دیگر مولکولهای زیستی، یک دستگاه به صورت همین نانوبیوسنسور که موجب Macromolecular crowding میشود را طراحی و اندازه گیریها را بر اساس قوانین آن انجام دهیم.
پارامترهایی برای عملکرد نانوبیوسنسورها
اگر شما قصد طراحی و یا بهینهسازی نانوبیوسنسور دارید، باید توجه کنید که در طول توسعه دستگاههای نانوبیوسنسور، عوامل زیادی باید جداگانه بهینهسازی شوند. همچنین این بهینهسازی در سطح کلی نیز با دیگر اجزا، ضروری بوده تا دستگاه به صورت هماهنگ کار کند.
انتخابی بودن اولین پارامتری است که باید بر روی آن کار کنید. انتخابی بودن اشاره به پاسخ نانوبیوسنسور به هدف دارد. یک نانوبیوسنسور باید هدفهای زیستی کاملا مشخصی داشته باشد و به عوامل مشابه، حساسیت نداشته باشد. اولین گزینه برای عملکرد نانوبیوسنسور، همین انتخابی بودن است که قادر خواهد بود، بین فعل و انفعالات مختلف تمایز قائل شود.
به صورت واقعی و در شرایط واقعی، مولکولهای زیستی هدف، اغلب در غلظتهای بسیار پایینتری نسبت به دیگر مولکولهای زیستی دیگر قرار دارند. این یکی دیگر از چالشهای طراحی نانوبیوسنسورهاست، چراکه در شرایط واقعی، روابط بسیار پیچیدهای بین هدف نانوبیوسنسور و محیط اطرافش موجود است که میتواند به صورت یک عملکرد غیراختصاصی، در اتصال بین هدف و بیوسنسور اختلال ایجاد کند. این اتفاق معمولا توسط مولکولهای زیستی غیراختصاصی که به پروبهای بیولوژیکی متصل میشوند، رخ میدهد. این اتصالها علاوه بر ایجاد سیگنالهای مثبت کاذب، محل اتصال هدف را نیز اشغال میکنند که به طور کلی باعث عدم کارایی بیوسنسور میشود.
برای حل این مشکل ابتدا باید ماکرومولکولها و یا موادی که باعث اختلال در سیستم میشوند را شناسایی کرد. به عنوان مثال آلبومین سرم یکی از موادی است که بر روی اغلب نانوبیوسنسورها، تاثیر منفی میگذارد. این بیومولکولها را میتوان با مواد شیمیایی و یا ایجاد واکنشهای غیراختصاصی در طول استفاده از بیوسنسور در دنیای واقعی خنثی کرد.
حد تشخیص کوچکترین و پایینترین میزان غلظت بیومولکولهای هدف میتواند توسط نانوبیوسنسورها بسیار فراتر از آنچه امروز وجود دارد، گسترش یاید. این افزایش حساسیت “Sensitivity of the nanobiosensor” نامیده میشود. این پارامتر اندازهگیری حساسیت نانوبیوسنسورهاست.
این حساسیت بوسیله منحنی دوز- پاسخ اندازهگیری میشود. و در آن طیف وسیعی از اندازهگیری غلظت نانوبیوسنسورها رسم میشود. این منحنی به عنوان نمودار کالیبراسیون نانوبیوسنسورها اهمیت دارد. همچنین با استفاده و رسم این محنی میتوان تکرارپذیری نانوبیوسنسورها را نیز محاسبه کرد.
تکرارپذیری پارامتر دیگری است که در ارتباط با دستگاه نانوبیوسنسور اهمیت دارد. با بررسی انحراف از معیار و Erorr Bar های منحنی دوز – پاسخ میتوان، دستگاههای نانوبیوسنسور را کالیبره کرد. بعد از کالیبراسیون، رنج دینامیکی محاسبه میشود که بزرگترین غلظت هدف اندازهگیری شده و کمترین غلظت هدف اندازهگیری شده (حد تشخیص) را مشخص میکند. همچنین با استفاده از دانش فوق میتوان نانوبیوسنسورهایی طراحی نمود که کمیت حضور ماکرومولکولها را نیز تعیین کنند. در این نانوبیوسنسورها محدوده دینامیکی و حدتشخیص به یکدیگر مرتبط بوده و پارامترهایی برای عوامل اتصال محسوب میشوند. افزایش یک پارامتر با کاهش پارامترهای دیگر مرتبط است.
پارامتر دیگری که در نانوبیوسنسورها مطرح میباشد Multiplexing است که اشاره به تشخیص چند هدف متعدد از یک نمونه بیولوژیکی دارد. این یکی از الزامات نانوبیوسنسورهاست و میتواند با محلیسازی و استفاده از پروبهای بیولوژیکی مختلف بدست آید. بزرگترین چالش در این گروه از نانوبیوسنسورها، واکنش متقاطع است. علاوه بر این با طراحی چند جایگاه شانس تشخیص غیر اختصاصی نیز افزایش پیدا میکند. همچنین احتمال پرشدن پروبها با محصولات عمومی نیز وجود دارد. تکنیکهای طراحی خلاق و هوشمند و طراحی پروبهای خاص، میتواند باعث کاهش این مشکلات شود.
باتوجه با توضیحات بالا، پارامترهای متعددی برای عملکرد نانوبیوسنسورها وجود دارد. مکانیزمهای تشخیص الکتریکی نیز وجود دارد که با به حداقل رساندن مسائل اتصال غیراختصاصی، محدودیتهای تشخیص را کاهش میدهند.
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام