نکات مهم کاربردی در میکروبشناسی بالینی
قسمت دوم
دکتر مریم متوسل، دکتری تخصصی باکتریشناسی
استادیار دانشکده پیراپزشکی، دانشگاه علوم پزشکی شیراز
کشت خون و کشت مایع مغزی نخاعی
الف) کشت خون
شناسایی باکتریهای عامل باکتریمی، سپسیس و عفونت دریچههای قلب مصنوعی یا طبیعی از اهمیت ویژهای در آزمایشگاه میکروبشناسی برخوردار است. مناسبترین زمان نمونهگیری از بیمار مشکوک به عفونت خون، هنگام بروز تب (بالاتر از 38 درجه)، هیپوترمی (کاهش دمای بدن به میزان کمتر از 36 درجه) و لرز است. خونگیری باید در شرایط کاملاً استریل صورت گیرد. برای این منظور ابتدا پوست ناحیه
ورید M (Median vein) دست را با اتانل 70% و حرکت دورانی، از مرکز به خارج ضدعفونی نموده، سپس ناحیه را به کمک یک محلول یده بطور کامل استریل نمایند. برای افرادی که به ترکیبات یددار حساسیت دارند میتوان از کلرهگزیدین برای ضدعفونی استفاده کرد. لازم به ذکر است که مواجه نمودن عوامل ضدعفونی با پوست به مدت 2-1 دقیقه، بهترین تأثیر باکتریکشی را بر روی باکتریهای فلور نرمال پوست میگذارد. تعیین حجم خون مناسب برای کشت در هر نوبت خونگیری، به نسبت 1:10 به ازای حجم کلی محیط کشت است. نمونهگیری ایدهآل شامل 3-2 نوبت خونگیری، هر نوبت به میزان 10 میلیلیتر خون در مدت 24 ساعت است. در نوزادان و کودکان، 5-1 میلیلیتر خون برای 50-10 میلیلیتر محیط کشت کفایت مینماید. ضروری است در زمان خونگیری، به ریسک آنمی نسبت به وزن بیمار توجه شود. بهتر است نمونههای خون گرفته شده در بطریهای هوازی و بیهوازی بطور جداگانه توزیع شوند. عمدتاً 80% موارد باکتریمیها با دو کشت خون در مدت 24 ساعت و 96% موارد با سه کشت خون طی 48 ساعت شناسایی میگردند.
رقیقسازی خون به نسبت 1:10، موجب خنثیسازی فعالیت ضد باکتریال سرم میگردد. توصیه میشود برای جلوگیری از لخته شدن خون، مهار فاگوسیتوز، مهار کمپلمان و غیرفعال شدن آمینوگلیکوزیدهای احتمالی در خون، ترکیب پلیانتول سولفونات (Polyenthol sulfonate) را به میزان 0/05-0/02% به محیط کشت اضافه نمایند. کشت خون به دو صورت دستی و اتوماتیک انجام میشود.
سیستم کشت خون دستی دوفازی معروف به سپتی چک (Septi-check)، شامل بطریهای محیط کشت مایع همراه با بخش آگار شیبدار است که شرایط بهتر را برای رشد ارگانیسمها و تشکیل کلنی فراهم مینماید. سیستم کشت خون دستی که حداکثر 20 روز نگهداری میشود، از حساسیت مناسب جهت جداسازی ارگانیسمها خصوصاً باکتریهای کند رشد (مانند بروسلا) برخوردار است.
سیستم کشت خون اتوماتیک از سیستم دستی کمزحمتتر است و ضمن کاهش دوره انکوباسیون از 21 روز به حدود چند ساعت تا چند روز، از حساسیت ویژهای در شناسایی باکتریها برخوردار است.
عملکرد سیستم اتوماتیک کشت خون مبتنی بر اساس سه مکانیسم است:
1- سیستم Bac/ ALERT 3D، بر اساس رنگسنجی فلورسنت کار میکند. متعاقب رشد باکتریها و تولید دیاکسید کربن، رنگ محیط از سبز به زرد تغییر مینماید. عملکرد سیستم به این نحو است که همزمان با متابولیسم باکتری و تولید یون هیدروژن و دیاکسید کربن، PH محیط کاهش مییابد. این امر سبب افزایش فلورسنت خروجی از حسگر شده و به اجزای نوری و الکتریکی دستگاه، سیگنال فرستاده میشود. پس از آن الگوریتم رشد میکروارگانیسم توسط کامپیوتر ترسیم شده و بهصورت هشدار به کاربر اعلام میگردد
2- سیستم Versa TREK، کمک میکند تا رشد ارگانیسمها در محیط مایع، با اندازهگیری گازهای تولیدی، شناسایی شود؛ به این ترتیب که یک سوزن به رابط حسگر متصل شده و به داخل فضای هر ویال فرستاده میشود. پس از آن هرگونه تغییرات ناشی از تولید و تجمع گازها (N2،H2، CO2) به حسگر منتقل میگردد، سپس سیستم کامپیوتری، اطلاعات دریافتی را پردازش نموده، هشدار رشد باکتری را نشان میدهد. شایان ذکر است که حتماً روشهای دستگاهی، با کمک رنگآمیزی گرم و رشد باکتری روی محیطهای کشت، مورد تأیید نهایی قرار گیرند. کشت خون بر روی محیطهای بلاد آگار، شکلات آگار، EMB آگار و تایوگلیکولات براث (Thyoglycolate broth) انجام میگیرد. رنگآمیزی و کشت، اصطلاحاً به استانداردهای طلائی (Gold standards) در شناسایی باکتریها معروف میباشند.
چند نکته در کشت خون:
نکته 1- زمان رشد بروسلا با روش کشت دستی 3-2 هفته و با سیستم اتوماتیک کمتر از یک هفته به طول میانجامد.
نکته 2- برای بالا بردن احتمال جداسازی دستهای از باکتریهای سخت رشد موسوم به HACEK (Hemophilus، Actinobacillus، Cardiobacterium، Eikenella، Kingella)، از سیستم اتوماتیک و انکوباسیون طولانی مدت استفاده میگردد.
نکته 3- با رنگآمیزی مستقیم خون، تشخیص سریعتر عفونتهای انگلی، تب راجعه (Borrelia recurrentis)، قارچی و کریپتوکوکی (Cryptococcus neoformans) تسهیل میگردد.

الف ب
تصویر 1- سیستم BACTEC، الف: دستگاه Bactec، ب: محیط کشتهای هوازی و بیهوازی


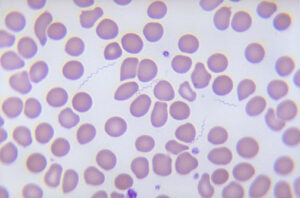
تصویر 2- الف: کشت خون مثبت
A) کدورت، B) گاز، C) همولیز، D) لخته- ب: محیط کشت خون دو فازی، ج: بورلیا برگدورفری (Borrelia burgdorferi) عامل بیماری لایم (Lyme disease)
ب) کشت مایع مغزی نخاعی (Cerebrospinal fluid culture)
مایع مغزی نخاعی (CSF) معمولاً با آسیپیراسیون از بین مهرههای کمری (L3 و L4) بدست میآید. نمونهگیری CSF نیز مانند نمونهگیری خون باید طی مراحل ضدعفونی دقیق صورت پذیرد. CSF معمولاً در 4-3 لوله جمعآوری میگردد؛ لوله اول به منظور تعیین میزان پروتئین و گلوکز، لوله دوم جهت میکروبشناسی، لوله سوم جهت شمارش سلولی و لوله چهارم مخصوص تستهای سرولوژی (سیفلیس، آنتیژنهای کریپتوکوکوس و تستهای مولکولی( مورد استفاده قرار میگیرد.
تعداد گلبولهای سفید در مایع مغزی نخاعی نوزادان و کودکان تا 30 عدد و در بزرگسالان تا 5 عدد در میلیمتر مکعب گزارش شده است. لنفوسیت و منوسیت از سلولهای تشکیلدهنده مایع نخاع بوده و نوتروفیل، سلول طبیعی مایع نخاع نیست. نوتروفیل از طریق آسیبهای مویرگی در هنگام گرفتن نخاع، افزایش نفوذپذیری عروق و یا با مکانیسم دیاپدز در عفونتهای میکروبی وارد مایع نخاع میشود.
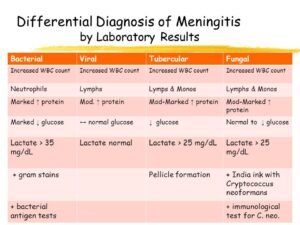
از ویژگیهای مننژیتهای ویروسی، پلئوسیتوزیس (بالا رفتن گلبولهای سفید با غلبه لنفوسیتها) است و در مننژیت میکروبی، پلئوسیتوزیس نوتروفیلی (بالا رفتن گلبولهای سفید با غلبه نوتروفیلها) مشاهده میشود. در مننژیت ویروسی ممکن است تعداد گلبولهای سفید مایع نخاع در اکثر موارد تا 500 و در مننژیت میکروبی حتی بالغ بر 10000 در میلیمتر مکعب گردد.
گلوکز کمتر از 40 در مایع مغزی نخاعی، بسیار حائز اهمیت بوده و بیانگر مننژیت میکروبی، قارچی و یا سلی است. گفتنی است که در مواردی از مننژیت ویروسی مانند عفونت با اوریون و هرپس ممکن است قند نیز کاهش داشته باشد. نرمال شدن قند به دنبال یک عفونت میکروبی اولین نشانه بهبودی از مننژیت است. میزان پروتئین مایع نخاعی بین mg/dl15-45 در حالت طبیعی است. مقدار پروتئین در عفونتهای ویروسی، نرمال یا با افزایش اندک (mg/dl20-80) همراه است. در حالی که افزایش چشمگیر پروتئین در عفونتهای میکروبی و سلی مشاهده میشود، به طوری که افزایش فوقالعاده پروتئین در مننژیت سلی ممکن است مایع را لخته کند. افزایش آنزیم آدنوزین دی آمیناز (ADA) که از لنفوسیتهای T ترشح میشود نیز گاهی مشاهده میگردد. در آزمایشهای روزمره از Spot test برای اینترفرون در تشخیص مننژیت سلی یا عفونتهای سلی استفاده میشود.
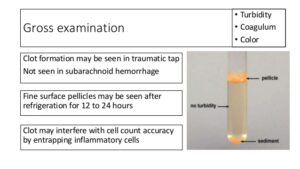
تصویر 3- در مننژیت سلی چنانچه CSF به مدت چند ساعت در یخچال قرار گیرد، یک لایه یا Pellicle روی مایع ظاهر میشود که از این لایه میتوان برای کشت و رنگآمیزی اسید فاست استفاده کرد
شایعترین عوامل مننژیت باکتریایی مانند هموفیلوس آنفلوانزا (Haemophilus influenza)، نایسریا مننژیتیدیس یا مننگوکوک (Neisseria meningitides)، استرپتوکوکوس نومونیه یا نوموکوک (Streptococcus pneumonia)، لیستریا منوسایتوژنز (Listeria monocytogenes) و استرپتوکوکوس آگالاکتیه (Streptococus agalactiae or Strptococcus group B) در گروه ارگانیسمهای مشکلپسند (Fastidious) قرار دارند، لذا توصیه میشود به هیچ عنوان نمونه مایع مغزی نخاعی به یخچال منتقل نگردد. انتقال نمونه CSF به آزمایشگاه و انجام آزمایشها باید بدون فوت وقت انجام شود. ابتدا نمونه را با دور g 1500-2500به مدت 15 دقیقه سانتریفیوژ نموده، مایع رویی را برای آزمایشهای سرولوژی جدا مینمایند و رسوب آن را جهت رنگآمیزی و کشت میکربی، مورد استفاده قرار میدهند. کشت CSF روی محیطهای بلاد آگار، شکلات آگار و EMB آگار انجام میگیرد. رنگآمیزی مستقیم از مایع مغزی نخاعی ارزش تشخیصی ویژهای دارد زیرا گاهی اوقات در جریان نمونهگیری و انتقال نمونه به آزمایشگاه، قابلیت رشد باکتریهای نامبرده، از دست میرود. در این موارد، تنها راه تشخیص ارگانیسم از طریق مشاهده میکروسکوپی باکتریهای رنگشده از نمونه بیمار است.
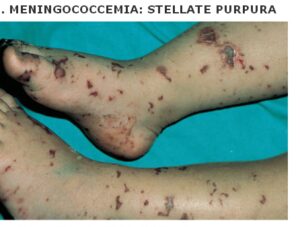
تصویر 4- پورپورای فولمینانت در مننژیت ناشی از مننگوکوک
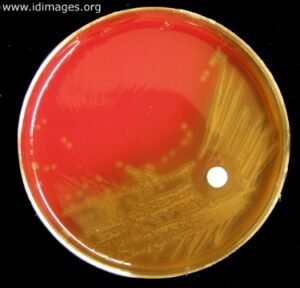
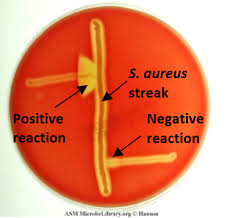
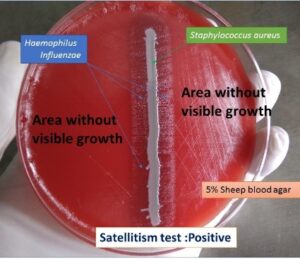
در مطالعه میکروسکوپی مننژیت هموفیلوسی، باسیلهای گرم منفی چند شکل (Pleomorph) از کوکوئید تا باسیل کشیده (Filamentus) مشاهده میگردند که اشکال فیلامنت ویژگی مهمی در شناسایی این باکتری محسوب میشود. هموفیلوس آنفلوانزا جهت رشد، نیاز به حضور باکتری کمکی دیگری بنام استافیلوکوکوس آرئوس دارد و بهصورت کلنیهای شفاف کوچک در اطراف آن رشد مینماید. رخداد چنین پدیدهای را رشد اقماری (Sutelitism) گویند. شناسایی قطعی سروتایپ Hib (Heamophilus influenza type b) از CSF بیمار (خصوصاً کودکان)، توسط تست آگلوتیناسیون با آنتیسرم اختصاصی، انجام میپذیرد. شایان ذکر است که امروزه شیوع هموفیلوس آنفلوانزا تایپ b که از مهمترین عوامل مننژیت کودکان است، با واکسیناسیون مناسب در جوامع پیشرفته، کاهش چشمگیری یافته است.
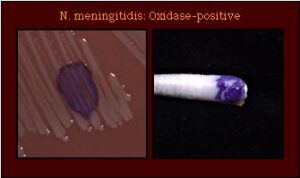
تشخیص مننژیت مننگوکوکی بیش از سایر موارد، مبتنی بر مطالعه میکروسکوپی است زیرا نایسریا مننژیتیدیس بهراحتی در زمان انتقال CSF بیمار به آزمایشگاه کشته میشود مگر آنکه از محیط ترانسپورتی به نام ترانس آیزولیت (Trans isolate) برای انتقال نمونه استفاده شده و کمتر از 30 دقیقه کلیه مراحل انتقال، آمادهسازی و کشت نمونه انجام شود. باکتری مذکور با رنگآمیزی گرم بهصورت دیپلوکوک لوبیایی شکل گرم منفی مشاهده میشود که در داخل و خارج سلولهای پلیمرفونوکلئر وجود دارد. در صورت رشد بر محیط شکلات آگار، بهصورت کلنی یک میلیمتری اکسیداز مثبت رشد مینماید و قادر به تخمیر گلوکز و مالتوز است.
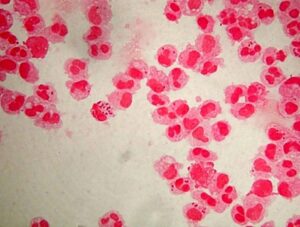
عامل مولد مننژیت نوموکوکی که تمام سنین را درگیر مینماید، دیپلوکوک شعله شمعی گرم مثبتی است که با همولیز آلفا روی بلاد آگار و شکلات آگار مشاهده میگردد. نوموکوک (Streptococcus pneumoniaea) در میزبان مناسب مانند کودکان، افراد مبتلا به ضعف سیستم ایمنی و افراد الکلی تولید خلط خونی و چسبناکی میکند که پس از رشد روی محیط کشت، کلنی موکوئید نافی شکل (Umblicate shape) ایجاد مینماید. نوموکوک حساس به اپتوچین، محلول در املاح صفراوی و تخمیرکننده اینولین است.
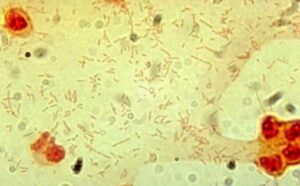
لیستریا منوسایتوژنز یک باکتری مشترک بین انسان و دام است و ایجاد یک بیماری زونوز (Zoonose disease) بنام لیستریوز مینماید که عمدتاً از طریق مصرف لبنیات به انسان منتقل میگردد. مادرانی که واجد باکتری مذکور در واژن خود هستند، ممکن است نوزاد مبتلا به مننژیت لیستریایی به دنیا بیاورند. آزمایش میکروسکوپی CSF، باکتری میلهای گرم مثبت با آرایش حروفچینی (China’s letters) را نشان میدهد که پس از رشد بر محیط بلاد آگار، ایجاد همولیز بتا مینماید، کاتالاز مثبت است و بر محیط بایل اسکولین (Bile esculine) تأثیر میگذارد. لیستریا مونوسایتوژنز حرکت مخصوصی دارد به این معنا که در 37 درجه سانتیگراد بیحرکت است و در دمای اتاق بهصورت چتر (Umbrella shape) رشد مینماید.
در موارد مننژیت لیستریایی نوزادان، معمولاً سقط جنین اتفاق میافتد. برای جداسازی لیستریا از بافت جنین سقط شده از تکنیک غنیسازی در سرما (Cold enrichment) استفاده میگردد. به منظور غنیسازی باکتری و حذف سایر باکتریها، نمونه بافت جنین سقط شده را قبل از آزمایش، به مدت 14-10 روز در یخچال 4 درجه سانتیگراد نگهداری میکنند. این روش که به غنیسازی در سرما (Cold enrichment) معروف است سبب خالصسازی لیستریا در نمونه و حذف سایر عوامل باکتریایی میگردد.
یکی از عوامل مهم مننژیت نوزادان، استرپتوکوکوس آگالاکتیه است. از آنجا که باکتری مذکور، کوکسی گرم مثبت و واجد همولیز بتا است، نیاز هست که از مننژیت لیستریایی تشخیص داده شود.، استرپتوکوکوس آگالاکتیه نسبت به سرما حساس است و در روش غنیسازی در سرما از بین میرود. در صورتی که نمونه مورد استفاده، مایع مغزی نخاعی باشد و مستقیماً مورد آزمایش قرار گیرد، باید توجه نمود که تمایز لیستریا منوسایتوژنز از استرپتوکوک آگالاکتیه به کمک تستهای کاتالاز و حرکت صورت میپذیرد. بدیهی است استرپتوکوک آگالاکتیه کاتالاز منفی و بیحرکت است. همچنین قادر به رشد در املاح صفراوی و تخمیر اسکولین نیست.
بیماری لایم (Lyme disease) که یک نوع درگیری سیستم عصبی با بورلیا برگدورفری است، عمدتاً توسط رنگآمیزی گستره خون محیطی به همراه آزمونهای سرولوژی و آنتی آنتیبادی اختصاصیIgG و IgM تشخیص داده میشود.
الف ب
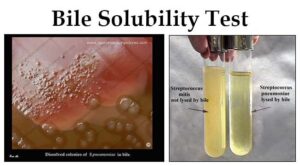
تصویر 5- تستهای تشخیصی استرپتوکوکوس نومونیه
الف: اسمیر مستقیم (Direct smear)- دیپلوکوکهای گرم مثبت شعله شمعی، ب: همولیز آلفا و حساسیت به اپتوچین، ج: حلالیت در صفرا- نوموکوک: لوله شفاف و استرپتوکوک ویریدانس: لوله کدر، د: حلالیت و از بین رفتن کلنیهای نوموکوک در صفرا بر روی پلیت بلاد آگار
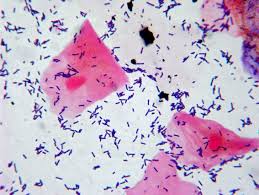
الف ب


ج د و
تصویر 6-تستهای تشخیصی لیستریا منوسایتوژنز
الف: اسمیر مستقیم- باکتریهای میلهای گرم مثبت با آرایش حروفچینی
(Gram positive rods in china’s letters shape)، ب: همولیز بتا، ج: تست CAMP مثبت (به شکل نوک پیکان یا Arrow head)، د: متحرک با الگوی حرکت چتری (Umbrella motility) و: بایل اسکولین مثبت (تست مثبت: لوله سیاه، تست کنترل: لوله زرد رنگ)
الف ب ج
تصویر 7- تستهای تشخیصی هموفیلوس آنفلوانزا
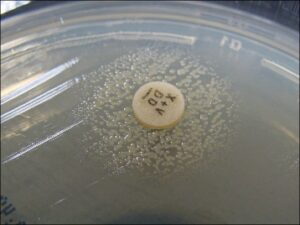
الف: باکتری میلهای گرم منفی چند شکلی (Gram negative pleopmorphysm rods) و حضور باکتریهای رشتهای و کشیده، ب: پدیده اقماری (Satelitism phenomenon) – رشد هموفیلوس آنفلوانزا در اطراف استافیلوکوکوس آرئوس، ج: نیاز به فاکتور X و V جهت رشد

الف ب ج
تصویر 8
الف: تشخیص نایسریا مننژیتیدیس در نمونه CSF – دیپلوکوکهای گرم منفی لوبیایی شکل خارج و داخل سلولهای پلیمورفونوکئر، ب) اکسیداز مثبت، ج: تستهای بیوشیمیایی تخمیر قند: گلوکز و مالتوز مثبت، سوکروز منفی
نکات مهم کاربردی در میکروبشناسی بالینی (1)
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام