کاربردهای تشخیصی آنتیبادیهای منوکلونال با اختصاصیت دوگانه
دکتر رضا جعفری1، دکتر نعیمه مجیدی ذوالبنین1
1. مرکز تولید آنتیبادیهای منوکلونال، مرکز تحقیقات ایمونولوژی، دانشگاه علوم پزشکی تبریز
مقدمه
آنتیبادیهای منوکلونال با اختصاصیت دوگانه (BsMAb) ماکرومولکولهای منحصربفرد مهندسی شده با عملکرد دوگانه هستند که به شکل یک مولکول دارای دو اختصاصیت متمایز میباشند. این آنتیبادیها در واقع نسل دوم آنتیبادیهای منوکلونال بوده و از نظر ساختار دو ظرفیتیاند.
بطور معمول، BsMAb دارای یک پاراتوپ اختصاصی برای یک پروتئین خاص یا یک آنتیژن و پاراتوپ اختصاصی دیگر برای ردیابی یک آنزیم میباشد (شکل 1).
بنابراین، BsMAbها میتوانند بعنوان کراسلینکرهای با عملکرد دوگانه عمل کنند. اتصال BsMAbبه هر دو مولکول، وابسته به افینینی تعامل اپیتوپ– پاراتوپ بوده و به شدت اختصاصی است.
BsMAbها از طریق 3 روش قابل تولید هستند:
1- کونژوگاسیون شیمیایی بصورت اتصال متقاطع شیمیایی (روشی که اولین بار پیشنهاد شد).
2- هیبریداسیون سوماتیک از طریق تکنولوژی هیبریدوما
3- مهندسی ژنتیک از طریق تکنولوژی نوترکیب DNA
تولید BsMAbها از طریق تکنولوژی هیبریدوما شامل فیوز دو نوع هیبریدومای متفاوت بوده که تولیدکننده آنتیبادیهای منوکلونال خاص هستند و دارای اختصاصیت دوگانهاند (شکل 2).
در تشخیص آزمایشگاهی، BsMAbها بعنوان ایمونوپروبهای تشخیصی مناسب مطرح هستند. BsMAbها نسبت به پروبهای رایج در تشخیص آزمایشگاهی بیماریها دارای مزایایی هستند؛ چرا که از یک طرف به یک آنتیژن و از طرف دیگر بطور مستقل به مارکر آنزیمی متصل میشوند. این مارکرهای آنزیمی معمولاً پراکسیداز (HRPO) horse radish، آلکالن فسفاتاز یا بتاگالاکتوزیداز میباشند. از کاربردهای تشخیصی BsMAbها میتوان به ایمونواسی، ایمونوهیستوشیمی و
radioimmuno diagnosis اشاره کرد.
2-1- مزایای BsMAb در تشخیص ایمونولوژیک بیماریها
BsMAbها علاوه بر اینکه زمان تشخیص را کوتاه میکنند، اختصاصیت و حساسیت تستها را نیز افزایش میدهند. استفاده از این آنتیبادیها واکنشهای مثبت کاذب موجود در روشهای سنجش نظیر ELISA را بطور چشمگیری کاهش یا حتی حذف میکند.
در تشخیصهای ایمونوهیستوشیمی، BsMAbها اثرات زمینه را کاهش داده و اطلاعات مرفولوژیک را برجستهتر جلوه میدهند و از واکنشهای جانبی ایمونولوژیک جلوگیری کرده و وضوح جزئیات ساختمانی بسیار ریز را بهبود میبخشند. در موارد ایمونواسی رقابتی میتوان ازBsMAb ها بصورت نانوپروبها نیز استفاده کرد.
آنتیبادیهای منوکلونال معمولی در بسیاری از ایمونواسیها کاربرد دارند. بطور معمول، استفاده از این آنتیبادیهای معمولی در تشخیص، نیاز به دستکاری شیمیایی دارد، مثلاً در موارد کونژوگه شدن با قسمت ردیاب نظیر آنزیم و بیوتین. این اتصال متقاطع شیمیایی دارای معایبی است، مثلاً یک پروسه راندوم بوده یا اندازه کونژوگههای آنتیبادی برای بررسیهای ایمونوهیستوشیمی چندان مناسب نیست. از سوی دیگر، اتصال کووالانت بین قسمت ردیاب و آنتیبادی برای کاربردهای In vivo مناسب نمیباشد و آنتیبادیهای تولید شده اغلب فعالیت اختصاصی کمتری دارند.
استفاده ازBsMAb ها نیاز به کونژوگاسیون شیمیایی آنتیبادی با قسمت ردیاب نداشته و قبلاً در مراحل خالصسازی آنها با آنزیمهای ردیاب برچسبگذاری شده است.
3-1- کاربردهای BsMAb در تشخیص بیماریهای عفونی
یکی از چالشهای سازمان بهداشت جهانی (WHO) بیماریهای عفونی است. سالانه حدود 9/5 میلیون نفر مرگ و میر ناشی از عوامل عفونی در سرتاسر جهان گزارش میشود.
تشخیص زودهنگام بیماریهای عفونی در استراتژیهای درمانی آنها حائز اهمیت است. BsMAbها برای تشخیص راحت و سریع بیماریهای عفونی بسیار حائز اهمیت هستند.
1-3-1- مایکوباکتریوم توبرکلوزیس
براساس گزارشات WHO، سالانه 1/3 میلیون نفر بر اثر ابتلا به توبرکلوزیس (TB)میمیرند. فقدان تشخیص زودهنگام افراد آلوده، منجر به گسترش سریع این بیماری به قسمتهای مختلف جهان شده است. مشکل دیگر، عفونت همزمان بیماران TB با HIV است و در واقع علت اصلی مرگ بیماران مبتلا به HIV توبرکلوئید میباشد. عامل بیماری TB مایکوباکتریوم توبرکلوزیس Mycobacterium tuberculosis است. تشخیص روتین باکتری براساس تستهای باکتریولوژیک است که از حساسیت کمی برخوردارند. به خاطر مشکلات ذکر شده، تشخیص عمدتاً براساس علائم بالینی و رادیوگرافی از قفسه سینه است، ولی از آنجایی که اکثر بیماریهای ریوی علائم بالینی و رادیوگرافی مشابهی دارند هیچیک از روشهای ذکر شده اختصاصی نمیباشند. به علت تشخیص دیرهنگام، اکثر بیماران پروسههای درمانی غیراختصاصی داشته و سویههای جدیدی از باکتری نظیر مقاوم به چند دارو (MDR) و کاملاً مقاوم به دارو (XDR) بوجود آمدهاند. روشهای تشخیص مولکولی نظیر روشهای سنجش آزاد شدن اینترفرون گاما (IGRA) و تکثیر اسید نوکلئوئیک (NAA) بعلت هزینههای بالا و سختی کار چندان مورد توجه قرار نگرفتهاند.
در آزمایشگاه تشخیص TB دانشگاه آلبوتا، بر اساس BsMAbها روش جدیدی برای تشخیص TB پیشنهاد شده است. در این روش، از آنتیژنهای اختصاصی مایکوباکتریوم توبرکلوزیس برای تولید BsMAbها استفاده شد.
2-3-1- E.Coli O157: H7
این نوع ایکولای از پاتوژنهای مهم بیماریزای ناشی از غذا و آب آلوده است. بیماری بصورت کولیت هموراژیک و سندرم اورمیک همولیتیک میتواند ظهور پیدا کند. O157:H7 بعنوان ایکولای انتروهموراژیک (EHEC) فقط در کشور آمریکا در هر سال حدود 73 هزار نفر را آلوده میکند.
تشخیص رایج در مورد O157:H7 براساس کشت در محیط سوربیتول مکانکی آگار و آگار PCR Rainbow و روشهای ایمونولوژیک میباشد.
این روشها اکثراً زمانبر (24 تا 48 ساعت در مورد کشت) بوده و در مورد PCR، جدا کردن DNA در نمونهها مشکل است.
داشتن CFU پایین در مورد O 157 :H7 برای ابتلا به عفونت شدید کافی است.
روش ایمونولوژیک تشخیص O157 :H7 براساس BsMAbها از حساسیت بسیار زیادی برخوردار است.
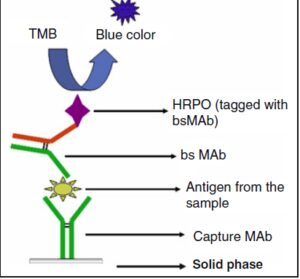
این آنتیبادیها از یک طرف اختصاصی لیپوپلیساکارید باکتری O157:H7 و از طرف دیگر اختصاصی HRPO میباشند. BsMAbهای تخلیص شده در الیزا ساندویچ مورد استفاده قرار میگیرند (شکل 2).
3-3-1-Bordetella Pertussis
سیاهسرفه یا پرتوزیس یکی از بیماریهایی است که مخصوصاً در نوجوانان در سالهای اخیر مشکلات بهداشتی زیادی بوجود آورده و توسط باکتری بردوتلاپرتوزیس منتقل میشود. تشخیص زودهنگام و سریع این بیماری در جلوگیری از گسترش عفونت و همچنین درمان مناسب مبتلایان بسیار ضروری است. تشخیص رایج عفونت B.Pertussis براساس جداسازی باکتری از محیط نمونههای آسپیره شده نازوفارنکس بالینی بوده که عموماً 3 تا 7 روز طول میکشد. شناسایی دقیق عامل بیماری وابسته به چند فاکتور دیگر نظیر جمعآوری صحیح نمونه از مجرای تنفسی و شرایط مناسب نگهداری و کشت میباشد. روش دیگر جداسازی B.Pertussis براساس direct fluorescont R antibody assay میباشد که براساس واکنش آنتیبادی منوکلونال فلورسانت بر علیه LPS باکتری است. با وجود اینکه تشخیص بر اساس LPS روش خوبی است ولی چنین روشی از حساسیت زیادی برخوردار نبوده و از نظر عملی مشکل است.
اخیراً روشهای تشخیصی بر مبنای سنجش ایمونولوژیک با استفاده از BsMAbها برای ردیابی جرم کامل بردوتلاپرتوزیس و نیز LPS محلول باکتری توسعه یافتهاند.
این روش نه تنها برای آنالیز نمونههای بالینی مفید است، بلکه برای مطالعات ساختاری ایمونوشیمیایی و تعیین خصوصیات سرولوژیکی LPS بردوتلاپرتوزیس نیز حائز اهمیت است.
BsMAbهای مورد استفاده در این سنجش از یک طرف اختصاصی LPS برودتلاپرتوزیس بوده و از طرف دیگر اختصاصی HRPO میباشند و در سنجش ایمونولوژیک ELISA هُموساندویچ بکار گرفته میشوند (شکل 2).
4-1- کاربردهای BsMAb در تشخیص سرطان
علاوه بر ویژگیهای رشد کنترل نشده سلولهای سرطانی، سرطان همراه با افزایش بیان مولکولهای بیوشیمیایی نظیر گلیکوپروتئینها بوده که در سطح سلولها بیان یافته و در ادامه به مایعات فیزیولوژیک بدن آزاد میشوند. چنین آنتیژنهای اختصاصی تومور که دچار افزایش بیان شدهاند بعنوان مارکرهای تشخیصی مطرح بوده و میتوانند مبنای روشهای تشخیصی بالینی قرار بگیرند. (براساس آنتیژنهای اختصاصی تومور (TAA).
5-1- جمعبندی
استفاده از BsMAbها در سنجشهای تشخیصی ایمونولوژیک موجب توسعه نسل جدید روشهای تشخیصی ایمونولوژیک شده و به شدت حساس بوده و در کنار سادگی و با صرفه بودن از نظر اقتصادی، سریع قابل انجام هستند.
گسترش چنین روشهایی در کشورهای پیشرفته در مبارزه با بیماریهای عفونی و تشخیص سریع بدخیمیها بسیار مؤثر بوده است. روشهای رایج و سنتی که مورد استفاده قرار میگیرند قادر به تشخیص زودهنگام بیماریها نبوده و خسارات اقتصادی و بهداشتی زیادی را برای اقتصاد سلامت کشورها بوجود میآورند.
در کشور ایران نیز گسترش چنین روشهای حساس و دقیق بر پایه آنتیبادیهای نسل جدید مانند BsMAbها نیز به نظر ضروری میرسد. از طرفی دیگر با توجه به گرایش خاص سیاستگذاران عرصه سلامت کشور بر تولیدات بومی و مخصوصاً اقتصاد دانش بنیان، تولید و بومی سازی چنین آنتیبادیهایی توسط محققین بیومدیکال و در ادامه تولید کیتهای تشخیصی مناسب ضروری میباشد.
1.Armbruster DA (1993) Prostate-specific antigen: biochemistry, analytical methods, and clinical application. Clin Chem 39(2):181–195
2.Bennett AR, MacPhee S, Betts RP (1996) The isolation and detection of Escherichia coli O157 by use of immunomagnetic separation and immunoassay procedures. Lett Appl Microbiol 22(3):237–243
3.Bhatnagar PK, Das D, Suresh MR (2008) Sequential affinity purification of peroxidase tagged bispecific anti-SARS-CoV antibodies on phenylboronic acid agarose. J Chromatogr B Analyt Technol Biomed Life Sci 863(2):235–241
4.Bopp DJ, Sauders BD, Waring AL, Ackelsberg J, Dumas N, Braun-Howland E, Dziewulski D, Wallace BJ, Kelly M, Halse T, Musser KA, Smith PF, Morse DL, Limberger RJ (2003) Detection, isolation, and molecular subtyping of Escherichia coli O157:H7 and Campylobacter jejuni associated with a large waterborne outbreak. J Clin Microbiol 41(1):174–180
5.Campos M, Quartin A, Mendes E, Abreu A, Gurevich S, Echarte L, Ferreira T, Cleary T, Hollender E, Ashkin D (2008) Feasibility of shortening respiratory isolation with a single sputum nucleic acid amplification test. Am J Respir Crit Care Med 178(3):300–305
6.Cao Y, Suresh MR (1998) Bispecific antibodies as novel bioconjugates. Bioconjug Chem 9(6):635–644
7.Caplan A, Kratz A (2002) Prostate-specific antigen and the early diagnosis of prostate cancer. Am J Clin Pathol 117(Suppl):S104–S108
8.Cardillo TM, Karacay H, Goldenberg DM, Yeldell D, Chang CH, Modrak DE, Sharkey RM, Gold DV (2004) Improved targeting of pancreatic cancer: experimental studies of a new bispecific antibody, pretargeting enhancement system for immunoscintigraphy. Clin Cancer Res 10(10):3552–3561
9.Cattini R, Cooksey M, Robinson D, Brett G, Bacarese-Hamilton T, Jolley N (1993) Measurement of alpha-fetoprotein, carcinoembryonic antigen and prostate-specific antigen in serum and heparinised plasma by enzyme immunoassay on the fully automated serono SR1 analyzer. Eur J Clin Chem Clin Biochem 31(8):517–524
10.CDCP (2002) Centers for Disease Control and Prevention. Pertussis 1997–2000. Morb Mortal Wkly Rep Surveill Summ 51:73–76
11.Chan PK, Ng KC, Chan RC, Lam RK, Chow VC, Hui M, Wu A, Lee N, Yap FH, Cheng FW, Sung JJ, Tam JS (2004) Immunofluorescence assay for serologic diagnosis of SARS. Emerg Infect Dis 10(3):530–532
12.Cole ST, Brosch R, Parkhill J, Garnier T, Churcher C, Harris D, Gordon SV, Eiglmeier K, Gas S, Barry CE 3rd, Tekaia F, Badcock K, Basham D, Brown D, Chillingworth T, Connor R, Davies R, Devlin K, Feltwell T, Gentles S, Hamlin N, Holroyd S, Hornsby T, Jagels K, Krogh A, McLean J, Moule S, Murphy L, Oliver K, Osborne J, Quail MA, Rajandream MA, Rogers J, Rutter S, Seeger K, Skelton J, Squares R, Squares S, Sulston JE, Taylor K, Whitehead S, Barrell BG (1998) Deciphering the biology of Mycobacterium tuberculosis from the complete genome sequence. Nature 393(6685):537–544 Das D, Suresh MR (2005) Producing bispecific and bifunctional antibodies. Methods Mol Med 109:329–346
13.Di B, Hao W, Gao Y, Wang M, Wang YD, Qiu LW, Wen K, Zhou DH, Wu XW, Lu EJ, Liao ZY, Mei YB, Zheng BJ, Che XY (2005) Monoclonal antibody-based antigen capture enzymelinked immunosorbent assay reveals high sensitivity of the nucleocapsid protein in acute-phase sera of severe acute respiratory syndrome patients. Clin Diagn Lab Immunol 12(1):135–140
14.Drosten C, Gunther S, Preiser W, van der Werf S, Brodt HR, Becker S, Rabenau H, Panning M, Kolesnikova L, Fouchier RA, Berger A, Burguiere AM, Cinatl J, Eickmann M, Escriou N, Grywna K, Kramme S, Manuguerra JC, Muller S, Rickerts V, Sturmer M, Vieth S, Klenk HD, Osterhaus AD, Schmitz H, Doerr HW (2003) Identification of a novel coronavirus in patients
with severe acute respiratory syndrome. N Engl J Med 348(20):1967–1976
15.Fraser ME, Fujinaga M, Cherney MM, Melton-Celsa AR, Twiddy EM, O’Brien AD, James MN (2004) Structure of shiga toxin type 2 (Stx2) from Escherichia coli O157:H7. J Biol Chem 279 (26):27511–27517
16.Gold DV, Goldenberg DM, Karacay H, Rossi EA, Chang CH, Cardillo TM, McBride WJ, Sharkey RM (2008) A novel bispecific, trivalent antibody construct for targeting pancreatic carcinoma. Cancer Res 68(12):4819–4826
17.Goldenberg DM, Chatal JF, Barbet J, Boerman O, Sharkey RM (2007) Cancer imaging and therapy with bispecific antibody pretargeting. Update Cancer Ther 2(1):19–31
18.Griffin PM, Tauxe RV (1991) The epidemiology of infections caused by Escherichia coli O157:H7, other enterohemorrhagic E. coli, and the associated hemolytic uremic syndrome. Epidemiol Rev 13:60–98
19.Guan Y, Zheng BJ, He YQ, Liu XL, Zhuang ZX, Cheung CL, Luo SW, Li PH, Zhang LJ, Guan YJ, Butt KM, Wong KL, Chan KW, Lim W, Shortridge KF, Yuen KY, Peiris JS, Poon LL (2003) Isolation and characterization of viruses related to the SARS coronavirus from animals in southern China. Science 302(5643):276–278
20.Gustafsson B, Lindquist U, Andersson M (1988) Production and characterization of monoclonal antibodies directed against Bordetella pertussis lipopolysaccharide. J ClinMicrobiol 26(2):188–193
21.Guttikonda S, Tang XL, Yang BM, Armstrong GD, Suresh MR (2007) Monospecific and bispecific antibodies against E. coli O157 for diagnostics. J Immunol Methods 327(1–2):1–9
22.Halstead SB (2007) Dengue. Lancet 370(9599):1644–1652
23.Hemungkorn M, Thisyakorn U, Thisyakorn C (2007) Dengue infection: a growing global health threat. Biosci Trends 1(2):90–96
24.Hiscox JA, Cavanagh D, Britton P (1995) Quantification of individual subgenomic mRNA species during replication of the coronavirus transmissible gastroenteritis virus. Virus Res 36(2–3): 119–130
25.Hrudey SE, Payment P, Huck PM, Gillham RW, Hrudey EJ (2003) A fatal waterborne disease epidemic in Walkerton, Ontario: comparison with other waterborne outbreaks in the developed world. Water Sci Technol 47(3):7–14
26.Husereau DR, Suresh MR (2001) A general affinity method to purify peroxidase-tagged antibodies. J Immunol Methods 249(1–2):33–41
27.Jiang SS, Chen TC, Yang JY, Hsiung CA, Su IJ, Liu YL, Chen PC, Juang JL (2004) Sensitive and quantitative detection of severe acute respiratory syndrome coronavirus infection by real-time nested polymerase chain reaction. Clin Infect Dis 38(2):293–296
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام