مروری بر آزمونهای تعیین حساسیت ضد میکروبی و روشهای نویدبخش در آینده
محمد صالحی- کارشناس ارشد زیست شناسی- میکروبیولوژی- جهاد دانشگاهی مشهد شعبه نیشابور
علی اکبر مرادیان ایوری-کارشناس آزمایشگاه- جهاد دانشگاهی مشهد شعبه نیشابور
بتول جنتی- کارشناس ارشد قارچ شناسی- جهاد دانشگاهی مشهد شعبه نیشابور
مسعود مبینی- کارشناسی ارشد زیست شناسی- میکروبیولوژی- باشگاه پژوهشگران جوان دانشگاه آزاد واحد تنکابن
مریم اصغر حیدری- کارشناسی ارشد زیست شناسی- میکروبیولوژی- باشگاه پژوهشگران جوان دانشگاه آزاد واحد تنکابن
آزمون حساسیت ضد میکروبی (AST)، یکی از تکنیکهای مهم در علم زیست شناسی مدرن است. این آزمون در پاتولوژی برای تعیین مقاومت سویههای میکروبی مشخص به عوامل ضد میکروبی مختلف مورد استفاده قرار میگیرد و در پژوهشهای فارماکولوژیکی از آن برای تعیین کارایی عوامل ضد میکروب جدید مشتق از عصارههای بیولوژیکی بر علیه میکروارگانیسمهای مختلف استفاده میشود. روشهای AST مختلف توسط محققان در سراسر دنیا بکار میرود و میتواند منجر به تغییراتی در نتایج بدست آمده هنگام بکارگیری گسترده روشهای AST شود که امروزه برای نشان دادن فعالیت ضد میکروبی و تعیین حداقل غلظت مهارکننده (MIC) مواد ضد میکروب بکار میروند. با اینکه روشهای AST استاندارد رایج توسط سازمانهای مختلف مانند NCCLS[1]، BSAC[2] و EUCAST[3] تأیید شدهاند، رهنمودهایی برای تعیین حساسیت ضد میکروبی داروی مناسب وجود دارد که این روشها نباید فقط برای طیف خاصی از مواد قابل اجرا باشد و از طرفی باید قابل اصلاح نیز باشند (1).
هرچند سویه استرپتوکوکوس پایوژن به پنیسیلین حساس باقی مانده است یک سؤال همیشه عنوان میشود که تا چه مدتی این حساسیت باقی میماند و با کشف سویههای استافیلوکوکوس اورئوس که به وانکومایسین مقاومند (2) و نیز سویههایی از گونههای اسینتوباکتر (3)، نقش تعیین حساسیت ضد میکروبی در درمان بیماریهای عفونی مهم و مهمتر میشود. هنوز هم آنچنانکه در آزمایشگاههای بالینی امروزی رایج میباشد بسیاری از این فنوتیپهای مقاوم جدید به آسانی با استفاده از روشهای تعیین حساسیت ضد میکروبی اتوماتیک تشخیص داده نمیشوند (4). اگرچه باکتریهای مقاوم قبلاً فقط در واحدهای مراقبتی بیمارستانها شایع بود، مقاومت چند داروئی یک موضوع مهم در میان سویههای عامل عفونتهای اکتسابی از جامعه مانند سالمونلا، شیگلا و حتی نیسریا گنوره میباشد (5). مشکلات پیچیدۀ درمان ارگانیسمهای مقاومی که از جامعه برخاستهاند و نیز در حال حاضر در محیطهای مراقبتی انتشار یافتهاند، رو به فزونی میباشد. بنابراین مسلم است که تغییرات در الگوهای مقاومت محدوده وسیعی از پاتوژنهای باکتریایی، لزوم درمان بهینۀ بیماران و حفظ رژیمهای درمانی را نشان میدهد(6).
دو روش فنوتیپیک اصلی تعیین حساسیت سویههای میکروبی، دیسک دیفیوژن وMIC (حداقل غلظت مهارکننده) است. در ایالات متحده، تقریباً 85% نتایج تعیین حساسیت با کمک روشهای اتوماتیک تفسیر میشود در حالی که مابقی عمدتاً در نتیجه آزمون دیسک دیفیوژن میباشد، اما آزمایشگاههای بالینی نیز مجموعههایی از آزمایش های غربالگری و تستهای تأییدی را برای نشان دادن مکانیسمهای مقاومت و اطمینان از دقت گزارشات تعیین حساسیت ضد میکروبی بکار میبرند. (جدول 1)
(جدول 1) غربالگری فنوتیپیک و تستهای تأییدی

اخیراً بیشتر روشهای مولکولی، جهشها و ژنهای مقاومت به عامل ضد میکروب را در فنوتیپهای مقاوم نشان میدهند، این در حالیست که رایجترین تست استفاده شده برای نشان دادن مستقیم استافیلوکوکوس اورئوس مقاوم به متیسیلین (MRSA) در نمونههای گرفته شده از بینی، استفاده از آزمون RT PCR میباشد. انواع دیگری از تستها از جمله پیروسکانسینگ و PNA-FISH نیز به آزمایشگاههای بالینی معرفی شدهاند (7).
انتشار دیسک
روش انتشار دیسک در 1940 توسعه یافت (8). هنگامی که این روش توسط سازمان NCCLS پذیرفته شد به طور گستردهای تا به امروز مورد استفاده قرار گرفت. این روش توسط بوئر، کربی، شریس و تراک توصیف شد (عموماً به آزمون کربی- بوئر معروف است) (9).
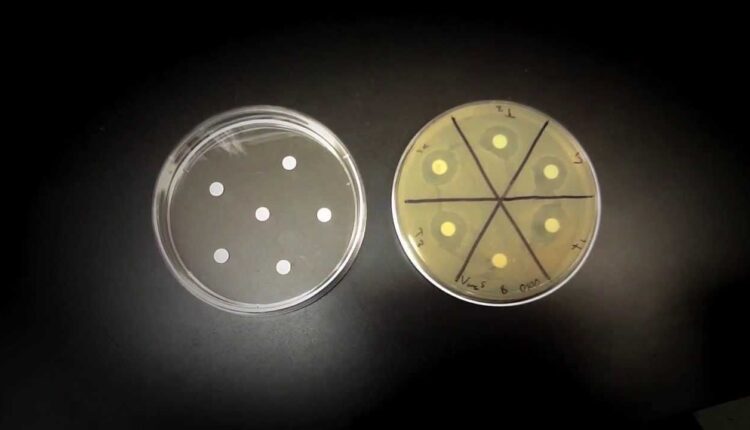
تکنیک انتشار دیسک معمولاً به صورت گستردهای در سنجش فعالیت ضد میکروبی یک مهارکنندۀ مجهول به کار میرود(10). در این روش دیسکهای کاغذی فیلتری استریل شده 6 میلیمتری توسط عامل ضد میکروب با غلظت دلخواه اشباع میشود(11). دیسکهای اشباع شده سپس روی سطح محیطهای آگار جامد مناسب مانند مولرهینتون، تریپتوکیسسوی آگار یا نوترین آگار که از قبل توسط ارگانیسمهای تلقیح شده قرار داده میشوند.
مقدار تلقیح استاندارد CFU/ mL 1×108 برای باکتری و CFU/ mL 1×105 برای قارچ میباشد (12) و این با استاندارد کدورت 0/5 مکفارلند برابر است. برخی از پژوهشگران دیسکهای کاغذی را قبل از قرار دادن روی پلیتهای تلقیح شده به عامل ضدمیکروب آغشته میکنند، در حالی که برخی دیگر ترجیح میدهند بعد از قرار دادن دیسکهای کاغذی روی پلیتهای تلقیح شده، آن را به عامل ضدمیکروب آغشته کنند (12 و 13). زمان خشک شدن دیسک کاغذی تلقیح شده در بین محققان از 2 ساعت تا یک شب کامل زیر هود لامینار متفاوت است (12). پلیتهای تلقیح شده به باکتری را 24 ساعت در 37 درجه سانتیگراد و تلقیح شده به قارچ را 48 ساعت در 25 درجه سانتی گراد قرار میدهند (11). بعد از انکوباسیون قطر هاله را تا نزدیکترین نقطهای که در آن یک کاهش 80 درصدی رشد را به طور مشخص داریم بر حسب میلیمتر گزارش میکنیم (14).
آزمون انتشار چاهک
اساس انتشار چاهک مشابه آزمون انتشار دیسک است. غلظت استانداردی از ماده تلقیحی را به صورت یکنواخت روی پلیت حاوی آگار بسته شده پخش میکنیم. سوراخهایی با قطر حدود 6 تا 8 میلیمتر توسط یک سنبه چوب پنبهای در شرایط استریل در پلیت حاوی محیط کشت ایجاد میکنیم. حجم ثابتی از عامل ضدمیکروب را درون چاهک ریخته و در دمای بهینه و زمانی که بستگی به میکروارگانیسم تست دارد، انکوبه میکنیم (15).
آزمون ماکرودایلوشن براث
هدف از آزمون MIC بدست آوردن نتایج کمّی (میکروگرم در میلیلیتر) و تفکیک شده (حساس، حدواسط یا مقاوم) میباشد که میتواند درمان را به صورت دقیقتری به ویژه برای عفونت در بخشهای مختلف بدن بهینه سازد تا به حداقل مقدار لازم از عامل ضد میکروب در بدن دست یابیم (مانند مایع مغزی نخاعی و استخوان در بدن). نتایج کمی MIC وقتی درمان طولانی مدت لازم است، موردنیاز است؛ مانند اندوکاردیت باکتریایی.
اساس کار این آزمون مشابه آزمون میکرودایلوشن براث است، اما این آزمون در لوله آزمایش انجام میشود. در آزمون ماکرودایلوشن یک سری لولههای آزمایش با غلظتهای مختلف از عامل ضدمیکروب (با حجم برابر) تهیه میکنیم. لولهها را با غلظت استانداردی از میکروارگانیسمهای مورد آزمایش انکوبه میکنیم. بعد از انکوباسیون، میزان کدورت لولهها را به عنوان شاخص رشد بررسی میکنیم. (12).
آزمون میکرودایلوشن براث
روش میکرودایلوشن براث یا میکروتیتر پلیت، تکنیکی مفید برای تعیین حداقل غلظت مهارکنندگی (MIC) تعداد زیادی از نمونههای مورد آزمایش میباشد..(12).
پلیت مورد استفاده در روش میکرودایلوشن
مولرهینتون براث یا آب مقطر استریل اغلب به عنوان یک رقیق کننده استفاده می شود.EUCAST در سال 2003 مولرهینتون براث خاصی را برای برخی از میکروارگانیسمها معرفی کرد. رقتهای سریالی ایجاد شده از اولین چاهک محدودۀ غلظت را ایجاد میکند (16). مقدار تلقیح برای این روش معمولاً CFU/ mL1×106 است (17).
برخی محققان از کشت میکروبی با چگالی نوری 0/4 نزدیک به 620 نانومتر یا یک کشت مایع 12 ساعته استاندارد شده با کدورت 0/5 مکفارلند استفاده میکنند (12). حجم مساوی از کشت میکروبی را به چاهکها اضافه میکنند (17). بعد از انکوباسیون، پلیتها را برای بررسی تغییرات در کدورت به عنوان یک شاخص رشد، بررسی میکنند، اولین چاهکی که ظاهری روشن دارد را به عنوان MIC در نظر میگیرند، برخی از محققان از شاخصهایی مانند نمکهای تترازولیوم یا رنگ رزازولین یا اسپکتروفتومتری برای تعیین حضور رشد استفاده میکنند. در روش اسپکتروفتومتری، جذب در مقابل کنترل منفی به عنوان بلانک معمولاً در طول موج 620 نانومتر میباشد. کاهش سریع در مقدار جذب یا کمترین غلظتی که جذب صفر خوانده میشود MIC عامل ضدمیکروب میباشد (11).
رقت در آگار بر اساس شیب یا Etest
رقت در آگار بر اساس شیب غلظت، یک روش اختصاصی است (Etest، AB بیودیسک، سولنا و سوئدی نیز نامیده میشود) که آزمون MIC را با آزمون انتشار در دیسک ترکیب کرده است. عامل ضد میکروب پشت نوار پلاستیکی به شکل ظریفی محصور میشود و وقتی روی سطح آگار قرار میگیرد از نوار به محیط کشت منتشر میشود و به سرعت مدل شیب را تشکیل میدهد. نوار Etest قدرت مهاری یک عامل ضد میکروب را با محدوده وسیعی از غلظتها ارزیابی میکند. چندین نوار Etset حاوی عوامل ضد میکروب مختلف را میتوان روی یک پلیت قرار داد. روش Etest برای باکتریهایی مانند کمپیلوباکتر (18) پنوموکوکوس (19) و باکتریهای بیهوازی مفید است و فقط مقدار محدودی از عوامل ضد میکروب برای آزمایش موردنیاز است (20). MIC دارو طوری خوانده میشود که حاشیه بیضی شکل هاله مهار رشد نسبت به نوار تست یک حالت متقاطع ایجاد میکند، در نتیجه این روش ترکیبی از اجرای سادۀ آزمون انتشار در آگار با روش رقتسازی در مایع است. نتایج چندین مطالعه نشان میدهد که نتایج Etest هماهنگی مشخصی با اطلاعات ایجاد شده توسط روش استاندارد CLSI دارد (21).
بیواتوگرافی
بیواتوگرافی روشی بسیار مناسب برای بررسی کردن اثرات عامل ضدمیکروب روی میکروارگانیسمهای پاتوژن میباشد. بیواتوگرافی میتواند در جداسازی مستقیم اجزاء فعال هدف، بکار رود (22). بیواتوگرافی همچنین به عنوان یک تکنیک جداسازی مواد فیتوشیمیایی به وسیله تفکیک بیواسی[4] برای نشان دادن ترکیبات فعال بکار میرود (23). کروماتوگرافی روی کاغذ به دنبال بیواتوگرافی انجام میشود که اولین بار در سال 1946 توسط گودال و لوی برای تخمین خلوص پنیسیلین مورد استفاده قرار گرفت. در این روش، کاغذ کروماتوگرام مخصوص را روی لایه آگار تلقیح شده قرار میدهند و آنتیبیوتیک از کاغذ به آگار دارای میکروارگانیسم انتقال پیدا میکند، کروماتوگرافی لایه نازک توأم با بیواتوگرافی (TLC-B) توسط فیشر و لئوتنز در 1961 معرفی شد (24).
فلوسیتومتری
فلوسیتومتری (به صورت مخفف FCM) تکنیکی برای شمارش و بررسی ذرات میکروسکوپی مانند کروموزومها و سلولها میباشد که با عبور دادن جریان مایع از مقابل یک دستگاه شناساگر الکترونیکی، شمارش میشوند. فلوسیتومتری اجازه تجزیه و تحلیل هزار ذره در هر ثانیه را از نظر چندین پارامتر فیزیکی و یا شیمیایی میدهد. یکی از موارد استفاده از این روش در پژوهشهای مربوط به میکروبیولوژی است که به منظورتعیین زنده بودن باکتری بعد از تأثیر عامل ضدمیکروب از روش فلوسیتومتری جهت افتراق میکروارگانیسمهای زنده از مرده استفاده میکنند و حتی این روش میزان زنده بودن (فعالیت و تنفس) میکروارگانیسم را مشخص میکند. در این روش، میکروارگانیسمها در مجاورت رنگ رودامین (ماده فلورسانس) قرار گرفته و در صورت زنده بودن رنگ را جذب کرده و میکروارگانیسم خاصیت فلورسانس پیدا میکند. پس از این با استفاده از دستگاه فلوسیتومتر میتوان میکروارگانیسمهای فلورسنت شده را شناسایی و شمارش کرد، بدین ترتیب میتوان تأثیرعوامل داروئی را بر حیات میکروارگانیسم به راحتی و به سرعت و دقت مورد مطالعه قرار داد (25).
روشهای نویدبخش در تعیین حساسیت ضد میکروبی
در آیندۀ نزدیک، روشهایی با پیچیدگی کمتر، سهولت بیشتر برای کاربر و نسبتهای هزینه به سود بهتری را خواهیم داشت که نتایج نویدبخشی توسط تکنیکهای زیر بدست آمده است:
1: ارزیابی بیومس میکروبی از طریق اندازهگیری فعالیت متابولیکی
بیومس عناصر میکروبی که در معرض غلظتهای مختلف داروهای ضدمیکروبی قرار گرفتهاند ممکن است توسط روشهای کالریمتری با استفاده از شاخصهای رنگی که با افزایش فعالیت متابولیک میکروارگانیسمها کاهش مییابد، تعیین شود (26). نمک 2و3 بیس{2 متوکسی 4 نیترو 5 [(سولفینیل آمین) کارنونیل] 2 اچ هیدروکسی تترازولیوم} معروف به XTT یکی از نمکهای زرد رنگ تترازولیوم است که توسط دهیدروژنازهای میتوکندریایی قارچها به محصول فورمازان نارنجی تبدیل میشود که نارنجی رنگ و محلول در آب است، سپس با کمک اسپکتروفتومتری میزان تغییر رنگ نارنجی به زرد را میتوان اندازهگیری کرد (27).
2: ارزیابی بیومس میکروبی از طریق اندازهگیری میزان مصرف اکسیژن
آراجو و همکاران روشی را برای اندازهگیری تغییرات بیومس عناصر ثانویه قارچی توسعه دادند تا در غلظتهای مختلف داروهای ضد قارچی، تغییرات را در میزان مصرف اکسیژن یا تعداد کنیدیهای حاضر در آزمایش نشان دهند. اساس چنین روشی، فرضیهای است که میگوید اندازه کل بیومس قارچی ارتباط نزدیکی با میزان مصرف اکسیژن دارد. این تست با کمک دستگاه نمایشگر اکسیژن بیولوژیکی قرائت میشود (28).
3: بکارگیری سیستم ردیاب سلول زیستی (Biocell-Tracer) در تعیین حساسیت
سیستم ردیاب سلول زیستی اتوماتیک و دستی به عنوان ابزار جدیدی برای ثبت فعالیتهای تشکیل، رشد، توسعه هیف و رویش کنیدی در مواجهه با عوامل ضد قارچی میباشد. سیستم BCT رشد هیف را به طور پیوسته نشان میدهد و وقتی یک عامل ضد قارچ اضافه میشود، اگر قارچ به عامل ضد قارچ، حساس باشد منحنی رشد هیف تغییر خواهد کرد. سیستم BCTدارای جایگاهایی برای پلیتهای تلقیح شده، میکروسکوپ، اسکنر عکس و یک کامپیوتر با نرمافزاری میباشد که اجازه نظارت اتوماتیک رشد انتهای هیفی را میدهد. هرچند این سیستمها با نیازهای یک آزمایشگاه معمولی منطبق نیست، اما ابزاری را با پتانسیل عالی در بررسی فعالیت بیولوژیکی داروهای جدید ارائه میدهد یا حتی صفات اختصاصی سینرژیکی یا آنتاگونیستی ترکیبات را در داروهای ضد قارچی توصیف میکند (28).
منابع:
- Hammer KA, Carson CF, Riley TV (1999). Antimicrobial activity of essential oils and other plant extracts. J. Appl. Microbiol. 86(6): 985.
- Chang, S., Sievert, D. M., Hageman, J. C., Boulton, M. L., Tenover, F. C., Downes, F. P., Shah, S., Rudrik, J. T., Pupp, G. R., Brown, W. J., Cardo, D. & Fridkin, S. K. (2003). Infection with vancomycinresistant Staphylococcus aureus containing the vanA resistance gene. N Engl J Med 348, 1342–7.
- Wang, S. H., Sheng, W. H., Chang, Y. Y., Wang, L. H., Lin, H. C., Chen, M. L., Pan, H. J., Ko, W. J., Chang, S. C. & Lin, F. Y. (2003). Healthcare-associated outbreak due to pan-drug resistant Acinetobacter baumannii in a surgical intensive care unit. J Hosp Infect 53, 97–102.
- Steward, C. D., Raney, P. M., Morrell, A. K., Williams, P. P., McDougal, L. K., Jevitt, L., McGowan, J. E., Jr. & Tenover, F. C. (2005). Testing for induction of clindamycin resistance in erythromycin-resistant isolates of Staphylococcus aureus. J Clin Microbiol 43, 1716–21.
- Tenover, F. C., Lancaster, M. V., Hill, B. C., Steward, C. D., Stocker, S. A., Hancock, G. A., O’Hara, C. M., Clark, N. C. & Hiramatsu, K. (1998). Characterization of staphylococci with reduced susceptibilities to vancomycin and other glycopeptides. J Clin Microbiol 36, 1020–27.
- Klevens, R. M., Edwards, J. R., Tenover, F. C., McDonald, L. C.,Horan, T. & Gaynes, R. (2006). Changes in the epidemiology of methicillin-resistant Staphylococcus aureus in intensive care units in US hospitals, 1992–2003. Clin Infect Dis 42, 389–91.
- Ahmadian, A., Ehn, M. & Hober, S. (2006). Pyrosequencing: history,biochemistry and future. Clin Chim Acta 363, 83–94
- Heatley NG (1944). Method for the assay of penicillin. Biochem. J. 38: 61-65.
- Bauer, A. W., Kirby, W. M., Sherris, J. C. & Turck, M. (1966).Antibiotic susceptibility testing by a standardized single disk method. Am J Clin Pathol 45, 493–6.
- Freixa B, Vila R, Vargas L, Lozano N, Adzet T, Caniguera S (1996). Screening for antifungal activity of nineteen Latin American plants. Phytother. Res. 12(6): 427-430.
- Salie F, Eagles PFK, Lens HMJ (1996). Preliminary antimicrobial screening of four South African Asteraceae species. J. Ethnopharmacol. 52(1): 27-33.
- Baris O, Gulluce M, Sahin F, Ozer H, Kilic H, Ozkan H, Sokmen M, Ozbek T (2006). Biological activities of the essential oil and methanol extract of Achillea Biebersteinii Afan. (Asteraceae). Turk. J. Biol. 30: 65-73.
- Nostro A, Germano MP, D’Angelo V, Marino A, Cannatelli MA (2000). Extraction methods and bioautography for evaluation of medicinal plant antimicrobial activity. Lett. Microbiol. 30(1): 379-384.
- Federal Register. (1972). Rules and regulations: antibiotic susceptibility discs. Fed Regist 37, 20525.
- Nakano MM, Zuber P (1998). “Anaerobic growth of a “strict aerobe” (Bacillus subtilis)”. Annu Rev Microbiol 52: 165–90.
- Mendoza MT (1998). What’s new in antimicrobial susceptibility testing? Philipp. J. Microbiol. Infect. Dis. 27(3): 113-115.
- Lourens ACU, Reddy D, Baser KHC, Viljoen AM, Van Vuuren SF (2004). In vitro biological activity and essential oil composition of four indigenous South African Helichrysum species. J. Ethnopharmacol. 9: 253-258
- Huang, M. B., Baker, C. N., Banerjee, S. & Tenover, F. C. (1992).Accuracy of the E test for determining antimicrobial susceptibilities of staphylococci, enterococci, Campylobacter jejuni, and gram-negative bacteria resistant to antimicrobial agents. J Clin Microbiol 30, 3243–8.
- Jorgensen, J. H., Ferraro, M. J., McElmeel, M. L., Spargo, J., Swenson, J. M. & Tenover, F. C. (1994). Detection of penicillin and extended-spectrum cephalosporin resistance among Streptococcus pneumoniae clinical isolates by use of the E test. J Clin Microbiol 32, 159–63.
- Croco, J. L., Erwin, M. E., Jennings, J. M., Putnam, L. R. & Jones, R. N. (1994). Evaluation of the Etest for antimicrobial spectrum and potency determinations of anaerobes associated with bacterial vaginosis and peritonitis. Diagn Microbiol Infect Dis 20, 213–9.
- Espinel-Ingroff, A. & Kerkering, T. M. (1991) Spectrophotometric method of inoculum preparation for the in vitro susceptibility testing of filamentous fungi. J Clin Microbial, 29, 393–4.
- Hostettmann K (1999). Strategy for the biological and chemical evaluation of plant extracts. Pure Appl. Chem. 70(11): 1-9.
- Schmourlo G, Mendonca-Filho RR, Alviano CS, Costa SS (2004). Screening of antifungal agents using ethanol precipitation and bioautography of medicinal food plants. J. Ethnopharmacol. 96(3): 563-568
- Goodall RR, Len AAA (1946). Micro-chromatographic method for the detection and approximate determination of the different penicillins in a mixture. Nature 158: 675-676.
- Waters, J.B., Oldstone,M.B.A., and Hahn, K.M.(1996) Changing in cytoplasmic stracture of CTLs during target cell recognition and killing.J.Immunol.157,3396-3402
- Jahn, B., Martin, E., Stueben, A. & Bhakdi, S. (1995) Susceptibility testing of Candida albicans and Aspergillus species by a simple microtiter menadione-augmented 3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2H-tetrazolium bromide assay. J Clin Microbiol, 33, 661–7.
- Paull, D. K., Shoemaker, H. & Boyd, M. R. (1998) The synthesis of XTT: a new tetrazolium reagent that is bioreducible to a water-soluble formazan. J Heterocycl Chem, 25, 911–4.
- Basri DF, Fan SH (2005). The potential of aqueous and acetone extracts of galls of Quercus infectoria as antibacterial agents. Indian J. Pharmacol. 37(1): 26-29.
Committee for Clinical Laboratory Standards [1] National
[2] British Society for Antimicrobial Chemotherapy
[3] European Union Committee for Antimicrobial Susceptibility Testing
[4] Bioassay guided fractionation
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام