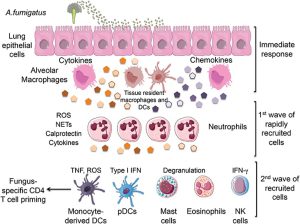
پاسخ سیستم ایمنی در برابر قارچها
دکتر محمد قهری
مقدمه
قارچهای بااهمیت از نظر پزشکی در یک گروه بسیار متنوع قرار دارند؛ برخی از آنها شیوع فراوانی در محیط داشته و چالش نیرومندی با سیستم ایمنی انسان دارند، حتی در درون گونهها اختلافات و تنوع در مرفولوژی وجود دارد و این ناهمسانی با تغییرات مرتبط در آنتیژنهای سطحی مرتبط است و فقط به قارچهای دوشکلی محدود نیست. بهعنوان مثال در میزبانان حساس، کونیدیهای استنشاقشدهی آسپرجیلوس، پوششهای سطحی مومیِ خود را ریخته (shed)، متورم شده و آنتیژنهای سطحی جدیدی را بروز میدهند، سپس ژرمیناسیون انجام میگیرد تا عناصر رشتهای (هایفی) را تشکیل دهند که آنها هم بهنوبهی خود دارای آنتیژنهای مجزای دیگری هستند.
این تغییرات سطحی موجب برانگیخته شدن پاسخهای ایمنی سلولی و همورال مشخص در میزبان میشوند. کاندیدا آلبیکنس درون بافتها بهصورت بلاستوکونیدیهای شبه مخمری، سودوهایفی و هایفی رشد میکند که در بیان آنتیژنهای سطحی با یکدیگر اختلاف دارند. علاوه بر این کاندیدا آلبیکنس و سایر قارچها میتوانند در شرایط داخل بدن فرکانس بالائی از سویچ کردن (قابل توارث) فنوتیپهای آنتیژنیک سطحی را نشان دهند. طیف وسیعی از مکانیزمهای دفاع میزبان تکامل یافته تا از انسانها در مقابل قارچها محافظت نمایند.
حتی پاتوژنترین قارچهای دیمورفیک یعنی کوکسیدیوئیدس ایمیتیس و هیستوپلاسما کپسولاتوم معمولاً در افرادی که سیستم ایمنی آنها دستنخورده و سالم است عفونتهای بدون علامت و یا خودمحدودشونده ایجاد میکنند. این مسئله بهویژه در مورد قارچهای فرصتطلب ساپروفیتیک صدق میکند، بنابراین پیامد واکنش متقابل میزبان و قارچ معمولاً به این بستگی دارد که وضعیت دفاعی میزبان چگونه است و اکثر عفونتهای جدی قارچی در افرادی واقع میشود که در یک یا چند جزء از دفاعهای ایمنی خود نقص داشته باشند.
آگاهی از نوع سازش (compromise) که یک میزبان را مبتلا و درگیر میکند کلینیسین را قادر میسازد که در مورد اینکه کدام میکوز احتمال وقوع دارد پیشبینیهایی را انجام دهد (جدول شماره 1). از طرف دیگر یک فرد اگر بدون اینکه اختلال شناختهشدهای در سیستم ایمنی داشته باشد، دچار یک عفونت منتشرهی قارچی شود حتماً باید برای یافتن نقص یا نارسائی زمینهای در سیستم ایمنی بهویژه از نظر ایدز مورد تحقیق و بررسی قرار گیرد.
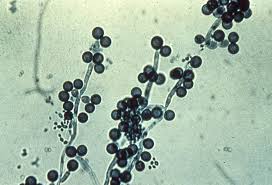
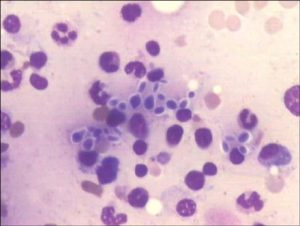
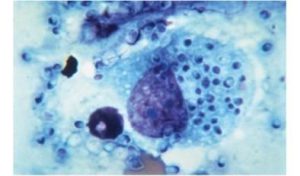
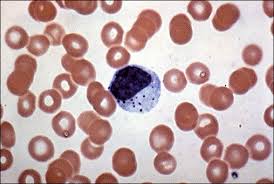
هایفی، بلاستوکونیدی و کلامیدوکونیدی (کاندیدا آلبیکنس)
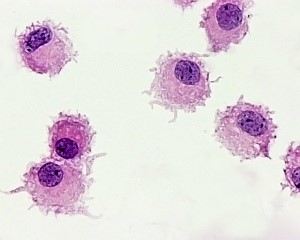
تصویر میکروسکوپ الکترونی از عناصر قارچی فاگوسیتشده توسط نوتروفیلها
بخشهای بعدی در این نوشتار اجزای مختلف پاسخ سیستم ایمنی میزبان را در مقابل قارچها شرح میدهد و تأکید ویژه بر روی ارتباطات میکوزهای خاص با نقایص اختصاصی در میزبان خواهد داشت. سیستم ایمنی سلولی بهخصوص برای دفاع میزبان علیه کریپتوکوکوس نئوفرمنس و قارچهای دیمورفیک اندمیک نظیر کوکسیدیوئیدس ایمیتیس، هیستوپلاسما کپسولاتوم، پاراکوکسیدیوئیدس برازیلینسیس و بلاستومایسس درماتیتیدیس بسیار بااهمیت است.
جدول شماره 1- عوامل اتیولوژیک عفونتهای سیستمیک قارچی مرتبط با فاکتورهای مستعدکنندهی اختصاصی
| عامل (عوامل) اتیولوژیک | فاکتورهای مستعدکننده |
| گونههای کاندیدا | پوست و غشاهای مخاطی آسیبدیده (تروما) |
| عوامل زایگومایکوز | کتواسیدوز |
| عوامل زایگومایکوز | درمان با دفروکسامین |
| گونههای کاندیدا (بیماری منتشره)
گونههای آسپرجیلوس عوامل زایگومایکوز سودوآلشریا بویدیائی گونههای تریکوسپورون گونههای فوزاریوم |
نوتروپنی |
| گونههای آسپرجیلوس
کاندیدا آلبیکنس (بیماری منتشره) |
بیماری گرانولوماتوز مزمن |
| گونههای کاندیدا (بیماری موکوکوتانئوس)
کریپتوکوکوس نئوفرمنس هیستوپلاسما کپسولاتوم کوکسیدیوئیدس ایمیتیس پاراکوکسیدیوئیدس برازیلینسیس بلاستومایسس درماتیتیدیس پنیسیلیوم مارنفئی پنوموسیستیس کارینی |
ایمنی با واسطهی سلولی مختل شده |
محافظت علیه میکوزهای تهاجمی نظیر کاندیدیازیس، آسپرجیلوزیس و زایگومایکوزیس به عملکرد صحیح و سالم نوتروفیلها بسیار وابسته است. برای راحتی در این بحثها پاسخهای ایمنی را به اجزای کوچکتری (بهعنوان مثال کمپلمان، آنتیبادی، نوتروفیلها) تقسیم کردهایم، هرچند که پاسخ ایمنی در شرایط درون بدن درنتیجهی ادغام یا همکاری بسیار پیچیدهی تمام این اجزاء است و بنابراین تقسیمبندی حاضر تا حدی دلبخواه است، بهعنوان مثال در مورد کریپتوکوکوس نئوفرمنس دادههای جدید مطرحکنندهی یک واکنش پیچیدهی متقابل ایمنی سلولی و آنتیبادی است.
علاوه بر این در مورد نوتروفیلها که زمانی فقط بعنوان فاگوسیتهای تمایزیافتهی نهایی در سیستم ایمنی ذاتی در نظر گرفته میشدند، اکنون بهعنوان منبع سیتوکاینها با اثرات متنوع بر روی ایمنی سلولی شناخته شدهاند و همچنین قادر هستند که توسط سایتوکاینهای دیگری که در طول یک دوره از پاسخ ایمنی اختصاصی تولید شدهاند، فعال و برانگیخته شوند.
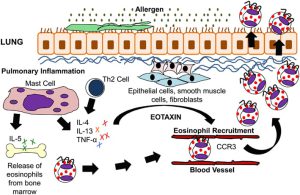
درمیزبانانی که سیستم ایمنی شایستهای دارند سیستم ایمنی در مقابله با تهاجمهای قارچی که اتفاق میافتند یک پاسخ التهابی متناسب اجرا میکند که معمولاً نقش حفاظتی برای میزبان دارد. هرچند گاهی اوقات اجرای یک پاسخ التهابی شدید ممکن است در پاتوژنز بیماری سهیم شود. یک مثال شایع از این نوع پاسخ را در فیبروز مدیاستینال مربوط به عفونت هیستوپلاسما کپسولاتوم مشاهده میکنیم. در اینجا تعداد کمی از قارچها میتوانند ماشهی پاسخ التهابی را بکشند و نتیجهی آن ایجاد یک فیبروز پیشروندهی مدیاستن تهدیدکنندهی حیات است. علاوه بر این حتی در غیاب تهاجم، قارچها میتوانند ماشهی واکنشهای ازدیاد حساسیت با واسطهی ایمنی را بکشند؛ بهعنوان مثال میتوان از وضعیتهایی مانند آسم، آلوئلیت آلرژیک اکسترینزیک و یا آسپرجیلوز آلرژیک برونکوپولمونری نام برد.
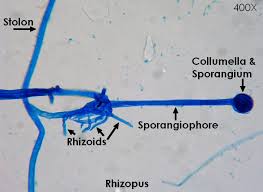
اجزای مختلف رایزوپوس
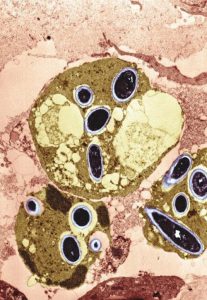
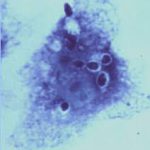
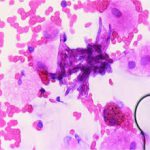
کریپتوکوکوس نئوفرمنس (مرکب چین)
فاکتورهای دفاعی غیرایمنی میزبان علیه قارچها
تعدادی از فاکتورهای غیراختصاصی مربوط به میزبان وجود دارند که معمولاً بهعنوان بخشی از سیستم ایمنی در نظر گرفته نمیشوند، هرچند که بهعنوان اولین خط دفاعی علیه تهاجم قارچی محسوب میگردند. این فاکتورها شامل سدهای مکانیکی است که توسط پوست و غشاهای مخاطی فراهم میگردند. رقابت برای جذب مواد مغذی توسط باکتریهای فلور نرمال که در بدن بیمار بومی شدهاند و سیستم پاکسازی موکوسیلیاری در مجاری تنفسی از دیگر اجزای دفاع غیرایمنی هستند. اهمیت و نقش این فاکتورها در مسئلهی ارتباط کاندیدیازیس منتشره با پارگی و ازهمگسیختگی سدهای مکانیکی در اثر سوختگیها، زخمهای جراحی و یا کاتترهای درونرگی نشان داده شده است و همچنین رقابت بر سر مواد مغذی با مسئلهی مهار باکتریهای فلور نرمال در اثر مصرف آنتیبیوتیکهای وسیعالطیف مشخص گردیده است.
در سرم، شلاته شدن آهن و سایر فلزات سنگین ضروری، رشد بسیاری از قارچها را محدود میکند. تصور میشود که ارتباط موکورومایکوزیس با درمان توسط دفروکسامین (شلاتور آهن) مربوط به توانایی قارچهای عامل بیماری به استفاده از دفروکسامین اشباعشده از آهن بهعنوان یک سیدروفور باشد. بهصورت مشابهی کتواسیدوز موجب سهولت دسترسی قارچ به آهن شده و میتواند بیماران را نسبت به موکورومایکوز مستعدتر نماید. علاوه بر این، فاکتورهای سرمی که بهطور کامل مشخص نشدهاند موجب مهار رشد کریپتوکوکوس نئوفرمنس، کاندیدا آلبیکنس و رایزوپوس آریزوس میشوند.
نقش آنتیبادی در دفاع علیه عفونتهای قارچی
مطالعات جدید بر پیچیدگیهای مربوط به اثرات متقابل ایمنی هومورال و سلولار و تا حدی ماهیت ساختگی این بخش ساده از پاسخ ایمنی تطبیقی تأکید کردهاند، با این حال برای بسیاری از قارچهای مهم از نظر پزشکی نقش مهم برای آنتیبادیهای اختصاصی در ایمنی طبیعی ثابتنشده باقی مانده است. بر عکس بیماران مبتلا به ایمنی سلولی آسیبدیده و یا مبتلایان به نوتروپنی و افرادی که درگیر هایپوگاماگلوبولینمی هستند استعداد خاصی نسبت به توسعهی عفونتهای قارچی تهاجمی از خود نشان نمیدهند و مطالعاتی که همبستگی بین حضور آنتیبادی اختصاصی و حفاظت را نشان دهند نتایج متضادی را بیان میکنند، بعلاوه در مدلهای حیوانی آسپرجیلوز، بلاستومایکوز و کوکسیدیوئیدومایکوز تاکنون هیچگونه اثر سودمندی از استعمال سرم ایمن نشان داده نشده است. همچنین حیوانات فاقد سلولهای B به نظر نمیرسد که نسبت به هیستوپلاسموز و کاندیدیازیس مخاطی حساسیت بیشتری داشته باشند.
با این اوصاف بررسیهای آزمایشگاهی (in vitro) برای کاندیدا آلبیکنس، کریپتوکوکوس نئوفرمنس و هیستوپلاسما کپسولاتوم، فعالیت افزایشیافتهی سلولهای اجرائی (مؤثر) را در حضور آنتیبادی به نمایش گذاشته است و مطالعات روی حیوان آزمایشگاهی که با استعمال آنتیبادی در آن تغییر و تبدیل بیماری نشان داده شده باشد – اهمیت یا پیچیدگیهای مربوط به نقش آنتیبادی در عفونت طبیعی هرچه باشد- استفادهی غیرفعال (passive) آنتیبادیهای اختصاصی برای بیماران مبتلا به این دسته از میکوزها میتواند مفید باشد. تحقیقات مربوط به آنتیبادیهای منوکلونال علیه کاندیدا آلبیکنس و کریپتوکوکوس نئوفرمنس نشان داده است که بسته به ویژگی و ایزوتایپ آنتیبادیها، آنها ممکن است اثرات حفاظتی، خنثی، یا درواقع افزایش بیماری داشته باشند، یافتهای که ممکن است به شرح و توضیح نتایج ناسازگار مطالعات قبلی مربوط به سرمهای پلیکلونال کمک نماید.
سرمهای ایمنی که بطریق تجربی علیه کاندیدا آلبیکنس تهیه شده است برحسب نحوهی آمادهسازی و طریقهی تلقیح، حاوی آنتیبادیهایی علیه اجزاء آنتیژنیک مختلف (بیش از 50 جزء) میباشد. سه نوع از مطالعات مطرح کردهاند که ایمنی هومورال در حفاظت علیه کاندیدیازیس منتشره تا حدی نقش دارد؛ نخست اینکه موشهایی که سلولهای B دارای آنتیبادی سطحی IgM آنها را تخلیه کردند، افزایش حساسیت نسبت به کاندیدیازیس سیستمیک نشان دادند. دوم اینکه برای برخی اما نه همهی آنتیبادیهای اختصاصی بر ضد کاندیدا یک همبستگی بین حضور آنتیبادی و حفاظت یافت شد و سوم اینکه طی برخی مطالعات معلوم شد که استفاده از آنتیبادی اختصاصی شامل آنهائیکه علیه Heat shock Protein 90 و اپیتوپهای مانان هستند در درمان مدلهای حیوانی عفونت منتشره سودمند هستند.
مکانیسمهای حفاظت از کاندیدیازیس مخاطی ممکن است در هر محلی اختصاصی باشد. در حالیکه ایمنی با واسطهی سلولی برای حفاظت علیه کاندیدیازیس اوروفارنژیال (دهانی حلقی) و ازوفاگال (مری) اهمیت دارد و بیماری واژن ممکن است درنتیجهی پاسخ بیش از اندازهی ایمنی ذاتی باشد، تنها شواهد محدودی وجود دارد که نقش مهم ایمنی هومورال را در هر یک از این نواحی مخاطی نشان دهد.
کمبود IgA با بیماری بسیار شدیدتر مخاطی ارتباط ندارد. هیچگونه اختلاف در سطوح آنتیبادیهای اختصاصی بر ضد کاندیدا در بزاق افراد HIV مثبت مبتلا یا غیر مبتلا به کاندیدیازیس دهانی وجود نداشته است. علاوه بر این، سطوح واژینال IgA و IgG اختصاصی بر ضد کاندیدا در زنان مبتلا به کاندیدیازیس واژن و یا غیر مبتلا به آن مشابه هم بوده است و حضور آنتیبادی از عفونت عودکننده محافظت نمیکند. با این اوصاف برخی از مطالعات حفاظت علیه واژینیت کاندیدایی در موشهای بزرگ آزمایشگاهی (rat) را بوسیلهی تجویز آنتیبادی اختصاصی بر ضد آسپارتیل پروتئیناز و آنتیژنهای مانان نشان دادهاند.
اکثر بیماران مبتلا به کریپتوکوکوزیس دارای کمبودهایی در ایمنی سلولی خود هستند اما برخی شواهد مطرح میکنند که ممکن است ایمنی هومورال نیز نقشی در حفاظت داشته باشد. مواردی از کریپتوکوکوزیس در بیماران با سندرم IgM بسیار بالا و هایپوگاماگلبولینمی وجود دارد. در بیماران مبتلا به مننژیت کریپتوکوکوسی، حضور آنتیبادی اختصاصی یک علامت پروگنوستیک خوب است و ظهور آنتیبادی در مایع مغزی نخاعی میتواند با بهبود همراه باشد، با این حال برخی مطالعات پاسخ آنتیبادی طبیعی نسبت به کریپتوکوکوس نئوفرمنس را مطرح میکنند که اغلب آنتیبادیهای ضد کپسولی که اپسونیک نیستند و ممکن است حفاظتی نباشند، غلبه دارند. اگرچه مطالعات قدیمیتر با سرمهای پلیکلونال نتایج خوبی نداشتهاند، گروههای متعددی از محققین اکنون اثرات مفید استفاده از آنتیبادی منوکلونال اختصاصی علیه جزء گلوکورونوکسیلومانان کپسول پلیساکاریدی کریپتوکوکال و همینطور یک پپتید که مقلد این آنتیبادی است را نشان دادهاند.
هم ایزوتیپ و هم ویژگی، مؤلفههای مهمی برای کارایی هستند و همانند کاندیدا آلبیکنس، در اینجا نیز آنتیبادیهای حفاظتی و غیرحفاظتی شرح داده شدهاند. تغییر ردهی آنتیبادی (class switching) غیرحفاظتی IgG3 به شکل دیگری مانند آنتیبادی IgG1 آن را به فرم آنتیبادی حفاظتکننده درمیآورد. اهمیت ویژگی ظریف با این حقیقت نشان داده شده است که دو نوع آنتیبادی IgM مشتقشده توسط موتاسیون سوماتیک از یک سلول B، یکی محافظتی و دیگری غیرمحافظتی بوده است. بهتازگی آنتیبادیهای منوکلونال بر ضد یک پروتئین شبههیستونی سطح سلولی هیستوپلاسما کپسولاتوم، بقاء حیات موشهایی را که قبلاً از طریق بینی عفونت به آنها القاء شده بود را افزایش داده است.
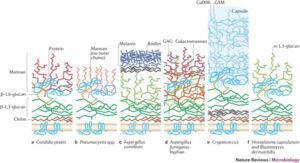
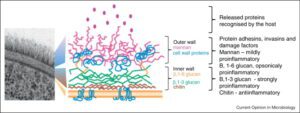
کارتونی از اجزاء تشکیلدهنده دیواره سلولی قارچها
بقاء طولانیمدت مرتبط با افزایش سطح IL-4 و IL-6 و اینترفرون گاما و کاهش التهاب در ریهها و کاهش بار یا حجم تودهی قارچی (burden) بوده است. در شرایط آزمایشگاهی، آنتیبادی فاگوسیتوز را افزایش میدهد و از رشد هیستوپلاسما کپسولاتوم بوسیله ماکروفاژهای موشی جلوگیری میکند. مکانیزمهائی که در طی آن آنتیبادیهای خاصی دورهی عفونتهای قارچی را بهبود میبخشند در حال تحقیق و بررسی هستند.
آنتیبادیهای ضد مانان کاندیدا آلبیکنس ممکن است با چسبندگی (adhesion) مداخله کنند و منجر به رسوب سریع کمپلمان بر روی سلولهای قارچی شده و به این وسیله فعالیت کاندیداکشی فاگوسیتها را تشدید کنند.
آنتیبادی برضد HSP90 به HSP قارچی بر روی سطح سلولی کاندیدا متصل میشوند و دارای فعالیت ضدقارچی مستقیم هستند، هرچند که ممکن است فوایدی از مهار HSP انسانی بدست آید که درگیر در مسیرهایی است که منجر به شوک گردش خونی میشود.
آنتیبادیهای ضدکریپتوکوکال میتوانند اپسونینهای پرقدرتی باشند و نشان داده شده که بیان آنتیژن کریپتوکوکال و فعالیت نوتروفیلها، سلولهای منونوکلئر و سلولهای کشندهی طبيعي بر ضد كريپتوكوكوس نئوفرمنس را افزایش میدهند.
آنتیبادیهای ضد كپسولي نيز سبب كليرانس گلوكورونوكسيلومانان بالقوه مضر (GXM) و كاهش رهاسازي GXM از كپسول میشوند و بسياري از اثرات سركوبگری ايمني GXM را لغو میکنند.
اكنون دادههای زيادي هستند كه يك واكنش پيچيده بين آنتيبادیهای حفاظتي بر ضد GXM و ايمني سلولي را مطرح میکنند. اثرات سودمند يك آنتیبادی IgG1 در موشهای داراي ايمني شايسته، در موشهایی که نقص توأم ايمني شديد (نقص B-cell و T-cell) دارند، در موشهای داراي نقص CD4 T-cell يا در موشهایی كه اينترفرون گاماي آنها از كار انداخته شده است دیده نمیشود. متعاقباً حفاظت با واسطهی آنتیبادی با تغييرات رو به پائين (downregulation) در سيتــــــــوكاينهاي ريه و نیز سيتوكاينهاي Th1 و Th2، B-cellها، iNOS و زمینه ژنتیکی موش مرتبط بوده است
سطح مقطع ديواره سلولي كانديدا آلبيكنس (TEM) و كارتوني كه نمایشدهندهی ترتيب قرار گرفتن اجزاي ديواره سلولي است
اين مشاهدات و ساير یافتهها منجر به اين شد كه casadevall و Pirofski مطرح كنند كه آنتیبادیها در اوائل دورهی عفونت به کاهش التهاب کمک می کنند، اما همچنين دارای اثرات ضدالتهابي مفيدی هستند كه موجب كاهش آسیب در عفونتِ استقرار یافته است. آنتیبادیهای اختصاصي ممكن است همچنين يك نقش حساس (critical) در پاتوژنز پاسخهای آلرژيك نسبت به قارچهای استنشاقشده داشته باشند؛ بعنوان مثال واکنشهای با واسطهی IgE نسبت به آلرژنهاي قارچي ممكن است در برخي حملات آسماتيك سهم داشته باشند. IgE اختصاصي ضدقارچي و IgG ممكن است در پاتوژنز رينوسينوزيت مزمن در بعضي از بيماران درگير شود و آنتیبادیهای رسوبي علیه آنتیژنهای قارچي مسئول برخي تظاهرات آلوئليت آلرژيك اكسترينزيك از طريق تشكيل کمپلکسهای ايمني هستند.
شناسایی غیراپسونیک قارچها توسط فاگوسیتها
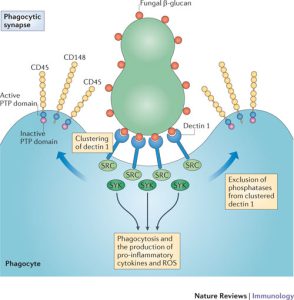
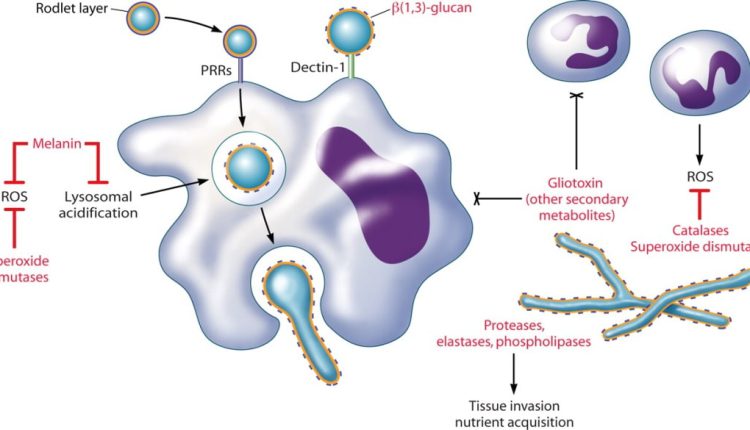
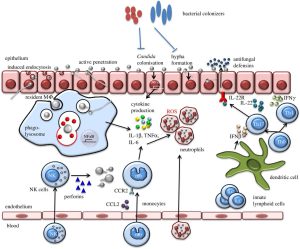
همانطور که قبلاً ذکر گردید، اپسونیزاسیون بهویژه با کمک کمپلمان و آنتیبادی یک نقش اساسی در تسهیل شناسایی قارچهای مهاجم بازی میکند. اگرچه حتی در غیاب اپسونیزاسیون، فاگوسیتها قادر به شناسایی لیگاندهای موجود در سطح اکثر قارچهای پاتوژن خواهند بود. (کریپتوکوکوس نئوفرمنس یک استثناء قابلتوجه است به دلیل کپسول ضدفاگوسیتیک این مخمر). به دنبال شناسایی سلول میزبان، 2 نوع پاسخ میتواند رخ دهد؛ اولین پاسخ منجر به فاگوسیتوز وابسته به اکتین (اینترنالیزاسیون) سلول قارچی میشود. دومین پاسخ منجر به تحریک مسیرها و راههای سیگنالینگ فاگوسیتیک میشود. اساساً پاسخ ضدقارچی وابسته است به اینکه ارگانیسم پاتوژن کدامیک از رسپتورها را تحریک میکند. دیوارهی سلولی قارچی غنی از بتاگلوکانها و مانانها میباشد. دکتین-1 نیز تقریباً در تمام جمعیتهای فاگوسیتی بیان میشود و برداشت و جذب قارچها را با بتاگلوکانهای نمایانشده واسطه میکند.
اگرچه برای برخی از قارچها، بتاگلوکانها عمدتاً در قسمت داخلی دیوارهی سلولی هستند و توسط مانانها، آلفاگلوکانها و یا کپسول پوشیده شدهاند و ممکن است برای واکنش دادن با دکتین-1 قابل دسترس نباشند. دنبالهی سیتوپلاسمی دکتین-1 ایمیونورسپتور تیروزین را فعال میکند که برای خواص سیگنالینگ آن اهمیت دارد. (دکتین-1 رسپتوری برای شناسایی قندهای موجود بر روی دیوارهی سلولی قارچها است. این رسپتور بر روی سلولهای ایمنی ذاتی بهویژه سلولهای دندریتیک قرار دارد. این رسپتور بعد از اتصال به لیگاند از طریق دومین سیتوپلاسمی انتقال پیام را انجام میدهد. در داخل این دومین سیتوپلاسمی، توالیی وجود دارد بنام ITAM یا رسپتورهای ایمنی واجد توالی فعالشونده با تیروزین، وظیفهی پیامرسانی بر عهدهی این توالی و اسیدآمینهی تیروزین است). لیگاند اختصاصی برای دکتین-2 کمتر شناخته شده است، هرچند متصل شدن دکتین-2 به هایفی کاندیدا آلبیکنس ثابت شده است.
دکتین-1 که بر روی فاگوسیتها وجود دارد یک رسپتور اختصاصی برای بتاگلوکانها است. بتاگلوکانها پلیمرهای گلوکز هستند که در دیواره سلولی قارچها یافت میشوند.
مانانها یا مانوپروتئینها در سطح دیواره سلولی اکثر قارچها ظاهر میشوند و در برخی از قارچها ترشح میشوند. مانولیزاسیون پروتئینها از طریق N-linkage و یا O-linkageها میتواند رخ دهد. گروههای مانوز نمایانشده بهوسیلهی طیف وسیعی از انواع سلولی بهویژه سلولهای دندریتیک و ماکروفاژها شناسایی میشوند. همانند دکتین-1، رسپتورهای مانوز قادر هستند که فاگوسیتوز و پاسخهای سیگنالینگ (هر دو) را واسطه کنند.
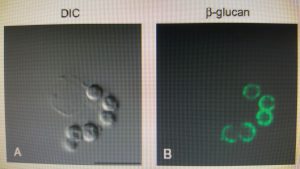
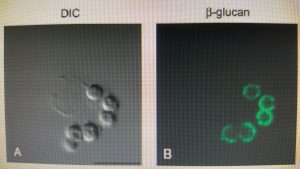
دکتین-1 در فاگوزوم های ماکروفاژ آلوئلی حاوی کنیدیهای آسپرجیلوس فومیگاتوس
(Differential interference contrast and confocal microscopy)
تصاویر میکروسکپی ماکروفاژهای آلوئلار موشی بدنبال مواجهه با کنیدیهای متورمشدهی آسپرجیلوس فومیگاتوس در شرایط داخل بدن. سلولها با آنتیبادی لیبله شده با رنگ سبز بر ضد بتاگلوکان و آنتیبادی لیبله شده با رنگ قرمز بر ضد دکتین-1 انکوبه شدهاند.
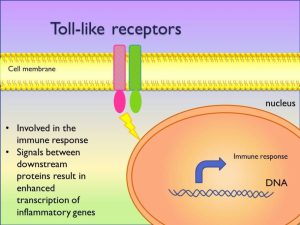
ارتباط اصلی Toll با دفاعهای ضدمیکروبی میزبان در مگس دروزوفیلا هنگامی مشخص شد که دیده شد که مگسهای دارای نقص در Toll بهطور غیرطبیعی نسبت به چالش با آسپرجیلوس فومیگاتوس حساس بودند. بعد از این کشف بر اساس مشابهتهای توالی در بخشهای سیتوپلاسمیک، رسپتورهای شبه Toll کشف شدند (TLR).
TLRها بیانگر یک فامیل از پروتئینهای محافظت شده است که پاسخهای سیگنالینگ داخل سلولی را به طرحهای ملکولی محافظتشدهی مرتبط با پاتوژن واسطه میکنند. عملکرد عمدهی TLR به نظر میرسد بهعوض فاگوسیتوز، سیگنالینگ باشد، هرچند که TLR میتواند درنهایت با رسپتورهای فاگوسیتیک (شامل رسپتورهای مانوز و دکتین-1) همکاری نماید.
رسپتورهای شبه تول (گیرندههای غشائی انتقال پیام) ردهای از پروتئینها هستند که نقش کلیدی در ایمنی ذاتی بازی میکنند. این رسپتورها کاتولیتیک نیستند، تنها (single) و غشائی هستند و معمولاً در سلولهای نگهبان همچون ماکروفاژها و سلولهای دندریتیک بیان میشوند و ملکولهای محافظتشدهی مربوط به میکروبها را شناسایی میکنند.
اثرات متقابل آسپرجیلوس فومیگاتوس با فاگوسیتها
ماکروفاژهای آلوئلار کنیدیهای استنشاقشده را فاگوسیت میکنند. متورم شدن کنیدی (درون یا خارج ماکروفاژها) موجب آزاد و رها شدن لایهی حفاظتی rodlet میشود و 1 و 3 بتا گلوکان را برای شناسایی بهوسیلهی دکتین-1 نمایان (expose) میسازد. اثرات متقابل دکتین-1-بتا (1 و 3) گلوکان نخست مسئول فعال شدن پاسخهای پیشالتهابی ماکروفاژها هستند که شامل کشتن کنیدیها میشود. نوتروفیلها به هایفیها متصل شده و دگرانوله میشوند و توسط مکانیزمهای اکسیداتیو و غیراکسیداتیو موجب آسیب هایفیها میگردند. همچنین نوتروفیلها ممکن است باعث تجمع کنیدیها شده و از این طریق مانع ژرمیناسیون آنها شوند. آسیب و اختلال در عملکرد نوتروفیلها یک فاکتور خطر اولیه برای آسپرجیلوزیس مهاجم است. محصولات قارچی که در تصویر فوق با رنگ قرمز نمایش داده شدهاند ممکن است در پاتوژنیسیتهی قارچ در میزبان ایجاد اختلال ایمنی کنند، یعنی موجب طفره رفتن دفاعهای میزبان میشوند.
سرانجام اینکه پاسخ سیتوکاینی و کموکاینی فاگوسیتها به تحریکات قارچی به مقدار زیادی بستگی دارد به اینکه کدامیک از انبوه رسپتورهای ایمنی ذاتی تحریک شده باشند. در شرایط آزمایشگاهی بنظر میرسد که TRL2 مهمترین رسپتور شبه تول برای پاسخهای سیگنالینگ نسبت به قارچها باشد هرچند که نقش رسپتورهای TRL4 و TRL9 نیز شرح داده شده است. در شرایط داخل بدن موشهای فاقد TRLهای خاص عموماً حساسیت بیشتری نسبت به چالش قارچها نداشته و یا اینکه این حساسیت نسبتاً کم بوده است که شاید علت این مسئله وجود مواد مختلف و فراوان در سیستم ایمنی باشد (redundancy).
به نظر میرسد برخی از قارچها با استفاده از رسپتور فاگوسیتها قادر به وارد شدن به درون سلولها هستند. این مسئله پارازیتیسم داخل سلولی را تسهیل میکند و مکانیسمهای اجرائی که در پاسخ به اپسونینها، مانانها و بتاگلوکانها فعال میشدند، در این حالت مورد اجتناب قرار میگیرد. ورود هیستوپلاسما کپسولاتوم به داخل ماکروفاژها و نوتروفیلها توسط واکنش متقابل بین HSP60 بر روی سطح سلول قارچی با CD18 موجود بر سطح سلول فاگوسیتی واسطه میشود. در مقابل، سلول دندریتیک اگرچه CD18 را بیان میکند، آنها در عوض از Very late Antigen-5 (VLA-5) بهره میبرند تا هیستوپلاسما کپسولاتوم را فاگوسیت کنند. بلاستومایسس درماتیتیدیس از یک پروتئین دیواره سلولی استفاده میکند (BAD1) برای دسترسی به ماکروفاژها از طریق CR3 و به راه انداختن یک برنامهی ضدالتهابی که بقاء پاتوژن را برمیانگیزد.
در جدول زیر لیگاندهای شناختهشدهی موجود در قارچهای پاتوژن که توسط رسپتورهای اختصاصی فاگوسیتیک مورد شناسایی واقع میشوند خلاصه شده است.
مثالهایی از رسپتورها و لیگاندهائی که در اتصال غیراپسونیک قارچها به فاگوسیتها دخالت دارند.
|
پاتوژن |
لیگاند(های) قارچی | رسپتور(های) فاگوسیتی |
|
آسپرجیلوس فومیگاتوس |
مانانها، بتاگلوکانها |
DC-SIGN, dectin-1 |
|
بلاستومایسس درماتیتیدیس |
BAD1 |
CR3, CD14 |
|
کاندیدا آلبیکنس |
مانانها، بتاگلوکانها |
Mannose receptors, dectin-1 |
|
کوکسیدیوئیدس پوساداسیآی |
مانانها، بتاگلوکانها |
Mannose receptors, dectin-1 |
|
کریپتوکوکوس نئوفرمنس |
گلوکورونوکسیلومانان |
TLR2, TLR4, CD14, CD18, FCɤRII |
|
هیستوپلاسما کپسولاتوم |
HSP60 |
CD18, VLA-5 |
| پنموسیستیس جیرووسی | مانانها، بتاگلوکانها |
Mannose receptors, dectin-1 |
نوتروفیلها و ائوزینوفیلها
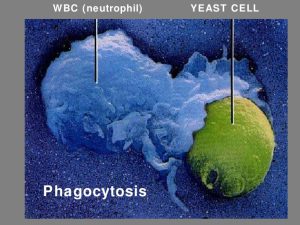
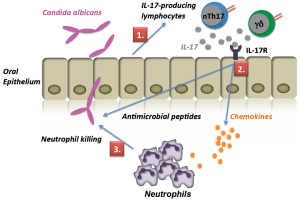
نوتروفیلها سلولهای اجرائی اولیه در التهاب حاد هستند که به تعداد زیاد در جریان گردش خون حضور داشته و بهوسیلهی یک سری از حوادثی که بهدقت تنظیم میشود، از طریق چسبیدن به اندوتلیوم عروق و مهاجرت از عرض اندوتلیوم و از میان بافت، خود را بهسرعت به محل عفونت میرسانند. محصولات میکروبی، اجزاء کمپلمان (بهویژه C5a)، کموکاینها (بهویژه IL-8) و متابولیتهای اسید آراشیدونیک بر روی سلولهای اندوتلیال و نوتروفیلها عمل میکنند تا این سری حوادث را آغاز کنند. در محل التهاب، اتصال به میکروبها توسط رسپتورهای اختصاصی نوتروفیلها واقع میشود و اگر میکروب توسط C3 یا IgG اپسونیزه شده باشد این عمل تسهیل میگردد. ممکن است در غیاب اپسونینها به علت حضور لیگاندها بر روی سطوح میکروبی (مانند مانوز و بتاگلوکان) که توسط رسپتورهای نوتروفیلی مورد شناسائی قرار میگیرند، اتصال رخ دهد.
بعد از اتصال، معمولاً فاگوسیتوز واقعی (اینترنالیزاسیون) ارگانیسم اتفاق میافتد. فرآیند کشتن میکروارگانیسمها میتواند در اثر مکانیزمهای اکسیداتیو یا غیراکسیداتیو رخ دهد. مکانیزمهای اکسیداتیو به فرآیندهایی برمیگردد که وابسته به انفجار تنفسی است که بهموجب آن اکسیژن ملکولی به آنیون سوپراکساید احیاء میگردد. مقدار عمدهی این آنیون سوپراکساید به پراکسید هیدروژن تبدیل میشود. پراکسید هیدروژن فعالیت ضدمیکروبی ضعیفی دارد. هرچند که در یک واکنش که بهوسیلهی آنزیم میلوپراکسیداز نوتروفیلی کاتالیز میشود پراکسید هیدروژن میتواند با یک یون هالید وارد واکنش شده و اکسیدانتها را با فعالیت قوی ضدمیکروبی تشکیل دهد (مثال: اسید هیپوکلرو).
منوسیتها و ماکروفاژها نیز در اثر تحریک میتوانند انفجار تنفسی را- اگرچه در یک سطح فعالیتی که بهطور قابلتوجهی کمتر از نوتروفیلها است- به راه بیاندازند، علاوه بر این ماکروفاژهای بالغ فاقد میلوپراکسیداز هستند. گرانولهای نوتروفیلها حاوی موادی هستند که میتوانند فعالیت میکروبکشی غیروابسته به اکسیژن را واسطه کنند و اینها شامل دفنسینها، لاکتوفرین و کلپروتکتین میباشد. در طول فعال شدن نوتروفیل، گرانولها تخلیه شده و محتوای خود را به داخل فاگولیزوزوم و فضای خارج سلولی آزاد میکنند.
از منظر بالینی یک ارتباط قوی بین نوتروپنی با کاندیدیازیس منتشره و آسپرجیلوزیس تهاجمی وجود دارد. بدون شک این ارتباط نهتنها از اهمیت ویژهی نوتروفیلها در دفاع میزبان علیه این دو میکوز حکایت میکند، بلکه همچنین مربوط به فراوانی میزان برخورد با این قارچهای همهجا حاضر نیز میباشد. بسیاری از میکوزهای دیگر شامل زیگومیکوز، فوزاریوز و سودوآلشریازیس اگرچه هنوز نسبتاً نادر هستند، با این وجود با شیوع روزافزونی در میزبانان نوتروپنیک دیده میشوند. ارتباط نوتروپنی با میکوزها موجب شده تا تحقیقات زیادی بر روی واکنشهای بین نوتروفیلها با تعداد متنوعی از قارچها بهویژه کاندیدا و آسپرجیلوس صورت گیرد. در شرایط آزمایشگاهی نوتروفیلهای انسان میتوانند سلولهای مخمری، سودوهایفی و هایفی کاندیدا آلبیکنس و نیز هایفی آسپرجیلوس فومیگاتوس را بکشند.
در مقابل، کنیدیهای آسپرجیلوس فومیگاتوس که فرم استنشاق شدهی ارگانیسم هستند علیرغم اینکه به سهولت فاگوسیت میشوند، نسبت به کشته شدن توسط نوتروفیلها مقاوم هستند. سلولهای هایفی کاندیدا و آسپرجیلوس آنقدر بزرگ هستند که نتوانند توسط نوتروفیلها بلعیده شوند، اگرچه گروهی از نوتروفیلها میتوانند به سطح قارچی چسبیده و آن را بکشند. هایفی هر دو قارچ نوتروفیلها را تحریک میکنند تا فرآیند انفجار تنفسی و دگرانولاسیون راه افتد. اکسیدانتهای ایجادشده (بهعنوان مثال پراکسید هیدروژن و اسید هیپوکلرو) و تولیدات گرانولی که آزاد میشوند (مانند دفنزینها) خواص قارچکشی دارند. اهمیت نوتروفیلها در دفاع علیه کاندیدا آلبیکنس و آسپرجیلوس فومیگاتوس و سایر قارچهای کاتالاز مثبت با کثرت این میکوزها (در یک سری بزرگ به میزان 20 درصد) در بیماری گرانولوماتوز مزمن، CGD (یک اختلال ارثی مربوط به NADPH oxidase) برجستهتر میشود.
نوتروفیلهای مربوط به این دسته از بیماران در توانائی خود برای به راه انداختن انفجار تنفسی دچار نقص هستند و تنها مقادیر ناکافی و اندکی اکسیدانتهای میکروبکش تولید میکنند. به دنبال این مسئله نوتروفیلهای بیماران CGD در کشتن ارگانیسمهای کاتالاز مثبت که شامل گونههای آسپرجیلوس و کاندیدا هستند، مشکل دارند. در مورد ارگانیسمهای کاتالاز منفی، نوتروفیلهای بیماران CGD قادر هستند نقص پراکسید هیدروژن را با استفاده از پراکسید هیدروژنی که توسط میکروارگانیسمها تولید شدهاند، تأمین نمایند. ارگانیسمهای کاتالاز مثبت با تجزیهی پراکسید هیدروژنی که تولید میکنند فاگوسیت را از پراکسید هیدروژن درونزاد خود محروم میکنند.
نوتروفیلها دارای رسپتورهای سایتوکاین هستند و تحریک نوتروفیلها با سایتوکاینهای مناسب میتواند موجب افزایش قدرت قارچکشی آنها شود که مطرحکنندهی مکانیزمهای فیدبکی است که به آن وسیله سلولهای تکهستهای تحریک شده، سایتوکاینها را تولید میکنند که در عوض نوتروفیلها را برای عمل قارچکشی مؤثرتر فعال میکنند. استعمال درون بدنی in vivo اینترفرون گامای نوترکیب به بیماران CGD نشان میدهد که بهصورت قابلتوجهی انسیدانس عفونتهای وخیم کاهش مییابد. نوتروفیلهای بهدستآمده از بیماران CGD که با اینترفرون گاما درمان شدهاند ظرفیت آسیب رساندن به هایفی آسپرجیلوس فومیگاتوس را کسب میکنند. برعکس، فعالیت کاندیداکشی نوتروفیلها بهوسیلهی سایتوکاینهای ضدالتهابی IL-4 و IL-10 دچار اختلال میشود. پروسهای که ممکن است آسیبی را که بهوسیلهی پاسخ التهابی فراوان و پرشاخ و برگ ایجاد شود را محدود نماید.
نوتروفیلها در اثر تحریک بهوسیلهی کاندیدا آلبیکنس و آسپرجیلوس فومیگاتوس سایتوکاینهای پیشالتهابی و ضدالتهابی، هر دو را ترشح میکنند. پاتولوژی کاندیدیازیس و آسپرجیلوزیس منتشره تهاجم عروقی است، این یافته موجب مطالعهی واکنش بین کاندیدا آلبیکنس و آسپرجیلوس فومیگاتوس با اندوتلیوم عروق شده و اینکه نوتروفیلها چگونه این واکنش را تحت تأثیر قرار میدهند. مولکولهای چسبنده (adhesins) متعددی شرح داده شدهاند که این پروسه را تسهیل میکنند که شامل آنالوگهای اینتگرین (پروتئینهای قارچی که مشابهت آنتیژنیک و عملکردی با اینتگرینهای پستانداران نشان میدهند) هستند که لیگاندهای اینتگرین را بر روی سلولهای اندوتلیال شناسائی میکنند. بسیاری از این رسپتورهای همانند هم، احتمالاً چسبیدن کاندیدا آلبیکنس به سلولهای اپیتلیال را وساطت میکنند.
در مقایسه با نوتروفیلها، اطلاعات کمتری در مورد سهم ائوزینوفیلها در پاسخهای میزبان در برابر قارچهای مهاجم وجود دارد. ائوزینوفیلها عموماً در ارتباط با بیماریهای آلرژیک قارچی که عمدتاً شامل سینوزیت و آسم است، دیده میشوند. در چنین مواردی ائوزینوفیلها به علت آزادسازی محصولات سمی از خودشان که شامل پراکسیداز ائوزینوفیلی و پروتئین بازی مهم آن است، اثرات زیانبخشی را از خود بر جای میگذارند. در شرایط آزمایشگاهی (in vitro) مواد استخراجشده از قارچهای محیطی آلترناریا آلترناتا و پنیسیلیوم نوتاتوم موجب القاء اگزوسیتوز ائوزینوفیلها در افراد نرمال میشود. یک پاسخ ائوزینوفیلیک گاهی اوقات در انسانها در ارتباط با برخی از میکوزها بهویژه در کوکسیدیوئیدومایکوزیس دیده میشود.
فاگوسیتهای تکهستهای
فاگوسیتهای تکهستهای نسبت به بروز یک پاسخ ایمنی محافظتی به تعدادی از مهمترین پاتوژنهای قارچی نقش مرکزی دارند. منوسیتها، ماکروفاژهای مقیم بافتی و سلولهای دندریتیک بخشی از خط مقدم ایمنی ذاتی با واسطهی سلولی را تشکیل میدهند، علاوه بر این فاگوسیتهای تکهستهای بهویژه سلولهای دندریتیک در برقراری ارتباط بین پاسخهای ایمنی ذاتی و تطبیقی بهوسیلهی به راه انداختن و ترویج پاسخهای ایمنی با واسطهی سلول T اختصاصی نقش بسیار مهمی دارند. سلولهای T فعالشده میتوانند سایتوکاینها را ترشح کنند و این سایتوکاینها فاگوسیتها را فعال میکنند تا بهصورت سلولهای اجرائی بسیار قویتری درآیند. به نظر میرسد که بسیاری از قارچها بهویژه کریپتوکوکوس نئوفرمنس و هیستوپلاسما کپسولاتوم با بقاء درون فاگوسیتها خود را تطبیق میدهند. (شکل زیر)
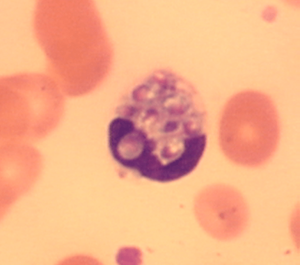
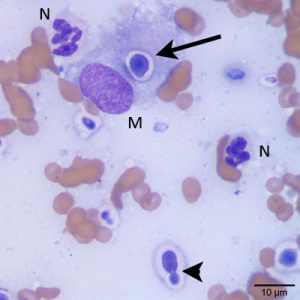
تصویر هیستوپلاسما کپسولاتوم درون یک منوسیت در خون محیطی.
گسترش خون محیطی که از یک بیمار ایدزی و مبتلا به هیستوپلاسموز منتشرهی پیشرونده تهیه شده است. سلولهای مخمری هیستوپلاسما کپسولاتوم درون سلول منوسیت دیده میشوند.
سلولهای مخمری هیستوپلاسما کپسولاتوم در نمونهی آسپیرهی مغز استخوان، هالهی شفاف اطراف مخمرها قابلتوجه است.
سلولهای دندریتیک
سلولهای دندریتیک در تمام ارگانهای بدن حضور دارند و بهعنوان نگهبان عمل میکنند. سلولهای دندریتیک هنگام مواجهه با آنتیژنها و یک سیگنال بالغ شدن به بافت لنفاتیک مهاجرت میکنند و در آنجا بالغ میشوند، سایتوکاینها را ترشح میکنند و پاسخهای ایمنی با واسطهی سلولی را شروع میکنند. واکنش سلولهای دندریتیک با سلولهای T در عقدههای لنفاوی نهتنها منجر به زایش و توسعه و گسترش سلولهای T اختصاصی نسبت به آنتیژن میگردد، بلکه همچنین موجب پولاریزه شدن سلولهای T به متمایز شدن به سلولهای T رگولاتوری یا Th1 و Th2 میشوند.
همچنین دندریتیک سلها پلهای کلیدی بین ایمنی تطبیقی و ایمنی ذاتی هستند و بنابراین تعجبآور نیست که در مطالعات متنوعی نشان داده شده است که سلولهای دندریتیک در به راه انداختن پاسخهای سلولهای +CD4 و +CD8 علیه پاتوژنهای قارچی اهمیت اساسی دارند، هرچند که تصور میشود عمل اولیهی آنها آغاز کردن پاسخهای ایمنی تطبیقی از طریق فرآیند بیان آنتیژن است. سلولهای دندریتیک همچنین سلولهای اجرائی فاگوسیتیک هستند.
پاتوژنهای قارچی که توسط سلولهای دندریتیک فاگوسیت شده یا علیه آنها فعالیت ضدقارچی انجام میشود شامل کاندیدا آلبیکنس، هیستوپلاسما کپسولاتوم، آسپرجیلوس فومیگاتوس، کریپتوکوکوس نئوفرمنس و کوکسیدیوئیدس پوساداسی میباشند. سلولهای دندریتیک برای فاگوسیتوز سلولهای کریپتوکوکوس نئوفرمنس کپسولدار نیاز به اپسونیزاسیون با کمپلمان یا آنتیبادی دارند، درحالیکه برای سایر قارچها لیگاندهائی که بر روی سطوح قارچی حضور دارند بهوسیلهی رسپتورهای سلولهای دندریتیک مورد شناسائی قرار میگیرند. مکانیزمهائی که بهوسیلهی آن سلولهای دندریتیک پاتوژنهای قارچی را میکشند بهخوبی مشخص نشده است، هرچند که در یک مطالعه از شرکت داشتن هیدرولازهای لیزوزومال نام برده شده است.
سلول دندریتیک میتواند به دنبال فاگوسیتوز بالغ شود، سایتوکاینها را ترشح کند و آنتیژنهای قارچی را بیان کند. مرفوتایپ قارچ میتواند طبیعت پاسخ ایمنی را تحت تأثیر قرار دهد. فاگوسیتوز سلولهای مخمری و کنیدیهای آسپرجیلوس فومیگاتوس توسط سلولهای دندریتیک منجر به پاسخ سلولی نوع Th1 میشود، درحالیکه فرمهای هایفی این قارچها سلولهای دندریتیک را تحریک میکنند تا پاسخ سلولی نوع Th2 را القاء نمایند.
نمایی از سلولهای دندریتیک
ماکروفاژها
ماکروفاژها از منوسیتهای در گردش به دنبال بکارگیری در بافت و تمایز بعدی آنها منشأ میگیرند. خواص ضدقارچی ماکروفاژها به مقدار زیادی تحت تأثیر محل آناتومیک است که در آن تمایز صورت میگیرد و همچنین تحت تأثیر حالت فعالسازی ماکروفاژ است. فعالسازی ماکروفاژها بهوسیلهی سایتوکاینهای مشتقشده از لنفوسیتها بهویژه اینترفرون گاما ممکن است خواص قارچکشی این فاگوسیتها را آشکار کند. این مسئله احتمالاً بیانگر اهمیت حیاتی ایمنی با واسطهی سلولی در کنترل بسیاری از قارچهای پاتوژن است. بهاستثنای کاندیدا آلبیکنس، برای اکثر قارچهایی که بیماری سیستمیک ایجاد میکنند، مواجههی ابتدائی بهوسیلهی استنشاق سلولهای قارچی هوابرد ایجاد میشود، بنابراین ماکروفاژهای برونکوآلوئلار بهویژه یک جزء مهم از دفاع میزبان را تشکیل میدهند.
ماکروفاژهای برونکوآلوئلار رشد تعدادی از قارچها را مهار میکنند و معمولاً فعالیت ضدقارچی بزرگتری نسبت به سایر جمعیــــتهای ماکروفاژی دارند. در شرایط آزمایشگاهی (in vitro) ماکروفاژهای برونکوآلوئلار میتوانند کنیدیهای آسپرجیلوس فومیگاتوس را بکشند ولی روی هایفی این قارچ اثری ندارند. برعکس، نوتروفیلها بر روی کنیدی اثرات مرگآوری ندارند ولی میتوانند هایفی را بکشند. در شرایط داخل بدن این دو نوع دفاع فاگوسیتی در ترکیب با یکدیگر عمل میکنند تا از استقرار عفونت جلوگیری کنند. کنیدیهائی که از کشته شدن توسط ماکروفاژهای برونکوآلوئلار مقیم بافتی فرار میکنند و ژرمیناسیون پیدا میکنند
نسبت به حمله توسط نوتروفیلها حساس خواهند بود. ماکروفاژهای برونکوآلوئلار علیه دیگر گونههای قارچی از قبیل کریپتوکوکوس نئوفرمنس، رایزوپوس آریزوس و بلاستومایسس درماتیتیدیس فعالیت دارند. در مقابل، میکروکونیدی هیستوپلاسما کپسولاتوم یعنی فرم استنشاقشدهی ارگانیسم، به دنبال بلعیده شدن توسط ماکروفاژهای برونکوآلوئلار روند تغییر فاز را به سمت سلولهای مخمری انجام داده و سپس تکثیر مییابد.
همانند نوتروفیلها، منوسیتها و ماکروفاژها فعالیت ضدقارچی خود را بهوسیلهی مکانیزمهای اکسیداتیو و غیراکسیداتیو اعمال میکنند. میانجیهای واکنشپذیر نیتروژن شامل اکسید نیتریک که توسط ماکروفاژهای فعالشده تولید میشوند یک نقش کلیدی در عمل ضدقارچی ماکروفاژهای موشی دارند، هرچند به علت کمتر ساخته شدن میانجیهای واکنشپذیر نیتروژن بهوسیلهی ماکروفاژهای انسانی از کاربرد این مکانیزم ضدقارچی در سلولهای انسانی اطمینانی حاصل نیست. فعالیت ضدقارچی واسطههای غیراکسیداتیو کمتر مشخص شدهاند اما احتمالاً شامل آنزیمهای تجزیهکننده و پپتیدهای ضدمیکروبی هستند. آنزیمها شامل لکتینازها که نقش مهمی در تجزیه و تلاشی دیوارهی سلول قارچی بازی میکنند، بهخوبی شرح داده شدهاند. به نظر میرسد که اسیدیفیکاسیون فاگوزوم بدنبال جوش خوردن فاگوزوم– لیزوزوم تا حدودی و به درجاتی رخ دهد اما ممکن است بسان یک شمشیر دو لبه عمل نماید.
یک pH پائین فعالیت مطلوب هیدرولازهای لیزوزومال را تشویق میکند و نیز آهن را برای قارچ قابل دسترسی مینماید. هیستوپلاسما کپسولاتوم مکانیزمهائی را ایجاد میکند که بهوسیلهی آن میتواند pH فاگوزومال را در حدود 6/5 نگاه دارد و بنابراین به ارگانیسم اجازه میدهد که آهن را بدست آورد و فعالیت هیدرولازهای لیزوزومال ماکروفاژ را به حداقل برساند. عواملی مثل کلروکین که pH فاگولیزوزومال را بالا میبرد بهصورت قابلتوجهی فعالیت ضدقارچی ماکروفاژهای انسانی را در برابر هیستوپلاسما کپسولاتوم و کریپتوکوکوس نئوفرمنس افزایش میدهد. در مورد هیستوپلاسما کپسولاتوم، کلروکین با فراهم کردن محدودیت آهن در pH بالاتر و در مورد کریپتوکوکوس نئوفرمنس اثر کلروکین مستقل از فقدان آهن بوده و به رشد ضعیف این قارچ در pH بالاتر ارتباط دارد.
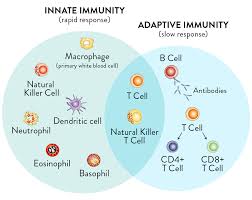
ایمنی با واسطهی سلول T
پاسخ ایمنی اختصاصی با واسطهی سلول T CD4
ایمنی اختصاصی با واسطهی سلول برای یک پاسخ محافظتی ایمنی نسبت به کریپتوکوکوس نئوفرمنس و قارچهای دیمورفیک نقشی اساسی دارد و در حفاظت علیه عفونتهای درماتوفیتی نیز درگیر میشود. ایمنی با واسطهی سلولی (بهعوض عملکرد دستنخوردهی نوتروفیل) اهمیت اولیه برای حفاظت کاندیدیازیس دهانی حلقی و کاندیدیازیس مری دارد. شواهد برای اهمیت ایمنی اختصاصی با واسطهی سلولی از مشاهدات کلینیکی و مطالعات حیوانی بهدستآمده است. این میکوزها با کثرت افزایشیافته در بیماران مبتلا به ایدز، لنفوم و سارکوئیدوز دیده میشوند و همچنین در افرادی که از داروهای سرکوبگر سیستم ایمنی نظیر کورتیکوستروئیدها و سیکلوفسفامید استفاده میکنند. این داروها ایمنی با واسطهی سلولی T را سرکوب میکنند. انسیدانس بالای عفونتهای قارچی در بیماران HIV مثبت بهویژه چشمگیر است. این ویروس، لنفوسیتهای CD4+و فاگوسیتهای منونوکلئر- یعنی دو نوع سلولی که نسبت به پاسخ ایمنی با واسطهی سلولی دارای واکنشهای مرکزی هستند- را عفونی میکند.
ایجاد یک پاسخ ایمنی اختصاصی با واسطهی سلولی T CD4 نیاز به سلولهای دندریتیک بیانکنندهی آنتیژن دارند که آنتیژن یا آنتیژنهای قارچی را برای لنفوسیتهای T آماده و عرضه کنند. آنتیژنهای خارجی مثل قارچها به داخل وزیکولهای اسیدی مسیر اندوزوم- لیزوزوم جذب شده و به قطعات پپتیدی تبدیل میشوند. این پپتیدها به ملکولهای اصلی سازگاری بافتی کلاس 2 باند میشوند که درون وزیکولها قرار دارند و کمپلکسهای MHC-peptide سپس بر روی سطح سلولی بیان میشوند؛ یعنی در جایی که آنها ممکن است بهوسیلهی سلولهای CD4 T helper شناسایی شوند.
رسپتور T cell به پپتیدی که در داخل شکاف ملکول MHC قرار گرفته است باند میشود و به دترمینانتهای پلیمرفیک روی MHC یعنی جایی که co-receptor سلول CD4 در یک محل جداگانه بر روی ملکول MHC class II باند میشود. برای اینکه فعالسازی T cell رخ دهد یک سیگنال دوم باید بهوسیلهی مولکولهای کمکی تحریککننده- نظیر CD80 و CD 86 -بر روی سلول عرضهکنندهی آنتیژن (APC) فراهم شود.
ملکولهای کمکی تحریککننده با رسپتورهای مشابه بر روی سلولهای T وارد واکنش میشوند. فاکتورهای دیگر شامل سایتوکاینهائی هستند که توسط سلولهای بیانکنندهی آنتیژن ترشح میشوند که بر روی طبیعت و وسعت و اندازهی پاسخ حاصلهی سلول T تأثیر میگذارند. فعال شدن سلولهای T به تکثیر و تزاید و گسترش کلونال از طریق تنظیم افزایشی (upregulation) اینترلوکین 2 و گیرندهی اینترلوکین 2 منجر میشود. اینترلوکین 2 فاکتور رشد اصلی سلول T میباشد. گسترش کلونال سلولهای T اختصاصی آنتیژن، یک منبع (استخر) بزرگ از سلولهای اجرائی و متعاقب آن سلولهای خاطرهای اختصاصی برای آنتیژن فراهم میکند که میتوانند یک پاسخ سریعتر در مواجههی بعدی با همان آنتیژن را شروع کنند. فعال شدن همچنین موجب میشود که سایر سایتوکاینها و ملکولهای سطحی که در عملکرد مؤثر سلولهای Th مؤثر هستند بیان شوند.
کاندیدا آلبیکنس فاگوسیت شده در سلول بیگانهخوار
مخمر کاندیدا درون ماکروفاژ
سلولهای فاگوسیت شدهی هیستوپلاسما کپسولاتوم درون ماکروفاژ
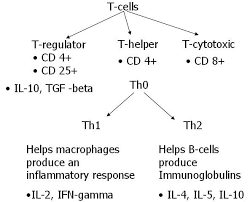
پاسخهای نوع Th1 و Th2
زیرمجموعههای مختلف سلولهای Th CD4 وجود دارند که انواع مختلفی از سایتوکاینها را ترشح میکنند. سلولهای سادهی T وابسته به فاکتورهایی مثل سیگنالهای تحریککننده از سلولهای بیانکنندهی آنتیژن، بومگاه سایتوکاینی (cytokine milieu) و دوز آنتیژن، ممکن است پولاریزه شوند و بهصورت عمده اینترلوکین 2 و اینترفرون گاما (الگوی ترشحی Th1) و یا بهصورت غالب اینترلوکین 4 و اینترلوکین 5 و اینترلوکین 13 را (الگوی ترشحی مربوط به Th2) ترشح کنند. این نوع برخورد مختلف بهوسیلهی ستهای اختصاصی فاکتورهای نسخهبرداری کنترل میشوند. هنگامیکه این پاسخ ایجاد شد، الگوهای پاسخ ممکن است بهوسیلهی تنظیم متقاطع حفظ شوند؛ بهعنوان مثال اینترلوکین 4 و اینترفرون گاما تولید هر یک از دیگری را مهار میکنند.
اگرچه الگوی Th1 و Th2 بدون تردید سادهسازی است و حال بهوسیلهی شناسایی زیرمجموعههای دیگری از سلولهای تنظیمی T پیچیده شده است، درک ما را از پاسخهای حفاظتی و غیرحفاظتی در مقابل عفونتهای قارچی به میزان زیادی افزایش داده است. پاسخهای مختلف ایمنی بهواسطهی الگوی ترشح سایتوکاین توسط Th1 و Th2 وجود دارد: اینترفرون گاما و اینترلوکین 2، ماکروفاژها و سلولهای T سایتوتوکسیک و سلولهای NK را به ترتیب برای پاکسازی ارگانیسمهای داخل سلولی فعال میکنند. در مقابل سایتوکاینهای Th2 رشد و تمایز سلولهای B و همچنین تبدیل ایزوتیپ به IgE و تمایز ائوزینوفیل و پاسخهای فعالسازی که ممکن است به حفاظت علیه برخی پارازیتها را موجب میشوند اما همچنین در آلرژی و ازدیاد حساسیت دخیل هستند.
فاکتورهای متعددی که این دگرگونی و انشعاب (divergence) بحرانی را در پاسخ ایمنی کنترل میکنند شامل تولید زودهنگام سایتوکاین بهوسیلهی انواع دیگر سلولی بهویژه سلولهای دندریتیک است، بنابراین تولید اینترلوکین 12 و اینترلوکین 18 در پاسخ به میکروبها یا محصولات میکروبی، تولید اینترفرون گاما را بهوسیلهی سلولهای T و NK تحریک میکند و پاسخ را به طرف الگوی Th1 هدایت میکند. علاوه بر این نشان داده شده است که قارچها مستقیماً سلولهای NK و سایر سلولهای ایمنی ذاتی را تحریک میکنند تا اینترلوکین 10 و اینترفرون گاما ترشح کنند که ممکن است روی طبیعت پاسخTh تأثیر کند. بررسیهایی که در حیوانات آزمایشگاهی انجام شده، نشاندهندهی این مطلب است که حفاظت در مقابل برخی از قارچها با پاسخ الگوی Th1 ارتباط دارد.
در مطالعات مربوط به کاندیدیازیس سیستمیک در موش، محققین نشان دادهاند که تعادل سایتوکاینی Th1 و Th2 میتواند بهوسیلهی استرین کاندیدا آلبیکنس، استرین موش، راه تلقیح اولیه (کلونیزاسیون معدی رودهای، موجب القاء یک الگوی Th1 و تزریق داخل وریدی موجب القای الگوی Th2 میشود) و مرفوتایپ قارچ تحت تأثیر قرار گیرد. در شرایط آزمایشگاهی بلعیدن مخمرها آزادسازی اینترلوکین 12 را از سلولهای دندریتیک القاء میکند و موجب شروع فعالیت سلولهای Th1 میگردد درحالیکه بلعیدن هایفیها تولید اینترلوکین 12 را مهار و تولید اینترلوکین 4 را القاء میکند.
در شرایط داخل بدن، ایمنی حفاظتی ضدقارچی با تزریق سلولهای دندریتیکِ تحریکشده (pulsed) با مخمرهای کاندیدا القاء میشود، اما این مسئله در مورد سلولهای تحریکشده با هایفیها اتفاق نمیافتد. ظرفیت ایمنیزایی سلولهای دندریتیکِ yeast-pulsed در غیاب اینترلوکین 12 از دست میرود درحالیکه سلولهای دندریتیک تحریکشده با هایفی (hypha – pulsed) در غیاب اینترلوکین 4 به دست میآید. علاوه بر این یک تعداد از مداخلهها که پاسخ Th2 را به نوع Th1 تبدیل میکنند مانند استعمال اینترفرون گاما، آنتیبادی علیه اینترلوکین 4 یا اینترلوکین 10، یا رسپتور محلول اینترلوکین 4 نیز با حفاظت مرتبط هستند. بهطور خلاصه اگرچه نوتروفیلها در حفاظت از کاندیدیازیس سیستمیک اهمیت اولیهای دارند، شواهد قابلتوجهی نشان میدهند که در موشها با عملکرد نرمال فاگوسیتها، القاء پاسخ با واسطهی سلولی نوع Th1 موجب افزایش پاکسازی ارگانیسم میشود.
ادامهی مطلب در مورد ایمنی با واسطهی سلول T: (پاسخهای نوع Th1 و Th2)
در مورد مقاومت نسبت به آسپرجیلوزیس مهاجم، دادههای بدست آمده در رابطه با موشها یک الگوی دفاعی نوع Th1 تولید سیتوکاین بهوسیلهی مطالعات کلینیکی تکمیل شده است و نشاندهندهی این مطلب است که افراد سالم و بیماران مبتلا به آسپرجیلوزیس که به درمان پاسخ میدهند با نسبت بالائی از اینترفرون گاما به اینترلوکین 10 پاسخهای قوی لنفوپرولیفراتیو به آنتیژن آسپرجیلوس داشتهاند و این در بیمارانی که عفونتهای آنها پیشرونده بوده است، برعکس بوده است، علاوه بر این سطوح سرمی اینترلوکین 10 در بیماران دچار آسپرجیلوزیس که نوتروپنیک نیستند بالا بوده و در آنهائی که به درمان جواب ندادهاند افزایش بیشتری نشان داده است.
مشابه مشاهداتی که در کاندیدیازیس موشی دیده شده است، سلولهای دندریتیک موشی یک پاسخ نوع Th1 را آغاز کردهاند موقعی که با کونیدیهای آسپرجیلوس تحت چالش قرار گرفتهاند، اما یک پاسخ نوع Th2 را هنگامیکه با هایفی مورد چالش قرار گرفتهاند، نشان دادهاند.
مطالعات کلینیکی و تجربی روی حیوانات همچنین مطرح میکند که یک پاسخ نوع Th1 مرتبط است با حفاظت علیه کوکسیدیوئیدس ایمیتیس و هیستوپلاسما کپسولاتوم. در استرینهای خویشآمیز (inbred) موشها، مقاومت نسبت به کوکسیدیوئیدس ایمیتیس با پاسخ نوع Th1 همبستگی و ارتباط دارد. موشهای حساس میتوانند بهوسیلهی درمان با اینترفرون گاما، آنتی اینترلوکین 4، یا اینترلوکین 12 مقاومتر شوند و موشهای مقاوم میتوانند بهوسیلهی آنتی اینترفرون گاما یا آنتی اینترلوکین 12 بیشتر حساس شوند.
در بیماران مبتلا به کوکسیدیوئیدومایکوزیس تیترهای بالای آنتیبادی فیکسکنندهی کمپلمان بیشتر مطرح کنندهی پاسخ نوع Th2 و با پیشآگهی بدتر مرتبط است، درحالیکه برگشت یک پاسخ نوع ازدیاد حساسیت تأخیری یک علامت پروگنوستیک خوب است.
با استفاده از سلولهای تکهستهای خون محیطی و سنجشهای روی خون کامل، بیان اینترفرون گاما، اما نه اینترلوکین 4 یا اینترلوکین 10 و آزادسازی در پاسخ به آنتیژن کوکسیدیوئیدال در دهندههای سالم نسبت به بیماران مبتلا به بیماری منتشرهی حاد بالاتر بود و در آنهائی که شدیدترین عفونت را داشتند در پائینترین حد بوده است. یک ارتباط معکوس بین پاسخهای ایمنی با واسطهی سلولی و تیترهای آنتیبادی همچنین در بیماران مبتلا به هیستوپلاسموزیس یافت شد. در هیستوپلاسموز موشی مقاومت با سطوح بالاتر اینترفرون گاما و حساسیت با القاء زودرس اینترلوکین 4 مرتبط است.
علاوه بر این موشهای حساس میتوانند بهوسیلهی استعمال اینترلوکین 12 (اثری که توسط اینترفرون گاما واسطه میشود) محافظت شوند. ارتباطات مشابهی بین طرحهای پاسخ نوع Th1 و حفاظت برای کریپتوکوکوس نئوفرمنس، بلاستومایسس درماتیتیدیس و پاراکوکسیدیوئیدس برازیلینسیس شرح داده شده است. علیرغم ثبات و سازگار بودن دادههای فوق، نکات زیادی باقی میماند که دربارهی پیچیدگیهای ایجاد، نگهداری و تنظیم حفاظت با واسطهی Th1 باید یاد فهمید. در برخی سیستمها پاسخ نوع Th2 و سایتوکاینهای تنظیمی مثل اینترلوکین 4 و اینترلوکین 10 اگرچه نشان داده شده که برای ایمنی در مدلهائی که در آن حفاظت با واسطهی Th1 است، ضروری هستند، سایر سایتوکاینهای پیشالتهابی بهویژه IL-1β، اینترفرون آلفا و اینترلوکین 6 نیز به نظر میرسد که درگیر هستند و در ایجاد پاسخهای نوع Th1 اهمیت دارند.
در هیستوپلاسموز موشی فقدان سیگنالینگ اینترلوکین 1 منجر به کاهش مقاومت نسبت به عفونت اولیه میشود که مرتبط با اینترفرون گامای کاهشیافته و اینترلوکین 4 و اینترلوکین 10 افزایشیافته در ریهها است، درحالیکه خنثیسازی فاکتور نکروز توموری آلفا منجر به کاهش مقاومت به عفونت ثانوی میشود، مجدداً مرتبط با افزایش غلظت ریوی اینترلوکین 4 و اینترلوکین 10 است. یک مکانیسم ممکن که در مشاهده اخیر سهیم است اثر پروآپوپتوتیک (proapoptotic) فاکتور نکروز توموری آلفا است.
مهار آپوپتوزیس موجب افزایش اینترلوکین 4 و اینترلوکین 10 و افزایش حساسیت به هیستوپلاسموز میگردد. گزارشهای مربوط به هیستوپلاسموز، کوکسیدیوئیدومایکوز، کریپتوکوکوزیس و کاندیدیازیس در بیمارانی که با آنتیبادیهای ضد فاکتور نکروزدهندهی توموری آلفا درمان شدهاند، بر اهمیت این سایتوکاین در دفاع میزبان علیه عفونتهای قارچی تأکید میکنند. در کریپتوکوکوزیس، اینترلوکین 6 با افزایش ایمنی ضدقارچی در شرایط آزمایشگاهی مرتبط است. سطوح اینترلوکین 6 در مایع مغزی نخاعی در بیماران مبتلا به مننژیت کریپتوکوکال با سطوحی از اینترفرون گاما و فاکتور نکروزدهندهی توموری آلفا ارتباط داشته و سطوح بالای آنها با بقاء میزبان مرتبط بوده است.
در آنالیز چندمتغیره سطح مایع مغزی نخاعی، اینترفرون گاما بهصورت مستقل با میزان پاکسازی عفونت از مایع مغزی نخاعی مرتبط بوده است و تائیدکنندهی نقش کلیدی ایمنی نوع Th1 در حفاظت علیه کریپتوکوکوزیس در شرایط داخل بدن انسان است. درحالیکه پاسخهای نوع Th1 به نظر میرسد برای حفاظت علیه عفونتهای تهاجمی اساسی است، این امکان وجود دارد که پاسخهای نوع Th2 بر پاتوژنز برخی از تظاهرات آلرژیک مواجهههای قارچی یا کلونیزاسیون آنها سایه اندازد.
نقش لنفوسیتهای T نوع CD8
سلولهای Th CD4 برای پاسخ حفاظتی نوع Th1 در عفونتهای قارچی نقشی اساسی دارند اما شواهدی نیز در دست است که سلولهای T CD8 نیز دارای یک نقش مهم هستند. سلولهای T CD8 پپتیدهائی را شناسایی میکنند که با ملکولهای MHC کلاس یک کمپلکس شدهاند. چنین پپتیدهایی از طریق عمل پروتئوزومها در سیتوزول تولید میشوند و سپس به داخل شبکه اندوپلاسمیک منتقل میگردند؛ جایی که با ملکولهای کلاس یک که بهتازگی سنتز شدهاند مرتبط میشوند و سپس از طریق دستگاه گلژی به سطح سلول میرسند. سلولهای دندریتیک قادر هستند به دنبال فاگوسیتوز قارچها، آنتیژنهای اگزوژنوس را به سلولهای T CD8 عرضه کنند.
Romani و همکاران با استفاده از یک مدل القائی داخل وریدی کاندیدیازیس سیستمیک نشان دادند که سلولهای T CD4 یک نقش غالب در ایجاد پاسخ حفاظتی در مقابل یک استرین غیربیماریزای کاندیدا آلبیکنس بازی میکنند، اما هر دو سلولهای T CD8 و T CD4 در بروز مقاومت به چالش مرگآور با استرین بیماریزا درگیر میشوند.
در کریپتوکوکوزیس موشی سلولهای T CD8 در ایجاد پاسخ نوع ازدیاد حساسیت تأخیری ) (DTH و در مقاومت به عفونت ریوی درگیر میشوند. در هیستوپلاسموز موشی اگرچه سلولهای CD4 برای حفاظت در موشهای دارای ایمنی شایسته اساسی هستند و سلولهای CD4 از موشهای ایمن میتوانند حفاظت را به حیوانات غیرایمن منتقل کنند، اما سلولهای T CD8 نیز برای حفاظت مطلوب ارگانیسم مورد نیاز هستند. علاوه بر این برای هیستوپلاسموز و بلاستومایکوز ایمنی میتواند بهوسیلهی واکسیناسیون با مخمرهای هیستوپلاسما کپسولاتوم یا بلاستومایسس درماتیتیدیس در موشهای فاقد CD4 القاء شود. حفاظت محدود به MHC کلاس یک است که بهوسیلهی سلولهای T CD8 وساطت میشود و با INF-ɣ، TNF-α و GM-CSF مشتقشده از سلولهای T CD8 ارتباط دارند. نتایج بر روی زیادی و فزونی پاسخ ایمنی و نیز کاربردهای مهم برای واکسیناسیون میزبانان فاقد CD4 مانند افراد آلودهشده با HIV تأکید میکنند.
پاسخهای تنظیمی و سرکوب پاسخ ایمنی
اخیراً علاوه بر Th1 و Th2، زیرمجموعههای دیگری از سلولهای T CD4 شرح داده شدهاند که سایتوکاینهای تنظیمی را با برتری و غلبهی بیشتری ترشح میکنند. سلولهای تنظیمی نوع 1 (Tr1) سطوح بالائی از اینترلوکین 10 را ترشح میکنند سلولهای Th3 سطوح بالائی از فاکتور رشد ترانسفورم بتا (TGF-β) و سلولهای Th17 که به دلیل تولید اینترلوکین 17 به این عنوان موسوم هستند. بنابراین بهعوض یک دوگانگی یا دورستگی بین پاسخهای نوع Th1 و Th2 در برخی وضعیتها یک پاسخ Th1 مرتبط با ایمنی به عفونت بهوسیلهی پاسخ هائی که ممکن است توسط Th2 داده شود، بالانس میشود. پاسخهای ایمنی تنظیمنشده که رشد میکروبیال را محدود میکنند ممکن است به آسیب بهواسطهی ایمنی منجر شود.
مشارکت اثرات میکروبیال و ایمنی، موقعی که پاسخ ایمنی یا بسیار ضعیف و یا بسیار قوی است، هر دو به آسیب میزبان منجر میشوند. بسیاری از تظاهرات کلینیکی میکوزها بهویژه در میزبانان دارای ایمنی شایسته (immunocompetent) درنتیجهی پاسخ التهابی به آنتیژنهای قارچی است، بنابراین سایتوکاینهائی که اثرات سرکوبکنندگی دارند که شامل اینترلوکین 10 و TGF-β است، هنگامیکه در مقادیر مناسب تولید میشوند در محدود کردن آسیب به بافتهای میزبان اهمیت دارند.
علاوه بر سلولهای T CD4 (القائی) تنظیمی مختص به آنتیژن میکروبیال که شرح داده شد، کارهای تازهتری بر روی سلولهای T CD4 تنظیمی طبیعی متمرکز شده است. این سلولها در تیموس بالغ میشوند و هنگامیکه از این غده خارج میشوند به لحاظ کارکردی متعهد شدهاند و با بیان رسپتور اینترلوکین 2، CD25 و فاکتور نسخهبرداری Foxp3 مشخص میشوند.
نقش این سلولها در ایمنی نسبت به عفونت تحت بررسی و تحقیق است، اما به نظر میرسد که آنها در محل عفونت تجمع و تکثیر مییابند و آسیب بافت را محدود میسازند، اما همچنین ایمنی آنتی میکروبیال را نیز از طریق اثرات اینترلوکین 19 و TGF-β و تماسهای مستقیم سلول به سلول محدود میکنند. ممکن است حداقل بعضی از سلولهای T تنظیمی طبیعی برای آنتیژنهای خودی اختصاصی باشند. جمعیتهائی از سلولهای T CD4 CD25 که التهاب را کاهش میدهند ممکن است ایمنی آنتیمیکروبیال را نیز کاهش دهند، این سلولها در کاندیدیازیس و آسپرجیلوزیس موشی شرح داده شدهاند.
هرچند که حداقل در برخی موارد به نظر میرسد که اینها بهعوض اینکه طبیعی باشند، القائی هستند. با توجه به نقش این جمعیتهای سلولی در ایمنی نسبت به عفونتهای قارچی هنوز کارهای زیادی باقی مانده که انجام شوند. بهطور متناقضی TGF-β که در تمایز و عملکرد سلولهای T تنظیمی درگیر است، همچنین با اینترلوکین 6 و اینترلوکین 23 و ترشح سایتوکاینهای IL-17 توسط در به حرکت درآوردن سلولهای Th17 درگیر است. سایتوکاین اخیر دارای اثرات پیشالتهابی است و در به حرکت درآوردن نوتروفیلها نقش دارد.
تکامل میزبان و میکروبها به همراه هم ممکن است به تنظیم ایمنی که آسیب بافتی را محدود کرده است منجر شده باشد و حضور عفونت در سطح پائین را اجازه میدهد که این حالت برای نگاهداری حفاظت در مقابل چالش جدید ضرورت دارد. از طرف دیگر تنظیمِ زیادی که در برخی موارد بهوسیلهی محصولات میکروبی موجب میشود ممکن است وابسته به میزبان باشد، به این معنی که پاتوژنها در مقابل نابودی و حذف خود شانه خالی کنند، بهعنوان مثال گلوکورونوکسیلومانان کریپتوکوکال دارای اثرات سرکوبکنندگی متعددی در ایمنی ذاتی و تطبیقی است.
این ملکول به رسپتورهای شناسایی سطحی چندین طرحی که بر روی سلولهای ایمنی ذاتی حضور دارند باند میشود. این رسپتورها شامل TLR4 و TLR2 و رسپتور FC gamma II مهاری هستند و موجب آزادسازی اینترلوکین 10 از ماکروفاژها میشوند. این عمل اخیر ممکن است در توسعه و ایجاد پاسخ سایتوکاینی تنظیمی طرح Th2 بیش از طرح Th1 اهمیت داشته باشد.
در رابطه با کاندیدا آلبیکنس الیگوساکاریدهای دارای مانوز بهصورت غیراختصاصی پاسخهای لنفوپرولیفراتیو را نسبت به آنتیژن مهار میکنند. چنین الیگوساکاریدهائی که از تجزیهی مانان دیوارهی سلولی کاندیدا مشتق میشوند در شرایط داخل بدن میتوانند در دپرسیون سیستم ایمنی با واسطهی سلولی که در کاندیدیازیس مزمن مشاهده میشود نقش داشته باشند. مثالهای دیگر شامل محصولات قارچی تنظیمکنندهی ایمنی شامل پروستاگلاندینهایی است که توسط کریپتوکوکوس نئوفرمنس و کاندیدا آلبیکنس و نیز مایکوتوکسین گلیوتوکسین که توسط آسپرجیلوس فومیگاتوس تولید میشود.
بهکارگیری و سازماندهی لکوسیتها در محل عفونت
برای آن دسته از قارچها که پاسخ ایمنی تطبیقی با واسطهی سلولی در حفاظت مهم و اساسی هستند فاگوسیتهای تکسلولی و لنفوسیتها در استخدام سلولهای ایمنی به محل عفونت و نیز در محدود کردن عفونت از طریق تشکیل گرانولوم یک نقش کلیدی بازی میکنند. Huffnagle و همکاران دریافتند که پاکسازی استرینهای کمتر بیماریزای کریپتوکوکوس نئوفرمنس بعد از عفونت داخل تراشه در موشها با هجوم زودهنگام و زیاد ماکروفاژها به داخل ریه ارتباط داشته است.
این بهکارگیری به تولید زودهنگام سایتکاینهای پیشالتهابی نظیر TNF-α، احتمالاً توسط ماکروفاژهای آلوئلار، شیموکاینها و توسعهی ایمنی اختصاصی سلول T و بهویژه سلولهای CD4 بستگی دارد. TNF-α پرولیفراسیون سلول T و تولید سایتوکاین را افزایش میدهد و برای ایجاد یا توسعهی ایمنی با واسطهی سلول T در این مدل مورد نیاز است. تهی شدن TNF-α از القاء اینترلوکین 12 و اینترفرون گاما جلوگیری میکند، اثری که ممکن است به نقش آن در بلوغ و تجمع سلولهای دندریتیک در عقدههای لنفاوی ریه ارتباط داشته باشد. بهکارگیری لکوسیتها همچنین به تولید شیموکاینهائی نظیر MCP-1 و MIP-1α (اعضای خانوادهی c-c شیموکاینهائی که بهطور غالب برای سلولهای تکهستهای اثرات کموتاکتیک دارند) بهوسیلهی ماکروفاژها، سلولهای T و سلولهای غیرلکوسیتی و بیان ملکولهای ادهزین اندوتلیال که اتصال و دیاپدز لکوسیتها را وساطت میکنند بستگی دارد.
موشهایی که در لیگاند MIP-1α دچار نقص و کمبود هستند یک نقص اختصاصی در بهکارگیری در سیستم اعصاب مرکزی و حفاظت علیه عفونت سیستم اعصاب مرکزی دارند. سلولهای T نیز برای بهکارگیری منوسیت/ ماکروفاژ مورد نیاز هستند، بطوریکه در غیاب آن پاسخ التهابی به تأخیر میافتد و عمدتاً از نوتروفیلها تشکیل مییابد. بعد از بهکارگیری، سلولهای T CD4 برای تشکیل گرانولوم و محدود کردن کریپتوکوکوس نئوفرمنس در سلولهای غول چندهستهای نیاز است. سرانجام همانطور که گفته شد فعالسازی کمپلمان منجر به تولید کموتاکسین قدرتمند لکوسیتی یعنی C5a میگردد.
برای عفونتهای قارچی که ایمنی نوع Th1 سرآمد است حفاظت و ایمنی با سازماندهی گرانولوماتوز سلولهای ایمنی در بافتها ارتباط دارد. در مورد مشخص نمودن سازماندهی ایمیونولوژیک گرانولومها در بیماریهای قارچی مطالعات کمتری صورت گرفته است. گرانولومهای ریوی کوکسیدیوئیدال از نکروز مرکزی با تعداد برابری از لنفوسیتهای TCD4 و TCD8 تشکیل شده که در آن خوشههای مجزایی از تعداد برابری از سلولهای B و T وجود داشته است. اینترلوکین 10 بهوسیلهی سلولهای B و TCD4 و نه سلولهای TCD8 بیان شده است.
فعال شدن سلولهای اجرائی
چند مکانیسم احتمالی وجود دارند که بهوسیلهی آن سلولهای T فعالشده میتوانند حفاظت و ایمنی را میانجیگری کنند. احتمالاً مهمترین آنها از طریق ترشح سایتوکاینهائی است که فعالیت ضدقارچی سایر سلولهای اجرائی نظیر ماکروفاژها، نوتروفیلها و سلولهای NK را افزایش میدهند. علاوه بر این، سلولهای T فعالشده ممکن است خودشان فعالیت ضدقارچی داشته باشند و سلولهای CD8 میتوانند ماکروفاژهای عفونیشده را لیز کنند و به این طریق سلولهای قارچی آزاد شده و در معرض سلولهای قویتر قرار گرفته و بلعیده شوند. مهار و کشتار هم به طریقهی داخلسلولی و هم خارجسلولی هر دو اتفاق میافتد.
برای آن دسته از قارچهایی که بهوسیلهی ایمنی با واسطهی سلولی کنترل میشوند فاگوسیتهای تکهستهای ممکن است مهمترین سلول اجرائی نهائی برای پاکسازی ارگانیسم باشند. همانطور که قبلاً بحث شد ماکروفاژها از گونههای مختلف و محلهای آناتومیک مختلف در ظرفیت خود برای مهار کردن یا کشتن قارچها فرق میکنند. علاوهبراین ماکروفاژهای موشی و انسانی برای فعال شدن خود برای کشتن قارچها ممکن است به سیگنالهای مختلفی نیاز داشته باشند. اینترفرون گاما فعالیت ماکروفاژهای موشی را علیه قارچهایی نظیر کریپتوکوکوس نئوفرمنس، هیستوپلاسما کپسولاتوم، کاندیدا آلبیکنس، بلاستومایسس درماتیتیدیس و کوکسیدیوئیدس ایمیتیس بهوسیلهی مکانیسمهائی شامل تولید اسید نیتریک و یا محدودسازی دسترسی آهن افزایش میدهند.
در مقابل مطالعاتی که در سلولهای موشی انجامشده نشان داده است که فعالیت ضدقارچی ماکروفاژهای فعالشدهی انسانی از آسانی کمتری برخوردار است. هرچند که اینترفرون گاما فعالیت ماکروفاژهای مشتق شده از منوسیتهای انسانی را علیه کاندیدا آلبیکنس افزایش میدهد اما اکثر مطالعات نشان دادهاند که اینترفرون گاما فعالیت ماکروفاژها علیه کریپتوکوکوس نئوفرمنس یا هیستوپلاسما کپسولاتوم را افزایش نمیدهد. تولید غلظتهای میکربکش از اکسید نیتریک در ماکروفاژهای انسان در شرایط آزمایشگاهی مشکل است و این مسئله ممکن است کمک کند به توضیح این مطلب که چرا اثرات اینترفرون گاما که در ماکروفاژهای موشی دیده میشود همیشه در سلولهای انسانی اثرات همانندی ایجاد نمیکند.
سایر فاکتورهای فعالکننده و مکانیزمهای قارچکشی ممکن است در ماکروفاژهای انسان درگیر شوند. ماکروفاژهای مشتق شده از منوسیتهای انسانی درصورتیکه فاکتورهای تحریککنندهی کلنی (CSF) اینترلوکین 3، فاکتور تحریککنندهی کلنی گرانولوسیت ماکروفاژ (GM-CSF) یا ماکروفاژ (M-CSF) در طول پروسهی تمایز حضور داشته باشند، رشد هیستوپلاسما کپسولاتوم را محدود میکنند. GM-CSF و اینترلوکین 3 فعالیت منوسیتهای انسان و ماکروفاژهای مشتق شده از منوسیت علیه کاندیدا آلبیکنس را افزایش میدهند. در مقابل، برخی سایتوکاینها (اینترفرون گاما، فاکتور نکروز دهندهی توموری آلفا، INF ɣ + TNF α، GM-CSF) فعالیت ضد کریپتوکوکال را در ماکروفاژهای مشتق از منوسیتهای انسانی افزایش نمیدهند.
ماکروفاژهای فعالشده سلولهای اجرائی مهمی هستند اما سایتوکاینهائی که در جریان یک پاسخ اختصاصی باواسطهی سلولی تولید میشوند ممکن است فعالیت ضدقارچی سلولهای NK، سلولهای CD8 سایتوتوکسیک و سلولهای T CD4 و نوتروفیلها را افزایش دهند. بهعنوانمثال اگرچه سلولهای NK اصولاً فعالیت ضد کریپتوکوکال دارند، اینترلوکین 12 فعالیت سلولهای NK خالصشده از دهندگان HIV-infected علیه کریپتوکوکوس نئوفرمنس را افزایش میدهد. اینترلوکین 2 فعالیت سلولهای CD8 موشی را علیه کاندیدا آلبیکنس افزایش میدهد و اینترلوکین 2 و اینترلوکین 15 فعالیت ضد کریپتوکوکی سلولهای T CD4 و T CD8 را به ترتیب افزایش میدهند.
TNF-α، INF-ɣ، اینترلوکین 8، G-CSF، GM-CSF و اینترلوکین 2 همگی فعالیت نوتروفیلها علیه بلاستوکونیدی کاندیدا آلبیکنس را افزایش میدهند. G-CSF و INF-ɣ اما نه TNF α قدرت کشندگی نوتروفیلها علیه هایفی کاندیدا آلبیکنس را افزایش میدهند.
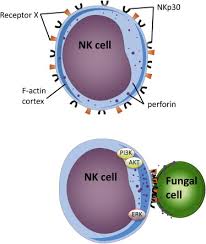
سلولهای NK و سلولهای T سایتوتوکسیک
سلولهای NK یک زیرمجموعه از لنفوسیتهای بزرگ با گرانولهای متعدد سیتوپلاسمیک است که توانائی لیز انتخابی سلولهای توموری خاص و سلولهای عفونی شده با ویروس را دارند. این سلولها دارای رسپتورهائی هستند که میتوانند مولکولهای MHC کلاس I را در ارتباط با پپتیدهای خودی شناسایی کنند. این نحوهی شناسایی مکانیسمهای سیتولیتیک را خاموش میکنند و بنابراین از سلولهای نرمال میزبان محافظت میکنند. سلولهای NK همچنین رسپتورهای fcɣ III (CD16) را دارا هستند و میتوانند سلولهای هدف را که با IgG پوشیده شدهاند لیز کنند. (سیتوتوکسیسیتی با واسطه سلولی، وابسته به آنتیبادی)، تعادل بین سیگنالهای مهارکنندگی و تحریککنندگی از طریق یک طیف از جفتهای رسپتور- لیگاند سلولهای NK فعالسازی سلول NK را تعیین میکنند. کشتن سلولهای هدف ممکن است شامل اگزوسیتوز گرانول با آزاد کردن پرفورین (که هومولوگ C9 است و سوراخهائی را در غشاء سلولهای هدف تشکیل میدهد)، سرین استرازها (همچنین granzymes نامیده میشوند) و سایر آنزیمها باشد.
به علت درگیر شدن لیگاند Fas بر روی سلولهای اجرائی که مسیر با واسطهی Fas در سلولهای هدف را برمیانگیزانند میتواند منجر به آپوپتوزیس (مرگ برنامهریزیشدهی سلول) شود. فعالیت سیتولیتیکی سلولهای NK بهوسیلهی اینترفرون گاما، اینترلوکین 12 و اینترلوکین 2 افزایش مییابد. سلولهای NK در غلظتهای بالای اینترلوکین 2 مقداری از ویژگیهای هدفیابی خود را از دست میدهند و بنام سلولهای کشندهی فعالشده توسط لنفوکاین موسوم هستند (Lymphokine – activated killer cells). سلولهای NK فعالشده همچنین سایتوکاینهایی بهویژه اینترفرون گاما را ترشح میکنند. این سایتوکاین میتواند قبل از ایجاد یک پاسخ اختصاصی با واسطهی سلول T ماکروفاژها را فعال کند.
سلول NK در گسترش خون محیطی
علاوه بر این واکنشهای بین سلولهای NK و سلولهای دندریتیک در بافتها و عقدههای لنفاوی ممکن است یک نقش مهم در شکل دادن به پاسخ ایمنی تطبیقی داشته باشند. با توجه به دفاع میزبان علیه قارچها، سلولهای NK در شرایط آزمایشگاهی به سلولهای کریپتوکوکوس نئوفرمنس، پاراکوکسیدیوئیدس برازیلینسیس و کوکسیدیوئیدس ایمیتیس متصل شده و رشد آنها را مهار میکنند. Murphy و همکارانش کشته شدن سلولهای کریپتوکوکوس نئوفرمنس توسط سلولهای NK موشی را نشان دادند و همچنین مهار رشد کریپتوکوکوس نئوفرمنس بهوسیلهی فراکسیونهای گرانولی سیتوپلاسمیک و پرفورین خالصشده از فراکسیونهای گرانولی از سلولهای NK توموری رت را ثابت کردند. اگزوسیتوز گرانولی در مهار رشد با واسطهی سلول NK در کریپتوکوکوس نئوفرمنس با تصاویر کنژوکههای سلول NK و کریپتوکوکوس نئوفرمنس نشان داده شده است که در آن به نظر میرسد که گرانولها در فرآیند تخلیه بر روی سطح سلول قارچی هستند.
Mody و همکارانش اخیراً ثابت کردند که فعالیت ضد کریپتوکوکال سلولهای NK انسانی بهوسیلهی پرفورین میانجی میگردد. علاوه بر فعالیت مستقیم ضد قارچی آنها، سلولهای NK میتوانند در دفاع میزبان از طریق تولید سایتوکاینها نقش داشته باشند. اگرچه مهار رشد کاندیدا آلبیکنس توسط سلولهای NK انسانی نشان داده نشده است اما سلولهای NK انسانی به کاندیدا آلبیکنس متصل شده و موجب آزادسازی سایتوکاینهائی شامل GM-CSF، TNFα و INFɣ میگردند که میتوانند نوتروفیلها و منونوکلئرهای فاگوسیت کننده را فعال کنند و به پاسخ نوع Th1 کمک نمایند.
اگرچه در مطالعاتی که در بدن موجود زنده انجام شده نقش محدودی برای سلولهای NK در دفاع علیه قارچها مطرح شده است. در مورد کریپتوکوکوس نئوفرمنس ممکن است سلولهای NK در پاکسازی اولیهی ارگانیسم از ریهها سهیم باشند اما هنگامیکه موشها از نظر سلولهای NK تخلیه شدند و سپس به طریق داخل رگی آنها را با سلولهای مخمری کریپتوکوکوس نئوفرمنس مواجه میکردند تعداد مخمرها در فاصلهی زمانی کوتاهی در ریهها افزایش مییافت درحالیکه در موشهای گروه کنترل چنین اتفاقی واقع نمیشد، هرچند که بعداً هیچگونه تفاوتی در میزان عفونت در بین این 2 گروه در ارگآنهای دیگر و یا به دنبال چالش داخل تراشهای دیده نمیشد. در آزمایشات مشابهی در موشهائی که با هیستوپلاسما کپسولاتوم و کاندیدا آلبیکنس آلوده شدند نقش قابلتوجهی برای فعالیت سلولهای NK در دفاع میزبان علیه این قارچها ثابت نشد.
همچنین نشان داده شده است که لنفوسیتهای T در شرایط آزمایشگاهی (in vitro) مستقیماً به سلولهای کاندیدا آلبیکنس و سلولهای کریپتوکوکوس نئوفرمنس متصل شده و موجب مهار رشد آنها میشوند. هم سلولهای T CD4 و هم سلولهای T CD8 انسانی علیه کریپتوکوکوس نئوفرمنس فعالیت دارند و بهوسیلهی کشت در مجاورت اینترلوکین 2 یا فیتوهماگلوتینین این فعالیت افزایش مییابد. مشاهده شده است که لنفوسیتها با سلولهای کریپتوکوکسی با اتصال نواحی وسیعی از تماس بین غشاء لنفوسیت و کپسول قارچ، کنژوکههای قابل بازگشتی تشکیل میدهند. رسپتور(ها) و لیگاند(ها)ئی که مسئول این اتصال هستند هنوز نامشخص باقی ماندهاند، هرچند که اپسونیزاسیون قارچ موردنیاز نیست. فعالیت سلول T CD8 بستگی به گرانولایزین (granulysin) دارد که یک lipid-binding protein است که در گرانولهای لنفوسیتهای سایتوتوکسیک حضور دارد و فعالیت مستقیم علیه کریپتوکوکوس نئوفرمنس دارد.
فعالیت سلول T CD8 به کمک سلولهای T CD4 از طریق فعال کردن سلولهای تکهستهای همدست و کمکی (accessory) و برای تولید اینترلوکین 15 نیاز دارد. سلولهای T CD4 همچنین از گرانولایزین برای مهار کریپتوکوکوس نئوفرمنس استفاده میکند. بیان گرانولایزین در سلولهای T CD4 به 5 الی 7 روز تحریک توسط اینترلوکین 2 نیاز دارد و در سلولهای T CD4 بیماران آلوده به HIV حتی در مراحل اولیهی بیماری دارای نقص است (با شمارش سلولهای T CD4 بیش از 400 در میکرولیتر). بهصورت مشابهی لنفوسیتهای T CD8 موشی تحریکشده با اینترلوکین 2 به سلولهای هایفی کاندیدا آلبیکنس متصل شده و رشد آنها را محدود میکنند. چسبیدن این سلولها به هایفی بستگی به شراکت رسپتورهای CR3 لنفوسیتی (CD11b/CD18) دارد.
اهمیت این فعالیت مستقیم ضد قارچی سلولهای T غیراختصاصی در شرایط داخل بدنی باید تعیین شوند. همچنین این امکان وجود دارد که سلولهای T CD8 غیراختصاصی، شبیه سلولهای NK، نقشی در ایمنی ذاتی از طریق ترشح اینترفرون گاما داشته باشند، همانطور که در عفونتهای باکتریال داخل سلولی دارند.
اثرات HIV بر روی پاسخ ایمنی به قارچها
عفونت با HIV یک فاکتور خطر اصلی است که افراد را نسبت به کسب عفونتهای مهلک قارچی مستعد میکند. شیوع میکوزهای مربوط به کریپتوکوکوس نئوفرمنس، کاندیدا آلبیکنس و پنموسیستیس جیرووسی در افراد آلوده به HIV بهویژه هنگامیکه بیماری به سمت ایدز پیشرفت میکند به مقدار زیادی افزایش یافته است. همچنین آسپرجیلوزیس با وقوع فزایندهای در افرادی که در مرحلهی آخر بیماری ایدز قرار دارند دیده میشود. بیمارانی که با HIV عفونی میشوند بسیاری از ناهنجاریهای ایمنولوژیک را دارند اما مکانیسمهای اختصاصی که موجب افزایش حساسیت به میکوزهای فرصتطلب میشود در افرادی که در مرحلهی آخر بیماری HIV قرار دارند هنوز بهطور کامل درک نشدهاند.
با اطمینان میتوان گفت که کاهش سلولهای +T CD4 یک نشان مهم (hallmark) و اصلی ایمنولوژیک برای ایدز است، درواقع برای تمامی میکوزهای گفتهشده یک ارتباط معکوس قوی بین شمارش سلولهای +T CD4 و خطر عفونت وجود دارد.
علاوه براین، نقش مهم سلولهای +T CD4 در دفاعهای میزبان بهوسیلهی یافتههای تکراری عفونتهای قارچی منتشره در بیماران مبتلا به لنفوسیتوپنی ایدیوپاتیک CD4 که بهوسیلهی شمارش پائین سلولهای +T CD4 مشخص میشود، در غیاب عفونت HIV پشتیبانی شده است. همچنین عفونت HIV اثراتی بر روی سیستم ایمنی دارد که وابسته به کاهش سلولهای +T CD4 نیست. HIV بهصورت مستقیم منوسیتها و ماکروفاژها و فاگوسیتهای تکهستهای را عفونی میکند و ثابت شده که موجب تغییراتی در بیان مارکر فنوتیپیک، کموتاکسی و تولید سایتوکاین و فعالیت انفجار تنفسی در این سلولها میگردد.
بهصورت جالب توجهی اختلال عمل فاگوسیتهای تکهستهای میتواند در عفونت HIV نسبتاً زود و قبل از آنکه کاهش سلولهای +T CD4 پدید آمده باشد، نشان داده شود. این بدعملکردی ممکن است نتیجهی اثرات مستقیم عفونت HIV باشد؛ یعنی از محصولات محلولی که توسط این ویروس آزاد میشوند بهویژه لفاف گلیکوپروتئین gp120 و یا اینکه ممکن است بهصورت غیرمستقیم از تغییرات مربوط به سایتوکاینها حاصل شود.
هنگامیکه پیامدهای عملکردی عفونت منوسیتهای سالم با ویروس HIV مورد آزمایش قرار گرفت (بهصورت in vitro) نتایج مناقشهآمیزی مشاهده گردید: Cameron و همکارانش منوسیتهای خون انسان، ماکروفاژهای صفاقی و ماکروفاژهای برونکوآلوئلار را با استرین منوسیتوتروپیک HIV تلقیح کردند. منوسیتها و ماکروفاژهای صفاقی یک کاهش گذرا در فعالیت ضدکریپتوکوکال داشتند که با یک دورهی رپلیکاسیون حداکثری ویروس مرتبط بود، اما در مقابل هیچگونه اثراتی در ماکروفاژهای برونکوآلوئلار دیده نشد. افزودن gp120 به ماکروفاژهای برونکوآلوئلار نرمال انسان به مهار فعالیت ضدکریپتوکوکال منجر شد. اگرچه gp120 اثری روی باند شدن کریپتوکوکال نداشت اما باعث مهار درونی بعدی مخمرهای باندشده گردید.
لاواژ برونکوآلوئلار حاوی میسلیومهای دارای دیواره عرضی که مطرحکنندهی آسپرجیلوس است به همراه ماکروفاژهای کفآلود مشاهده میشود
نشان داده شده که لکوسیتهای خون محیطی که از افراد عفونی شده با HIV بدست آمده است، در پاسخ ایمنی با واسطهی سلولی نسبت به پاتوژنهای قارچی ضعف و اختلال دارند.
ماکروفاژهای خون محیطی از دهندگان آلوده به HIV عمیقاً پاسخهای تکثیرشوندگی ضعیفی نسبت به آنتیژنهای قارچی دارند. الگوی تولید سایتوکاین نیز تغییر کرده است، بهعنوان مثال در پاسخ به آنتیژنهای کریپتوکوکوس نئوفرمنس، کاندیدا آلبیکنس و کوکسیدیوئیدس ایمیتیس، بیان و آزادسازی اینترفرون گاما بهوسیلهی ماکروفاژهای خون محیطی افراد دهندهی آلوده به HIV بهصورت قابلتوجهی کاهش یافته است. همچنین یک کاهش در تولید اینترلوکین 12 وجود دارد که میتواند قبل از تحریک بهوسیلهی اینترفرون گاما بازگردانده شود.
در منوسیتهای بدست آمده از افراد دهندهی آلوده به HIV، فعالیت ضدکریپتوکوکی، انفجار تنفسی و دگرانولاسیون لکوسیتی در مقایسه با منوسیتهای کنترل کاهش یافته است، همچنین در منوسیتهای کشتشده از افراد آلوده به HIV، نقایص و کمبودهایی در باند شدن و مهار رشد هیستوپلاسما کپسولاتم دیده میشود. بهطور مشابهی نوتروفیلهای بیماران مبتلا به ایدز فعالیت قارچکشی ضعیفی علیه کاندیدا آلبیکنس و کریپتوکوکوس نئوفرمنس در مقایسه با افراد کنترل دارند و سلولهای NK و T CD4 افراد دهندهی آلوده به HIV فعالیت ضدکریپتوکوکال معیوبی دارند. استفاده از G-CSF رکامبینانت انسانی در شرایط داخل بدنی موجب افزایش فعالیت ضدقارچی نوتروفیلها در شرایط in vitro شده و انفجار تنفسی بیشتر و قویتری رخ میدهد. در شرایط آزمایشگاهی اینترلوکین 12 فعالیت ضدکریپتوکوکال سلولهای NK از دهندههای آلوده به HIV را بازمیگرداند.
علاوه براین اثرات HIV بر روی پاسخ ایمنی نسبت به قارچها، تحریک T cellهای آلوده به HIVو فاگوسیتهای تکهستهای در شرایط آزمایشگاهی با قارچها یا محصولات قارچی رپلیکاسیون HIV را القاء میکند.
این یافته ممکن است اشاره به مسائل کلینیکی داشته باشد زیرا القاء میتواند لود ویروسی را افزایش دهد و دورهی بیماری را شتاب داده و به دفاع میزبان در مقابل پاتوژن قارچی بهصورت سیستماتیک و لوکال در محل عفونت آسیبهای بیشتری وارد شود.
Lortholary و همکارانش دریافتند که سایتوکاینهای پیشالتهابی از قبیل اینترلوکین 6 و اینترلوکین 8 و فاکتور نکروزدهندهی توموری آلفا، همانند اینترلوکین 10 همگی در مایع مغزی نخاعی افراد مبتلا به مننژیت کریپتوکوکی آلوده به HIV در مقایسه با بیماران غیرآلوده به HIV مبتلا به مننژیت کریپتوکوکی پایینتر بودند. در یک مطالعهی جداگانه ذر بیماران کریپتوکوکال آلوده به HIV، سهگانهی اینترلوکین 6، فاکتور نکروزدهندهی توموری آلفا و اینترفرون گاما در مایع مغزی نخاعی به مقدار زیادی با همدیگر همبستگی دارند. سطوح بالاتر با بقاء بیشتر مرتبط بوده است و اینترفرون گاما بهعنوان یک فاکتور مستقل پیشگوئیکنندهی میزان پاکسازی از عفونت نشان داده شد.
بعلاوه، مشخص شده است که برگشت یا اعادهی ایمنی به دنبال درمان ضد رتروویروسی معمولاً به وخیم شدن بیماری کلینیکی در بیماران درگیر عفونتهای قارچی و عفونتهای فرصتطلب دیگر میانجامد. در صورتی که نمونههای پاتولوژی در دسترس باشند افزایش التهاب گرانولوماتوز را در مقایسه با بیماران قبل از درمان ضدرتروویروسی نشان میدهند. در بیماران با سندرم التهابی، بازسازی ایمـــــــــــــنی کریپتوکوکال (immune reconstitution inflammatory syndrome)، شمارش لکوسیتی در مایع مغزی نخاعی اغلب بالاتر از بیمارانی است که مننژیت کریپتوکوکال قبل از درمان ضدرتروویروسی داشتهاند.
https://medlabnews.ir/%d9%82%d8%a7%d8%b1%da%86%e2%80%8c%d9%87%d8%a7-2/
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام