روشهای آزمایشگاهی و استانداردهای بینالمللی در تشخیص اختلالات انعقادی
(بخش چهارم)
دستورالعمل راهبردی برای تشخیص کمبود فاکتور سیزده در ایران
اکبر درگلاله، دانشجوی دکترای تخصصی هماتولوژی و بانک خون، گروه هماتولوژی و بانک خون دانشکده پیراپزشکی، دانشگاه علوم پزشکی ایران
کمبود فاکتور سیزده نوعی بیماری خونریزی دهنده نادر است که شیوع آن یک نفر به ازای هر دو میلیون نفر در جمعیت عمومی میباشد. به دلیل آمار بالای ازدواجهای فامیلی، شیوع 12 برابری بیماری در ایران گزارش شده است (1). این اختلال نادر با میزان بالایی از رخدادهای تهدیدکننده حیات شامل سقط مکرر، خونریزی از بند ناف و خونریزی از سیستم اعصاب مرکزی (System Central Nervous,CNS) همراه است. خونریزی CNS، نوعی خونریزی شایع در بین بیماران با کمبود فاکتور سیزده بوده که در 32% بیماران ایرانی دارای کمبود شدید فاکتور سیزده قابل مشاهده است (3،2) که باعث درصد بالایی از مرگومیر در بین بیماران ایرانی شده است. تشخیص دیرهنگام یا عدم تشخیص کمبود فاکتور سیزده میتواند باعث بیش از 40% مرگ در بین این بیماران گردد (4).
درصد بالای رخدادهای خونریزی دهنده در میان بیماران با کمبود فاکتور سیزده، بر ضروری بودن تشخیص به موقع بیماری تأکید میکند. تشخیص زودهنگام این کمبود همراه با درمان مناسب و منظم با رسوب کرایو، پلاسمای تازه منجمد شده (FFP)، کنسانتره فاکتور سیزده یا نوترکیب میتواند به طور قابلملاحظهای رخدادهای خونریزی دهنده را در این بیماران کاهش داده یا حذف کند (3،2،1). علاوه بر این، علائم بالینی، رویکرد آزمایشگاهی مناسب مطابق با امکانات در دسترس، تجهیزات و آزمایشات آزمایشگاهی میتواند اجازه تشخیص به موقع را فراهم سازد.
از آن جایی که فاکتور سیزده در شکلگیری لخته ناپایدار اولیه نقشی ندارد، تمام آزمایشات معمول انعقادی شامل زمان خونروی (Bleeding Time, BT)، زمان پروترومبین (Prothrombin Time, PT) و زمان ترومبوپلاستین نسبی فعال شده (Activated Partial Thrombin Time, APTT) در کمبود فاکتور سیزده طبیعی است و این موضوع تشخیص بیماری را دشوار می سازد (1،4). بر اساس تمام آزمایشات بالا در صورت وجود کمبود فاکتور سیزده چون شکلگیری لخته اولیه طبیعی است آزمایش فاکتور سیزده با برقراری پیوندهای کووالان، لخته ناپایدار اولیه حاصل از آبشار انعقادی را تبدیل به لخته پایدار میکند که به راحتی توسط سیستم فیبرینولیتیک تخریب نمیشود (4،5)، بنابراین یک آزمایش مناسب برای ارزیابی پایداری لخته میتواند برای غربالگری کمبود فاکتور سیزده مورد استفاده قرار گیرد. از سال1960 آزمایش حلالیت لخته به عنوان یک آزمایش غربالگری برای شناسایی کمبود فاکتور سیزده مورد استفاده قرار گرفت. به طور خلاصه در این آزمایش، نمونه سانتریفوژ شده خون حاوی ضدانعقاد به وسیله کلرید کلسیم لخته شده و در اوره 5 مولار یا مونوکلرواستیک اسید حل میشود و در دمای اتاق یا 37 درجه سانتیگراد انکوبه میگردد. سپس در طی فواصل منظم حل شدن لخته مورد بررسی قرار میگیرد (9،8،7،6).
از آنجا که آزمایش حلالیت لخته دارای حساسیت کافی نیست، برای غربالگری کمبود فاکتور سیزده توصیه نمیشود، در نتیجه ارزیابیهای کمی برای شناسایی دقیق این بیماری توصیه میگردد. اما به علت عدم دسترسی به روشهای غربالگری کمی، آزمایش حلالیت لخته هنوز در بسیاری از آزمایشگاهها استفاده میشود.
جهت اندازهگیریهای کمی کمبود فاکتور سیزده، الگوریتم زیر توسط کمیته بینالمللی ترومبوز و هموستاز (International Society on Thrombosis and Haemostasis, ISTH) پیشنهاد شده است که شامل موارد زیر است (9):
1) اولین مرحله، اندازهگیری سطح فعالیت فاکتور سیزده: با این اندازهگیری کمی میتوان تمام اشکال کمبود فاکتور سیزده مانند نوع کمبود خفیف، متوسط و شدید را شناسایی کرد.
2) مرحله دوم، اندازهگیری سطح آنتیژنی فاکتور سیزده: سطح هتروتترامر A2B2 اندازهگیری میشود. در صورت کاهش سطح آنتیژنیA2B2 بیمار، سطح آنتیژنهای A2 و B2 در سرم و نیز سطح فعالیت و آنتیژنی A2 در پلاکت باید بررسی شود.
3) مرحله سوم، شناسایی اتوآنتیبادی علیه فاکتور سیزده.
4) مرحله چهارم، در صورت طبیعی بودن نتایج همه آزمایشات قبلی گفته شده، آزمایش بررسی اتصال متقاطع فیبرین توسط سدیم دودسیل سولفات پلیآکریلامید (SDS-PAGE) صورت میگیرد.
5) مرحله پنجم، شناسایی ملکولی نقص کمبود فاکتور سیزده.
اگرچه این الگوریتم در حال حاضر یک روش قابل اعتماد برای تشخیص کمبود فاکتور سیزده میباشد، اما تقریباً در تمام آزمایشگاههای بالینی ایران و تعداد قابلتوجهی از آزمایشگاههای کشورهای توسعه یافته جهان (حدود 20%)، اولین آزمایش غربالگری برای شناسایی کمبود فاکتور سیزده آزمایش حلالیت لخته میباشد (10). در حالی که در این الگوریتم آزمایش حلالیت فاقد هرگونه ارزش تشخیصی میباشد، بنابراین تا زمان راهاندازی تمامی روشها و آزمایشات موردنیاز برای تشخیص دقیق کمبود فاکتور سیزده در ایران مطابق با الگوریتم ISTH، یک الگوریتم منطقهای بر اساس آزمایشات و امکانات موجود در ایران برای تشخیص این کمبود ضروری به نظر میرسد.
در ایران متأسفانه با توجه به شیوع تقریباً 12 برابری این بیماری نسبت به سایر کشورها، به دلیل هزینه بالا و عدم سرمایهگذاری در این زمینه، بسیاری از ارزیابیهای آزمایشگاهی مانند اندازهگیری فعالیت و سطح آنتیژنیک فاکتور سیزده به صورت بسیار محدود و تنها به عنوان بخشی از طرحهای تحقیقاتی صورت گرفته و بنابراین در اکثر نقاط کشور تشخیص کمبود فاکتور سیزده بر پایه علائم بالینی، سوابق خانوادگی و آزمایش حلالیت لخته صورت میپذیرد (1). تقریباً در تمام آزمایشگاههای انعقادی ایران اولین آزمایش غربالگری، آزمایش حلالیت لخته میباشد و این در حالی است که در کشورهای توسعه یافته استفاده از این روش بسیار محدود شده است و استفاده از این روش برای تشخیص فاکتور سیزده توسط کارشناسان توصیه نمیگردد (1،9).
برای یک بیمار مشکوک به کمبود فاکتور سیزده بطور سنتی در ایران، ابتدا آزمایشات معمول آزمایشگاهی شامل PT، PTT، BT و شمارش پلاکتی انجام شده و پس از مشاهده نتایج طبیعی، آزمایش حلالیت لخته صورت میگیرد. از آنجایی که این آزمایش تحتتأثیر عوامل مختلفی از جمله سطح فیبرینوژن- عاملی که جهت لخته کردن خون استفاده میشود- و نیز معرفهایی که لخته در آن حل میگردد قرار میگیرد، این آزمایش دارای حساسیت و اختصاصیت پایینی بوده و نمیتوان به عنوان آزمایش تأییدی برای تشخیص این بیماری از آن استفاده کرد (8،9)، بنابراین نتایج غیرطبیعی در آزمایش حلالیت لخته میبایست توسط یک آزمایش مناسب مانند ارزیابی سطح فعالیت فاکتور سیزده تأیید شود اما این آزمایش در ایران به طور محدود استفاده میشود. از طرف دیگر، تشخیصهای ملکولی کمبود فاکتور سیزده نیز به طور گسترده در بیماران ایرانی استفاده نمیشود اما تعدادی از مراکز هموفیلی و تحقیقاتی نقص ژنتیکی عامل کمبود فاکتور سیزده را در بسیاری از بیماران ایرانی مشخص میکنند و بنابراین آزمایش ملکولی میتواند به عنوان آزمایش تأییدی برای تشخیص بیماران با کمبود شدید فاکتور سیزده و شناسایی حاملین در مرحله پیش از تولد، مورد استفاده قرار گیرد (14،13،11،12). در مراکز هموفیلی با راهاندازی تشخیص ملکولی به روش RFLP، تشخیص زودهنگام و قابلاعتماد کمبود فاکتور سیزده قابل ارائه میباشد.
یکی دیگر از راههای ممکن در انجام آزمایشات تشخیصی، استانداردسازی و بالا بردن کیفیت آزمایشات غربالگری فاکتور سیزده است. بکارگیری اندکی تغییرات در روش انجام آزمایش، میتواند به بهبود در انجام آزمایش تشکیل لخته کمک کند. برای این منظور، خون بیمار را با ماده ضدانعقاد سیترات 3/2% به نسبت 9 به 1 جمعآوری کرده و برای به دست آوردن پلاسمای عاری از پلاکت سانتریفیوژ میکنند. پس از آمادهسازی، معرف ایجادکننده لخته به پلاسما اضافه میگردد و سپس لخته ایجاد شده در محیط اوره، مونوکلرواستیک اسید یا استیک اسید قرار گرفته و حل شدن لخته در فواصل منظم ارزیابی میگردد. معرف ایجادکننده لخته یک فاکتور مهم در میزان حساسیت آزمایش حلالیت میباشد. معرفهای مختلفی مثل ترومبین یا مخلوط کلسیم و ترومبین به عنوان معرف لختهکننده مورد استفاده قرار میگیرند. از طرف دیگر رایجترین معرف حلال، اوره یا مونوکلرواستیک اسید میباشد. چندین مطالعه در رابطه با اختصاصیت و حساسیت معرفهای مختلف لختهکننده یا معرفهای حلال انجام شده است. در ایران رایجترین روش برای آزمایش حلالیت لخته، مخلوط کلسیم کلرید به عنوان معرف لختهکننده و مونوکلرواستیک اسید به عنوان معرف حلال میباشد. این روش نسبت به سایر روشها دارای حساسیت پایینی است و فقط در کمبود شدید فاکتور سیزده، غیرطبیعی میگردد (8). روش دیگری که در آن از ترومبین به عنوان معرف لختهکننده و از استیک اسید به عنوان معرف حلال استفاده میشود دارای حساسیت بیشتری برای شناسایی کمبود خفیف یا متوسط فاکتور سیزده، یا شناسایی بیماران تحت درمان پروفیلاکسی یا کمبود اکتسابی فاکتور سیزده میباشد. گفته شده که روش کلسیم/ اوره حساس به 5-1 U/ml از فاکتور سیزده میباشد، در حالی که روش ترومبین/ استیک اسید به حداقل 10U/mlحساس است. کلسیم/ استیک و ترومبین/ اوره به عنوان روشهایی با حساسیت متوسط گزارش شدهاند. هر چند، ارزیابی بر پایه استیک اسید نسبت به حلالیت در اوره سریعتر و حساستر میباشد اما اختصاصیت کمتری دارد (8).
اندازهگیری فعالیت فاکتور سیزده
اندازهگیری فعالیت فاکتور سیزده یک آزمایش اختصاصی تأییدی محسوب میشود. در ایران این آزمایش به ندرت برای تشخیص استفاده میشود و استفاده از آن محدود به چند طرح تحقیقاتی بوده است. چندین روش شامل فوتومتریک، پوترسینوفلوئورمتریک برای اندازهگیری فعالیت فاکتور سیزده معرفی شده است (17، 16، 15).
یک روش رایج برای ارزیابی فوتومتریک فاکتور سیزده بر این اساس استوار است که فاکتور سیزده فعال شده، ایجاد یک واکنش متقاطع بین قسمت آمینی گلوتامین در پایانه مهارکننده آلفا 2 پلاسمین ایجاد میکند. طی این رخداد آمین آزاد شده و برای شکلگیری گلوتامین در واکنش مورد استفاده قرار میگیرد و NADPH را به NADP تبدیل میکند. کاهش مقدار NADPH باعث کاهش جذب نوری در 340nm میشود و شدت کاهش جذب نوری بیانگر فعالیت فاکتور سیزده است. در میان روشهای اندازهگیری فعالیت این فاکتور روش پوترسینوفلوئورمتریک دارای حساســــــــــیت بیشتری است اما روش زمانبری است (17، 15، 2).
رایجترین نقص مولکولی در زیرواحد A فاکتور سیزده جهش بدمعنی (بیش از50%) میباشد. جهش بیمعنی و حذف/ اضافه از دیگر نقصهای معمول ژن زیر واحد A فاکتور سیزده در بیماران مبتلا به این کمبود هستند. چندین بیماری شایع که باعث نقص ژنتیکی در میان جوامع مختلف میشوند، مشاهده شده است. در بین بیماران اروپایی شایعترین جهش IVS5-1G>A میباشد و در میان بیماران اروپایی با ملیتهای مختلف از جمله؛ هلندی، لهستانی، انگلستانی و غیره نیز مشاهده شده است. جهش Arg661stop در اگزون 14 ژن زیرواحد A فاکتور سیزده نقص شایع دیگری در میان بیماران اروپایی بوده و در فنلاند، سوئیس، لهستان، سوئد و نیز در هند گزارش شده است. همچنین جهش Arg326Gln در ژن زیرواحد A در بیماران آلمانی و هلندی مشاهده شده است، بنابراین در بیماران مبتلا در اروپا، این سه جهش میتوانند به عنوان نخستین گام در تشخیص مولکولی کمبود فاکتور سیزده انتخاب شوند. در میان بیماران هندی، جهش در اگزون شماره 6 و 10 معمولاً مشاهده شده است. به نظر میرسد که پلیمورفیسم IVS1 A246G شایعترین پلیمورفیسم فاکتور سیزده در بیماران هندی بوده و یک نشانگر تشخیصی مناسب برای کمبود فاکتور سیزده در این کشور است. روش (PCR-RFLP) و یا PCR اگزون ویژه برای پیگیری کمبود فاکتور سیزده در این چند کشور میتواند به عنوان اولین مارکر نشانگر تشخیصی ژنتیکی استفاده شود، اما در دیگر نقاط جهان جهش تکرارشونده عامل بیماری مشاهده نشده و بیش از 120 جهش مختلف پراکنده در سراسر ژن فاکتور سیزده وجود دارد که تعیین توالی کامل آن اجتناب ناپذیر است.
در ایران تشخیص ملکولی کمبود فاکتور سیزده به طور محدود انجام میشود. بسیاری از مطالعات ملکولی در جنوب شرقی ایران انجام شده است که کمبود فاکتور سیزده از شیوع بالایی در این منطقه برخوردار است، در تعدادی از مطالعات این منطقه مشخص شده که جهش در موقعیت 187 و جایگزینی تریپتوفان به جای آرژنین (Trp187Arg) باعث این کمبود در بیماران جنوب شرق ایران و نیز به عنوان شایعترین جهش در کشور معرفی شده است. در یک مطالعه دیگر، جهش در موقعیت 77 و جایگزینی هیستیدین به جای آرژنین (Arg77His) به عنوان جهش رایج در بیماران ایرانی گزارش شده است. علاوه بر این در بین بیماران ایرانی با کمبود فاکتور سیزده، چندین جهش دیگر هم یافت شد اما این جهشها تکرارشونده نبوده و به عنوان جهشهای غیرشایع در جمعیت ایرانی شناخته میشوند (20،19،18،1).
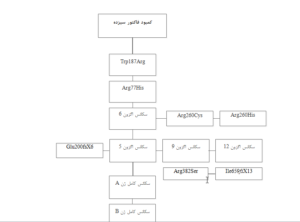
با در نظر داشتن مطالعات صورت گرفته، بهتر است در بیماران مشکوک به کمبود فاکتور سیزده در ایران، در ابتدا جهش Trp187Arg به عنوان اولین موتاسیون و سپس جهش Arg77His در اگزون 3 به عنوان جهش دوم برای تأیید این بیماری مورد استفاده قرار گیرد، سپس تعیین سکانس اگزون 6 برای فاکتور سیزده تیپ A باید انجام گیرد زیرا دو موتاسیون Arg260Cys و Arg2560His در اگزون 6 در بیماران ایرانی مشاهده شده است (جدول1). به علت بزرگ بودن زیرواحدA ژن فاکتور سیزده (دارای 15 اگزون)، سکانس کردن کامل این ژن دشوار و هزینهبر بوده، از اینرو، اگزونهای شماره 5، 9 و 14 سکانس میشود زیرا بررسی موارد موتاسیون جمعیت ایرانی توسط این اگزونها سابقاً صورت گرفته است (22،21،1). سکانس کردن کامل این ژن دشوار و هزینهبر بوده در صورت عدم دستیابی به موتاسیون در تمامی این اگزونها، باید سکانس کردن کامل ژن زیرواحد A مدنظر قرار گیرد (شکل1).
جدول 1: پرایمرها و شرایط شناسایی تمام جهشهای شناخته شده برای کمبود فاکتور سیزده در بیماران ایرانی
|
موتاسیون |
اگزون | تکنیک مناسب | پرایمر | دمای اتصال (Annealing) |
آنزیم برشدهنده |
|
Trp187Arg |
4 | PCR-RFLP | F: 5′-TTGCAGACTTGCCTGATTTG-3′
R: 5′-CAAGCGATCCTCCCATCTTG-3′ |
58 |
Eco130I |
|
Arg77His |
3 | PCR-RFLP | F: 5′-TGCTACCTGCCTTCTTCAGG-3′
R: 5′-CCTGCCACTGTTGACATATG-3′ |
56 |
Aci I |
|
Arg260Cys & Arg260His |
6 | PCR-Sequencing | F: 5′-GCTTGCAGAGTGAACACTAGTTT-3′
R: 5′-TGACAGGTGTTAACAGATTTTAGG-3′ |
54 |
– |
|
Glu200fsX6 |
5 | PCR-Sequencing | F: 5′-AAGTGTTTGGAAACAGTCTGG-3′
R: 5′-ATGAAGTAAAAATGTCCTTGAC-3′ |
54 |
– |
|
Arg382Ser |
9 | PCR-Sequencing | F: 5′-CACTTCTTGATCTCTTGGAGCA-3′
R: 5′-AGATCAGCAATGAAGCAAGTTC-3′ |
56 |
– |
|
Ile659fsX13 |
14 | PCR-Sequencing | F: 5′-AGAGCAGAACGAGGTTTT-3′
R: 5′-GCTTCCCACAGCTCTGCAC-3′ |
52 |
– |
شکل 1: الگوریتم ملکولی پیشنهادی برای تشخیص کمبود فاکتور سیزده در ایران
الگوریتم تشخیصی کمبود فاکتور سیزده در ایران
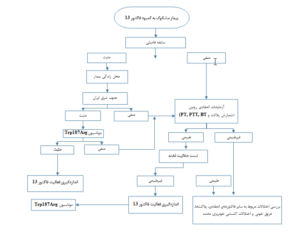
با توجه به اطلاعات موجود درباره بیماران ایرانی با کمبود فاکتور سیزده یک الگوریتم اختصاصی میتواند برای تشخیص زودهنگام، به موقع و قابلاعتماد در این بیماران پیشنهاد شود. به دلیل تعداد نسبتاً زیاد بیماران دارای کمبود فاکتور سیزده در ایران، طیف وسیعی از علائم بالینی در بین این بیماران مشاهده شده است (1). این علائم بالینی میتواند نشانههایی برای تشخیص زودهنگام و مناسب این نقص انعقادی باشد. در بیماران ایرانی همانند سایر نقاط دنیا خونریزی از بندناف رایجترین علامت بالینی در کمبود فاکتور سیزده میباشد (23،1). علاوه بر این سقط مکرر، خونریزی داخل جمجمه، هماتوم، تأخیر در بهبود زخم و خونریزی طولانی از محل زخم در میان بیماران ایرانی دارای کمبود فاکتور سیزده گزارش شده است (1،12،19). پس از معاینه دقیق فیزیکی و بررسی علائم بالینی دومین معیار کمککننده جهت تشخیص، گرفتن یک سابقه فامیلی مناسب میباشد. در مطالعهای که بر روی تعداد زیادی از بیماران دارای کمبود فاکتور سیزده انجام گرفت، مشخص شد که حدود 78% بیماران دارای والدینی با رابطه خویشاوندی نزدیک، بیش از 10% والدین دارای رابطه خویشاوندی دور و تنها حدود10% بیماران دارای والدینی بدون رابطه خویشاوندی بودند (24)، بنابراین بررسی مناسب علائم بالینی و گرفتن سابقه فامیلی دقیق نشانههای بسیار مهمی در تشخیص کمبود فاکتور سیزده هستند. پس از سابقه فامیلی مثبت، سومین قدم مناسب در تشخیص، سؤال درباره محل تولد بیمار است. از 473 بیمار گزارش شده دارای کمبود فاکتور سیزده در ایران 352 بیمار ساکن استان سیستان و بلوچستان در جنوب شرقی ایران بودند و 62 بیمار ساکن استانهای کرمان، خراسان، یزد و گلستان بودند که یا در زمره استانهای مجاور سیستان و بلوچستان قرار دارند و یا مانند استان گلستان و یزد میزان بالایی از مهاجرت و جابجایی جمعیت با استان سیستان و بلوچستان دارند (1)، بنابرابن میتوان اینگونه نتیجهگیری کرد که احتمالاً تعداد قابلتوجهی از بیماران با کمبود فاکتور سیزده در استانهای ذکر شده ممکن است اصالت سیستان و بلوچستانی داشته باشند. اهمیت سؤال درباره محل تولد بیمار یا والدین آنها بر این اساس است که مطالعاتی که در بیماران دارای این کمبود در این استان انجام شده نشان داده است که موتاسیون Trp187Arg در این منطقه تنها عامل ژنتیکی ایجاد کمبود فاکتور سیزده میباشد، بنابراین در بیماران استان سیستان و بلوچستان با یک سابقه فامیلی مثبت، یک آزمایش ساده اما قابلاعتماد PCR-RFLP میتواند منجر به تشخیص سریع و مناسب کمبود فاکتور سیزده شود. از آن جایی که تقریباً تمام استانهایی که دارای تعداد زیادی از بیماران دارای این کمبود میباشند در مجاورت استان سیستان و بلوچستان قرار دارند یا یک درصد بالایی از مهاجرت استانی با سیستان و بلوچستان دارند، در نتیجه جهش Trp187Arg باید به عنوان اولین آزمایش ملکولی برای هر ایرانی با کمبود فاکتور سیزده انتخاب شود. از طرف دیگر در مورد بیماری که دارای سابقه فامیلی از کمبود فاکتور سیزده نمیباشد و دارای اصالت سیستان و بلوچستانی هم نیست، در مرحله نخست تمام آزمایشات معمول انعقادی باید به منظور رد سایر اختلالات خونریزیدهنده با بدست آمدن نتایج طبیعی در این آزمایشات انجام شود (شکل 2).
مشاهده نتایج طبیعی در آزمایشات انعقادی باید با آزمایش حلالیت لخته همراه شود. در این مرحله ما به نتایج طبیعی یا غیرطبیعی از آزمایش حلالیت دست پیدا میکنیم. به دلیل اختصاصیت پایین این آزمایش نتایج غیرطبیعی در آزمایش حلالیت لخته با آزمایشاتی قابلاعتماد بیشتری مانند اندازهگیری فعالیت فاکتور سیزده همراه میشود. سرانجام باید با انجام یک آزمایش ملکولی مناسب اساس ملکولی بیماری مشخص شود.
ایران حدود نیمی از کل بیماران مبتلا به کمبود فاکتور سیزده دنیا را در خود جای داده است (1). بیماران ایرانی طیف وسیعی از علائم کلینیکی را بروز دادهاند و تشخیص دیرهنگام یا عدم تشخیص کمبود فاکتور سیزده در تعدادی از بیماران موجب شده است تا آمار به نسبت بالایی از مرگومیر در خانواده این بیماران گزارش شود. تعدادی از این مرگومیرها ناشی از رخدادهای خونریزی دهنده مربوط به کمبود فاکتور سیزده بوده در حالیکه تعداد قابلملاحظهای از موارد مرگومیر علت مشخصی نداشته و بیماران جهت ارزیابی کمبود فاکتور سیزده مراجعه نکردهاند. با این وجود علائمی که موجب بروز مرگ در این بیماران شده است شدیداً این فرضیه که این بیماران در اثر خونریزیهای ناشی از کمبود فاکتور سیزده جان خود را از دست دادهاند را تقویت میکند.
شکل 2: الگوریتم پیشنهادی برای تشخیص کمبود فاکتور سیزده در ایران
به دلیل شیوع بالای مرگومیر در بیماران مبتلا به کمبود فاکتور سیزده، ISTH نوعی الگوریتم جهت تشخیص کمبود فاکتور سیزده ارائه داده است. این الگوریتم به تشخیص دقیق کمبود فاکتور سیزده کمک شایانی میکند و در اغلب کشورهای توسعه یافته به راحتی قابلیت پیادهسازی دارد. در کشور ما مانند بسیاری از کشورهای در حال توسعه، اعمال این الگوریتم هزینههای سنگینی را بر بیمار تحمیل میکند. از سویی دیگر این الگوریتم به دلیل نیاز به بررسیهای تخصصی و سرمایهگذاری، قابلیت پیادهسازی در تمام نقاط کشور را ندارد و تاکنون نیز بخش عمده الگوریتم برای تشخیص کمبود فاکتور سیزده پیاده نشده است. هرچند به نظر میرسد در برخی از کشورهای درحال توسعه نیز مانند ایران پیادهسازی الگوریتم دشوار باشد اما با توجه به بررسی متون، تاکنون اقدامی در راستای ارائه الگوریتم منطقهای یا کشوری در این مناطق صورت نگرفته است و تنها الگوریتم موجود در جهان برای تشخیص کمبود فاکتور سیزده الگوریتم ISTH و الگوریتم ارائه شده در این مقاله میباشد که علت اصلی این موضوع میتواند آمار بسیار پایین بیماران مبتلا به کمبود فاکتور سیزده در این کشورها باشد. در کشور ما مسئله کاملاً متفاوت بوده و تعداد بسیار زیادی از بیماران مبتلا به کمبود فاکتور سیزده در کشور ما قرار دارند و این موضوع ضرورت طراحی و پیادهسازی الگوریتم کشوری بر اساس امکانات و تجهیزات موجود در کشور را اجتنابناپذیر میسازد. الگوریتم ارائه شده توسط ISTH صرفا آزمایشگاهی بوده و به جنبههای بالینی و دموگرافیک بیماری توجهی نشده است در حالی که با توجه به بررسیهای متعددی که در کشور در مورد ویژگیهای بالینی و دموگرافیک بیماران صورت گرفته است، این آیتم میتواند به عنوان بخشی از فرایند تشخیص و الگوریتم کشوری مفید باشد. به همین دلیل در الگوریتم ارائه شده بخش ابتدایی الگوریتم به بررسی اطلاعات دموگرافیک بیماری پرداخته است و سپس وارد اقدامات آزمایشگاهی شده است. هر چند تست حلالیت لخته در الگوریتم ارائه شده توسط ISTH جایگاهی ندارد اما با توجه به اینکه تمام آزمایشگاههای کشور از این آزمایش برای بررسی اولیه کمبود فاکتور سیزده استفاده میکنند و با توجه به سهولت انجام این آزمایش و هزینه پایین آن، حذف این آزمایش از فرایند تشخیص کمبود فاکتور سیزده در ایران منطقی به نظر نمیرسد، بلکه با انجام اصلاحاتی در این آزمایش، میتوان حساسیت آن را برای تشخیص بیماران با کمبود شدید فاکتور سیزده افزایش داد. به همین دلیل آزمایش حلالیت لخته به عنوان بخشی از الگوریتم کشوری کمبود فاکتور سیزده پیشنهاد شده است.
هرچند اندازهگیری فعالیت فاکتور سیزده به صورت محدود در کشور انجام میگیرد اما به عنوان آزمایش تأییدی میتوان از آن بهره برد. بدون شک تنها نکته قوت در تشخیص کمبود فاکتور سیزده در کشور وجود مطالعات ملکولی در این زمینه میباشد. اگرچه این مطالعات کامل نیست و تمام بیماران را مورد بررسی قرار ندادهاند، اما بخش عمدهای از بیماران از نظر ملکولی مورد بررسی قرار گرفتهاند و موتاسیون عامل بیماری در آنان مشخص شده است، به همین دلیل از تشخیص ملکولی میتوان به عنوان آزمایش تأییدی در کشور بهره جست. به دلیل اهمیت فوقالعاده بررسیهای ملکولی در تشخیص بیماریهای ارثی، مطالعه حاضر یک الگوریتم جداگانه برای تشخیص ملکولی بیماری ارائه داده است، که هزینههای تأیید نهایی بیماری را به شدت کاهش میدهد. هرچند باید در راستای پیادهسازی الگوریتم ISTH درکشور پیش رفت اما بکارگیری الگوریتم منطقهای با هزینه کم و با توجه به امکانات و تجهیزات موجود راهی بسیار مهم در راستای تشخیص زودهنگام و پیشگیری از مرگومیر ناشی از کمبود فاکتور سیزده در کشور میباشد.
منابع:
- Dorgalaleh A, Naderi M, Alizadeh Sh, Hosseini M, Hosseini S, Tabibian Sh: Factor XIII Deficiency In Iran, A Comprehensive Review of the Literature. Seminars in Thrombosis and Hemostasis 01/2015;
- Naderi M, Dorgalaleh A, Tabibian S, Alizadeh S, Eshghi P, Solaimani G. Current understanding in diagnosis and management of factor XIII deficiency. Iran J Pediatr Hematol Oncol 2013; 3(4): 164-72.
- Naderi M, Dorgalaleh A, Alizadeh S, Tabibian S, Bamedi T. clinical manifestations and management of life-threatening bleeding in the largest group of patients with severe factor XIII deficiency. Int J Hematol 2014.
- Maccpherson, Richard A, Henrys clinical diagnosis and management by laboratory methods, 21nd ed. 2006.
Hethershaw EL, Cilia La Corte AL, Duval C, Ali M, Grant PJ, Ariëns RA, et al. The effect of blood coagulation factor XIII on fibrin clot structure and fibrinolysis. Journal of Thrombosis and Haemostasis 2014;12(2):197-205.
- Biswas A, Ivaskevicius V, Thomas A, Oldenburg J. Coagulation factor XIII deficiency. Diagnosis, prevalence and management of inherited and acquired forms. Hamostaseologie 2014; 34(2).
- Schroeder V, Durrer D, Meili E, Schubiger G, Kohler HP. Congenital factor XIII deficiency in Switzerland: from the worldwide first case in 1960 to its molecular characterisation in 2005. Swiss medical weekly 2007; 137(19-20): 272-8.
- Jennings I, Kitchen S, Woods T, Preston F. Problems relating to the laboratory diagnosis of factor XIII deficiency: a UK NEQAS study. Journal of Thrombosis and Haemostasis 2003; 1(12): 2603-8.
- Kohler H, Ichinose A, Seitz R, Ariens R, Muszbek L. Diagnosis and classification of factor XIII deficiencies. Journal of Thrombosis and Haemostasis 2011; 9(7): 1404-6.
- Naderi M, Dorgalaleh A, Ahmadinejad M, Alizadeh Sh, Tabibian Sh, Hossenin MS, et al, Long term prophilaxis in severe congenital factor XIII deficiency was not complicatted with inhibitor development, European Association for Haemophilia and Allied Disorders, 2015.
- Naderi M, Alizadeh S, Kazemi A, et al. Central nervous system bleeding in pediatric patients with factor XIII deficiency: A study on 23 new cases. Hematology 2014; 10.1179/1607845414Y.0000000172.
- Naderi M, Imani M, Eshghi P, Dorgalaleh A,Tabibian S, Alizadeh S, et al. Factor XIII deficiency in Sistan and Baluchistan province. Sci J Blood Transfus Organ 2013; 10(3): 282-288.
- Naderi M, Dorgalaleh A, Alizadeh S, Kashani K Z, Tabibian S, Kazemi A, et al. Polymorphism of thrombin activatable fibrinolysis inhibitor and risk of intracranial haemorrhage in factor XIII deficiency. Haemophilia 2014; 20(1): e89-e92.
- Dorgalaleh A, Alizadeh S, Tabibian S, Bamedi T, Karimi M. Molecular Analysis Of The Largest Group Of Patients With Factor XIII Deficiency In Southeast Of Iran. Blood 2013; 122(21): 4780.
- Kárpáti L, Penke B, Katona É, Balogh I, Vámosi G, Muszbek L. A modified, optimized kinetic photometric assay for the determination of blood coagulation factor XIII activity in plasma. Clinical Chemistry 2000; 46(12): 1946-55.
- Hayward CP, Moffat K. Laboratory testing for bleeding disorders: strategic uses of high and low‐yield tests. International journal of laboratory hematology 2013; 35(3): 322-33.
- Hsieh L, Nugent D. Factor XIII deficiency. Haemophilia 2008; 14(6): 1190-200.
- Eshghi P, Cohan N, Lak M, Naderi M, Peyvandi F, Menegatti M, et al. Arg77His and Trp187Arg are the most common mutations causing FXIII deficiency in Iran. Clinical and Applied Thrombosis/Hemostasis 2012; 18(1): 100-3.
- Naderi M, Dorgalaleh A, Alizadeh S, Tabibian S, Hosseini S, Shamsizadeh M, et al. Clinical manifestations and management of life-threatening bleeding in the largest group of patients with severe factor XIII deficiency. International journal of hematology 2014;100(5): 443-9.
- Peyvandi F, Tagliabue L, Menegatti M, Karimi M, Komáromi I, Katona É, et al. Phenotype‐genotype characterization of 10 families with severe a subunit factor XIII deficiency. Human mutation 2004; 23(1): 98.
- Souri M, Biswas A, Misawa M, Omura H, Ichinose A. Severe congenital factor XIII deficiency caused by novel W187X and G273V mutations in the F13A gene; diagnosis and classification according to the ISTH/SSC guidelines. Haemophilia 2014; 20(2): 255-62.
- Borhany M, Handrkova H, Cairo A, Schroeder V, Fatima N, Naz A, et al. Congenital factor XIII deficiency in Pakistan: characterization of seven families and identification of four novel mutations. Haemophilia 2014; 20(4): 568-74.
- Anwar R, Minford A, Gallivan L, Trinh CH, Markham AF. Delayed umbilical bleeding—a presenting feature for factor XIII deficiency: clinical features, genetics, and management. Pediatrics 2002; 109(2): e32-e.
23. Naderi M, Alizadeh S, Tabibian S, Hosseini S, Dorgalaleh A, Effect of social factors on the highest global incidence of factor XIII deficiency in southeast of Iran, Archives of Iranian medicine, 2015.
روشهای آزمایشگاهی و استانداردهای بینالمللی در تشخیص اختلالات انعقادی (بخش اول)
رویکرد عملی در تشخیص آزمایشگاهی و ملکولی کمبود فاکتور سیزده (بخش دوم)
رویکرد عملی در تشخیص آزمایشگاهی و ملکولی کمبود فاکتور سیزده (بخش سوم)
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام