آنتیژنهای پلاسمودیوم فالسیپاروم
(Antigens of Plasmodium falciparum)
گردآوری و تألیف: دکتر احمد مردانی، استادیار مؤسسه عالی آموزشی و پژوهشی طب انتقال خون
Abbreviations:
AMA (apical membrane antigen)
CSP (circamsporozoite protein)
EBA (erythrocyte binding antigen)
GLURP (glutamate-rich protein)
HLA (human leukocyte antigen)
HSP (heat-shock protein)
IRBCs (infected red blood cells)
KAHRP (knob-associated histidine-rich protein)
KP (knob protein)
LSA (liver stage antigen)
MESA (mature parasite-infected erythrocyte surface antigen)
MSA (merozoite surface antigen)
MSP (merozoite surface protein)
PfAMA (Plasmodium falciparumapical membrane antigen)
PfEMP (Plasmodium falciparum-infected erythrocyte membrane protein)
PfHRP (Plasmodium falciparumhistidine-rich protein)
RAP (rhoptry antigen protein)
RESA (ring-infected erythrocyte surface antigen)
SALSA (sporozoite and liver stage antigen)
SSP (sporozoite surface protein)
TBVs (transmission blocking vaccines)
TRAP (thrombospondin-related adhesive protein)
مقدمه
انگلهای مالاریا (malaria parasites) یا پلاسمودیومها (Plasmodia) از نظر آنتیژنیکی خیلی پیچیده هستند و دارای آنتیژنهای زیادی میباشند که اختصاصی سویه (strain)، گونه(species) و مراحل مختلف سیر تکاملی آنهاست. با وجود تشابه آنتیژنیکی بین پلاسمودیومهای مختلف، پاسخهای ایمنی خنثیکننده (neutralizing) تا حدود زیادی اختصاصی گونههاست [1]. تصور میشد محافظت متقاطع (cross protection) در بین انگلهای مختلف مالاریا وجود ندارد، امّا بررسیهای اپیدمیولوژیکی نشان داد که عفونت با پلاسمودیومهای ویواکس (vivax) و مالاریه (malariae) درجاتی از محافظت بالینی در مقابل عفونتهای شدید پلاسمودیوم فالسیپاروم (Plasmodium falciparum) ایجاد میکند. محافظت متقاطع بین مراحل مختلف یک گونه مشاهده نشده و یا در حد بسیار اندکی بوده است.
به دلیل اهمیت بیماریزایی پلاسمودیـوم فالسیپاروم، ساختارهای ژنتیکی و آنتیژنیکی این گونه بیشتر از سایر گونههای انگل مالاریا بهمنظور ساخت واکسن مورد بررسی قرار گرفته است. یکی از ویژگیهای قابلتوجه آنتیژنهای سطحی انگل پلاسمودیوم فالسیپاروم، داشتن توالیهای تکراری نسبتاً کوتاه از آمینواسیدها میباشد. پروتئین CSP، اولین آنتیژنی است که توالیهای تکراری آن مشخص شده است [2].
بسیاری از آنتیژنهای انگل پلاسمودیوم فالسیپاروم از نظر ساختمانی پلیمورفیک (polymorphic) هستند که اساس تنوع آنتیژنیکی سویهها و ایزولههای مختلف این گونه میباشد. آنتیژنهای پلاسمودیوم فالسیپاروم از چهار جنبه قابل اهمیت و بررسی هستند که عبارتند از [3،4]:
- تعداد نسبتاً محدودی آنتیژن سطحی در مراحل تهاجمی چرخه زندگی پلاسمودیوم فالسیپاروم وجود دارد که نشاندهنده نقش آنها در تشخیص و اتصال به سلول میزبان است مانند CSP و TRAP در مرحله اسپوروزوئیتی (sporozoite)، MSP-1 و MSP-2 در مرحله مزوزوئیتی (merozoite)و Pfs48/45 و Pfs25 در مرحله گامتوسیتی (gametocyte)
- مراحل خارج گلبولی چرخه زندگی پلاسمودیوم فالسیپاروم همگی دارای اندامکهای خاص تهاجمی هستند که بسیاری از آنتیژنها خاص این اندامکها هستند مانند AMA-1، RAP-1، RAP-2، EBA-175 و Ag512. اگرچه این آنتیژنها در سطح انـگل پلاسمودیوم فالسیپاروم قرار ندارند، امّا نقش مهمی در اتصال انگل به سلول میزبان، تهاجم و واکنشهای ایمنی ایفا مینمایند.
- تعدادی از آنتیژنها در سطح گلبولهای قرمز و یا سلولهای پارانشیم کبدی (hepatocytes) آلوده قرار دارند که یا مستقیماً توسط انگل بیان میشوند مانند PfEMP-1 و یا ماحصل انگل و سلول میزبان (HLA-1) میباشند مانندCSP ، HSP-70، LSA-1، LSA-2 و SALSA
- تعداد زیادی آنتیژن در درون انگل پلاسمودیوم فالسیپاروم وجود دارد که بسیار ایمونوژنیک هستند و مسئول بخش قابلتوجهی از کل پاسخ ایمنی میزبان میباشند. برخی از این آنتیژنها در تشخیص آزمایشگاهی مورد استفاده قرار میگیرند و تعدادی در وقایع ایمونوپاتولوژیکی دخالت دارند. این آنتیژنها یا در طی شیزوگونی (schizogony) ترشح میشوند و یا در اغلب موارد در هنگام پاره شدن شیزونت (schizont) آزاد میگردند.
مراحل مختلف سیر تکاملی انگل پلاسمودیوم فالسیپاروم دارای آنتیژنهای مختلف و متعددی است که تعداد زیادی از آنها به مراحل غیرجنسی خونی تعلق دارد. آنتیژنهایی که از اهمیت بیشتری برخوردار میباشند عبارتند از:
الف. آنتیژنهای مروزوئیتی (merozoite) و شیزونتی (schizont)
- AMA-1
چندین آنتیژن از مراحل مختلف چرخه زندگی انگل پلاسمودیوم فالسیپاروم بهعنوان آنتیژنهای کاندید واکسن مورد بررسی قرار گرفتهاند [5،6]. آنتیژن AMA-1، آنتیژن مرحله خونی غیرجنسی انگلهای مالاریاست که در دیگر اعضای شاخه آپیکمپلکسا (apicomplexa) نیز یـافت میشـود [11-7]. این آنتیژن توسط ژن تکلوکوسی (single-locus gene) و بدون اینترون (intron) کد میشود که برای رشد انگل در شرایط برونتنی (in-vitro) ضروری است [11]. ژن کدکننده آنتیژن AMA-1، 1/8 کیلوباز طول دارد و از انگلهای مالاریای جونده، میمون و انسان کلون و تعیینتوالی شده است [16-12]. ثابت شده است که ژن ama-1 در هر دو عامل بیماریزای اصلی مالاریا (پلاسمودیوم فالسیپاروم و پلاسمودیوم ویواکس) بهشدت تطابقی است [22-17].
آنتیژن AMA-1 پلاسمودیوم فالسیپاروم (PfAMA-1) یا Pf83، آنتیژن 83 کیلودالتونی است که در مرحله شیزونت رسیده (mature schizont) چرخه زندگی انگل بیان میشود [14،23،24] و طی فرایندی قبل از انتقال به سطح مروزوئیتها (راس میکرونمها) گسسته شده و به یک آنتیژن 66 کیلودالتونی تبدیل میگردد [27-25]. این آنتیژن (PfAMA-1) از سه ناحیه تشکیل شده است که عبارتند از:
- ناحیه extracellular با 546 اسیدآمینه
- ناحیه transmembrane با 21 اسیدآمینه
- ناحیه cytoplasmic tail با 55 اسیدآمینه
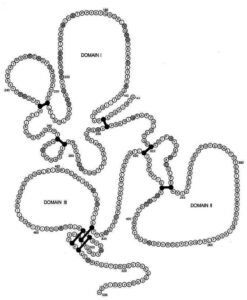
ناحیه extracellular توسط هشت پیوند دیسولفیدی به سه domain (I-III) تقسیم میشود (شکل 1) [23،24]. متنوعترین بخش آنتیژن PfAMA-1، domain I میباشد [5،18،20،28،29،30] و به نظر میرسد این domain هدف اصلی آنتیبادیهای ضد PfAMA-1 باشد [31]. اگرچه آنتیژن AMA-1 از دیگر آنتیژنهای پلاسمودیوم فالسیپاروم کمتر متغیر و متنوع میباشد [28،32،33]، امّا میزان جهشهای nonsynonymous در domain I آن همیشه به علت رخداد پدیده انتخاب طبیعی مثبت (positive natural selection) بیشتر بوده است [20،21،28،32،34]. ژن کدکننده آنتیژن PfAMA-1 بر روی کروموزوم شماره 11 قرار دارد و برخلاف اکثر ژنهای آنتــیژنیک تعیینتوالی شده پلاسمودیوم فالسیپاروم، فاقد توالیهای تکراری است [35].
شکل 1: نمایش شماتیک سه domain (I-III) تشکیلدهنده ناحیه extracellularآنتیژن AMA-1 پلاسمودیوم فالسیپاروم و هشت پیوند دیسولفیدی [24]
عملکرد واقعی و دقیق آنتیژن AMA-1 مشخص نشده است، امّا در تهاجم مروزوئیتهای انگل مالاریا به گلبولهای قرمز میزبان نقش اساسی را ایفا میکند. علاوه بر این، آنتیبادیهای ضد PfAMA-1 عرضه آنتیژن و تهاجم مروزوئیتی [26،31،36] و همچنین رشد پلاسمودیوم فالسیپاروم را در شرایط in-vitro مهار میکنند [31،36]. بررسیهای تجربی در پریماتها و موشها نشان داده است که ایمنیزایی با AMA-1 پلاسمودیومهای اختصاصی، آنها را در برابر عفونتهای کشنده محافظت مینماید [23،37،38]. بررسیهای اولیه، وجود آنتیبادیهای ضد PfAMA-1 و لنفوسیتهای T حساس به PfAMA-1 در افراد ساکن مناطق اندمیک مالاریا در آفریقا را نشان داده است [39،40،41]، امّا اپیتوپهای محافظتی هنوز مشخص نشدهاند. لازم به ذکر است که آنتیژن AMA-1، کاندیدای اصلی واکسن مرحله خونی غیرجنسی مالاریاست [7،9،42] و اخیراً واکسن مالاریای فالسیپاروم بر پایه این آنتیژن در فاز II کارآزمایی بالینی، مورد بررسی و ارزیابی قرار گرفته است [8].
- MSP-1
این پروتئین سطحی مروزوئیت که به آن آنتیژن سطحی مروزوئیت (MSA-1) نیز میگویند، در طی مرحله شیزوگونی خونی (erythrocyticschizogony) سنتز میشود. وزن این پروتئین 185 تا 215 کیلودالتون است و ژن کدکننده آن بر روی کروموزوم شماره نه قرار دارد [43]. این آنتیژن یکی از کاندیدهای اصلی واکسن مالاریا است و از اجزای تشکیلدهنده واکسنهایSPf66 و NYVAC-Pf7 میباشد [44].
- MSP -2 یا MSA-2
این آنتیژن با وزن مولکولی 55-45 کیلودالتون در مرحله شیزوگونی خونی سنتز میشود. ژن کدکننده MSP-2 بر روی کروموزوم شماره دو قرار دارد و آنتیبادیهای ضد این آنتیژن از تهاجم انگل در شرایط in-vitro جلوگیری میکنند.
- RESA یا Pf155
آنتیژن RESA با وزن مولکولی 155 کیلودالتون در سطح میکرونم (microneme) مروزوئیتهای انگل قرار دارد. آنتیبادیهای ضد این آنتیژن در شرایط in-vitro قادر به جلوگیری از رشد انگل هستند و حضور این آنتیبادیها در سرم بیماران مالاریایی با ایجاد محافظت در برابر علائم بالینی، مرتبط میباشد [44].
- GLURP
پروتئین غنی از گلوتامات، تنها پروتئینی است که در تمامی مراحل سیر تـکاملی انـگل مالاریا بیان میشود و باعث تحریک سیستم ایمنی هومورال و سلولی میزبان میگردد. این پروتئین 220 کیلودالتونی با پاره شدن شیزونت خونی آزاد میشود.
- EBA-175
این آنتیژن 175 کیلودالتونی، احتمالاً مهمترین لیگاند اتصالی انگل مالاریا به اریتروسیتها است. آنتیژن مذکور ایمونوژنیک بوده و مقدار آنتیبادی ضد آن با افزایش سن افراد در مناطق اندمیک افزایش مییابد.
- HSP-70
پروتئین شوک حرارتی با 75 کیلودالتون وزن مولکولی در همه مراحل سیر تکاملی انگل مالاریا بهجز مراحل اسپوروگونی مشاهده میشود. توالی این پروتئین با HSP انسانی 60 درصد همولوژی دارد و آنتیبادیهای ضد آن نقش محافظتی دارند [3].
ب. آنتیژنهای مالاریایی اریتروسیتی
- KAHRP
پلاسمودیـوم فالسیپاروم تکیاخته انگلی درون گلبـولی است که سبب رخداد شدیدترین شکل مالاریای انسانی میگردد. اکثر مرگومیرهای ناشی از ابتلا به مالاریای فالسیپاروم به علت قابلیت تجمع این انگل در ارگانهای داخلی بدن است. تجمع گلبولهای قرمز آلوده به مراحل رشد کرده انگل پلاسمودیوم فالسیپاروم در عروق منجر به بروز اختلالاتی از جمله مالاریای مغزی میشود که علت اصلی مرگومیر ناشی از ابتلا به مالاریای فالسیپاروم است [45]. این تجمع یک پدیده cytoadherence با واسطه knobs میباشد.
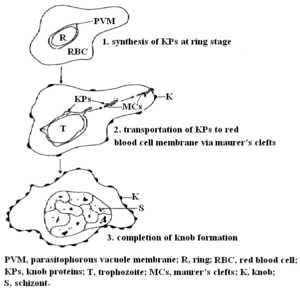
به برجستگیهای فنجانی شکل که در سطح گلبولهای قرمز آلوده (IRBCs) به تروفوزوئیت (trophozoite) و شیزونت پلاسمودیوم فالسیپاروم تشکیل میشود، knobs میگویند. اندازه knobs 60-100 نانومتر بوده و حاوی مواد electron dense میباشند.
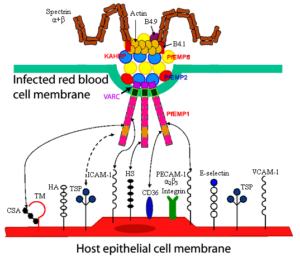
چندین مولکول مشتق شده از انگل و گلبولهای قرمز میزبان در تشکیل knobs شرکت میکنند؛ یکی از آنها، پروتئین KAHRP است که به آن PfHRP-1 و یا KP نیز میگویند [46،47]. این پروتئین 105-85 کیلودالتونی توسط مراحل اولیه (تروفوزوئیت جوان) چرخه غیرجنسی انگل پلاسمودیوم فالسیپاروم سنتز میشود و سپس از طریق Maurer’s clefts به غشاء گلبولهای قرمز آلوده به مراحل رشد کرده انگل منتقل میگردد [46،48،49] (شکل2). لازم به ذکر است که ژن کدکننده پروتئین PfHRP-1 روی کروموزوم شماره دو قرار دارد [50].
شکل 2: نمایش شماتیک عوامل دخیل در تشکیل knobs و ارتباط آنها با هم و با گیرندههای موجود در سطح سلولهای اندوتلیال عروق میزبان [51]
- PfEMP-1
یکی از اجزای اصلی تشکیلدهنده knobs، PfEMP-1 میباشد. این پروتئین 350-200 کیلودالتونی از تنوع ژنتیکی بسیار بالایی برخوردار است. برجستگیهای فنجانی شکل سطح گلبولهای قرمز آلوده به انگل (knobs) از طریق PfEMP-1 به گیرندههای موجود در سطح سلولهای اندوتلیال عروق میزبان متصل میشوند (شکل 3).
شکل 3: نمایش شماتیک مراحل تشکیل knobs [46]
- MESA یا PfEMP-2
این پروتئین 300-250 کیلودالتونی همراه با PfHRP-1، PfEMP-1 و PfEMP-3 از اجزای تشکیلدهنده knobs در سطح گلبولهای قرمز آلوده به انگل میباشند [52].
ج. آنتیژنهای گامتوسیتی (gametocyte) و گامتی (gamete)
آنتیژنهای مرحله گامتوسیتی با آنتیژنهای مراحل غیرجنسی انگل پلاسمودیوم فالسیپاروم تشابه کمتری دارند، اگرچه با آنتیژنهای گامتی و زیگوتی (zygote) تشابه آنتیژنی بیشتری مشاهده میشود. اساس و پایه واکسنهای بلوکهکننده انتقال (TBVs)، آنتیژنهای گامتوسیتی و گامتی هستند. دو آنتیژن با وزن مولکولی 230 (Pfs230) و 45/48 (Pfs48/45) کیلودالتون در گامتوسیتها سنتز میشود که در سطح گامتها و زیگوتها نیز قابل مشاهده هستند. در طی تغییر شکل زیگوت به اواوکینت (ookinete)، آنتیژن 25 کیلودالتونی (Pfs25) در سطح اواوکینت ظاهر میشود که آنتیبادیهای ضد آن قادر به جلوگیری از رشد انگل در پشه میباشند [44].
د. آنتیژنهای مراحل خارج گلبولی
- CSP
این پروتئین 60-45 کیلودالتونی در بقای اسپوروزوئیتها در بدن پشه و تشخیص سطح هپاتوسیتها از طریق پروتئوگلیکان سولفات کبدی نقش دارد. ژن کدکننده CSP دارای بخش مرکزی است که چندین توالی تکراری خاص گونه مانند NANP در پلاسمودیوم فالسیپاروم دارد [2]. پروتئین CSP یکی از مهمترین کاندیداهای واکسن مالاریا است و به نظر میرسد در سطح هپاتوسیتهای آلوده نیز وجود داشته باشد [44].
- TRAP یا SSP-2
این پروتئین در سطح اسپوروزوئیتها، هپاتوسیتهای آلوده و مراحل غیرجنسی داخل گلبولی مشاهده میشود. پروتئین SSP-2 در هدایت اسپوروزوئیتها به غدد بزاقی پشه و هپاتوسیتها نقش دارد. آنتیبادیهای ضد این پروتئین نقش محافظتی داشته و عیار آنها با افزایش سن افراد در مناطق اندمیک افزایش مییابد.
- LSA
این آنتیژنها در شیزونتهای نسجی و داخل هپاتوسیتها دیده میشوند. آنتیژن LSA-1 با 230 کیلودالتون وزن مولکولی، شناختهشدهترین آنتیژن مرحله کبدی است و در بین ایزولههای پلاسمودیوم فالسیپاروم بسیار محافظتشده میباشد [44].
منابع:
1.Wahlgren M, Perlmann P. 1999. Malaria: Molecular and Clinical Aspects, 1th ed. CRC Press.
- Ferreira MU, Nunes MDC, Wunderlich G. Antigenic diversity and immune evasion by malaria parasites. ClinDiagn Lab Immunol 2004; 11:987-995.
3.Perlmann P. 2002. Malaria Immunology, 2th ed. S Karger Pub.
4.ClarkIA, Alleva LM, Mills AC, Cowden WB. Pathogenesis of malaria and clinically similar conditions.ClinMicrobiol Rev 2004; 17:509-539.
- Oliveira DA, Udhayakumar V, Bloland PB, Shi YP, Nahlen BL, Oloo AJ, Hawley WE, Lal AA. Genetic conservation of the P. falciparum apical membrane antigen-1 (AMA-1).MolBiochemParasitol1996; 76: 333-336.
6.Genton B, Reed ZH. Asexual blood-stage malaria vaccine development: facing the challenges. CurrOpin Infect Dis2007; 20:467-475.
7.Polhemus ME, Magill AJ, Cummings JF, Kester KE, Ockenhouse CF, Lanar DE, Dutta S, Barbosa A, Soisson L, Diggs CL, Robinson SA, Haynes JD, Stewart VA, Ware LA, Brando C, Krzych U, Bowden RA, Cohen JD, Dubois MC, Ofori-Anyinam O, De-Kock E, Ballou WR, Heppner DJ. Phase I dose escalation safety and immunogenic trail of Plasmodium falciparum apical membrane protein (AMA-1) FMP2.1, adjuvanted with AS02A, in malaria-naive adults at the Walter Reed Army Institute of Research. Vaccine 2007; 26:4203-4212.
8.Sagara I, Dicko A, Ellis RD, Fay MP, Diawara SI, Assadou MH, Sissoko MS, Kone M, Diallo AI, Save R, Guindo MA, Kante O, Niambele MB, Miura K, Mullen GE, Pierce M, Martin LB, Dolo A, Diallo DA, Doumbo OK, Miller LH, Saul A. A randomized controlled phase 2 trial of the blood stage AMA1-C1/Alhydrogel malaria vaccine in children in Mali. Vaccine 2009; 27:3090-3098.
- Saul A, Lawrence G, Allworth A, Elliott S, Anderson K, Rzepczyk C, Martin LB, Taylor D, Eisen DP, Irving DO, Pye D, Crewther PE, Hodder AN, Murphy VJ, Anders RF. A human phase I vaccine clinical trial of the Plasmodium falciparum malaria vaccine candidate apical membrane antigen 1 in Montanide ISA 720 adjuvant. Vaccine 2005; 23:3076-3083.
- Hehl AB, Lekutis C, Grigg ME, Bradley PJ, Dubremetz JF, Ortega-Barria E, Boothroyd JC. Toxoplasma gondii homologue of Plasmodium apical membrane antigen 1 is involved in invasion of host cells. Infect Immun 2000; 68:7078-7086.
11.Triglia T, Healer J, Caruana SR, Hodder AN, Anders RF, Crabb BS, Cowman AF. Apical membrane antigen 1 plays a central role in erythrocyte invasion by Plasmodium species. MolMicrobiol 2000; 38:706-718.
- Cheng Q, Saul AJ. Sequence analysis of the apical membrane antigen I (AMA-1) of Plasmodium vivax.MolBiochemParasitol 1994; 65:183-187.
- Marshall VM, Peterson GM, Lew AM, Kemp DJ.Structure of the apical membrane antigen I (AMA-1) of Plasmodium chabaudi.MolBiochemParasitol 1989; 37:281-284.
- Peterson MG, Marshall VM, SMythe JA, Crewther PE, Lew A, Silva A, Anders RF, Kemp DJ. Integral membrane protein located in the apical complex of Plasmodium falciparum. Mol Cell Biol 1989; 9:3151-3154.
- Peterson MG, Nguyen-Dinh P, Marshall VM, Elliott JF, Collins WE, Anders RF, Kemp DJ. Apical membrane antigen of Plasmodium fragile.MolBiochemParasitol 1990; 39:279-284.
- Waters AP, Thomas AW, Deans JA, Mitchell GH, HudsonDE, Miller LH, McCutchan TF, Cohen S. A merozoite receptor protein from Plasmodium knowlesi is highly conserved and distributed throughout Plasmodium. J BiolChem 1990; 265:17974-17979.
17.Hughes MK, Hughes AL. Natural-selection on Plasmodium surface-proteins. MolBiochemParasitol 1995; 71:99-113.
18.Kocken CH, Narum DL, Massougbodji A, Ayivi B, Dubbeld MA, van der Wel A, Conway DJ, Sanni A, Thomas AW. Molecular Characterization of plasmodium reichenowi apical membrane antigen-1 (AMA-1), comparision with p.falciparum AMA-1, and antibody-mediated inhibition of red cell invasion.MolBiochemParasitol 2000; 109:147-156.
19.Verra F, Hughes AL. Evidence for ancient balanced polymorphism at the apical membrane antigen-1 (AMA-1) locus of Plasmodium falciparum.MolBiochemParasitol 2000; 105:149-153.
20.Polley SD, Conway DJ. Strong diversifying selection on domains of the Plasmodium falciparum apical membrane antigen 1 gene. Genetics 2001; 158:1505-1512.
21.Polley SD, Chokejindachai W, Conway DJ. Allele frequency-based analyses robustly map sequence site under balancing selection in a malaria vaccine candidate antigen. Genetics 2003; 165:555-561.
22.Gunasekera AM, Wickramarachchi T, NeafseyDE, Ganguli I, Perera L, Premaratne PH, Hartl D, Handunnetti SM, Udagama-Randeniya PV, Wirth DF. Genetic diversity and selection at the Plasmodiumvivaxapical membrane antigen-1 (PvAMA-1) locus in a Sri Lanka population.MolBiolEvol 2007; 24:939-947.
- Deans JA, Knight AM, Jean WC, Waters AP, Cohen S, Mitchell GH. Vaccination trials in rhesus monkeys with a minor, invariant, Plasmodium knowlesi 66 kDamerozoite antigen.Parasite Immunol 1988; 10:535-352.
24.Hodder AN, CrewtherPE, Matthew MLSM, Reid GE, Moritz RL, Simpson RJ, Anders RF. The disulfide bond structure of Plasmodium apical membrane Antigen-1.J BiolChem 1996; 271:29446-29452.
25.Narum DL, Thomas AW. Differential localization of full-length and processed forms of PF83/AMA-1 apical membrane antigen Plasmodium falciparummerozoites.MolBiochemParasitol 1994; 67:59-68.
26.Dutta S, Haynes JD, Moch JK, Barbosa A, Lanar DE, 2003. Invasion-inhibitory antibodies inhibit proteolytic processing of apical membrane antigen 1 of Plasmodium falciparummerozoites. ProcNatlAcadSci USA 2003; 100:12295-12300.
- Howell SA, Withers-Martinez C, Kochen CH, Thomas AW, Blackman MJ. Proteolytic processing and primary structure Plasmodium falciparumapical membrane antigen-1. J BiolChem 2001; 276:31311-31320.
- Escalante AA, Grebert HM, Chaiyaroj SC, Magris M, Biswas S, Nahlen BL, Lal AA. Polymorphism in the gene encoding the apical membrane antigen-1 (AMA-1) of Plasmodium falciparum.X. Asembo Bay Cohort Project.MolBiochemParasitol2001; 113:279-287.
- Marshall VM, Zhang L, Anders RF, Coppel RL.Diversity of the vaccine candidate AMA-1 of Plasmodium falciparum.MolBiochemParasitol 1996; 77:109-113.
- Thomas AW, Waters AP, Carr D. Analysis of variation in PF83, an erythrocyticmerozoite vaccine candidate antigen of Plasmodium falciparum. MolBiochemParasitol 1990; 42:285-287.
31.Hodder AN, CrewtherPE, Anders RF. Specificity of the protection antibody response to apical membrane antigen 1. Infect Immun 2001; 69:3286-3294.
32.Cortes A, Mellombo M, Mueller I, Benet A, Reeder JC, Anders RF. Geographical structure of diversity and differences between symptomatic and asymptomatic infections for Plasmodium falciparumvaccine candidate AMA-1. Infect Immun 2003; 71:1416-1426.
33.Eisen DP, Marshall VM, Billman-Jacobe H, Coppel RL. A Plasmodium falciparum apical membrane antigen-1 (AMA-1) gene apparently generated by intragenic recombination.MolBiochemParasitol 1999; 100:243-246.
34.Garg S, Alam MT, Das MK, Dev V, Kumar A, Dash AP, Sharma YD, 2007. Sequence diversity and natural selection at domain I of the apical membrane antigen 1 among Indian Plasmodium falciparum population. Malar J 2007; 22:154.
- Anders R, Saul AJ. Candidate antigens for an asexual blood stage vaccine against falciparum malaria, p.169. In Good MF and Saul AJ (ed), Molecular immunological consideration in malaria vaccine development. 1994. CRC Press, Boca RatonFla.
36.Kocken CH, Withers-Martinez C, Dubbeld MA, Vander WA, Hackett F, Valderraman A, Blackman MJ, Thomas AW, 2002. High-level expression of the malaria blood-stage vaccine candidate induction of antibodies that inhibit erythrocyte invasion.Infect Immun 2002; 70:4471-4476.
37.Collins WE, Pye D, Crewther PE, Vandenberg KL, Galland GG, Sulzer AJ, Kemp DJ, Edwards SJ, Coppel RL, Sullivan JS, Morris CL, Anders RF. Protective immunity induced in squirrel monkeys with recombinant apical membrane antigen-1 of Plasmodium fragile. Am J Trop Med Hyg 1994; 51:711-719.
38.Crewther PE, Matthew ML, Flegg RH, Anders RF. Protective immune responses to apical membrane antigen 1 of Plasmodium chabaudiinvolve recognition of strain-specific epitipes. Infect Immun 1996; 64:3310-3317.
39.Thomas AW, Trape JF, Rogier C, Goncalves A, Rosario VE, Narum DL. High prevalence of natural antibodies against Plasmodium falciparum 83-kilodalton apical membrane antigen (PF83/AMA-1) as detected by capture-enzyme-linked immunosorbent assay using full-length Baculovirus recombinant PF83/AMA-1. Am J Trop Med Hyg 1994; 51:730-740.
40.Lal AA, Hughes MA, Oliveira DA, Nelson C, Bloland PB, Oloo AJ, Hawley WE, Hightower AW, Nahlen BL, Udhayakumar V. Identification of T-cell determinants in natural immune responses to the Plasmodium falciparum apical membrane antigen-1 (AMA-1) in an adult population exposed to malaria. Infect Immun 1996; 64:1054-1059.
41.Riley EM, Wagner GE, Ofori MF, Wheeler JG, Akanmori BD, Tetteh K, McGuinness D, Bennett S, Nkrumah FK, Anders RF, Koram KA. Lack of association between maternal antibody and protection of African infants from malaria infection. Infect Immun 2000; 68:5856-5863.
42.Malkin EM, Diemert DJ, McArthur JH, Perreault JR, Miles AP, Giersing BK, Mullen GE, Orcutt A, Muratova O, Awkal M, Zhou H, Wang J, Stowers A, Long CA, Mahanty S, Miller LH, Saul A, Durbin AP. Phase I clinical trail of apical membrane antigen 1: an asexual blood-stage vaccine for Plasmodium falciparum malaria. Infect Immun 2005; 73:3677-3685.
- Tanabe K, Sakihama N, Kaneko A. In vitro recombination during PCR of Plasmodium falciparum DNA; A potential piffle in molecular population genetic analysis.MolBiochemParasitol 2002; 122:211-216.
44.Greenwood B. The molecular epidemiology of malaria. Trop Med Int Health 2002; 7:1012-1021.
- Miller L. Distribution of mature trophozoites and schizonts of Plasmodium falciparum in the organs of Aotustrivirgatus, the night monkey. Am J Trop Med Hyg 1969; 18:860-865.
- Sharma YD. Knobs, knob proteins and cytoadherence in falciparum malaria. Int J Biochem 1991; 23:775-789.
47.Kilejian A. Characterization of a protein correlated with the production of knob-like protrusions on membranes of erythrocytes infected with Plasmodium falciparum. ProcNatlAcadSci USA 1979; 76:4650-4653.
48.Kilejian A, Sharma YD, Karoui H, NasLund L. Histidine-rich domain of the knob protein of the human malaria parasite Plasmodium falciparum. ProcNatlAcadSci USA 1986; 83:7938-7941.
49.Kilejian A, Rashid MA, Aikawa M, Aji T, Yang YF. Selective association of a fragment of the knob protein with spectrin, actin and the red cell membrane.MolBiochemParasitol 1991; 44:175-182.
- Corcoran LM, Forsyth KP, Bianco AE, Brown GV, Kemp DJ. Chromosome size polymorphisms in Plasmodium falciparum can involve deletions and are frequent in natural parasite populations. Cell 1986; 44:87-95.
51.http://www.bioch.ox.ac.uk/aspsite/research/brochure/vakonakis/image001.png
- Moody A. Rapid diagnostic tests for malaria parasite. ClinMicrobiol Rev 2002; 15:66-78.
پلاسمودیوم فالسیپاروم و پروتئین Knob
واکسن مالاریا (Malaria Vaccine)
نگاهی اجمالی بر روشهای تشخیص آزمایشگاهی مالاریا
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام

سلام سندروم دوعن تیپ یک چشم چپ قابل درمان برای درمان کجا مراجعه کنیم