مطالعه موردی
مردی با درد پا و شکستگیهای متعدد
دکتر شاهرخ مستور تهرانی
پزشک عمومی بیمارستان ضمن تماس با آزمایشگاه علت پایین بودن مقدار آلکالن فسفاتار ALP را در یک بیمار مرد 54 ساله جویا میشود. کاهش (ALP) یک ناهنجاری بیوشیمیایی است که کمتر به آن پرداخته شده است (1). بیمار یک کهنه سرباز است که اکنون به شغل آتشنشانی مشغول است. سوابق پزشکی وی نشان میدهد که در گذشته شکستگیهای متعدد در قسمتهای مختلف بدن داشته است؛ از جمله شکستگی ترقوه راست در 12 سالگی، شکستگی تیبیا (درشتنی) چپ در 13 سالگی و انگشت دست راست در 15 سالگی. در 44 سالگی درد شدیدی در پاها را تجربه میکند. در 50 سالگی عکسهای رادیوگرافی که در دو سری جداگانه تهیه میشوند در استخوان دوم متاتارسال شواهد استئونکروز و کاهش تراکم استخوان را نشان میدهند. در همین دوران درد شدیدی به مدت دو هفته در پاشنه پای راست احساس میشود. تمامی این مشاهدات در غیاب هرگونه آسیب یا ترومای خارجی بعمل میآیند. در حال حاضر کورتیکواستروئید استنشاقی، دی هیدروکدئین، باکلوفن، کوکودامول، کوئینین سولفات، پروپانولول، گاباپنتین و دیازپام توسط بیمار مصرف میشود.
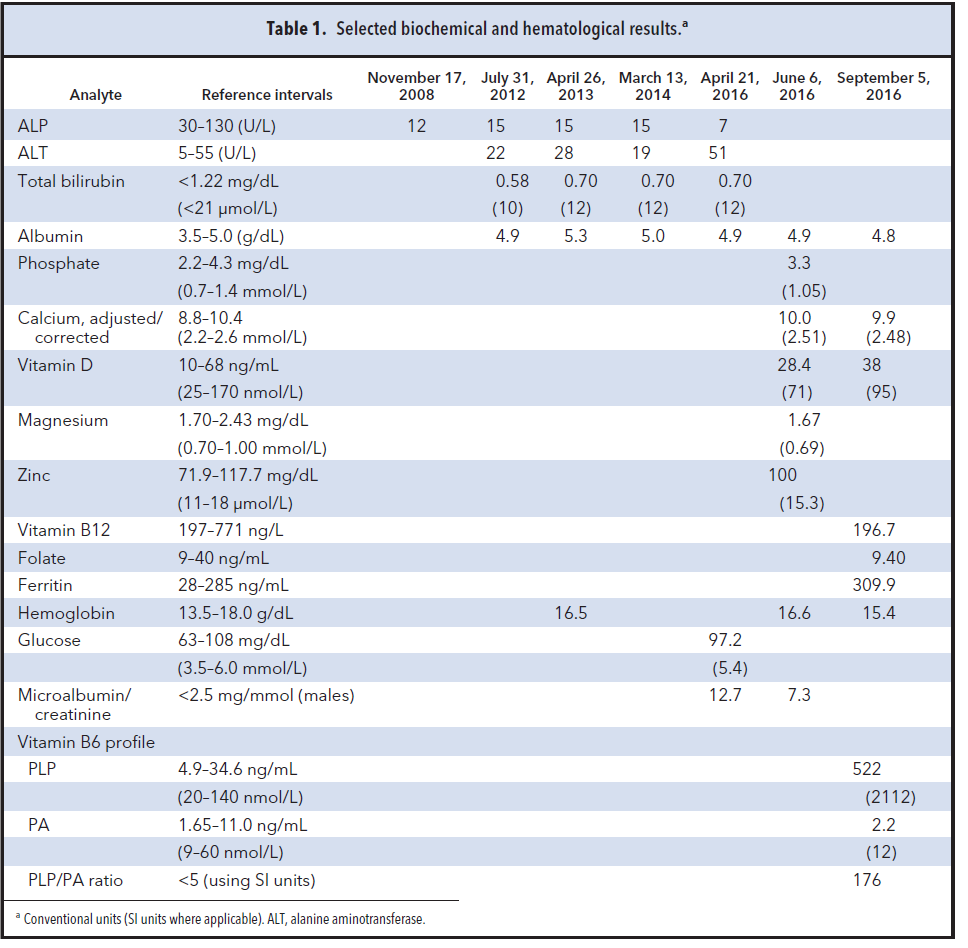
همانگونه که در جدول 1 مشاهده میگردد، مقدار ALP این بیمار در 5 آزمایش جداگانه در طی 8 سال کمتر از محدوده مرجع بوده است. هیچ شواهدی مبنی بر بیماری متابولیک استخوان، هیپوتیروئیدیسم، کمبود ویتامین D و یا اختلال الکترولیتها وجود ندارد.
مقدار منیزیم و ویتامین B12 کمی پائین بوده و مقدار روی (Zinc) طبیعی است. مقدار فریتین افزایش دارد که شاید علت آن بخاطر واکنش مرحله حاد (ناشی از شکستگی) باشد.
در دو آزمایش میکروآلبومینوری گزارش شده است. نشانی از بیماری دیابت مشاهده نمیشود. با توجه به تاریخچه بیمار، پلاسمای او را جهت آزمایشهای پروفایل ویتامین B6 به یک آزمایشگاه اختصاصی ارسال کردیم.
مقدار (PLP) Pyridoxal 5’-phosphate با توجه به اینکه بیمار مکمل ویتامین مصرف نکرده، شدیداً افزایش نشان میدهد و لذا نسبت PLP به (PA) Pyridoxic acid بالا است (حد مرجع کمتر از 5 واحد بینالمللی) (2).
| سؤالاتی که باید در نظر گرفت:
1- علل کاهش فعالیت ALP در سرم چه عواملی میتوانند باشند؟ 2- کاهش ALP چگونه باید مورد بررسی قرار گیرد؟ 3- کدام شرایط بالینی موجب کاهش ALP و افزایش PLP میگردند؟ |
بحث
دلایل کاهش آلکالن فسفاتاز
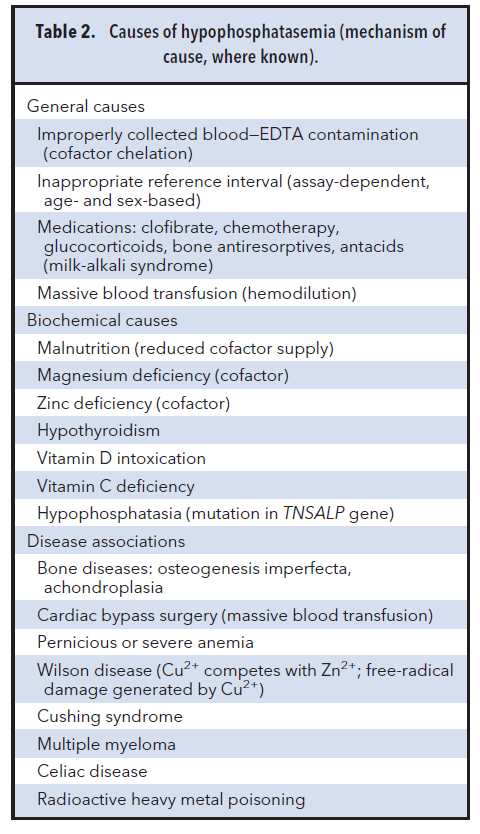
دلایل کاهش آلکالن فسفاتاز در جدول 2 فهرست شدهاند. برای کشف علت کاهش آلکالن فسفاتاز باید رویکردی سیستمیک بهکار گرفت که شروع آن با آزمایشهای متداولتر باشد.
باید توجه داشت که محدوده مرجع ALP به روش آزمایش، سن و جنس بستگی دارد (3). مقدار ALP در نوزادان بالا است که با رشد و رسیدن به دوران بلوغ افزایش هم مییابد و پس از تکمیل رشد به حد افراد بزرگسال تنزل میکند (3). بسیاری از آزمایشگاهها فقط محدوده مرجع بزرگسال را در جواب قید میکنند و بدیهی است که ممکن است نتیجه آزمایش یک کودک یا نوجوان در محدوده مرجع بزرگسال قرار بگیرد، اما درواقع و با توجه به سن بیمار کمتر از حد مرجع باشد. زینک و منیزیم هردو کوفاکتورهای آنزیم ALP هستند و لذا کمبود آنها باید بررسی و آزمایش شود. (4). آلوده شدن نمونه با EDTA میتواند منجر به شلات کردن این دو عنصر و کاهش فعالیت ALP گردد (5). داروهایی همچون antiresorptives استخوان موجب کاهش ALP میشوند (4). در بیمارانی که جراحی قلب باز دارند، مقدار ALP کاهش مییابد (4). علت دقیق این کاهش مشخص نیست و شاید بعلت رقیق شدن خون یا رقیق شدن کوفاکتورها باشد. در یک مطالعه همگروه مشاهده گردید که سوءتغذیه در 26% این مردان موجب کاهش ALP میشود که احتمالاً به علت کمبود کوفاکتورها باشد. (4). در بیماری ویلسون، مس برای اتصال به سایتهای فعال ALP با زینک رقابت میکند و پس از اتصال موجب کاهش فعالیت آنزیم میگردد (6)، علاوه بر این مس با اکسیداسیون آسکوربات ایجاد رادیکالهای آزاد هیدروکسیل میکند که این رادیکالها نیز موجب تخریب ALP میشوند (7). سایر مواردی که در جدول 2 بهعنوان عوامل کاهش ALP ذکر شدهاند از نظر بالینی در مورد این بیمار مصداق ندارند. بعید است که کاهش اندک منیزیم و ویتامین B12 موجب این هیپوفسفاتازمی شده باشند. در مورد این بیمار افزایش PLP همراه با هیپوفسفاتازمی و تاریخچه شکستگیهای متعدد تشخیص (HPP) Hypophosphatasia را مطرح میکند.
(HPP)Hypophosphatasia
وقوع و شیوع:
HPP یک بیماری ارثی متابولیک استخوانی است که در اثر موتاسیون در ژن کدکننده
(TNSALP) alkaline phosphatase tissue-nonspecific isoenzyme of بهوجود میآید (10-8). بیش از 300 موتاسیون TNSALP شناسایی شدهاند که موجب ناهنجاریهایی با دامنه و شدت متغیر میگردند (10). در جنین قبل از تولد انتقال اتوزومال غالب سبب HPP بهصورت ملایم و انتقال اتوزومال مغلوب سبب بیماری کشنده میشود (8). فرم شدید بیماری برحسب منطقه جغرافیایی بین 1 در صدهزار تا 1 در سیصدهزار نفر را مبتلا میکند و فرم متوسط آن در جمعیت اروپایی یک نفر در هر 6370 نفر را درگیر میسازد (10). فرم خفیف ممکن است شایعتر از این حد باشد. (9).
تظاهرات بالینی:
HPP در تمامی سنین امکان بروز دارد و شش فرم متمایز از این بیماری شناسایی شده است (10-8).
Odontohypophosphatasia خفیفترین و شایعترین فرم بیماری است که کودکان و بزرگسالان را درگیر میکند. این فرم از این بیماری موجب تخریب دندانها شده و معمولاً قبل از 5 سال سبب از بین رفتن آنها میگردد. HPPی بزرگسالان معمولاً در میانسالی با درد پا بعلت شکستگی در استخوانهای متاتارسال و یا درد در ناحیه ران به علت شکستگی کاذب فمور تظاهر میکند. در سابقه بیمار ممکن است از بین رفتن زودرس دندان و یا راشیتیزم موجود باشد.
HPP در اطفال تظاهرات مختلفی از جمله ریختن زودهنگام دندان و راشیتیزم، بدشکلی جمجمه و کوتاهی قد و اشکال در راه رفتن دارد. HPP در نوزادان در شش ماه اول تولد به شکل رشد کم، اختلالات تنفسی بهعلت راشیتیزم دندهها، Craniosynostosis به علت افزایش فشار داخل جمجمه، هیپوکلسیمی و تشنج بروز میکند. HPP پریناتال تقریباً همیشه کشنده است که به علت هیپومینرالیزاسیون شدید اسکلتی است. فرم خوشخیم درگیری پریناتال هم گزارش شده است.
پاتوژنز:
مشخصه HPP نقص در مینرالیزه شدن استخوان و دندان است که منجر به ناهنجاریهای اسکلتی و دندانی میشود (10-8).
در این بیماران مقدار ALP کاهش مییابد و هرچه مقدار کاهش بیشتر باشد شدت بیماری بیشتر است (9). کمبود TNSALP منجر به تجمع خارج سلولی مواد مختلفی از جمله پیروفسفات آلی (PPi) میگردد که این ماده با مهار تشکیل کریستال هیدروکسی آپاتایت مانع از مینرالیزاسیون استخوان میگردد. سوبسترای دیگر TNSALP که تجمع مییابد PLP یا همان فرم اصلی ویتامین B6 در گردش خون است. بهطور طبیعی TNSALP موجب هیدرولیز PLP به پیریدوکسال میشود که ماده اخیر قادر به عبور از سد خونی- مغزی است و پس از عبور از این سد مجدداً تبدیل به PLP میگردد و بهعنوان کوآنزیم در ساخت نوروترانسمیترها دخالت میکند (10-8). تجمع PLP در جریان خون موجب کاهش ویتامین B6 در سیستم اعصاب مرکزی شده و در فرمهای شدید منجر به تشنج ناشی از کمبود پیریدوکسین میگردد (8).
فسفواتانولآمین که از تجزیه فسفاتیدیل اینوزیتول گلیکن به دست میآید نیز در HPP افزایش مییابد (10-8).
تشخیص و ویژگیهای بیوشیمیایی
تجمع این مواد در جریان خون تشخیص HPP را ممکن میسازد. PLP مارکر حساس و اختصاصی برای HPP است اما موارد مثبت کاذب در کسانی که مکمل ویتامین B6 مصرف میکنند، دیده میشود (8).
توصیه میشود یک هفته قبل از انجام آزمایش مصرف مکمل قطع گردد (10). برخی از آزمایشگاهها علاوه بر PLP مقدار PA (که متابولیت پیریدوکسال است) و نیز نسبت PLP به PA را هم گزارش میکنند (2). گرچه مقدار فسفواتانولآمین در سرم و ادرار فرد مبتلا به HPP افزایش مییابد، اما مقدار آن به رژیم غذایی، سن و ساعت نمونهگیری وابسته است و در سایر بیماریهای متابولیک استخوان نیز افزایش مییابد (10-8). شناسایی موتاسیون برای تشخیص بیماری ضروری نیست اما درخصوص الگوی توارث و خطر عود، اطلاعاتی را بهدست میدهد و برای مشاوره ژنتیک مفید است (8).
عدم مشارکت مواد معدنی در ساختار استخوان منجر به هیپرکلسمی و هیپرفسفاتمی میشود (8). هیپرکلسمی منجر به هیپرکلسیوری و گاهی سنگ کلیوی بهویژه در نوزادان میشود (8)، علاوه بر این تجمیع PPi ممکن است به کندروکلسینوز، نقرس کاذب و کلسیفیکاسیون بافت منجر شود (10). برعکس در راشیتیزم و استئومالاسی هیپوکلسمی، هیپوفسفاتمی و کمبود ویتامین D وجود دارد.
درمان
تا همین سالهای اخیر هیچ درمان پزشکی تأییدشده برای HPP وجود نداشت. اصلیترین اقدام درمانی کنترل درد و مداخله جراحی بود (10). در سال 2015 ( asfotase alfa (recombinant TNSALP در آمریکا برای بیماران پرهناتال، نوزاد و کودک تأیید گردید و در سال 2016 این دارو در انگلستان فقط برای موارد پرهناتال و نوزاد تأیید شد. درمان با Bisphosphonates که آنالوگ PPi هست موجب افزایش احتمال شکستگی استخوان میگردد و لذا در مبتلایان به HPP ممنوع است (10 و 8). دوزهای درمانی ویتامین D و کلسیم میتوانند هیپرکلسمی و هیپرفسفاتمی را تشدید کرده و لذا از آنها باید اجتناب شود (8).
| نکات قابلتوجه
– کاهش ALP سرم معمولاً مورد غفلت واقع میشود. محدوده مرجع باید برحسب روش آزمایش، سن و جنس تعریف گردد. – در بررسی کاهش ALP عواملی همچون سوءتغذیه، کمبود منیزیم و روی، هیپوتیروئیدیسم، بیماری سلیاک و آنمی پرنیسیوس را مدنظر داشته و یافتههای بیوشیمیایی را با یافتههای بالینی مطابقت دهید. – یک علت نادر کاهش ALP بیماری HPP است که بهسادگی ممکن است نادیده انگاشته شود. HPP در هر سنی ممکن است مشاهده شود اما نوع بالغین آن معمولاً درمیانسالی دیده میشود. – اولین مشخصه آزمایشگاهی HPP کاهش ALP است. برای تأیید تشخیص HPP پروفایل ویتامین B6 را بررسی کنید. افزایش PLP شاخص حساس و ویژهای برای HPP است. – در مبتلایان به HPP، درمان با bisphosphonates ریسک شکستگی استخوان را افزایش میدهد و نباید تجویز گردد. مکملهای ویتامین D و کلسیم هم در این بیماران موجب تشدید هیپرکلسمی میشوند. |
سرانجام بیمار
تشخیص این فرد در میانسالی انجام شد، لذا با HPP بزرگسالان منطبق است. گرچه سوابق وی شکستگیهای متعدد را در کودکی نشان میدهد که بیانگر عدم تشخیص در آن دوره است. شکستگیهای متعدد تأثیر بدی در کارایی بیمار داشته و سبب مراجعه مکرر وی به بخش ارتوپدی شده است.
به لحاظ دربرداشتن هزینه زیاد و نیز مشخص بودن تشخیص، آزمایش ژنتیک برای این بیمار انجام نشد. مقرر شد که فرزندان وی مورد بررسی و معاینه مستمر قرار گیرند. هدف درمان فعلی وی درمان حمایتی و کاهش درد است. متأسفانه داروی asfotase alfaدر سیستم درمانی انگلستان برای بزرگسالان در دسترس نیست و این مسئله سؤالات مهمی را در ارتباط با استفاده از فرصتهای درمانهای نوین در ذهن سیاستگزاران، پزشکان و جامعه برمیانگیزد.
این مقاله ترجمهای است از:
A Man with Recurrent Fractures and Foot Pain
Clinical Chemistry 64:4
639–644 (2018)
منابع:
- Maman E, Borderie D, Roux C, Briot K. Absence of recognition of low alkaline phosphatase
level in a tertiary care hospital. Osteoporos Int 2016;27:1251– 4.
- Talwar D, Quasim T, McMillan DC, Kinsella J, Williamson C, O’Reilly DS. Optimisation
and validation of a sensitive high-performance liquid chromatography assay for routine
measurement of pyridoxal 5-phosphate in human plasma and red cells using pre
column semi-carbazide derivatisation. J Chromat B Analyt Technol Biomed Life Sci
2003;792:333– 43.
- Adeli K, Ceriotti F, Nieuwesteeg M. Reference information for the clinical laboratory.
In: Nader R, Horwarth AR, Wittwer CT, editors. Tietz textbook of clinical chemistry and
molecular diagnostics. 6th Ed. St. Louis (MO): Elsevier; 2018. p. 1778.
- Lum G. Significance of low serum alkaline phosphatase activity in a predominantly
adult male population. Clin Chem 1995;41:515– 8.
- Davidson DF. Effects of contamination of blood specimens with liquid potassium-EDTA
anticoagulant. Ann Clin Biochem 2002;39:273– 80.
- Oosthuizen N. Undetectable serum alkaline phosphatase activity in a patient with
fulminant hepatic failure and hemolytic anemia. Clin Chem 2011;57:382–7.
- Hoshino T, Kumasaka K, Kawano K, Yamagishi F, Koyama I, Fujimori-Arai Y, et al. Low
serum alkaline phosphatase activity associated with severe Wilson’s disease. Is the
breakdown of alkaline phosphatase molecules caused by reactive oxygen species?
Clin Chim Acta 1995;238:91–100.
- Whyte MP. Hypophosphatasia—aetiology, nosology, pathogenesis, diagnosis and
treatment. Nat Rev Endocrinol 2016;12:233– 46.
- Mornet E. Hypophosphatasia. Best Prac Res Clin Rheumatol 2008;22:113–27.
- Whyte MP. Hypophosphatasia: enzyme replacement therapy brings new opportunities
and new challenges. J Bone Miner Res 2017;32:667–75.
برای دانلود پی دی اف برروی لینک زیر کلیک کنید
ورود / ثبت نام