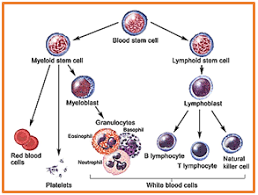
شناسایی عوامل قارچی در نمونههای بالینی به روش ایمونوفلورسانس
دکتر سهیلا محمودپور1، صادق خداویسی2، زینب کاویانی3، فائزه محمدی2
1مسئول فنی آزمایشگاه پاستور، سنندج
2گروه انگل شناسي و قارچ شناسي پزشكي، دانشکده بهداشت، دانشگاه علوم پزشکی تهران
3گروه ایمنولوژی پزشكي، دانشکده پزشکی، دانشگاه علوم پزشکی کردستان
یکی از روشهای تشخیصی در قارچ شناسی پزشکی جهت اندازهگیری میزان آنتیبادی در سرم، مایعات بدن و بافت، استفاده از روش ایمونوفلورسانس (FA) بر پایه مشاهده واکنش آنتیژن– آنتیبادی در زیر میکروسکوپ فلورسنت مجهز به نور فرابنفش میباشد. در این روش، جهت نشاندار کردن آنتیبادی اولیه و یا ثانویه، از ترکیبات فلوروکروم یا فلورسنت مانند فلورسئین، رودامین و فایکواریترین استفاده میشود. این ترکیبات، بدون هیچگونه تأثیری بر روی ویژگی آنتیبادی، به ناحیه FC آنتیبادی متصل شده و باعث ساطع شدن نور رنگی میشوند. فلورسئین با جذب نورآبی 490nm، فلورسنت شدید زرد- سبز با طول موج 517nm را ساطع مینماید و رودامین با جذب نور زرد- سبز 515nm، نور قرمز با طول موج 546nm ساطع میکند. تکنیک ایمونوفلورسانس به دو صورت مستقیم و غیرمستقیم انجام میشود؛ در روش ایمونوفلورسانس مستقیم (DFA)، آنتیبادی اختصاصی (اولیه) مستقیماً با ترکیبات فلوروکروم، کونژوگه میشود ولی در روش ایمونوفلورسانس غیرمستقیم (IFA)، برخلاف روش DFA، آنتیبادی اولیه نشاندار نبوده بلکه از یک آنتیبادی ثانویه نشاندار شده با فلوروکروم برای ردیابی یک پروتئین یا آنتیبادی مورد نظر، استفاده میشود. با توجه به این که در روش IFA، نیازی به کونژوگه نمودن آنتیبادی اولیه با ترکیبات فلوروکروم نيست و چندین مولکول از آنتیبادی ثانویه نشاندار شده به یک مولکول آنتیبادی اولیه متصل میشوند و میزان نور ساطع شده را در جایگاه هر مولکول آنتیبادی اولیه را افزایش میدهند، بنابراین روش IFA نسبت به روش DFAکاربرد بیشتری دارد، اما روش DFA به دلیل سادگی برای تشخیص قارچ در کشت و موارد بالینی بیشتر استفاده میشود.
جهت اندازهگیری میزان آنتیبادی در تشخیص عوامل قارچی با روش ایمونوفلورسانس، نیاز به تهیه نمونه مناسب میباشد. در صورت تهیه برشهای بافتی نازک و غیر متراکم و یا زیاد بودن عوامل قارچی، نیازی به حذف پارافین نيست، در غیر این صورت باید برشهای پارافینه شده را به مدت یک ساعت در محلول تریپسین pH: 7.2)) در دمای 37oC قرار داد. گاهی اوقات جهت بهتر نمایان شدن عوامل قارچی در برشهای بافتی تهیه شده، نیاز به حذف کلسیم داريم که بدین منظور باید نمونه به مدت 2 ساعت در محلول حاوی اسید فرمیک، فرمالین 10% و آب قرار گیرد و پس از آن دو بار با آب مقطر شست و شو داده شود. همچنین میتوان از برشهای بافتی رنگآمیزی شده با H&E، گیمسا و رایت در روش FA استفاده نمود. در این روش با حرارت دادن اسلایدهای رنگآمیزی شده و غوطهور کردن آنها در گزیلول میتوان چسب بر روی اسلایدها را حذف نمود. سپس نمونهها با PBS (pH:7.2) شست و شو شده و در تریپسین 1% حل میگردند و به عنوان برشهای رنگآمیزی نشده دپارافینه استفاده میشوند. باید به این نکته توجه شود که نمیتوان از برشهای بافتی رنگآمیزی شده با PAS، Gridley یا GMS در تکنیک FA استفاده نمود که شاید علت آن اکسیداسیون پلی ساکاریدهای دیواره سلولی و تغییر آنتیژنیسیتی ارگانیسم باشد، بنابراین قادر به واکنش با آنتیبادیهای نشاندار نيست. نتایج مطالعات نشان میدهند که تکنیک ایمونوفلورسانس علاوه بر تشخیص عفونتهای قارچی اخیر، در تشخیص یک عفونت قارچی مربوط به گذشته نیز کاربرد دارد، بنابراین نگهداری طولانی مدت بافتهای فیکس شده در فرمالین، بر روی آنتی ژنیسیته قارچ اثری ندارد.
تهیه محلول کونژوگه جهت رنگآمیزی اختصاصی
از آن جایی که روش ایمونوفلورسانس جهت تشخیص بافتی هیستوپلاسموزیس، روشي ارزشمند است، بنابراین تهیه یک محلول کونژوگه با اختصاصیت بالا بسیار اهمیت دارد. بر اساس مطالعات انجام شده کاربرد محلول آنتیگلوبولین هیستوپلاسما کپسولاتوم نشاندار شده با فلوئورسین که توسط سلولهای مخمری شکل بلاستومیسس درماتیتیدیس جذب سطحی شدهاند، به دلیل عدم رنگ پذیری هیستوپلاسما کپسولاتم واریته کپسولاتم در این محلول کونژوگه و یا رنگ پذیری ضعیف قارچ، محدود میباشد، بنابراین جهت افزایش اختصاصیت محلول کونژوگه هیستوپلاسما کپسولاتوم از آنتیگلوبولینهای هیستوپلاسماکپسولاتم واریته کپسولاتم نشاندار شده که توسط سلولهای کاندیدا آلبیکنس جذب شدهاند استفاده گردید. در این محلول، برخلاف بلاستومایسس درماتیتیدیس و هیستوپلاسما کپسولاتم واریته دوبئزی، اشکال مخمری تمام سروتیپهای هیستوپلاسما کپسولاتم واریته کپسولاتم قدرت رنگ پذیری بالایی دارند. در بسیاری موارد، فرم بافتی هیستوپلاسما کپسولاتم واریته کپسولاتم براساس تفاوتهای مورفولوژیکی از بلاستومایسس درماتیتیدیس افتراق داده میشود. عدم کاربرد ایمونوفلورسانس در تشخیص هیستوپلاسما کپسولاتم واریته کپسولاتم در اولسرهای بهبود یافته یا کلسیفه شده و نیز در ندولهای فیبروزه شده، ارزش این تکنیک را در تشخیص هیستوپلاسما کپسولاتم واریته کپسولاتم محدود مینماید. محلولهای کونژوگه جهت تشخیص فرم بافتی پاراکوکسیدیوئیدس برازیلینسیس نیز تهیه شدهاند که نیاز به بررسیهای بیشتری دارد. برخلاف محلولهای اختصاصی ایمونوفلورسانس، فرم بافتی قارچهای دیمورفیسم، در تهیه محلولهای اختصاصی فرم میسلیال، پیشرفت زیادی نداشته است. علیرغم عدم موفقیت در تولید محلولهای اختصاصی برای گونههای کاندیدا و یا گونههای آسپرژیلوسی، محققین موفق به تولید کونژوگههای اختصاصی جهت افتراق آسپرژیلوس بافتی از سایر قارچهای مشابه شدهاند. همچنین تولید کونژوگه جهت تشخیص پتریلیدیوم (آلشریا) بوئیدی و گونههای ریزوپوس در موارد بالینی همراه با پیشرفتهایی بوده است.
شناسایی تعدادی از عوامل قارچی و اکتینومایستها توسط تکنیک ایمونوفلورسانس
تکنیک ایمونوفلورسانس
جهت تشخیص گونههای پروتوتکا در کشت (شکل شماره 11) و در بافتهای فیکس شده با فرمالین نیز محلولهای اختصاصی تولید شده است. با توجه به اهمیت روش FA جهت تشخیص عوامل اتیولوژیکی اصلی اکتینومایکوزیس، محلولهایی برای رنگآمیزی اختصاصی اکتینومایسس اسرائیلی (3 سروتیپ شناخته شده)، اکتینومایسس ناسلوندی (3 سروتیپ شناخته شده) و اکتینومایسس ویسکوسوس (2 سروتیپ شناخته شده) تولید شدهاند. این کونژوگهها به طور مؤثر برای تشخیص اختصاصی این اکتینومایسسها در کشت و اسمیر نمونههای بالینی کاربرد دارند، به علاوه، آنتیگلوبولینهای نشاندار شده با فلوئورسین، برای رنگآمیزی اختصاصی آراکنیا (اکتینومایسس) پروپونیکا در کشت و نمونههای بالینی تولید شده است (شکل شماره 12). مشکلات قابل توجهی در به کاربردن روش FA برای تشخیص این اکتینومایسسها در برشهای دپارافینه یا بافتهای فیکس شده وجود دارد، بنابراین در حال حاضر این روش برای این هدف توصیه نمیشود.
با توجه به حساسیت و اختصاصیت محلولهای ایمونوفلورسانت در ردیابی و شناسایی عوامل قارچی در نمونههای بالینی، بدون شک تولید این محلولهای کونژوگهای در آینده افزایش خواهند یافت. در حال حاضر به دلیل عدم دسترسی به محلولهای ایمونوفلورسانس تجاری و نیز کمبود تکنسین مجرب و آشنا، تکنیک FA در جهت تشخیص عوامل قارچی استفاده گسترده ای ندارد.
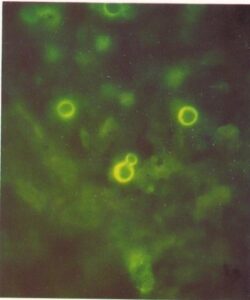
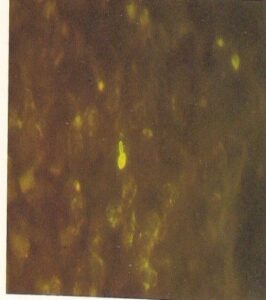
- سلولهای کریپتوکوکوس نئوفورمنس در رسوب نمونه ادرار سانتریفیوژ شده که با آنتیگلوبولین نشاندارشده با فلورسین اختصاصی برای این قارچ رنگآمیزی شده است (240×)
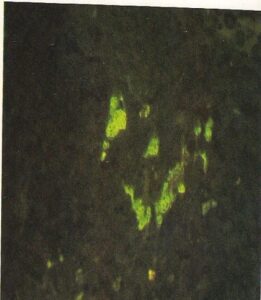
- فرم بافتی سلولهای بلاستومایسس درماتیتیدیس در برش ریه که توسط آنتیگلوبولینهای
اختصاصی نشاندار شده با فلورسین رنگآمیزی شدهاند. یک سلول درحال جوانه زدن است (160×)
- کوکسیدیوئیدس ایمیتیس در برش بافت فرمالینه ریه انسان. دو اسفرول در مرکز فتومیکروگراف شکاف خورده و اندوسپورهای رها شده فلورسنت میشوند. (240×)
- کوکسیدیوئیدس ایمیتیس در سلول اپیتلیوئید گرانولوما از ریه انسان. دو اسفرول خالی با فلورسنس روشن از بافت اطراف متمایز میشود. این اسفرولهای خالی برای کوکسیدیوئیدس ایمیتیس تشخیصی نیستند و از نظر مورفولوژیکی ممکن است با سایر قارچها اشتباه شود، اما به طور مشخص توسط ایمونوفلورسانس قابل تشخيصند. (240×)
- اسپوروتریکس شنکئی. یک سلول درحال جوانه زدن درون یک آبسه کوچک پوستی در انسان دیده میشود. برش پوست با روش اختصاصی FA رنگآمیزی شده است. (384×)
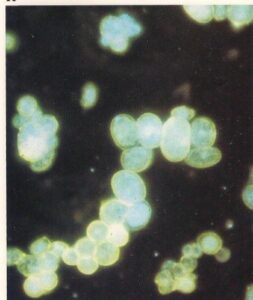
- هیستوپلاسماکپسولاتم واریته کپسولاتم. اجتماع سلولهای مخمری داخل ماکروفاژها در برش از غده لنفی از یک بیمار مبتلا به هیستوپلاسموزیس حاد. سلولها با آنتیگلوبولینهای نشاندار شده با فلورسین مخصوص این قارچ که توسط سلولهای کاندیدا آلبیکنس جذب سطحی شدهاند، رنگآمیزی شده است. (560×)
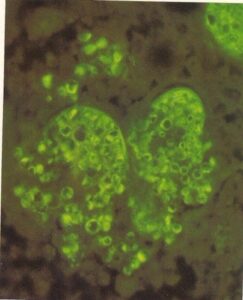
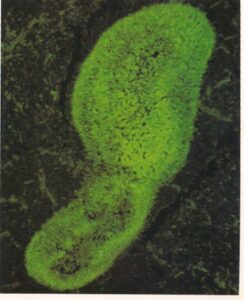
- گونههای کاندیدا. تعداد زیادی سلولهای قارچی در میوکارد بیماری که در اثر بدخیمی خونی فوت کرده است. آنتیگلوبولینهای نشاندارشده با فلورسین اختصاصی برای گونههای کاندیدا برای رنگآمیزی استفاده شده است. نکتهی مهم عدم وجود پاسخ التهابی است. (450×)
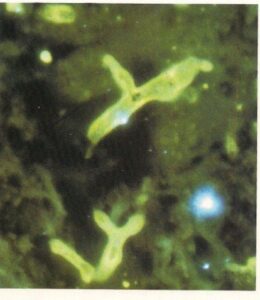
- گرانول پتریلیدیوم (آلشریا) بوئیدی در برش بافت ریه انسان که با آنتیگلوبولینهای نشاندار شده با فلورسین رنگآمیزی شدهاند. (160×)
- پتریلیدیوم بوئیدی. گرانول دیگری در یک برش از ریه انسان که توسط آنتیگلوبولینهای نشاندار شده با فلورسین رنگآمیزی شدهاند. (320×)
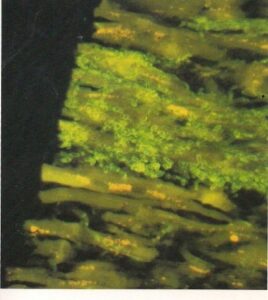
- ریزوپوس اوریزا. هیفهای بدون دیواره عرضی در برش مغز که با آنتیگلوبولین نشاندار شده با فلورسین رنگآمیزی شدهاند. (450×)
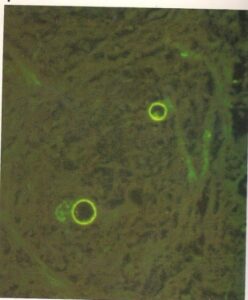
- سلولهای پروتوتکا زوفئی که توسط آنتیگلوبولینهای نشاندار شده با فلورسین اختصاصی رنگآمیزی شدهاند. (570×)
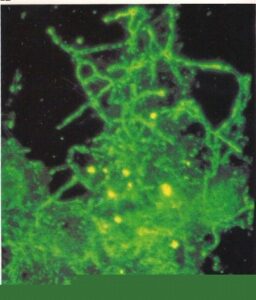
- آراکنیا پروپونیکا. یک اجتماع از رشتهها در یک اسمیر از بافت ریه انسان که توسط آنتیگلوبولین نشاندارشده با فلورسین اختصاصی برای این اکتینومایست رنگآمیزی شده است. (1300×)
منابع:
- Jones G. L, Hebert G. A, Cherry W. B Fluorescent Antibody Technique and Bacterial Applications. DHEW Publication(CDC) .1978; 78-8364.
- Kaplan W, Kraft D E. Demonstration of pathogenic fungi in formalin-fixed tissues by immunofluorescence. Am. J. Clin. Pathol. 1969; 52: 420-437.
- Kaplan W. Practical application of fluorescent antibody producer in medical mycology . In Mycoses, . 1975;304:. 178-185.
- Kafman, L, Blumer S. Development and use of a polyvalent conjugate to differentiate Histoplasma capsulatum and Histoplasma duboisii from other pathogens. J. Bacteriol. 1968; 95: 1243-1246.
- Hotchi M., Schwartz J, Kaplan. W . Limitations of fluorescent antibody staining of Histoplasma capsulatum in tissue sections. Sabouraudia. 1972;10 : 157-163.
- Gordon M. A, Elliott J D, Hawkins T W . Identification of Candida albicans, other Candida species and Torulopsis glabrata by means of immunofluorescence. Saouraudia . 1967;5 : 323-328.
7 . Sudman M S, Kaplan W. Identification of the Prototeca species by immunofluorescence. Appl. Microbiol. .1973; 25 : 981-990.
- Lambert F W,Brown J M. , Georg L K. Identification of actinomyces israelii and actinomyces naeslundii by fluorescent antibody and agar gel diffusion techniques. J. Bacteriol. 1967; 94 : 1287-1295.
- Blank C H, Georg L K .The use of fluorescent antibody methods for the detection and identification of Actinomyces species in clinical material. J. Lab. Clin. Med. 1968; 71 : 283-293.
- Gerencser M A, Slack J M. Isolation and characterization of Actinomyces propionicus. J. Bacteriol. 1967;94 : 109-115.
- Palmer D F, Kaufman L, Kaplan W, Cavallaro J J. Serodiagnosis of Mycotic Disease. Publication. 1977; 236-43.
مروری بر روش هیبریداسیون فلوئورسانس درجا
تشخیص سریع عوامل میکروبی با بیوسنسورها
-
برای دانلود پی دی اف برروی لینک زیر کلیک کنید
ورود / ثبت نام