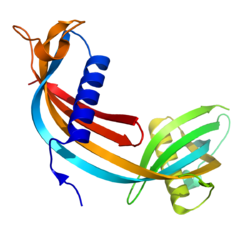سیستاتین C و کاربردهای آن در پزشکی
سیده زهره رزمی1، دکتر غلامرضا اسدی کرم2
- دانشجوی کارشناسی ارشد بیوشیمی، گروه بیوشیمی دانشگاه علوم پزشکی کرمان
- استاد بیوشیمی مرکز تحقیقات فیزیولوژی و گروه بیوشیمی دانشگاه علوم پزشکی کرمان ( نویسنده مسئول)
تلفن 09131406916 و 0341322048 , e-mail: gh_asadi@kmu.ac.ir
تاریخچه و ویژگیها
سیستاتین [1]C یا سیستاتین 3[2]، یک پروتئین غیرگلیکوزیله، با وزن مولکولی پایین13343Da) ) و متشکل از 120 اسید آمینه است [1,2]. نقطه ایزوالکتریک آن نسبتاً بالا (9.3) است. ساختمان سوم این پروتئین متشکل از یک مارپیچ آلفای بزرگ و یک مارپیج آلفای کوچک است که از یک صفحه بتای بزرگ 5 رشتهای موازی ناهمسو میگذرند[3]. این پروتئین ابتدا در سال 1961 در مایع مغزی- نخاعی و ادرار بیماران با نارسایی کلیه کشف شد و گاماتریس نام گرفت. Crubb و Lofberg برای اولین بار توالی اسید آمینهای آن را تعیین کردند[4].
شکل 1: ساختمان سوم سیستاتین C
این پروتئین جزء خانواده بزرگ سیستاتینهاست که عمدتاًٌ فعالیت مهارکنندگی سیستئین پروتئازی دارند. در انسان12 نوع سیستاتین وجود دارد که بر اساس ساختمان مولکولی و توزیع در بدن به سه گروه تقسیم ميشوند:
– سیستاتینهای نوع اول (A و B)، که عمدتاً در داخل سلول وجود دارند.
– سیستاتینهای نوع دوم (C ,D ,E/M ,F ,G ,S ,SN and SA)، که سیستاتینهای خارج سلولی هستند.
– نوع سوم(L and H)، سیستاتینهای داخل عروقی هستند[5].
سیستاتین C که در گروه سیستاتینهای نوع دوم قرار دارد. در بین تمامی اعضای این خانواده بزرگ، منحصر به فرد است و بیشترین مطالعات روی آن صورت گرفته است[1]. سیستاتین C فعالیت مهارکنندگی قابل توجهی در برابر پروتئازهای پاپایین مانند دارد و مانند سایر سیستاتینها یک مهارکننده سیستئین پروتئاز درونی[3] است[5]. سیستاتین C قویترین مهارکننده کاتپسینهای B، H، K و S است که ثابتهای مهاری آن در حدود نانومولار یا حتی کمتر از آن است[6].
سیستئین پروتئازها گروهی از آنزیمهای پروتئولیتیک هستند که پیوندهای پپتیدی را با استفاده از یک ریشه سیستئین در جایگاه فعال آنزیم میشکنند. کاتپسینها گروهی از سیستئین پروتئازهای لیزوزومی هستند که به دنبال آزاد شدن از لیزوزومها در فرآیندهایی از قبیل التهاب و تهاجم تومور نقش بازی میکنند. در حالت کلی سیستئین پروتئازها در فرآیندهای کاتابولیسم پپتیدها و پروتئینها، پردازش پروآنزیمها و پروهورمونها، شکست کلاژن، بازجذب استخوان و پردازش تعداد زیادی از آنتیژنهای ویروسی از جمله HIV- 1 فعالیت دارند. بهرحال فعالیت نامتعادل سیستئین پروتئازهای درونی به بیماریهای مختلفی از قبیل آرتریت روماتوئید، مالتیپل اسکلروزیس، ناهنجاریهای عصبی، تومورها و استئوپورز منجر میشود، بنابراین کنترل دقیق فعالیت پروتئولیتیک سیستئین پروتئازها برای عملکرد صحیح و مناسب سلولها و کل ارگانیسم ضروری است[7,8].
علاوه بر فعالیت مهارکنندگی سیستئین پروتئازی، سیستاتین C در طیف وسیعی از فرآیندهای بیولوژیکی از قبیل القای رشد، التهاب و فعالیتهای ضد ویروسی و ضد میکروبی نقش دارد، لذا میتواند کاربردهای زیادی در پزشکی داشته باشد و ارتباط آن با بسیاری از بیماریها مثل سرطان، دیابت، صرع، بیماریهای کلیه، بیماریهای قلبی- عروقی و بیماریهای تخریب کننده عصبی از قبیل آلزایمر[4]، در حال بررسی است[9]. این مولکول توسط تمام سلولهای هستهدار بدن تولید میشود و در تمام مایعات بدن وجود دارد، اما در سطوح خارج سلولی آن در قسمتهای مختلف تفاوت قابل ملاحظهای وجود دارد و به خصوص در پلاسمای سمینال، مایع مغزی نخاعی و شیر فراوان است[2]. غلظت آن در مایع مغزی –نخاعی و سمینال در حد مایکرو مولار است در حالی که مقدار آن در سرم و بزاق بسیار پایینتر است (جدول 1). بیش از 90% فعالیت مهارکنندگی سیستئین پروتئازی در مایع مغزی –نخاعی مربوط به سیستاتین C است در صورتی که در پلاسمای خون درصد کمی از این فعالیت را به سیستاتین C نسبت میدهند[6].
ژن سیستاتین C، CST3 نامیده میشود. این ژن بر روی بازوی کوچک کروموزوم 20 قرار دارد و متشکل از 3 اگزون و 2 اینترون است. این ژن جزء دسته ژنهای خدمتکار[5] است که به طور متوسط و ثابتی بیان میشود. در جمعیت دو هاپلوتایپ از این ژن معمول است که A و B نامیده میشوند و در اثر جابجایی یک باز در موقعیت 73 از اگزون 1 به وجود میآیند. منطقه جهش در هاپلوتایپ A کد کننده آلانین و در هاپلوتایپ B کد کننده ترئونین است [10,11].
جدول 1- غلظتهای سیستاتین C در مایعات مختلف خارج سلولی در بدن انسان
| مایعات خارج سلولی | غلظت (mg/L)؛ میانگین و محدوده |
| پلاسمای خون | 0/96؛ 1/79- 0/57 |
| مایع مغزی- نخاعی | 5/8؛ 12/5- 3/2 |
| ادرار | 0/095؛ 0/29- 0/033 |
| بزاق | 1/8؛4/8- 0/36 |
| پلاسمای سمینال | 51/0؛ 61/8- 41/2 |
| مایع آمنیوتیک | 1/0؛ 1/4- 0/8 |
| شیر | 3/4؛ 3/9- 2/2 |
همچنین یک جهش نقطهای در CST3، سیستاتینی تولید میکند که به جای لوسین در موقعیت 68 زنجیره اصلی دارای گلوتامـــــــــــــــین است و یک بیماری به نام آنژیوپاتی آمیلوئید سیستاتین C ارثی [6](HCCAA)ايجاد میکند. افراد مبتلا به این بیماری دچار فلج و فراموشی میشوند و در سن سی تا چهل سالگی میمیرند. HCCAA یک بیماری کنفورماسیونی است که در آن مقادیر غیرطبیعی پروتئین تجمع یافته مسئول ایجاد بیماری است. احتمال میرود که از دست رفتن قسمتی از فعالیت سیستئین پروتئازی روی فنوتیپ بیماری اثر میگذارد. شاید بتوان گفت عوارض این بیماری اهمیت عملکرد سیستاتینC را به خصوص در مغز و سیستم عصبی نشان میدهد[5].
کاربردهای سیستاتین C در پزشکی
سیستاتین C و GFR
از نظر عملکرد کلیوی، ویژگی مهم آن، اندازه کوچک و نقطه ایزوالکتریک بالا (pI= 9.3) میباشدکه باعث میشود به سادگی نسبت به پروتئینهای دیگر از گلومرول فیلتر شود. به نظر میرسد غلظت پلاسمایی سیستاتین C، تحت تأثیر حجم عضله، رژیم غذایی یا جنسیت قرار نگیرد. هیچ مسیر حذفی به جز کلیرانس از طریق فیلتراسیون گلومرولی برای این پروتئین وجود ندارد. علاوه بر این، به نظر میرسد سیستاتین C توسط مداخلهگرهای نوری که سنجش کراتینین را تحت تأثیر قرار میدهند، تغییر نمیکند. به دلیل محاسن زیاد این پروتئین، سیستاتین C یک شاخص عالی برای تعیین GFR میباشد. سیستاتین C به خصوص در تعیین دقیق عملکرد کلیوی ضعیف یا متوسط بسیار مفید است. اندازهگیری سیستاتین C ممکن است روش حساس و ویژهتری نسبت به کراتینین پلاسمایی در نشان دادن تغییرات GFR باشد. از معایب کاربرد سیستاتینC در تعیین GFR وابستگی غلظت آن به دوزهای بالای گلوکوکورتیکوئیدها و هورمونهای تیروئیدی میباشد. دوزهای بالای گلوکوکورتیکوئیدها و فعالیت بیشتر تیروئید باعث افزایش در مقدار سیستاتینC میشوند[1,12].
سیستاتین C و آترواسکلروز، چاقی و بیماریهای قلبی- عروقی
پروتئینهای ماتریکس خارج سلولی نظیر کلاژن و الاستین از پروتئینهای مهم مؤثر در ساختار و عملکرد جدار عروق هستند. پروتئولیز ماتریکس خارج سلولی از عوامل ایجاد آترواسکلروز و انیوریسم آئورتیک-شکمی است که در آن چند آنزیم پروتئولیتیک و از جمله کاتپسینها نقش دارند. گزارش شده است که بیان کاتپسینهای K، L و S در سلولهای ماهیچه صاف، سلولهای اندوتلیال و ماکروفاژها در زخمهای آترواسکلروتیک و انیوریسم آئورتیک- شکمی افزایش پیدا میکند. فرآیندهای التهابی که در زمان تشکیل پلاک فعال میشوند از طریق IL- 1β، INF- gamma و TGF-β به طور موضعی اشکال فعال این کاتپسینها را افزایش میدهند. با فعالیت این سیستئین پروتئازها، پروتئینهای کلاژن و الاستین تخریب میشوند و موجبات تغییر دیواره رگ فراهم میآید. از آنجایی که فعالیت این کاتپسینها به وسیله مهارکنندههای درونی که فراوانترین آنها سیستاتینC است تنظیم میشود، اثر این پروتئین در روند بیماریهای آترواسکلروز بررسی شده است. در انسان سیستاتین C تحت شرایط نرمال در عروق بیان میشود اما در زخمهای آترواسکلروتیک و انیوریسم آئورتیک- شکمی، یعنی شرایطی که کاتپسینهای K و S فراوان هستند به شدت کاهش پیدا میکند. این مشاهدات میتواند بیانگر یک نقش آنتیآتروژنیک برای سیستاتین C باشد. با وجود این، مطالعات اپیدمیولوژیک ارتباط مثبتی را بین مقادیر افزایش یافته سیستاتین C و بیماریهای قلبی- عروقی نشان میدهند. احتمال میرود که افزایش سیستاتین C در این شرایط یک مکانیسم جبرانی برای کاهش اثرات آتروژنیک کاتپسینها باشد.
در خیلی از جمعیتها رابطه مستقیم بین BMI و مقدار سیستاتین C سرم مشخص شده است. همچنین افزایش درصد چربی بدن با افزایش سیستاتین C سرم همراه است. مقایسه میزان سیستاتین C در افراد چاق و نرمال افزایش آن را در افراد چاق نشان داده است. با توجه به بیان بالای سیستاتین C در بافت چربی و ترشح فراوان این پروتئین در سلولهای چربی در محیط کشت، به نظر میرسد که این بافت چربی است که در افراد چاق و با وزن بالا مسؤول بالا رفتن غلظت سیستاتین C سرم است. افزایش سیستاتین C شاید یک مکانیسم حفاظتی باشد که از طریق مهار کاتپسینها توسعه بافت چربی را کنترل و تنظیم میکند. کاتپسینها را میتوان به عنوان عوامل خطر جدید بیماریهای قلبی- عروقی در نظر گرفت [13].
سیستاتین C و سرطان
کاتپسینها به عنوان یک دسته از تومورمارکرها محسوب میشوند. بیان و محل کاتپسینهای B و L در تومورها نسبت به بافتهای نرمال تغییر میکند. افزایش بیان کاتپسین B در سرطانهای مختلف از جمله در سینه، کولون، معده، ریه و پروستات مشاهده شده است. نشان داده شده است که عدم تعادل بین کاتپسینها و مهارکنندگان درونی آنها در فرآیندهای ایجاد سرطان، تهاجم تومور و متاستاز نقش دارد[12,14].
در ارتباط با نقش سیستاتین C به عنوان یکی از مهمترین مهارکنندگان کاتپسینها مطالعات مختلفی انجام شده است. برای مثال، نشان داده شده است که افزایش بیان سیستاتین C ویژگیهای متاستاتیک سلولهای ملانوسیت را تغییر میدهد و تحرک و تهاجم آنها را کاهش میدهد[5]. سطوح سرمی کمپلکس Cystatin C/ Cathepsin B در افراد مبتلا به سرطان ریه در مقایسه با افراد سالم کاهش نشان میدهد[14]. رشد سلولهای سرطانی لنف در موشهای آزمایشگاهی با کاهش محتوی سیستاتین C خارج سلولی در تومور و پلاسما همراه بود و درمان با یک داروی آنتیتوموری به افزایش طول زندگی، کاهش سایز تومور و افزایش محتوی سیستاتین C در بافت توموری و پلاسما منجر شد. براساس مطالعات انجام شده اندازهگیری سیستاتین C در بافتهای توموری و پلاسما میتواند به پیشگویی مقدار رشد تومور و ارزیابی کارآیی درمان با آنتیتومورها کمک کند[15].
سیستاتین C، عملکرد مغز و بیماریهای عصبی
تغییرات سطوح سیستاتین C در مایع مغزی- نخاعی در تعدادی از بیماریهای عصبی نشان داده شده است و دارای اهمیت تشخیصی است. بیان سیستاتین C درسلولهای خاصی از مغز افراد مبتلا به آلزایمر افزایش پیدا میکند. همچنین بیان سیستاتین C در هیپوفیزکتومی، تحریکهای کشنده به نخاع حسی، ایسکمی زودگذر مغز، ضربه فتوترومبیک و در القای صرع افزایش پیدا میکند. در نرونهای مغزی رت که در محیط کشت تحت شرایط استرس اکسیداتیو قرار گرفتند نیز افزایش بیان سیستاتین C مشاهده شد.
بیان افزایش یافته سیستاتین C تحت شرایط یاد شده، این سؤال را ایجاد میکند که آیا این افزایش، سبب به وجود آمدن نورودجنراسیون میشود یا اینکه پاسخی درونی و جبرانی است که از فرآیند بیماریزایی جلوگیری یا روند آن را کند میکند[16].
به هر حال اخیراٌ مطالعات زیادی چه به صورت برونتنی (In vitro)و چه به صورت درونتنی (In vivo)، در این زمینه صورت گرفته است که نشان میدهند سیستاتین C اثرات محافظتی را بر سیستم عصبی اعمال میکند. نقش کاتپسینها در مغز افراد مبتلا به آلزایمر نشان داده شده است. بر اساس مطالعات انجام شده مهار فارماکولوژیک کاتپسینها تخریب نورونها را بعد از ایسکمی مغز کاهش میدهد. سیستاتین C به عنوان مهارکننده درونی کاتپسینها میتواند یک نقش محافظت کننده نورونی داشته باشد. سیستاتین C مستقل از فعالیت مهارکنندگی سیستئین پروتئازی خود یک عامل مهم در تکثیر سلولهای عصبی و تمایز سلولهای بنیادی جنینی به سلولهای بنیادی عصبی است. مطالعات همچنین نشان دادهاند که سیستاتین C باعث القای اوتوفاژی در سلولهای عصبی میشود؛ به این معنی که در شرایط پاتولوژیکی از قبیل کمبود غذایی، استرس تغذیهای، هیپوکسی و ایسکمی باعث مقاومت بیشتر سلولها میشود. بررسیهای انجام شده در مورد نقش سیستاتین C در بیماری آلزایمر شرکت آن را در بسیاری از جنبههای بیماری نشان میدهد. بسیاری از مطالعات ابراز میکنند که در دیواره عروق آمیلوئیدی شده و در هسته پلاکهای آمیلوئیدی در مغز افراد مبتلا به آلزایمر، سندرم داون، HCCAA و سکتههای مغزی سیستاتین C با آمیلوئید همراه میگردد. افراد هموزیگوت هاپلوتایپ B ژن سیستاتین C، همان طور که قبلاً نیز بیان شد مقدار سیستاتین C کمتری تولید میکنند و به خصوص در سنین بالای 75 سال در معرض خطر بیشتر ابتلا به بیماری آلزایمر هستند. احتمالاً تغییرات ظریف سیستاتین C در سیستم عصبی مرکزی یا محیطی بر تشکیل رسوبات آمیلوئید تأثیر میگذارند و سیستم را از اثرات سمی آمیلوئید بتای مجتمع حفظ میکنند[16].
لذا با توجه به نتایج مطالعات برونتنی (In vitro) و درونتنی (In vivo) سیستاتین C میتواند به عنوان نامزدی برای ایجاد استراتژیهای درمانی جدید برای جلوگیری و درمان آسیبهای مغزی، بیماری آلزایمر و دیگر اختلالات مرتبط معرفی شود.
:References
1- Filler G, Bfkenkamp A , Hofmann W, Bricon T, Bru C, Grubbf A. Cystatin C as a marker of GFR—history, indications, and future research. Clinical Biochemistry. 2005; 38: 1 – 8.
2- Babiloni C, Benussi L, Binetti G, Bosco P, Busonero G, Cesaretti S, Forno G, Del Percio C, Ferri R, Frisoni G, Roberta G, Rodriguez G, Squitti R, Rossini P. Genotype (cystatin C) and EEG phenotype in Alzheimer disease and mild cognitive impairment: A multicentric study. NeuroImage . 2006; 29; 946-964.
3- Janowski R, Kozak M, Jankowska. “Human cystatin C, an amyloidogenic protein, dimerizes through three-dimensional domain swapping”. Nat. Struct. Biol. 2001; 8: 316–20.
4-Grubb A, Löfberg H. “Human gamma-trace, a basic microprotein: amino acid sequence and presence in the adenohypophysis”. Proc. Natl. Acad. Sci. U.S.A. 1982; 79 : 3024–7.
5-Wallin H, Bjarnadottir M, Vogel L, Wesselius J. Cystatins- Extra and intracellular cysteine proyease inhibitors: High- level secretion and uptake of cystatin C in human neuroblastoma cells. Biochimie . 2010; 92: 1625-1634.
6- Brguljan P, Cimerman N, Human cystatin C. Turkish Journal of Biochemistry–Turk J Biochem. 2007; 32: 95–103.
7-Adeliana S. Oliveira; José Xavier-Filho; Maurcio P. Sales. Cysteine proteinases and cystatins. Braz .Arc. biol. technol. 2003; 46: 91-104.
8- Shah A , Bano B. Cystatins in Health and Diseases. Int J Pept Res Ther . 2009; 15: 43–48.
9- Tizon B, Sahoo S, Yu H, Gauthier1 S, Kumar A, Mohan P,Figliola M, Pawlik M, Grubb A, Uchiyama Y Bandyopadhyay U, Cuervo A, Nixon R, Levy E. Induction of Autophagy by Cystatin C: A Mechanism That Protects Murine Primary Cortical Neurons and Neuronal Cell Lines. Neurons and Neuronal Cell Lines. 2010, 5:
10- Finckh U, Kammer H, Velden J, Michel T, Andersen B, Deng A, Zhang J, Thomsen T. Genetic association of a cystatin C gene polymorphism with late-onset Alzheimer disease. Original contribution. 2000; 57: 1579-1583.
11- Lin C, Wang S, Wu C, Chou L, Kuo Y. The association of a cystatin C gene polymorphism with late –onset Alzheimerُ disease and vascular dementia. Chines Journal of Physiology. 2003; 46: 111-115.
12- Carl B. TIETZ Fundamentals of clinical chemistry. 2008; 482, 883.
13- Lafarge J, Naour N, Clément K, Guerre-Millo M. Cathepsins and cystatin C in atherosclerosis and obesity. Biochimie. 2010; 92: 1580-1586.
14- Strojan P, Oblak I, Svetic B, Smid L, Kos J. Cysteine proteinase inhibitor cystatin C in squamous cell carcinoma of the head and neck: relation to prognosis. Br J Cancer. 2004; 17: 1961–1968.
15- Poteryaeva O, Falameeva O, Zhanaeva S, Svechnikova I, Korolenko T, Kaledin V. Role of Cystatin C and Cysteine Proteinases in the Development of Mouse LS-Lymphosarcoma. Bulletin of experimental biology and medicine. 2001; 132: 675-677.
16- Gauthier S, Kaur G, Mi W, Tizon B, Levy E. Protective mechanisms by cystatin C in neurodegenerative diseases. Front Biosci (Schol Ed). 2011; 1: 541-54.
[1] – Cystatin C
[2] – Cystatin 3
[3] – Endogenous
[4] – Alzheimer
[5] – House keeping genes
[6]-Hereditary cystatin C amyloid angiopathy
سيستاتين C، جايگزيني براي كراتينين
برای دریافت پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام