بررسی میزان استرس اکسیداتیو سرم و مایع آسیت بیماران مبتلا به سیروز کبدی
در شهرستان تبریز
پریسا صمدزاده1، محمد رحمتی یامچی2، همایون دولتخواه3*
1. دانشجوی کارشناسی ارشد بیوشیمی، گروه بیولوژی، دانشکده علوم، دانشگاه آزاد اسلامی واحد اهر
2. دانشیار بیوشیمی بالینی،PhD، گروه بیوشیمی و آزمایشگاههای بالینی، دانشکده پزشکی، دانشگاه علوم پزشکی و خدمات بهداشتی درمانی تبریز
3. *نویسنده رابط، دانشجوی دکتری تخصصی بیوشیمی بالینی، مرکز تحقیقات بیماریهای گوارش و کبد، دانشگاه علوم پزشکی و خدمات بهداشتی درمانی تبریز
چکیده
مقدمه و اهداف: سيروز کبدي حاصل التهاب مزمن بافت کبد است که به دلايل گوناگوني اتفاق میافتد؛ هرگونه التهابي بهصورت کم يا زياد باعث تخريب بافت کبد میشود. یکی از شاخصهای ارزیابی بسیار مفید تعیین کاهش ظرفیت بیوسنتز کبد، بررسی میزان استرس اکسیداتیو در بیماران سیروز کبدی است که معمولاً در بیماریهای مزمن کبدی دچار تغییرات غیرطبیعی میشود، بنابراین هدف اصلی این مطالعه بررسی میزان استرس اکسیداتیو سرم و مایع آسیت در بیماران مبتلا به سیروز کبدی میباشد.
مواد و روشها: اين يك مطالعه تحقيقي از نوع مقطعي بود كه جمعيت هدف آن افراد مبتلا به سيروز کبدی بودند که مايع آسيت آنها عفوني يا غيرعفوني بود. افراد شرکتکننده در این مطالعه 120 نفر بودند که در چهار گروه مجزا بررسی شدند. یک گروه افراد سالم بهعنوان گروه کنترل و سه گروه بهعنوان گروههای مورد، انتخاب شدند. از تمامی افراد دو نمونه خون و از بیماران سیروزی با مایع آسیت، یک نمونه آسیت اخذ شد. در نمونههای خون و مایع آسیت فعالیت آنزیمهای سوپراکسید دیسموتاز و گلوتاتیون پراکسیداز اندازهگیری شد.
نتایج: در گروههای مورد، میزان فعالیت آنزیمهای سوپراکسید دیسموتاز و گلوتاتیون پراکسیداز در گلبولهای قرمز و در مایع آسیت کاهش معنیداری را نشان داد.
بحث و نتیجهگیری: در بیماران با سیروز کبدی، میزان استرس اکسیداتیو افزایش معنیداری را با پیشرفت بیماری نشان میدهد که از این افزایش میتوان بهعنوان یک مارکر سهلالوصول برای مانیتورینگ پیشرفت بیماری استفاده نمود و نیز نشاندهنده آسیب جدی به کبد است که کبد را به سمت اختلالات پیچیدهتر و بدخیمی سوق میدهد.
کلمات کلیدی: سیروز کبدی، مایع آسیت عفونی و غیرعفونی، استرس اکسیداتیو
مقدمه:
سيروز کبدي حاصل التهاب مزمن بافت کبد است که به دلايل گوناگوني اتفاق میافتد؛ هرگونه التهابي بهصورت کم يا زياد باعث تخريب بافت کبد میشود (1)؛ سپس بافتهای تخریبشده بهصورت جبراني بازسازي میشوند (2). ادامه اين فرايند بهطور مزمن و مکرر، ساختار منظم و یکشکل کبد را بینظم و مختل میکند و بهتدریج فيبروز و سفتي کبد و سيروز ايجاد میشود (3). علل عمده سيروز کبدي در ايران شامل هپاتيت B، هپاتيت C و هپاتیت اتوايميون است، ولي داروها و مواد سمي، کبد چرب، بيماري ويلسون، تنگي مجاري صفراوي و انسداد وريدهاي کبدي از علل اصلی اين بيماري میباشند (4).
علائم سيروز کبدي بستگي به مرحله بيماري دارد بهطوریکه در مراحل اوليه، بيماري هیچگونه علائمي ندارد و تنها با آزمايشهاي دقيق، بررسیهای راديولوژيکي و بافتشناسی قابلتشخیص است. بهتدریج که بيماري پيشرفت میکند علائم و عوارض بيماري نيز افزايش مییابد (5).
از علائم بسیار مهم سيروز کبدي آسيت و تجمع مايع در شکم میباشد که به دليل کاهش ميزان آلبومين خون و افزايش سديم و آب در بدن بوجود میآید. اين عارضه باعث تورم پاها و بزرگي شکم میشود. مایع آسیت یک علامت بسیار آشکار حمله سیروزی است که نشاندهنده یک تجمع پاتولوژیک از مایع در حفره صفاقی است. اصطلاح “آسیت” از واژه یونانی “askos” گرفته شده که اشاره به ظاهر شبیه به یک کیسه شراب و یا کیسه دارد که به نظر میرسد معنی مناسبی نیست. تظاهرات بالینی از آسیت از دوران باستان شرح داده شده بود که شرح منطقی و قابل استنتاج در متن پزشکی مصر، Ebers پاپیروس ج. 1550 پیش از میلاد بود (6). دلایل تجمع مایع آسیت سیروزی از تعدادی از فاکتورهای گسترده تشکیل شده که مهمترین آنها عبارت از اختلالات هورمونی و اختلال در نظم سایتوکاین و حجم مرتبط با آن در تنظیم فشارخون سیاهرگی است (7). ایجاد آسیت نقطه عطفی مهم در پیشرفت سیروز است. تجمع مایع آسیت در بیماران با سیروز کبدی شایعترین علت بستری بیماران در بیمارستان است (6). نتایج مطالعات اپیدمیولوژیک در کشورهای مختلف حاکی از افزایش مرگومیر بیماران مبتلا به سیروز کبدی در سالهای اخیر است، بطوریکه چهاردهمین علت رایج مرگومیر در بیشتر کشورهای توسعهیافته بوده اما چهارمین علت مرگومیر در اروپای مرکزی است. حدوداً یک میلیون و سیصد هزار نفر در هر سال در سراسر جهان از این بیماری تلف میشوند (8).
عوارض عمده سیروز شامل فشارخون بالای پورتال، واریسهای مری، هپاتومگالی، آسیت، پریتونیت باکتریایی خودبخودی، آنسفالوپاتی کبدی، سوءتغذیه، اختلال در انعقاد خون، کمبود فاکتور فیبرینولیز، ترومبوسیتوپنی، اختلالات استخوان، استئوپروز، پوکی استخوان، نرمی استخوان، اختلالات خونی، کمخونی، همولیز، نوتروپنی، دیابت، سرطان، نارساییهای قلبی و کلیوی، پانکراتیت و غیره است (4-2).
بیماران مبتلا به سیروز نیازمند بررسیهای بالینی و آزمایشگاهی مستمر برای کنترل سیروز و یا عوارض آن هستند، بااینحال، انتخاب طرح درمان مناسب بستگی به شدت، نوع آسیب کبدی و امکان ارزیابی میزان آن دارد (1). رادیکالهای آزاد بهتنهایی چندان سمی نیستند. اکسیژن مولکولی در قالب گونههای اکسیژن فعال (ROS) یک بخش طبیعی از زندگی هوازی است که مسئول بروز برخی از اعمال سلولی اعم از مسیرهای انتقال سیگنال، دفاع در برابر تهاجم میکروارگانیسمها و بیان ژن بهمنظور ارتقاء رشد و یا مرگ سلولی میباشد (9)، بااینوجود، مقدار بیشازحد از ROS در سلولها بسیار سمی است. استرس اکسیداتیو باعث آسیب به اجزاء بزرگ سلولها مانند پروتئینها، چربیها و DNA میگردد و معمولاً در پاتوژنز بیماریهای مختلف دژنراتیو مانند دیابت، سرطان، اختلالات قلبی و عروقی یا بیماریهای عصبی دخیل میباشد (10 و 9). قرار گرفتن در معرض مقادیر بسیار بالایی از ROS نیز ممکن است به آسیبهای جدی در بدن انسان، مانند اختلالات جدی کبد منجر شود. گذشته از این اثرات مضر، ROS نیز بهعنوان پیامبران ثانویه مولکولی هستند که در پاسخ به عوامل رشد، هورمون، سایتوکاین و ATP خارج سلولی تولید میشوند، ازاینرو نقش عوامل اکسیدان در سلولها بسیار پیچیده است و بستگی به تعادل بین اکسیدانها و سیستم دفاع آنتیاکسیدانی دارد (11). اقدامات حفاظتی در برابر ROS توسط چند آنزیم بسیار مهم آنتیاکسیدانی مانند سوپراکسید دیسموتاز (SOD) و گلوتاتیون پراکسیداز (GPX) و همچنین ترکیباتی مانند توکوفرول، ویتامین E، بتاکاروتن، آسکوربات و گلوتاتیون (GSH) انجام میشود (12). هنگامیکه ظرفیت این سیستم آنتیاکسیدان کاهش مییابد، میزان گونههای اکسیژن فعال افزایش نشان میدهد؛ درنهایت، یک وضعیت خطرناک از حالت استرس اکسیداتیو ایجاد میشود و تأثیرات نامطلوب عوامل اکسیداتیو بروز خواهد کرد (13).
با توجه به نقش بسیار حیاتی استرس اکسیداتیو در بیماریهای کبدی، بررسی میزان سیستم آنتیاکسیدانها بهعنوان یک استراتژی درمانی خوب برای درمان اختلالات کبدی محسوب میشود (10)، ولی متأسفانه تا به امروز، نتایج مطالعه انجامشده برروی میزان دفاع آنتیاکسیدانی بدن در بیماران با اختلالات کبدی بهطور اعم و بیماری سیروز کبدی بهطور اخص، همچنان بینتیجه و بحثبرانگیز باقیمانده است، بنابراین هدف اصلی این تحقیق، بررسی میزان استرس اکسیداتیو در خون و مایع آسیت در بیماران با سیروز کبدی میباشد که این ارزیابی توسط اندازهگیری میزان فعالیت آنزیمهای سوپراکسید دیسموتاز و گلوتاتیون پراکسیداز در خون و مایع آسیت انجام شد
مواد و روشها:
اين تحقیق يك مطالعه مقطعي از نوع مورد شاهدی بود و بيماران موردمطالعه بيماراني بودند كه سيروز كبدي داشته و سيروز در آنها توسط شاخصهای باليني، آزمايشگاهي، آندوسكوپي و سونوگرافي تشخيص داده شد و نيز وجود مايع آسيت در آنها با معاينه باليني و سونوگرافي مشخص گردید و وجود SBP با PMN مايع آسيت بيش از ml /250000 و همچنين كشت مثبت مشخص شد.
افراد موردمطالعه در این تحقيق، در چهار گروه بررسي شدند؛ گروه كنترل (گروه A) كه افراد سالم ازنظر سيروز بوده و بعلت ناراحتیهای گوارشي به کلینیکهای گوارشي مراجعه کرده بودند و بهمنظور تشخيص آلودگي به هليكوباكترپيلوري به آزمايشگاه بهمنظور انجام آزمايش سرولوژيكي Anti-IgG HP ارجاع شدند که درصورت منفي بودن اين تست و با تفهيم اين تحقيق، با گرفتن اجازه از نمونه خون تام ايشان براي اهداف اين مطالعه استفاده شد و گروه بيماران در سه گروه، گروه بیمار سیروزی بدون مایع آسیت (گروه B)، گروه بیمار سیروزی با مايع آسيت و عفونت SBP (گروه C) و گروه بیمار سیروزی با مايع آسيت بدون عفونت SBP (گروه D). از افراد گروههای C و D بيمار یک نمونه خون تام بهمنظور استفاده از گلبولهای قرمز آن برای اندازهگیری فعالیت آنزیمهای سوپراکسید دیسموتاز و گلوتاتیون پراکسیداز و يك نمونه مايع آسيت اخذ شد و از افراد گروه كنترل و گروه بیمار B، یک نمونه خون تام به صورتی که در بالا شرح داده شد، اخذ گردید. نمونههای خون در شرایط ناشتايي دريافت شدند. بر روی نمونههای مايع آسيت گروههای بيمار آزمايش كشت ميكروبي، همچنين شمارش گلبولي و فعالیت آنزیمهای سوپراکسید دیسموتاز و گلوتاتیون پراکسیداز انجام شد. در خون تام فعالیت آنزیمهای سوپراکسید دیسموتاز و گلوتاتیون پراکسیداز بررسی گردید.
معیارهای خروج بیماران:
- بيماران با نارسايي كليوي؛ بدين منظور از تمامي نمونههای خون جمعآوري شده آزمايش اوره و كراتينين انجام شد و درصورتیکه اوره خون بيش از 40 میلیگرم در صد میلیلیتر و كراتينين نيز بيش از 1/2 میلیگرم در صد میلیلیتر بود، از مطالعه حذف گردیدند.
- وجود علائم بیماری دیابت با سابقه قند خون ناشتای بالای 120 میلیگرم در دسی لیتر سرم و هموگلوبین گلیکوزیله بیش از 6/7 درصد.
- وجود نارسایی قلبی که توسط نتایج آزمایشگاهی میزان LDH سرم بیش از IU/L 500، CK-MB سرم بیش از IU/L25 و CTN-I سرم بیش از 1/3 نانوگرم در میلیلیتر، تأیید میشود.
اندازهگیری ميزان فعاليت آنزيم سوپراكسيد ديسموتاز و گلوتاتیون پراکسیداز خون تام و مایع آسیت توسط كيت دستي و كلريمتريك ساخت كارخانه راندوكس انگلیس انجام گرفت.
روش تجزیهوتحلیل دادهها (روشهای آماري):
ابتدا به دلیل مستقل بودن گروههای موردمطالعه، ميانگين نتایج بدستآمده توسط نرمافزار آماری SPSS در هر گروه محاسبه شد و سپس توزیع نرمال بودن نتایج توسط آزمون Shapiro Wilks بررسی گردید که تمامی نتایج توزیع نرمال داشتند، بنابراین نتایج مربوط به مایع آسیت بدلیل اینکه در دو گروه بودند، توسط آزمون Paired Sample t-Test در دو گروه مقایسه شدند و نتایج مربوط به خون تام، بدلیل اینکه در چهار گروه جداگانه بودند، توسط آزمون One-Way ANOVA باهم مقایسه شدند. این آزمونها زمانی معنیدار در نظر گرفته شدند که مقدار p کمتر از 0/05 بود.
نتایج:
مقایسه اطلاعات دموگرافیک بیماران گروههای موردمطالعه:
در جدول 1 اطلاعات دموگرافی بیماران در چهار گروه نشان داده شده است که ازنظر آماری باهم مقایسه شدهاند و همانطوریکه مشاهده میشود، گروههای موردمطالعه ازنظر سن، جنس، فشارخون، میزان هموگلوبین و هماتوکریت، اوره و کراتینین با همدیگر بهخوبی همسانسازی شدهاند (در تمامی موارد 0/05< p).
جدول 1. اطلاعات دموگرافی بیماران گروههای موردمطالعه
|
گروهها
فاکتورهای بالینی |
گروه شاهد
(تعداد 30 نفر) میانگین± انحراف معیار |
گروه مورد A
(تعداد 30 نفر) میانگین± انحراف معیار |
گروه مورد B
(تعداد 30 نفر) میانگین± انحراف معیار |
گروه مورد C
(تعداد 30 نفر) میانگین± انحراف معیار |
مقدار p |
| سن (سال) | 14/42 ± 60/70 | 15/25 ± 63/83 | 9/68 ± 63/66 | 15/52 ± 60/20 | 0/132 |
|
جنس: مرد (64) زن (56) |
14
16 |
16
14 |
17
13 |
17
13 |
0/854 |
| فشارخون سیستولی (mmHg) | 15/86 ± 113/66 | 16/71 ± 115/83 | 16/60 ± 115/00 | 16/77 ± 113/50 | 0/938 |
| فشارخون دیاستولی (mmHg) | 11/50 ± 74/33 | 11/10 ± 75/16 | 12/04 ± 74/16 | 11/89 ± 75/00 | 0/984 |
| اوره (mg/dl) | 37/5 ± 57/93 | 43/58 ± 64/30 | 38/46 ± 51/60 | 33/07 ± 55/73 | 0/673 |
| کراتینین (mg/dl) | 0/38 ± 1/13 | 0/63 ± 1/17 | 0/42 ± 1/06 | 0/56 ± 1/12 | 0/299 |
| هموگلوبین (g/dl) | 1/84 ± 11/40 | 1/90 ± 11/51 | 1/63 ± 12/49 | 1/93 ± 11/79 | 0/100 |
| هماتوکریت (%) | 5/84 ± 35/13 | 5/63 ± 35/59 | 5/05 ± 36/54 | 6/01 ± 35/46 | 0/786 |
مقایسه میانگین میزان فعالیت آنزیمهای سوپراکسید دیسموتاز و گلوتاتیون پراکسیداز خون در چهار گروه موردمطالعه
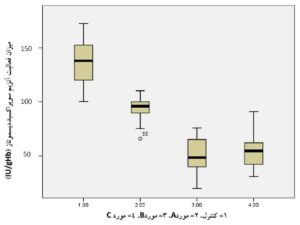
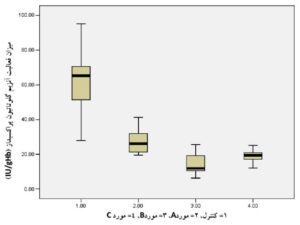
همانطوریکه در جدول 2 و نمودارهای 1 و 2 مشاهده میشود، تفاوت معنیداری در بین میانگین گروههای موردمطالعه مشاهده میشود. توضیح اینکه با استفاده از نرمافـــــــــزار SPSS نسخه 21 و آزمون One-Way ANOVA مشخص گردید که در گروههای مورد، میزان فعالیت آنزیمهای سوپراکسید دیسموتاز و گلوتاتیون پراکسیداز خون در مقایسه با گروه کنترل ازنظر آماری تفاوت معنیداری دارند. نتایج بهصورت میانگین ± انحراف معیار نشان داده شدهاند.
جدول 2) اطلاعات مربوط به مقایسه میانگین میزان فعالیت آنزیمهای سوپراکسید دیسموتاز و گلوتاتیون پراکسیداز در چهار گروه موردمطالعه
| فعالیت آنزیم | n | Mean±SD
(گروه کنترل)
|
Mean±SD
(گروه مورد A) |
Mean±SD
(گروه مورد B) |
Mean±SD
(گروه مورد C) |
p-value |
| سوپراکسید دیسموتاز
(IU/gHb) |
30 | 21/15 ± 136/57 | 9/58 ± 93/78 | 15/62 ± 50/14 | 16/18 ± 54/91 | 0/002 |
|
گلوتاتیون پراکسیداز (IU/gHb) |
30 | 15/75 ± 61/28 | 6/02 ± 26/98 | 5/10 ± 14/01 | 2/64 ± 19/12 | 0/012 |
نمودار 1) منحنی مربوط به مقایسه میانگین فعالیت آنزیم سوپراکسید دیسموتاز در چهار گروه موردمطالعه
نمودار 2) منحنی مربوط به مقایسه میانگین فعالیت آنزیم گلوتاتیون پراکسیداز خون در چهار گروه موردمطالعه
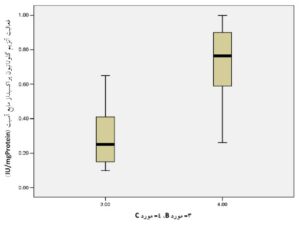
مقایسه میانگین میزان فعالیت آنزیمهای سوپراکسید دیسموتاز و گلوتاتیون پراکسیداز مایع آسیت در دو گروه مورد B و C:
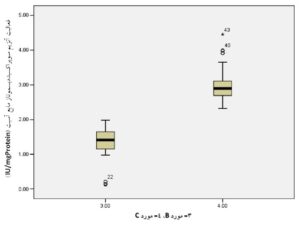
همانطوریکه در جدول 3 و نمودارهای 3 و 4 مشاهده میشود، تفاوت معنیداری در بین میانگین دو گروه مورد B و C دیده میشود. توضیح اینکه با استفاده از نرمافــــــــــزار SPSS نسخه 21 و آزمون Independent Samples t-Test مشخص گردید که در گروههای مورد B و C، میزان فعالیت آنزیمهای سوپراکسید دیسموتاز و گلوتاتیون پراکسیداز مایع آسیت در مقایسه با هم ازنظر آماری تفاوت معنیداری دارند. نتایج بهصورت میانگین ± انحراف معیار نشان داده شدهاند.
جدول 3) اطلاعات مربوط به مقایسه میانگین میزان فعالیت آنزیمهای سوپراکسید دیسموتاز و گلوتاتیون پراکسیداز مایع آسیت در دو گروه مورد B و C
| فعالیت آنزیم | n | Mean±SD
(گروه مورد B) |
Mean±SD (گروه مورد C) |
p-value |
| سوپراکسید دیسموتاز (IU/mgProtein) | 30 | 0/49 ± 1/36 | 0/54 ± 3/02 | 0/0001< |
| گلوتاتیون پراکسیداز (IU/mgProtein) | 30 | 016 ± 0/30 | 0/21 ± 0/71 | 0/0001< |
نمودار 3) منحنی مربوط به مقایسه میانگین فعالیت آنزیم سوپراکسید دیسموتاز مایع آسیت در دو گروه مورد B و C
نمودار 4) منحنی مربوط به مقایسه میانگین فعالیت آنزیم گلوتاتیون پراکسیداز مایع آسیت در دو گروه مورد B و C
بحث:
در انسان سیروز کبدی در هر سنی میتواند ایجاد شود و اغلب باعث عوارض دراز مدت میشود (14). سیروز هشتمین علت مرگومیر در دنیا است، اگر تشخیص کبد منبسط داده شود، آسیت یکی از رایجترین عوارض عمده سیروز است. عوارض دیگر انسفالوپاتی کبدی و خونریزی Variceal است (16-15). تقریباً 50% از بیماران مبتلا به سیروز (پنهانی) هستند؛ یعنی بدون گسترش یکی از این عوارض، آسیت در طول 10 سال از مشاهده پیشرفته میشود. آسیت شایعترین عارضه سیروز است که منجر به بستری در بیمارستان میشود. توسعه تجمع مایع در محیط سیروز نقطه عطف مهمی در روند بیماریهای مزمن کبدی است (17). حدود 15% از بیماران مبتلا به آسیت در یک سال و 42% از آنها در 5 سال از پای درمیآیند. بسیاری از بیماران پس از توسعه آسیت به پیوند کبد ارجاع داده میشوند (18-17).
حالت استرس اکسیداتیو پسزمینه بسیار مهم از اختلالات متعدد کبدی میباشد (19). رادیکالهای آزاد اکسیژن و افزایش آن در دورههایی از التهاب، متابولیسم طبیعی بدن و بیماریهای پرولیفراتیو کبد دیده میشود (20). گونههای اکسیژن فعال (ROS) در درجه اول در میتوکندری و در شبکه آندوپلاسمی سلولهای کبدی از طریق آنزیمهای سیتوکروم P450 تولید میشود (21). در شرایط طبیعی بدن، سلولها با استراتژیهای خاص مولکولی که بهعنوان دفاع آنتیاکسیدانی شناخته میشود، سطح استرس اکسیداتیو را کنترل کرده و تعادل بین اکسیدانها و آنتیاکسیدانها را حفظ میکنند (22). استرس اکسیداتیو نشاندهنده عدم تعادل بین رادیکالهای آزاد و عوامل آنتیاکسیدانی میباشد (23). در اختلالات کبدی، پروتئینها، چربیها و DNA موجود در میان ساختارهای سلولهای کبدی، در درجه اول توسط گونههای فعال اکسیژن تحتتأثیر قرار گرفته و باعث تغییر در ساختار طبیعی آنها میشود (24). این فرایند منجر به ناهنجاریهای ساختاری و عملکردی در کبد میشود (25)؛ بنابراین، در اختلالات کبدی بطور اعم و در سیروز کبدی بطور اخص، پدیده استرس اکسیداتیو و پروفایل لیپیدی باید به چند دلیل بررسی شود: اولاً اینکه استرس اکسیداتیو و میزان پروفایل لیپیدی ممکن است دلایل پاتوژنز اختلالات مختلف کبدی را توضیح دهد، ثانیاً پیگیری مارکرهای اکسیداتیو و پروفایل لیپیدی در بین سلولهای کبدی، پتانسیل لازم برای تشخیص میزان آسیب کبدی و در نهایت مانیتورینگ پاسخ به نمایش دارویی در بیماران با سیروز کبدی را ممکن خواهد ساخت که ما در این مطالعه به این هدف یعنی بررسی میزان استرس اکسیداتیو و پروفایل لیپیدی سرم و مایع آسیت در بیماران با سیروز کبدی دست پیدا کردیم.
فشارخون سیاهرگی عامل اصلی افزایش تولید مایع آسیت در یک بیمار مبتلا به التهاب کبد می باشد که در نتیجه افزایش مقاومت داخل عروقی در نتیجه اتساع عروق احشایی بواسطه افزایش وازودیلاتورهایی مانند نیتریک اکساید ایجاد می شود(26). التهاب شدید کبد (سیروز) براثر تغییر شکل و آسیب ناشی از کبد مزمن و تصلب بافتها اتفاق میافتد. افزایش مقاومت جریان خون سیاهرگی در نتیجه التهاب کبد و حالت عروقی صورت میگیرد که به دلیل افزایش محصولات تنگکننده عروق همانند آنژیوتانسین، آندوتلین، سیسیتین، لوکوترینها و ترومبوکسان است و به افزایش تدریجی فشارخون سیاهرگی، گردش خون رگی و تغییر جهت خون در گردش سیستمی منجر میشود (27). اتساع عروق احشایی بهعنوان عامل افزایش فشارخون سیاهرگی بوده و در نتیجه تولید بیش از حد وازودیلاتورها مانند نیتریک اکساید، کلسیتونین، مواد پپتیدی، کربن مونوکسید و مانابیونویدها ایجاد می شود (29-28).
بنابراین التهاب کبد با تأخیرخون شریانی وابسته به احشاء همراه است که منجر به کاهش حجم گردش خون مؤثر و عدم وجود یک گردش خون پرقدرت ختم میشود. کاهش در حجم گردش خون مؤثر باعث فعالسازی پمپ سدیم کلیه و اختلال در مسیر حفاظتی میشود. تجمع آب و سدیم به آبآوردگی شکم منجر میشود که در اثر مازاد نشست سدیم و آب از عفونت کبدی در حفرهی صفاقی است (30). در جریان بیماری کاهش مرحلهای در روند حجم گردش خون مؤثر باعث انقباض شدید کلیه و کاهش در میزان تصفیه گلومرولی میشود (31). شروع کاردیومیوپاتی سیروزی در نتیجه افزایش رادیکالهای آزاد و اختلال در پروفایل لیپیدی این مشکل را دوچندان میکند. اختلال گردش به نارسایی ارگانها و مرگ ختم میشود (33-32). اطلاعات اخیر پیشنهاد میکند که در التهاب کبد، عفونت باکتریایی بیشتر گرههای لنفاوی مزانتریک را درگیر می کند و تحریک برآیند محصولات سیتوکینی نقش اساسی در مرحله اتساع شریانی را بازی میکند (34). اتساع عروق احشایی و شراکت نتیجهبخش خون در گردش احشایی باعث یک کاهش حجم خون شریانی مؤثر و فشار شریانی میشود. در پاسخ به تغییر در حجم خون شریانی مؤثر و فشار شریانی، گیرندههای فشار وابسته به سیستم عصبی فعال میشود. سیستم رنین-آنژیوتانسین، آلدوسترون و هورمون آنتیدیورتیک باعث احتباس سدیم و آب کبدی میشود (35). بازگرداندن هموستاز در التهاب کبد همچنین با افزایش فشار سینوسی و کاهش فشار پلاسمایی همراه است که باعث افزایش توسعه عفونت کبدی میشود. وقتی ظرفیت لنفاوی کبدی به گردش لنفاوی هپاتیک برمیگردد، سرعت آن زیاد میشود. مازاد لنف در حفره صفاقی ریخته میشود که آبآوردگی شکم را ایجاد میکند (37-36). حجم پلاسمایی خروجی قلبی در مراحل اولیه التهاب کبد افزایش مییابد که عملکرد گردش جبران شده را حفظ میکند، اگرچه کاهش در خروجی قلبی در نتیجه کاردیومیوپاتی سیروزی اتفاق میافتد (39-38). در حالت پیشرفته، التهاب کبد به کاهش حجم خون شریانی و متعاقب آن کاهش فشار خون شریانی کمک میکند. این امر باعث فعال شدن مکانیسم انقباض عروق سیستماتیک میشود که بهطور ویژه بر کلیهها و افزایش گلومرولی و جریان پلاسمایی کلیه تأثیر دارد و در حالت بسیار شدید به پیشرفت آسیب کلیوی منجر میشود که همان سندرم کبدی-کلیوی است (41-40).
در مطالعهای که گالیسیا مورنو و همکاران در سال 2014 (42) بر روی بیماران با سیروز الکلی انجام دادند، گزارش کردند که استرس اکسیداتیو نقش بسیار مهمی در توسعه ضایعات کبدی دارد و در این خصوص بحث کردند که باید مطالعات بسیار گستردهای برروی میزان استرس اکسیداتیو در بیماران سیروزی انجام گیرد تا بتوان از نتایج این مطالعات برای درمان کمکی جهت مقابله با رادیکالهای آزاد در این بیماران استفاده نمود که نتایج بدست آمده در این مطالعه نشان داد که میزان استرس اکسیداتیو (که با میزان فعالیت آنزیمهای سوپراکسید دیسموتاز و گلوتاتیون پراکسیداز بررسی شده است) هم در خون و هم در مایع آسیت، با پیشرفت بیماری و نیز با عفونی شدن مایع آسیت افزایش معنیداری را نشان میدهد و تأییدکننده نتایج گالیسیا مورنو و همکاران (42) میباشد. در مطالعهای که توسط دشپانته و همکاران در سال 2013 (43) انجام شده بود، گزارش کردند که کاهش فعالیت آنزیمهای سوپراکسید دیسموتاز و گلوتاتیون پراکسیداز در گلبولهای قرمز و افزایش میزان مالوندیآلدئید سرم در بیماران با سیروز کبدی در نتیجه مصرف الکل میباشد و ممکن است با پاتوژنز و پیشرفت بیماری کبدی همراه باشد که این سؤال پیش میآید که آیا در بیماران سیروزی که بیماری در نتیجه مصرف الکل ایجاد نشده است نیز چنین حالتی دیده میشود؟ که ما با نتایج بدست آمده در این تحقیق به این سؤال نیز پاسخ دادیم که در سیروز کبدی که بدون مصرف الکل ایجاد شده است نیز میزان فعالیت آنزیمهای سوپراکسید دیسموتاز و گلوتاتیون پراکسیداز هم در داخل گلبولهای قرمز و هم در مایع آسیت کاهش پیدا کرده و از طرف دیگر میزان LDL اکسیده هم در سرم و هم در مایع آسیت بیماران با سیروز کبدی افزایش معنیداری را نشان داده است. این نتایج و نتایج بدست آمده در مطالعه دشپانته و همکاران (43) باهم همخوانی داشته و همدیگر را حمایت میکنند.
نتیجهگیری:
از نتایج بدست آمده در این مطالعه چنین میتوان نتیجهگیری کرد که در بیماران با سیروز کبدی، میزان استرس اکسیداتیو افزایش معنیداری را با پیشرفت بیماری نشان میدهد که از این افزایش میتوان بهعنوان یک مارکر سهلالوصول برای مانیتورینگ پیشرفت بیماری استفاده نمود و نیز نشاندهنده آسیب جدی به کبد است که کبد را به سمت اختلالات پیچیدهتر و بدخیمی سوق میدهد.
References:
- Park BJ, Lee YJ, Lee Chronic liver inflammation: Clinical implications beyond alcoholic liver disease, World J Gastroenterol, 20(9): 2168–2175, 2014.
- Lin J, Wu JF, Zhang Q, Zhang HW, Cao Virus-related liver cirrhosis: Molecular basis and therapeutic options World J Gastroenterol, 20(21): 6457–6469, 2014.
- Stefanescu H, Procopet Noninvasive assessment of portal hypertension in cirrhosis: Liver stiffness and beyond World J Gastroenterol, 20(45): 16811–16819, 2014.
- Imani F, Motavaf M, Safari S, Alavian SM. The therapeutic use of analgesics in patients with liver cirrhosis: a literature review and evidence-based recommendations, 14(10):e23539, 2014.
- Schuppan D, Afdhal Liver Cirrhosis. Lancet, 371(9615): 838–851, 2008.
- Qeisari M, Tavakoli T, Ayatollahi A, Rashtian Unusual Presentation of Angiokeratoma in a Cirrhotic Patient Indian J Dermatol, 59(1): 105–106, 2014.
- Moore CM, Van Thiel Cirrhotic ascites review: Pathophysiology, diagnosis and management World J Hepatol, 5(5): 251–263, 2013.
- Scaglione S, Kliethermes S, Cao G, Shoham D, Durazo R, Luke A, Volk ML. The Epidemiology of Cirrhosis in the United States: A Population-based Study. J Clin Gastroenterol. 2014 Oct 8. [Epub ahead of print].
- Apostolova N, Blas-Garcia A, Esplugues JV. Mitochondria sentencing about cellular life and death: a matter of oxidative stress. Curr Pharm Des, 17:4047–4060, 2011.
- Cichoż-Lach H , Michalak Oxidative stress as a crucial factor in liver diseases World J Gastroenterol, 20(25): 8082–8091, 2014.
- Edeas M, Attaf D, Mailfert AS, Nasu M, Joubet R. Maillard reaction, mitochondria and oxidative stress: potential role of antioxidants. Pathol Biol (Paris) , 58:220–225, 2010.
- Majima HJ, Indo HP, Suenaga S, Matsui H, Yen HC, Ozawa T. Mitochondria as possible pharmaceutical targets for the effects of vitamin E and its homologues in oxidative stress-related diseases. Curr Pharm Des, 17:2190–2195, 2011.
- Mao G, Kraus GA, Kim I, Spurlock ME, Bailey TB, Beitz DC. Effect of a mitochondria-targeted vitamin E derivative on mitochondrial alteration and systemic oxidative stress in mice. Br J Nutr, 106:87–95, 2011.14.
- Zuckerman E, Lanir A, Sabo E, Rozenvald TZ, Matter I, Yeshurun D and Eldar S. Cancer Antigen 125: A sensitive marker of ascites in patients with liver cirrhosis. The Am J Gastro, 94(6): 1613-1618, 1999.15.
- June E. Hall (2009). Guyton and Hall Textbook of Medical Physiology. Twelfth Edition, SAUNDERS, ELSEVIER, USA.
16. Chung C and Iwakir Y. The lymphatic vascular system in liver diseases: its role in ascites formation. Clin Mol Hepatol. 19(2): 99–104, 2013.
17. M F Chen, T L Hwang, and C F Hung. Human liver regeneration after major hepatectomy. A study of liver volume by computed tomography. Ann Surg. 213(3): 227–229, 1991.
18. Schuppan D, Afdhal NH. Liver cirrhosis. Lancet. 8;371(9615):838-51,2008.
19. Vajro P, Hadchouel P, Hadchouel M, Bernard O, Alagille D. Incidence of cirrhosis in children with chronic hepatitis. J Pediatr. 117(3):392-6, 1990.
20. Tajiri K, Tsuneyama K, Miyazono T, Kawai K, Minemura M, Sugiyama T. A Case of Primary Biliary Cirrhosis That Progressed Rapidly after Treatment Involving Rituximab. Case Rep Gastroenterol. 7(1): 195–201, 2013.
21.Singal KA, Anand SB. Recent Trends in the Epidemiology of Alcoholic Liver Disease. Clinical Liver Disease, 2(2), 53-56, 2013.
22. J. L. Boyer, W. Shockcor, and T. C. Mahl. The natural history of primary biliary cirrhosis. Trans Am Clin Climatol Assoc. 103: 157–163, 1992.
23. Gunnarsdottir SA, Olsson R, Olafsson S, Cariglia N, Westin J, Thjódleifsson B, Björnsson E. Liver cirrhosis in Iceland and Sweden: incidence, aetiology and outcomes. Scand J Gastroenterol. 44(8):984-93, 2009.
24.Kim WR, Lindor KD, Locke GR 3rd, Therneau TM, Homburger HA, Batts KP, Yawn BP, Petz JL, Melton LJ 3rd, Dickson ER. Epidemiology and natural history of primary biliary cirrhosis in a US community. Gastroenterology. 119(6):1631-6, 2000.
25. David A Leon, Jim McCambridge. Liver cirrhosis mortality rates in Britain — Authors’ reply. The Lancet. 367(9526): 1900, 2006.
26.Gunnarsdottir SA, Olsson R, Björnsson ES. Characteristics, prognosis and outcome of patients with oesophageal varices in a university hospital in Sweden 1994-1999. Scand J Gastroenterol. 40:1462-1468, 2005.
27.Gunnarsdottir SA, Sadik R, Shev S, Simrén M, Sjövall H, Stotzer PO, Abrahamsson H, Olsson R, Björnsson ES. Small intestinal motility disturbances and bacterial overgrowth in patients with liver cirrhosis and portal hypertension. Am J Gastroenterol. 98:1362-1370, 2003.
28.Grant BF, Dufour MC, Harford TC. Epidemiology of alcoholic liver disease. Semin Liver Dis. 8(1):12-25, 1988.
- Bosetti C, Levi F, Lucchini F, Zatonski WA, Negri E, La Vecchia C. Worldwide mortality from cirrhosis: an update to 2002. J Hepatol, 46(5):827-39, 2007.
- Buhac I, Flesh L, Kishore R. Intraabdominal pressure and resorption of ascites in decompensated liver cirrhosis. J Lab Clin Med, 104(2):264-70, 1984.
- Yokoyama Y, Nimura Y, Nagino M, Bland K I, Chaudry IH. Role of Thromboxane in Producing Hepatic Injury during Hepatic Stress. Arch Surg, 140, 801-807, 2005.
- Roshoid N, Basha M. Biochemical parameters study of serum, an ascetic fluid in decompensate cirrhosis. Academy of Romanian Scientists Annals – Series on Biological Sciences, 1(1), 69-84, 2012.
- Wong F. Cirrhotic cardiomyopathy. Hepatol Int. 3(1): 294–304, 2009.
- Bansal S, Lindenfeld JA, Schrier RW. Sodium Retention in Heart Failure and Cirrhosis: Potential Role of Natriuretic Doses of Mineralocorticoid Antagonist? Circ Heart Fail. 2, 370-376, 2009.
- Mannucci PM, Tripodi A. Hemostatic defects in liver and renal dysfunction. Hematology Am Soc Hematol Educ Program. 2012, 168-173, 2012.
36. Fagundes C, Ginès P. Hepatorenal syndrome: a severe, but treatable, cause of kidney failure in cirrhosis. Am J Kidney Dis. 59(6):874-85, 2012.
- Choi EY, Hwang YM, Lee JY, Choi JI, Choi IS, Jin JY, Ko JS, Kim SJ. Lipid A-associated proteins from Porphyromonas gingivalis stimulate release of nitric oxide by inducing expression of inducible nitric oxide synthase. J Periodontal Res. 42(4):350-60, 2007.38.
- Qureshi MO, Dar FS, Khokhar N. Cancer Antigen-125 as a Marker of Ascites in Patients with Liver Cirrhosis. Journal of the College of Physicians and Surgeons Pakistan. 24 (4): 232-235, 2014.39.
- Coskun U, Ozenirler S, Sancak B, Bukan N. Serum and Ascitic Fluid Nitrates Levels in Patients with Cirrhosis. Clin Chem Acta., 306(1-2):127-32, 2001.40.
- Tietz N W. Textbook of Clinical Chemistry, W B Saunders, Third Edition; 589, 1999.41.
- Bolognesi M, Pascoli MD, Verardo A, Gatta A. Splanchnic vasodilation and hyperdynamic circulatory syndrome in cirrhosis. World J Gastroenterol; 20(10): 2555–2563, 2014.
- Galicia-Moreno M, Gutiérrez-Reyes G. The role of oxidative stress in the development of alcoholic liver disease. Rev Gastroenterol Mex, 79(2):135-44, 2014.
- Deshpande N, Kandi S, Kumar PV, Ramana KV, Muddeshwar M. Effect of Alcohol Consumption on Oxidative Stress Markers and its Role in the Pathogenesis and Progression of Liver Cirrhosis. American Journal of Medical and Biological Research, 1 (4), 99-102, 2013.
اختلالات کبدی و بررسیهای آزمایشگاهی آنها
استرس اکسیداتیو و سیستم دفاع آنتیاکسیدانی
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام