اختلالات غده آدرنال (1)
سندرم کوشینگ
مراد رستمي: کارشناس ارشد بیوشیمی بالینی، دانشگاه علوم پزشكي جندي شاپور اهواز
معصومه جرفی: کارشناس ارشد میکروبشناسی، دانشگاه علوم پزشكي جندي شاپور اهواز
سندرم کوشینگ (Cushing’s syndrome)
مقدمه:
بر روی هر کلیه، یک عدد غده فوقکلیوی (آدرنال) وجود دارد. این غده، یک غده درونریز است و با ترشح هورمونها، سلامت بافتها و اعضای بدن را حفظ میکند. غده فوقکلیه، به بخش داخلی (مدولا) و بخش خارجی (کورتکس) تقسیم میشود.
بخش خارجی، از 3 ناحیه تشکیل شده که به ترتیب از خارج به داخل، گرانولوزا، فاسیکولاتا و رتیکولاریس نام دارند. لایه گرانولوزا مسئول سنتز آلدوسترون (مهمترین مینرالوکورتیکوئید) است که در تنظیم سطح خونی سدیم و پتاسیم نقش دارد. در لایه فاسیکولاتا، سنتز گلوکوکورتیکوئیدها صورت میگیرد که مهمترین آنها، کورتیزول است که بر روی متابولیسم پروتئینها، لیپیدها و بهویژه کربوهیدراتها اثر دارد. لایه رتیکولاریس، علاوه بر سنتز کورتیزول، مسئول تولید مقادیر کم هورمونهای جنسی است.
بیوسنتز گلوکوکورتیکوئیدها:
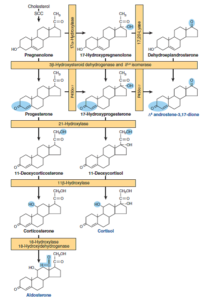
گلوکوکورتیکوئیدها شامل مجموعهای از هورمونهای استروئیدی 21 کربنه هستند که کورتیزول، مهمترین آنها است. هورمونهای تولیدشده در قسمت خارجی (کورتکس) غده فوقکلیه، از کلسترول مشتق میشوند.
تصویر: مسیرهای دخیل در سنتز هورمونهای استروئیدی آدرنال
(مینرالوکورتیکوئیدها، گلوکوکورتیکوئیدها و آندروژنها)
سنتز و کنترل ترشح کورتیزول:
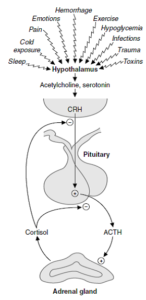
سنتز کورتیزول در کورتکس آدرنال، تحت کنترل ACTH (Adrenocorticotropin hormone) (هورمون آدرنوکورتیکوتروپین) از بخش قدامی غده هیپوفیز صورت میگیرد. ACTH با اتصال به گیرندههای موجود در سطح سلولهای سنتزکننده کورتیزول، موجب افزایش غلظت سیتوزولی cAMP شده که خود از طریق فعالسازی پروتئین کیناز A، منجر به فسفریلاسیون و فعالسازی “پروتئینهای تنظیمکننده حاد سنتز استروژن” (StAR) میشوند.
ACTH دارای هر دو اثر استروئیدوژنیک (سنتز استروژن) و تروفیک (تغییر اندازه سلول) بر روی کورتکس آدرنال است، از این رو تماس مزمن با ACTH موجب هیپرپلازی (افزایش تعداد سلولها) لایههای سنتزکننده کورتیزول (فاسیکولاتا و رتیکولاریس) میشود. برعکس، کمبود ACTH موجب آتروفی (کوچک شدن اندازه سلولها) این لایهها خواهد شد.
ترشح ACTH خود تحت تأثیر CRH (Corticotropin-releasing hormone) (هورمون آزادکننده کورتیکوتروپین) از غده هیپوتالاموس است.
ترشح CRH، ACTH و کورتیزول با یک ریتم شبانهروزی صورت میگیرد. بیشترین مقدار ترشح کورتیزول در اوایل صبح (8-4 صبح) بوده و سپس در طی روز میزان ترشح آن کاهش مییابد. در فردی با چرخه خواب- بیداری طبیعی، کمترین میزان ترشح ACTH، مدت کوتاهی پس از نیمهشب رخ میدهد. ترشح کورتیزول بهصورت ضربانی بوده و تعداد این ضربانهای ترشحی در صبح بیشتر است.
در شرایطی از قبیل استرس، آسیبهای ناشی از جراحی، تروما، عوامل تبزا، هیپوگلیسمی و خونریزی، افزایش حادی در ترشح ACTH و کورتیزول رخ میدهد.
تولید کورتیزول از طریق فیدبک منفی، موجب مهار آزاد شدن CRH و ACTH میگردد. مصرف مقادیر زیاد گلوکوکورتیکوئیدهای اگزوژن (خارجی) نیز از طریق مهار فیدبک منفی بر هیپوتالاموس و هیپوفیز موجب کاهش سطح CRH و ACTH میشوند. در صورت سرکوب طولانی (بیش از چند هفته) گلوکوکورتیکوئیدهای خارجی، ممکن است سرکوب دائمی هیپوفیز و در نتیجه، آتروفی غدد فوقکلیه رخ دهد.
تصویر: نحوه کنترل ترشح کورتیزول توسط CRH و ACTH و مکانیسم فیدبک منفی آن برای تنظیم ترشح خود
انتقال کورتیزول در گردش خون:
حدود 75% کورتیزول موجود در خون به CBG (گلبولین متصلشونده به کورتیزول) و حدود 15% آن به آلبومین متصل میشود. حدود 10% کورتیزول موجود در گردش خون به فرم آزاد وجود دارد.
کاتابولیسم کورتیزول:
اولین مرحله در غیرفعالسازی کورتیزول، اکسیداسیون عامل هیدروکسی کربن شماره 11 به عامل کتونی و تولید کورتیزون است. حدود 1% کورتیزول و کورتیزون بدون تغییر از طریق ادرار دفع میشود، درحالیکه اغلب آنها دستخوش تغییراتی دیگر در کبد (گلوکورونیده شدن و سولفاته شدن) میشوند و سپس از طریق ادرار دفع میگردند.
اغلب متابولیتهای موجود در مسیر سنتز و کاتابولیسم کورتیزول شامل داکسی کورتیکواسترون، مورتیزول، کورتیزون و متابولیتهای احیاء شده آنها، داستروئیدهای 21 کربنهای هستند که دارای 2 گروه هیدروکسی بر روی کربنهای 17 و 21 بوده و به “17- هیدروکسی کورتیکواستروئیدها ” (17-OHCS) موسوم هستند. در بررسی اختلالات متابولیسم گلوکوکورتیکوئیدها از اندازهگیری 17-OHCS استفاده میشود.
تعریف سندرم و بیماری کوشینگ:
سندرم کوشینگ اشاره به بالا بودن سطح کورتیزول (هیپرکورتیزولیسم) به هر دلیل دارد، درحالیکه بیماری کوشینگ اشاره به بالا بودن کورتیزول در نتیجه “آدنومای هیپوفیزی تولیدکننده ACTH” دارد.
شیوع:
وقوع بیماری کوشینگ به میزان 5 تا 25 مورد در هر 1 میلیون نفر در سال است. سایر علل ایجاد سندرم کوشینگ کمتر شایع هستند.
علل ایجادکننده سندرم و بیماری کوشینگ:
سندرم کوشینگ ممکن است وابسته و یا غیروابسته به ACTH باشد.
1- سندرم کوشینگ وابسته به ACTH:
1-1: یکی از شایعترین علل ایجاد سندرم کوشینگ، بیماری کوشینگ (مسئول 70-65% موارد) است. تقریباً تمامی افراد مبتلا به بیماری کوشینگ، آدنومای هیپوفیز دارند. آدنوماها اغلب دارای اندازه کوچک بوده و حتی تکنیک بسیار دقیقی مانند MRI (Magnetic Resonance Imaging)، تنها قادر به تشخیص 50% آنها میباشد.
سلولهای آدنومای هیپوفیز نسبت به سلولهای طبیعی دارای نقطه تنظیمی (Set point) بالاتری برای مهار فیدبکی توسط کورتیزول هستند که همین ویژگی، اساس تشخیصی برخی آزمایشها مانند “مهار سرکوب توسط دگزامتازون” را تشکیل میدهد.
2-1: ترشح اکتوپیک (نابجای) ACTH توسط تومورهای غیرهیپوفیزی تقریباً مسئول 15-10% موارد ایجادکننده سندرم کوشینگ است. طیف وسیعی از تومورها (اغلب کارسینوماها و کمتر سارکوماها و لنفوماها) با ترشح اکتوپیک ACTH مرتبط هستند. شایعترین علل، سلولهای کوچک کارسینوماهای ریه، تومورهای کارسینوئید برونش یا ریه و تومورهای سلولهای جزایر لانگرهانس پانکراس و تیموس هستند.
اغلب سرطانها به سه دسته تقسيم میشوند:
کارسينوما: شامل سرطانهایی میشود که از سلولهایی که سازنده پوست هستند (مثل سرطان پوست) و يا لايه داخلي اعضا را میپوشانند (مثل سرطان ريه) و يا سازنده غدد هستند (مثل سرطان سينه) منشأ میگیرد.
سارکوما: اين دسته سرطانهایی هستند که از بافت همبند مثل غضروف، استخوان و ماهيچه منشأ میگیرند.
لوسمي و لنفوماها: شامل سرطانهایی است که از سلولهای تشکیل دهنده خون و سلولهای ايمني منشأ میگیرد.
ترشح اکتوپیک ACTH، مسئول هیپرپلازی (افزایش تعداد سلولها) و پرکاری (Hyperfunction) دوطرفه “بخش کورتکس غده آدرنال” (آدرنوکورتیکال) است.
3-1: “سندرم نابجای هورمون آزادکننده کورتیکوتروپین” (CRH)، مسئول کمتر از 1% موارد ایجادکننده سندرم کوشینگ است. ترشح CRH توسط تومورهای غیرهیپوتالاموسی، موجب هیپرپلازی هیپوفیز، ترشح زیاد ACTH و هیپرپلازی دوطرفه آدرنوکورتیکال میشود.
2- سندرم کوشینگ غیروابسته به ACTH:
1-2: تومورهای آدرنال (کلیوی) مسئول ایجاد 20-18% موارد سندرم کوشینگ هستند. نکته مهم این است که باید قبل از انجام آزمونهای تصویربرداری آدرنال، از تشخیص بیوشیمیایی مطمئن شویم، زیرا حدود 4% بیماران دارای Incidentaloma (یافتههای تصادفی) هستند.
2-2: سندرم کوشینگ Iatrogenic (ناشی از درمان) یا Factitious (ساختگی)، اغلب در نتیجه مصرف پردنیزون (Prednisone) و یا گلوکوکورتیکوئیدها از قبییل بکلومتازون (Beclomethasone) و فلوسینوولون (Fluocinolone) ایجاد میشود.
گلوکوکورتیکوئیدهای اگزوژنوس (با منشأ خارجی)، از طریق مهار ترشح CRH و ACTH، موجب آتروفی (کوچک شدن اندازه سلول) دوطرفه آدرنوکورتیکال میشوند. سطح ACTH پلاسما و کورتیزول سرم و ادرار همگی پایین هستند.
علائم و نشانههای سندرم کوشینگ:
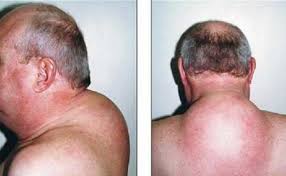
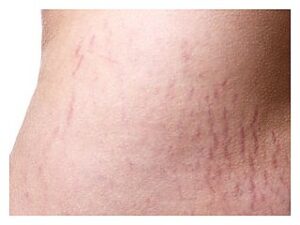
علائم و نشانههای سندرم کوشینگ شامل هیپرتانسیون (افزایش فشارخون)، دیابت ملیتوس نوع II و اختلالات قاعدگی و روانی است. یافتههای معاینه فیزیکی شامل چاقی مرکزی، ضعف عضلانی، خطوط (Striae) ارغوانی پهن، اکیموزهای (لکههای خونریزی زیرپوستی و یا زیرمخاطی) خودبخودی، گرد شدن صورت (Moon face) و تجمع چربی در ناحیۀ پشت (Buffalo hump) است.
|
خطوط (Striae) ارغوانی پهن |
تجمع چربی در ناحیۀ پشت (Buffalo hump) |
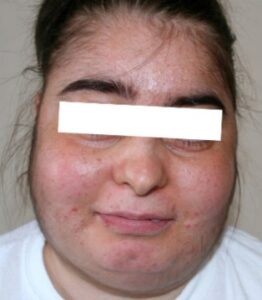
گرد شدن صورت (Moon face) |
یافتههای آزمایشگاهی:
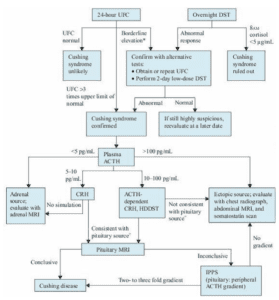
تشخیص سندرم کوشینگ شامل 3 مرحله است (تصویر زیر):
مرحله 1: شک به سندرم کوشینگ بر اساس علائم و نشانههای بیماری
مرحله 2: تأیید حضور مقادیر بالای سطح کورتیزول توسط آزمایشهای بیوشیمیایی
مرحله 3: مشخص کردن این که آیا بالا بودن سطح کورتیزول، وابسته و یا غیروابسته به ACTH است. همچنین اگر بالا بودن سطح کورتیزول وابسته به ACTH است، منشأ تولید ACTH نیز مشخص شود.
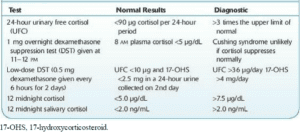
- آزمایشهای خط اول (First line tests) که برای غربالگری سندرم کوشینگ بهکار میروند شامل “کورتیزول آزاد ادرار 24 ساعته”، “کورتیزول بزاق در نیمهشب” و “تست سرکوب دگزامتازون (DST) با دوز پایین شبانه (1 mg)” هستند. برای مثبت تلقی کردن نتیجه غربالگری سندرم کوشینگ، حداقل باید 2 تا از این آزمایشهای خط اول، غیرطبیعی شوند. اندازهگیری سطح کورتیزول آزاد ادرار 24 ساعته و بزاق باید حداقل 2 مرتبه تکرار شوند.
1-1: اندازهگیری دفع کورتیزول آزاد ادرار 24 ساعته (Urinary Free Cortisol ; UFC)، یک اندیس عملی مستقیم و قابلاطمینان از میزان ترشح کورتیزول را فراهم میآورد. افزایش ترشح کورتیزول باعث میشود که میزان کورتیزول از میزان ظرفــیت گلبولین متـصلشــــــــونده به کورتیزول (Cortisol-binding globulin) بیشتر شده و بهصورت کورتیزول آزاد در ادرار دفع شود. دو نکته مهم در این مورد، جمعآوری صحیح ادار 24 ساعته و داشتن محدوده طبیعی قابلاعتماد برای این آزمایش است. مقادیر بالاتر از 4 برابر حد بالای طبیعی، برای سندرم کوشینگ تشخیصی است.
2-1: سطح کورتیزول بزاق در نیمهشب (ساعت 23)، نیز ممکن است به کار رود. بزاق به سهولت جمعآوری میشود و برای چندین روز حتی در دمای اتاق، پایدار است. مقادیر کورتیزول بزاق بیشتر از 2 نانوگرم در میلیلیتر دارای حساسیت 100% و اختصاصیت 96% برای تشخیص سندرم کوشینگ است.
سطح کورتیزول دارای تغییرات روزانه است، بهطوریکه بیشترین غلظت آن در صبح و کمترین غلظت آن در نیمهشب مشاهده میشود. از دست دادن این الگوی تغییرات روزانه و بالا بودن سطح کورتیزول در نیمهشب، یکی از اولین نشانههای پرکاری آدرنال است.
3-1: تست سرکوب دگزامتازون (یک گلوکوکورتیکوئید سنتتیک قوی) با دوز پایین شامل تجویز شبانه (بین ساعت 23 تا 24) 1 میلیگرم دگزامتازون خوراکی و انجام نمونهگیری در صبح روز بعد (ساعت 8 صبح) است. در افراد طبیعی، تجویز دگزامتازون، رفتار کورتیزول را تقلید کرده و منجر به سرکوب ترشح CRH و ACTH و در نتیجه، سرکوب ترشح کورتیزول میشود، درحالیکه در سندرم کوشینگ این سرکوب مختل بوده و سطح کورتیزول بالا خواهد بود، بهعبارتیدیگر، پاسخ طبیعی به تجویز دگزامتازون، سرکوب ترشح کورتیزول خواهد بود، ازاینرو مقادیر بالاتر از 10 میکروگرم در دسیلیتر، برای سندرم کوشینگ تشخیصی است.
- در صورت مثبت شدن تستهای غربالگری، آزمایشهای مرحله دوم که شامل آزمایشهای تأییدی “سرکوب دگزامتازون با دوز پایین دوروزه” (0/5 میلیگرم هر 6 ساعت) و اندازهگیری “کورتیزول پلاسمایی نیمهشب” هستند، انجام میشوند.
1-2: در تست سرکوب دگزامتازون با دوز پایین دوروزه، 0/5 میلیگرم دگزامتازون خوراکی به فواصل هر 6 ساعت یکبار (در مجموع 8 بار) به مدت 2 روز داده میشود. در این آزمایش، 48 ساعت پس از اولین دوز دگزامتازون، کورتیزول سرم را در ساعت 8 صبح اندازهگیری میکنند. در این آزمایش میتوان از جمعآوری ادرار 24 ساعته نیز استفاده کرد؛ بدینصورت که ابتدا ادرار 24 ساعته جمعآوری شده و مقدار پایه کورتیزول ادرار 24 ساعته تعیین میشود. سپس 0/5 میلیگرم دگزامتازون خوراکی به فواصل هر 6 ساعت یکبار به مدت 2 روز به بیمار داده و در روز دوم، ادرار 24 ساعته جمعآوری شده و سطح کورتیزول آن با سطح کورتیزول پایه ادرار مقایسه میشود.
2-2: کورتیزول پلاسمایی نیمهشب به این دلیل است که در افراد چاق و افسرده، سطح کورتیزول در غروب و یا ابتدای شب، بالا (Pseudo-Cushing syndrome) است. این آزمایش باید حداقل در دو نوبت (دو شب) تکرار شود. برای اندازهگیری کورتیزول پلاسمایی نیمهشب، باید از بیمار در هنگام خواب نمونهگیری صورت گیرد. میزان کورتیزول پلاسمایی بالاتر از 7/5 میکروگرم در دسیلیتر برای سندرم کوشینگ، تشخیصی است.
برای اندازهگیری سطح کورتیزول خون در نیمهشب، بیمار باید در بیمارستان بستری شود.
- پس از تأیید تشخیص سندرم کوشینگ، باید تشخیص افتراقی آن انجام و بین 3 علت شایع “تومور هیپوفیز”، “ترشح اکتوپیک ACTH” و “تومور آدرنال” افتراق داده شود. تعیین این که آیا افزایش سطح کورتیزول، وابسته به ACTH (در نتیجه تومورهای تولیدکننده ACTH) است و یا غیروابسته به ACTH (در نتیجه اختلال اولیه آدرنال)، بر مبنای اندازهگیری سطح ACTH پلاسما صورت میگیرد.
1-3: مقادیر ACTH ساعت 8 صبح کمتر از 10 پیکوگرم در میلیلیتر، از سندرم کوشینگ غیروابسته به ACTH و مقادیر ACTH بیشتر از 20 پیکوگرم در میلیلیتر، از سندرم کوشینگ وابسته به ACTH حمایت میکند.
درصورتیکه مقادیر ACTH بین 20 – 10 پیکوگرم در میلیلیتر باشد، ACTH مجدداً پس از آزمایش تحریکی CRH، اندازهگیری میشود.
2-3: اغلب تومورهای هیپوفیزی و تعداد کمی از تومورهای اکتوپیک تولیدکننده ACTH، در نتیجه تحریک توسط CRH بهصورت افزایش ACTH و کورتیزول پلاسمایی پاسخ میدهند، درحالیکه در مبتلایان به کوشینگ آدرنال، این پاسخ بسیار کمتر است.
برای انجام تست تحریکی CRH، در ساعت 8 صبح، 2 نمونه خون به فاصله 5 دقیقه از هم گرفته شده و سطح ACTH و کورتیزول آنها (بهعنوان مقادیر پایه) اندازهگیری میشود. سپس 1 میلیگرم به ازای هر کیلوگرم از وزن بدن و یا در مجموع 100 میلیگرم از CRH گوسفندی سنتتیک (ساختگی) از راه وریدی تزریق میشود، سپس به فواصل هر 15 دقیقه از زمان تزریق، برای مدت 1 ساعت (در زمانهای 15، 30، 45 و 60 دقیقه پس از تزریق CRH) خونگیری انجام میشود. در مبتلایان به بیماری کوشینگ، یک افزایش بیش از 50% در ACTH و متعاقب آن یک افزایش بیش از 20% در کورتیزول مشاهده میشود. در موارد تولید اکتوپیک ACTH و تومورهای آدرنال، اغلب یک پاسخ پهن (Flat) (کمتر) به تزریق CRH مشاهده میشود.
تصویر: الگوریتم بررسی سندرم کوشینگ
*بیماران الکلیسم و یا مبتلا به افسردگی ممکن است دارای سندرم کوشینگ کاذب بوده و نیازمند انجام آزمایش CRH برای بررسی بیشتر هستند.
+ در صورت داشتن منشأ هیپوفیزی، باید پس از تجویز CRH، ACTH افزایش یابد و تولید کورتیزول توسط تست سرکوب دگزامتازون با دوز بالا (HDDST)، کاهش یابد.
ACTH: Adrenocorticotropic hormone; هورمون آدرنوکورتیکوتروپیک
CRH: Corticotropin-releasing hormone; هورمون آزادکننده کورتیکوتروپین
DST: Dexamethasone suppression test; تست سرکوب دگزامتازون
HDDST: High-dose dexamethasone suppression test; تست سرکوب دگزامتازون با دوز بالا
MRI: Magnetic resonance imaging; تصویرسازی رزونانس مغناطیسی
IPPS: Inferior petrosal sinus sampling; نمونهبرداری از سینوس پتروز تحتانی
UFC: Urinary free cortisol; کورتیزول آزاد ادرار
نمونهبرداری از سینوس پتروز تحتانی (IPPS)، یک روش تهاجمی برای جمعآوری نمونه از ورید تغذیهکننده غده هیپوفیز بهمنظور اندازهگیری سطح هورمون ACTH آن و مقایسه آن با سطح هورمون ACTH خون محیطی است. هدف از انجام این کار، تعیین این نکته است که آیا تومور هیپوفیز، مسئول سندرم کوشینگ وابسته به ACTH است و یا خیر. همچنین از IPPS برای تعیین محل تومور در غده هیپوفیز استفاده میشود.
جدول: تستهای رایج تشخیصی سندرم کوشینگ و مقایسه مقادیر طبیعی و تشخیصی آنها با یکدیگر
سایر مطالعات و بررسیها:
اسکن سر، سینه (بهویژه ریهها) و شکم توسط تکنیک “توموگرافی کامپیوتری ” (CT) ممکن است به یافتن تومور احتمالی در آدرنال، هیپوفیز و یا سایر نواحی اکتوپیک کمک کند. تکنیک “تصویربرداری رزونانس مغناطیسی ” (MRI) نیز ممکن است بهمنظور کمک به ارزیابی حضور تومور در غده هیپوفیز و یا آدرنال به کار رود.
اولتراسوند نیز از جمله تکنیکهایی است که ممکن است در این موارد به کار گرفته شود.
هنگامی که سطح ACTH پلاسما کمتر از 5 پیکوگرم در میلیلیتر باشد، تصویربرداری (MRI و CT) از آدرنال اندیکاسیون پیدا میکند. هیپرپلازی دوطرفه آدرنال ممکن است نشاندهنده “وابسته به ACTH بودن” بیماری باشد.
تشخیص منابع اکتوپیک تولیدکننده ACTH، بسیار مشکل است. از آن جایی که بسیاری از این تومورها کارسینوئید بوده و دارای رسپتورهای سوماتواستاتین هســــــــتند، لذا از اسکن Octreotide (Octreotide scan یا Octreoscan) با استفاده از داروی Octreotide (که مشابه سوماتواستاتین است) استفاده میشود. در این روش، داروی Octreotide توسط Indium-111-pentreotide رادیواکتیو، نشاندار شده و از طریق وریدی تزریق میگردد. این داروی نشاندار رادیواکتیو از طریق گردش خون به رسپتورهای سوماتواستاتین در سلولهای توموری متصل شده و توسط یک وسیله اندازهگیری رادیواکتیویته، محل تومور را که با سایر روشهای معمول قابلردیابی نیست، توسط رسم تصاویری در بدن نشان میدهد. این روش به نام somatostatin receptor scintigraphy (SRS) نیز نامیده میشود.
References:
1- Arneson W, Brickell J. Clinical chemistry; a laboratory perspective. 2007.
2- Pagana KD and Pagana TJ. Diagnostic and laboratory test refrence. 2015; 12th edition.
3-Kasper DL, Fauci AS, Hauser SL, Longo DL, Jameson JL, Loscalzo J. Harrison’s principles of internal medicine. 2015; 19th edition.
4- Crook MA. Clinical biochemistry and metabolic medicine. 2012; 8th edition.
5-Rodwell VW, Bender DA, Botham KM, Kennelly PJ, Weil PA. Harper’s illustrated biochemistry. 2015; 30th edition.
6- Smith CS, Marks AD, Lieberman M. Marks basic medical biochemistry. 2012; 4th edition.
7-Williamson MA, Snyder LM. Wallasch’s interpretation of diagnostic tests. 2015; 10th edition.
8- Chatterjea MN, Chawla R. Clinical chemistry. 2010; 2nd edition.
9- محمدی رضا. هورمونشناسی تئوری. 1392. چاپ اول
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام