سندرم لش- نیهان
Lesch-Nyhan Syndrome
شاهین اسعدی*، فرح قاسم پور، محبوبه عبدلی، وحید قربانی، خاطره غریبه (دانشجویان ژنتیک مولکولی)- دکتر علی نظیرزاده متخصص ژنتیک استادیار دانشگاه
*نویسنده مسئول: شاهین اسعدی
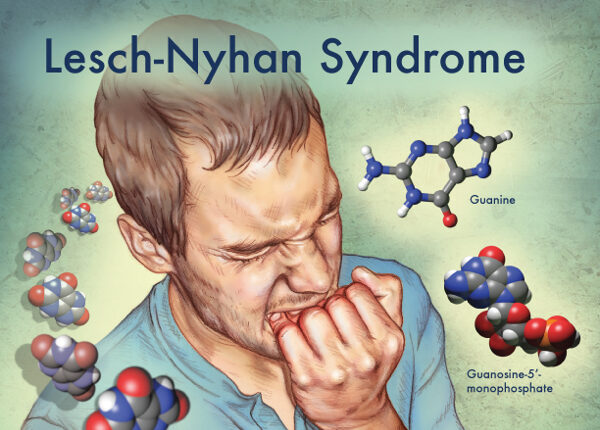
سندرم لش- نیهان به عنوان سندرم نقرس نوجوانان شناخته شده است که یک اختلال نادر به ارث رسیده ناشی از کمبود آنزیم هیپوگزانتین گوانین فسفوریبوزیل ترانسفراز است. این سندرم در اثر جهش در ژن HGPRT واقع در کروموزوم X میباشد که از الگوی توارثی وابسته به X مغلوب پیروی میکند. میزان شیوع LNS یک در 380000 تولد زنده میباشد. این اختلال برای اولین بار در سال 1964 توسط مایکل لش دانشجوی پزشکی و ویلیام نیهان متخصص اطفال شناخته شد.
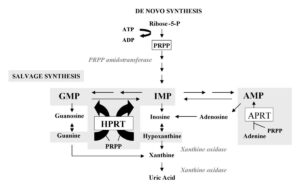
کمبود ژن HGPRT باعث ساخت اسید اوریک در تمام مایعات بدن میشود در این حالت هایپروارسمی و هایپراوریکوسوری دیده میشود که شامل مشکلات شدید کلیهها همراه با نقرس میباشد. نشانههای عصبی شامل کنترل ضعیف عضلات و ناتوانی ذهنی بصورت متوسط میباشد.
این عوارض معمولاً در سال اول زندگی ظاهر میشوند. در آغاز سال دوم زندگی، یکی از ویژگیهای بخصوص قابلتوجه از LNS، رفتارهای خودآزاری و حساسیت به یک رفتار خاص مانند گاز گرفتن شدید لب و انگشتان دست میباشد که در افراد مبتلا به این بیماری دیده میشود. علائم عصبی نیز شامل استرسهای بیجا، نوشتن غیر ارادی بر روی کاغذ یا هر وسیله دیگر و حرکات تکراری از دستها و پاها است که مشابه همین رفتارها در بیماری هانتیگتون نیز دیده میشود. خاطرنشان شویم که کمبود یا عدم بیان ژن HGPRT منجر به کمبود ویتامین B12 در بدن میشود و همین امر ممکن است در برخی از فرزندان پسر، کمخونی مگالوبلاستیک را سبب شود. LNS یک بیماری مغلوب وابسته به X است. جهش در ژن مربوطه معمولاً در مادر ایجاد میشود و مادر بیماری را به پسران منتقل میکند، هر چند یک سوم از تمام موارد بوجود آمده این اختلال سابقه خانوادگی نداشته و در اثر عوامل تراتوژنیک، جهش نیز ایجاد میشود. LNS اکثراً نوزادان پسر را درگیر میکند که همراه با مشکلات شدید روحی و جسمی است و تنها تعداد محدودی از زنان را در جهان مبتلا میسازد.
علائم و نشانههای سندرم لش- نیهان
علائم ناشی از تجمع اسید اوریک ( نقرس و علائم کلیوی ) منجر به کندذهنی و اختلالات رفتاری میشود که هیچ درمانی برای آن وجود ندارد و بیماران تا بزرگسالی نیز زندگی میکنند.
اختلال عملکرد عصبی و رفتاری از جمله قطع عضوی مانند انگشت به دست خود بیماران و تولید بیش از حد اسید اوریک، بطور عمده سه نشانه اصلی برای تشخیص LNS هستند. برخی از افراد ممکن است به کمخونی ماکروسیتیک نیز مبتلا شوند. تقریباً تمام بیماران مرد هستند و مردان مبتلا از تأخیر در رشد و بلوغ و آتروفی بیضه رنج میبرند. زنان حامل ژن جهش یافته HGPRT در افزایش خطر ابتلا به آرتروز نقرسی هستند اما به دلیل اینکه زنان دارای دو کروموزوم X هستند و همیشه نسخه جهشیافته این ژن در یکی از کروموزومها نهفته است، بنابراین نسخه سالم همین ژن در کروموزوم X دیگر اثر منفی بیماری را میپوشاند و زنان به عنوان حامل بیماری میباشند، اما در مردان چون دارای یک کروموزوم X هستند که آن را از مادر به ارث بردهاند، چنانچه که ژن HGPRT در کروموزوم X مردان دارای جهش به سندرم لش- نیهان باشد، اثرات فنوتیپی آنرا نشان خواهند داد.
تولید بیش از حد اسید اوریک:
یکی از اولین علائم افزایش اسید اوریک، حضور کریستال مانند شن و ماسه در پوشک نوزادان مبتلا است. تولید بیش از اسید اوریک ممکن است به توسعه بلورهای اسید اوریک و یا سنگ در کلیهها و مثانه منجر شود که باعث نقرس و تورم مفاصل میشود. تولید بیش از حد اسید اوریک در زمان تولد است اما ممکن است با روشهای تست آزمایشگاه بالینی نتوان آن را در همان زمان تولد تشخیص داد. غلظت اسیداوریک در سرم مبتلایان اغلب غیرطبیعی است و این به دلیل حذف بیش از حد پورین در ادرار است. کریستال معمولاً به عنوان یک ماده دانهدار نارنجی به نظر میرسد یا به شکل سنگ کوچک دیده میشود که باعث هماچوری (خون در ادرار ) و افزایش خطر ابتلا به به عفونت دستگاه ادراری میشود.
اختلال سیستم عصبی
دوره تولد به طور معمول در افراد مبتلا به LNS طبیعی است. شایعترین اختلالات هیپوتونی و تأخیر رشدی است که از سه تا شش ماهگی مشهود است. نوزادان مبتلا به این بیماری بصورت خزیده راه میروند و در ایستادن بر روی دو پا ناتوانند. در چند سال اول زندگی دخالت اکستراپیرامیدال باعث انقباضات غیرطبیعی و غیرارادی عضلانی مانند دیستونی و اجرای حرکات ناشایست بصورت غیر ارادی و همینطور کمانپیکری در ستون فقرات مبتلایان به LNS میشود. این افراد تا آخر عمر بایستی از صندلی چرخدار جهت حرکت کردن استفاده کنند.
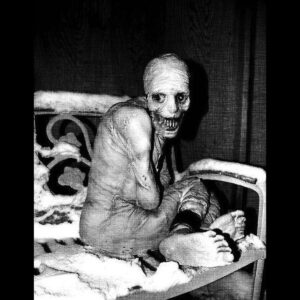
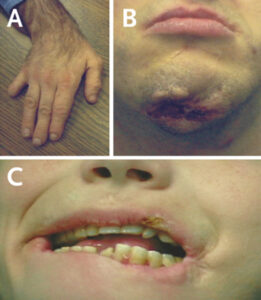
عکس فوق قدیمیترین تصویر از یک مرد مبتلا به LNS را نشان میدهد که به دلیل اختلال عصبی شدید دست و پاهایش را بستهاند. به چهره غیرطبیعی و اندام غیرطبیعی فرد مبتلا توجه کنید
رفتار خودآزاری در سندرم لش- نیهان
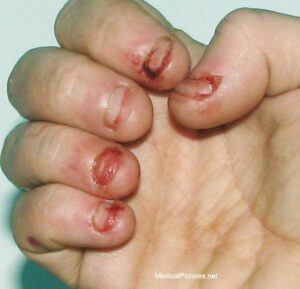
اختلالات رفتاری مبنی بر خود را زخمی کردن در دو تا سه سال پس از تولد بیماران نمایان میشود. آسیب مرتبط با LNS غیرقابل کنترل بوده و معمولاً از سه سالگی آغاز می شود. آسیب به خود با گاز گرفتن لب و زبان آغاز میشود و در نوع پیشرفتهتر جویدن انگشتان دست و کوبیدن سر به دیوار بصورت غیرارادی دیده میشود. خودآزاری یکی از ویژگیهای متمایز این بیماری است که در 85 درصد از مردان مبتلا آشکار است و در زمان استرس میزان خودآسیبی افزایش پیدا میکند. در این افراد پرخاشگری بیمورد و ادای سوگند بیجا به صورت غیرارادی دیده میشود.
LNS در زنان
در حالیکه زن حامل بطور کلی بدون علامت است اما در برخی موارد در زنان حامل منجر به افزایش دفع اسید اوریک شده و یا علائم هایپراورسمی دیده میشود و ممکن است از بیماری نقرس رنج ببرند. تست بالینی در این زمینه هیچ نتیجهای ندارد اما میتواند امکان انتقال صفت بیماری به فرزند پسر را فاش کند.
تشخیص سندرم لش- نیهان
LNS توسط سه معیار اصلی تولید بیش از اسید اوریک، اختلالات عصبی و اختلالات شناختی و رفتاری در مبتلایان تشخیص داده میشود. وجود علائمی مانند تأخیر در رشد، سنگ کلیه و خون در ادرار (هماچوری) میتوانند نشان دهنده سندرم لش- نیهان باشند. گاز گرفتن انگشتان دست و لب یکی از ویژگیهای قطعی سندرم لش- نیهان است.
افراد مبتلا به سندرم لش- نیهان همیشه بایستی تحت مراقبت باشند و به همین منظور همیشه این افراد در صندلی چرخدار خود بصورت دست و پای بسته زندگی میکنند چرا که آزاد بودن دستها منجر به خودآسیبی شدید در این افراد خواهد شد. هم در کودکان و هم در بزرگسالان بایستی مراقبت از نزدیک صورت پذیرد.
روش تست سندرم لش- نیهان
آزمایش ژنتیک مولکولی مؤثرترین روش تست است که میتواند ژن HGPRT1 را که تنها ژن شناخته شده همراه با LNS است مبنی بر دارا بودن جهش شناسایی کند. تجزیه و تحلیل توالی mRNA این ژن میتواند به منظور تشخیص جهش در ژن HGPRT1 در مردان مبتلا به سندرم لش- نیهان استفاده شود. رایجترین تست، PCR است که میتواند 9 اگزون از این ژن را شناسایی کند، اگر تعداد بیشتری از اگزونها در ژن هدف موجود باشند از روش Multiplex PCR استفاده میشود.
ژنتیک مولکولی سندرم لش- نیهان
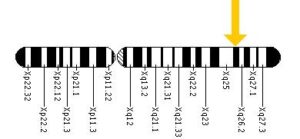
ژن جهشیافته این سندرم در بازوی بلند کروموزوم جنسی X بصورت Xq26.2 مستقر است که نام آن HGPRT میباشد. این ژن آنزیم هیپوگزانتین-گوانین فسفوریبوزیل ترانسفراز را کد میکند و این آنزیم در مسیرهای بیوشیمیایی بدن برای تولید پورین یکی از اجزای مولکول DNA یا RNA را درگیر میسازد. نقص این آنزیم منجر به افزایش اسید اوریک میشود.
مسیرهای درمانی سندرم لش- نیهان
نقرس را میتوان با آلوپورینول برای کنترل مقادیر بیش از حد اسید اوریک درمان کرد. سنگ کلیه را میتوان با امواج شوک یا پرتوهای لیزر درمان کرد. هیچ درمان استاندارد برای علائم عصبی LNS وجود ندارد، چرا که سلولهای عصبی همانند سلولهای عضلانی و اسکلتی و ماهیچهای تنها یکبار سنتز میشوند. در بعضی موارد ممکن است از داروهایی مانند دوپامین، لوودویا، دیازپام، فنوباربیتال و یا هالوپریدول جهت آرامبخشی به مبتلایان استفاده شود. درمان برای مبتلایان به LNS عبارتند از استفاده صحیح از دستگاه محافظ برای جلوگیری از خودآسیبی بیماران، استفاده از روشهای رفتاری صحیح و مناسب بطوریکه نباید بیماران را مورد خشم و پرخاشگری قرار داد و همیشه بایستی با مهربانی و لطافت با این بیماران برخورد کرد؛ چرا که هیجان و استرس برای این بیماران بسیار خطرناک است و گاهی اوقات هم با استفاده از دارو، میتوان رنج این بیماران را تخفیف داد.
فرجام سخن
در مقاله فوق مختصری با سندرم لش- نیهان آشنا شدیم، طبق مطالب ذکر شده عمدهترین مشکل بیماران لش- نیهان اختلالات عصبی در آنها است که به خاطر علائم بیماری مانند تأخیر در رشد یا بلوغ و یا عدم حفظ تعادل بر روی دوپا باعث پریشان شدن افکار در این بیماران میشود، به عبارتی مبتلایان به این سندرم قادر به درک واقعیت بیماری خودشان نیستند و همین امر منجر به افزایش خودآسیبی غیرارادی در آنها میشود.
:References
- James، William D.; Berger، Timothy G.; et al. (2006). Andrews’ Diseases of the Skin: clinical Dermatology. Saunders Elsevier. p. 546.
- Hladnik U، Nyhan WL، Bertelli M (September 2008). “Variable expression of HPRT deficiency in 5 members of a family with the same mutation”. Arch. Neurol. 65 (9): 1240–3.
- Visser J، Smith D، Moy S، Breese G، Friedmann T، Rothstein J، Jinnah H (2002). “Oxidative stress and dopamine deficiency in a genetic mouse model of Lesch-Nyhan disease”. Brain Res Dev Brain Res 133 (2): 127–39.
- Breese GR، Knapp DJ، Criswell HE، Moy SS، Papadeas ST، Blake BL (2005). “The neonate-6-hydroxydopamine-lesioned rat: a model for clinical neuroscience and neurobiological principles”. Brain Res. Brain Res. Rev. 48 (1): 57–73.
- Deutsch SI، Long KD، Rosse RB، Mastropaolo J، Eller J. (Jan–Feb 2005). “Hypothesized deficiency of guanine-based purines may contribute to abnormalities of neurodevelopment، neuromodulation، and neurotransmission in Lesch-Nyhan syndrome”. Clin Neuropharmacol. 28 (1): 28–37.
- de Brouwer AP، Williams KL، Duley JA، van Kuilenburg AB، Nabuurs SB، Egmont-Petersen M، Lugtenberg D، Zoetekouw L، Banning MJ، Roeffen M، Hamel BC، Weaving L، Ouvrier RA، Donald JA، Wevers RA، Christodoulou J، van Bokhoven H. (September 2007).
- Glick N (October 2006). “Dramatic reduction in self-injury in Lesch-Nyhan disease following S-adenosylmethionine administration”. J. Inherit. Metab. Dis. 29 (5): 687.
- Kudo M، Moteki T، Sasaki T، Konno Y، Ujiie S، Onose A، Mizugaki M، Ishikawa M، Hiratsuka M. (March 2008). “Functional characterization of human xanthine oxidase allelic variants”. Pharmacogenet Genomics. 18 (3): 243–51.
- Bavaresco C، Chiarani F، Matté C، Wajner M، Netto C، de Souza Wyse A (2005). “Effect of hypoxanthine on Na+،K+-ATPase activity and some parameters of oxidative stress in rat striatum”. Brain Res 1041 (2): 198–204.
- Seegmiller JE، Rosenbloom FM، Kelley WN (1967).
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام