مورفولوژی و عملکرد سلولهای استخوانی
فاطمه محمدعلی1، دکتر سعید آبرون2
1- دانشجوی دکترای تخصصی هماتولوژی- دانشگاه تربیت مدرس
2- دانشیار گروه هماتولوژی- دانشگاه تربیت مدرس
مقدمه
بافت استخوان يك نوع بافت همبند اختصاصي و بشدت سازمانیافته است كه از سلولهای مختلفي تشكيل شده كه در آن اجزاء خارج سلولي كلسيفيه شده و مادهاي سخت و مقاوم را بوجود آوردهاند. اين بافت با تمام سختي خاصيت الاستيسيته دارد و با وجود سختي يك ماده حياتي ديناميكي است كه دائماً در طول عمر خود تجديد و دوبارهسازی ميشود. ماتريكس استخوان از دو جزء آلي و معدني تشكيل يافته است كه جزء آلي عمدتاً از الياف كلاژن يا اوستئين به همراه كلاژن استخواني تشکیل شده و حدود 2/3 وزن استخوان را شامل ميشود و جزء معدني حاوي نمکهای معدني، هیدروکسی آپاتیت و کریستالهای فسفات کلسیم آمورف رسوبکرده در ماتریس آلی میباشد كه سفتي استخوانها مربوط به آنها است.
فسفات كلسيم 85%، كربنات كلسيم 10% و مقادير كمي كلروركلسيم و منيزيوم جزء معدنی را تشکیل میدهند. استخوان بهطور مداوم توسط چهار نوع سلول مختلف تجدید و نوسازی میشود؛ این سلولها عبارتند از:
1) استئوسیت
2) استئوکلاست
3) استئوبلاست
4) سلولهای پوششی
استئوسيتها در حفراتي به نام لاكونا[1] قرار دارند و از استئوبلاستها منشأ ميگيرند. از آنجا كه متابوليتها قادر به انتشار از طريق ماتريكس كلسيفيه استخوان نيستند تبادل بين استئوسيتها و مويرگهاي خوني بستگي به ارتباط سلولي از طريق كاناليكولها دارد كه بستر را سوراخ ميكنند. اين كاناليكولها به استئوسيتها امكان ميدهند كه از طريق استطالههاي خود با سلولهای همسايه ارتباط برقرار كنند (1 و 2).
استئوبلاستها كه اجزاء آلي و معدني ماتريكس را ميسازند از سلولهای بنيادي مزانشيمي مغز استخوان منشأ ميگيرند. استئوكلاستها كه از فیوژن خانواده مونوسیت/ ماکروفاژ تشکیل شدهاند، سلولهای غولآسای چندهستهای هستند كه با ترشح اسید و آنزیمهای لیزوزومی خود به فضای بین سطوح مینرالیزه استخوان در فرآيند جذب و بازسازي مجدد[2] بافت استخواني نقش دارند. یکی دیگر از سلولهای استخوانی که از استئوبلاست مشتق میشود سلولهای پوششی است؛ سلولهای پوششی سطوح استخوان را میپوشانند و در نتیجه سطح استخوان را از مغز استخوان جدا میکنند، با این حال عملکرد دقیق سلولهای پوششی استخوان همچنان نامشخص است (3 و 4).
برای حفظ عملکرد استخوان، این بافت بهطور مداوم توسط استئوکلاستها بازجذب شده و توسط استئوبلاستها بازسازی میشود. این فرآیند، بازسازی استخوان نامیده میشود که عملکرد اصلی آن تجدید بافت استخوان بهمنظور حفظ استحکام استخوان در دوران بزرگسالی است (5 و 6). در طول بازسازی استخوان، استخوان ابتدا توسط استئوکلاستها بازجذب میشود و پس از آن، استئوبلاستها فرامیرسند و بازسازی استخوان بازجذب شده را با سنتز ماتریکس استخوانی جدید انجام میدهند. بازسازی استخوان متشکل از چرخههای پیدرپی بازجذب و تشکیل استخوان در سطح استخوان میباشد. بدون بازسازی استخوان، حفظ سطوح کلسیم خون، حمایت مکانیکی از بافتهای نرم و حفاظت از مغز و نخاع ممکن نخواهد بود (5). در این مقاله به توصیف خصوصیات مرفولوژیکی و عملکرد سلولهای استخوانی میپردازیم.
سلولهای استخواني
استئوسيتها[3]
استئوسيتها كه از استئوبلاستها[4] مشتق ميشوند، در لاكوناهايي كه بين تيغههاي ماتريكس قرار گرفتهاند، مستقر ميباشند. فقط يك استئوسيت در هر لاكونا يافت ميشود. كاناليكولهاي نازك استوانهاي زوائد سيتوپلاسمي استئوسيتها را در خويش جاي ميدهند. این کانالیکولها بهعنوان مسیر تأمین مواد مغذی و اکسیژن از خون مویرگی به استئوسیتها عمل میکنند. استئوسیتها به دلیل زوائد سیتوپلاسمی متعدد دارای سطحی بزرگ میباشند. علاوه بر این، این زوائد دارای دستهجات رشتههای اکتینی هستند که استرس مکانیکی را دریافت میکنند. به نظر میرسد که استئوسیتها با دریافت و انتقال استرس مکانیکی در متابولیسم استخوان درگیر باشند. درواقع، تحقیقات اخیر نشان داده است که استئوسیتها کانال فعال شده با کشش (7) و عناصر پاسخدهنده به استرس (8) را بیان میکنند.
با این حال، هنوز مکانیسم انتقال سیگنال و ژنهای تنظیمشده با فشار مکانیکی مشخص نشده است. زوائد سلولهای مجاور از طريق اتصالات شكافدار با هم در تماس ميباشند و مولکولها از اين طريق از يك سلول به سلول ديگر ميرسند. برخي تبادلات مولكولي نيز از طريق مقدار اندكي ماده خارج سلولي كه بين استئوسيتها و ماتريكس استخوان قرار گرفته است، انجام ميشود. تبادلات اخير ميتوانند يك زنجيره متشكل از حدود 15 سلول را تغذيه كنند. در مقايسه با استئوبلاستها، استئوسيتهاي پهن بادامي شكل داراي شبكه اندوپلاسمي خشن و دستگاه گلژي بسيار كمتر و كروماتين هستهاي متراكمتر ميباشند. اين سلولها فعالانه در حفظ ماتريكس استخواني دخالت دارند. متعاقب مرگ استئوسيتها، ماتريکس جذب ميگردد (1).
استئوسیتها تمایزیافتهترین سلولهای دودمان استئوبلاستی هستند که برای مدت بسیار طولانی در ماتریکس استخوانی باقی میمانند، بااینحال نقش اصلی استئوسیتها هنوز بهطور کامل شناخته نشده است. شواهدی وجود دارد که نشان میدهند این سلولها نقش مهمی را در حفظ توده استخوانی بازی میکنند. ثابت شده است که حفظ توده استخوانی متکی بر تحریک مداوم مکانیکی است، با این حال فشار مکانیکی و جریان سیال ضرباندار قادر به القاء مولکولهای سیگنالینگ، مانند نیتریک اکسید توسط استئوسیتها در شرایط in vitro میشود (9 و 10). جالبتوجه است بهتازگی مشاهده شده است که مهارکننده پروتئین مورفوژنیک استخوانی (اسکلروستین) [5] بهطور اختصاصی به استئوسیتها متصل شده و ممکن است به تنظیم توده استخوانی کمک کند (11).
استئوكلاستها[6]
استئوكلاستها سلولهای بسيار بزرگ انشعابدار متحركي هستند. بخشهاي متسع جسم سلول، داراي 5 تا 50 يا تعداد بيشتري هسته ميباشند. در مناطقي كه جذب استخواني وجود دارد، استئوكلاستها درون فرورفتگيهايي در ماتريكس بنام لاكوناهاي هوشيپس[7]، قرار دارند. استئوكلاستها از اتصال سلولهای مشتق از مغز استخوان ايجاد ميشوند. در استئوكلاستهاي فعال، ماتريكس استخواني كه در سطح قرار گرفته است، درون برآمدگيهاي نامنظم و غالباً انشعابدار چینخوردگی پيدا ميكند و تشكيل يك سرحد نامنظم و ناهموار[8] ميدهد. پيرامون سرحد ناهموار، يك ناحيه سيتوپلاسمي ناحيه پاك[9] قرار دارد كه فاقد اندامك است، ولي غني از فيلامانهاي اكتين است.
اين ناحيه منطقه چسبندگي استئوكلاست به ماتريكس استخوان بوده و محيط كوچكي براي جذب استخوان ايجاد ميكند. استئوكلاستها، كلاژناز و ساير آنزيمها را ترشح و پروتون را درون يك حفره زيرسلولي پمپ ميكنند، بدين ترتيب موجب هضم موضعي كلاژن و حل بلورهاي نمك كلسيم ميشوند. فعاليت استئوكلاستها توسط بعضي از سيتوكينها و هورمونها مهار ميشود (12). استئوكلاستها گيرندههايي براي كلسيتونين ولي نه براي هورمون پاراتيروئيد دارند؛ اما استئوبلاستها داراي گيرندههايي براي هورمون پاراتيروئيد هستند و وقتي توسط اين هورمون تحريك شوند سيتوكيني به نام فاكتور محرك استئوكلاست توليد ميكنند. سرحد ناهموار در ارتباط با فعالیت استئوكلاستها است.
استئوبلاستها از سلولهای بنيادي مزانشيمي مغز استخوان منشأ ميگيرند. استئوبلاستها مسئول ساخت اجزاي آلي ماتريكس استخواني (كلاژن نوع I، پروتئوگليكانها و گليكوپروتئينها) هستند. رسوب اجزاي غيرآلي استخوان نيز وابسته به حضور استئوبلاستهاي زنده است. اين سلولها منحصراً در سطوح بافت استخواني، كنار به كنار قرار دارند، بهگونهای كه شبيه اپيتليوم ساده ميشوند. وقتي اين سلولها فعالانه مشغول ساخت ماتريكس ميشوند، شكل مكعبي تا استوانهاي و سيتوپلاسم بازوفيل پيدا ميكنند. وقتي فعاليت سازندگي كاهش مييابد، اين سلولها مسطح ميشوند و بازوفيلي سيتوپلاسم كاهش مييابد.
برخي استئوبلاستها بهتدریج توسط ماتريكس تازه تشكيلشده محصور و به استئوسيت تبديل ميشوند. در حين اين فرايند فضايي به نام لاكونا تشكيل ميشود. لاكوناها توسط استئوسيتها و زوائد آنها، همراه با ميزان اندكي از ماتريكس غيركلسيفيه خارج سلولي، اشغال ميشوند، بقیه در سطح استخوان بهصورت خاموش باقی میمانند و تحت عنوان سلولهای پوششی استخوان نامیده میشوند. سلولهای پوششی استخوان شکل مسطحی دارند و شامل چند اندامک سلولی هستند.
این خصوصیات مورفولوژیک نشان میدهد که سلولهای پوششی استخوان بهسختی درگیر در تشکیل استخوان هستند. درواقع، کمی استئویید[10] زیر سلولهای پوششی استخوان دیده میشود. استئوبلاستها در هنگام سنتز ماتريكس، واجد اجزاي سلولي خاصي ميشوند كه مشخصه سلولهایی است كه فعالانه پروتئين سنتز كرده و به بيرون ترشح ميكنند. استئوبلاستها سلولهای قطبي هستند. ترشح اجزاي ماتريكس در سطح سلول انجام ميشود كه در تماس با ماتريكس استخواني قديميتر ميباشد، بدين ترتيب يك لايه جديد (ولي هنوز كلسيفيه نشده) ماتريكس به نام استئوئيد بين لايه استئوبلاست و استخوان از پیش ساختهشده، تشكيل ميشود. اين فرآيند تبديل استخواني[11] ناميده ميشود كه سپس توسط رسوب نمکهای كلسيم درون استخوان تازه تشكيلشده، تكميل ميشود (13).
مطالعات نشان میدهند که استئوبلاست بالغ بهطور متوسط طول عمر یک ماه دارد و پس از آن متحمل آپوپتوز میشوند که توسط استئوبلاستهای جدید تمایزیافته جایگزین میشوند و یا در حدود یکسوم از این سلولها ممکن است در ماتریکس استخوانی بهعنوان سلولهای استئوسیتی رسوب کنند.
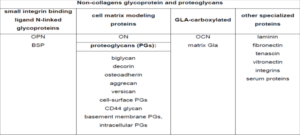
خصوصیات فراساختاری استئوبلاستها، ویژگی ترشحی معمولی، همراه با شبکه آندوپلاسمی خشن با سیسترنای متسع را نشان میدهد (14 و 15). کمپلکس بزرگ گلژی شامل چندین لایه از دستگاه گلژی، وزیکولها و واکوئلهای با ساختار فیبریلار است که به نظر میرسد فراهمکننده کلاژن و پروتئوگلیکانها باشد. استئوبلاستها همچنین قادر به سنتز پروتئوگلیکانها و پروتئینهای غیرکلاژنی مهم هستند که در جدول 1-1 ذکر شده است. از آنجا که گلیکوپروتئینها و پروتئوگلیکانها میتوانند با یون کلسیم ترکیب شوند، بنابراین به نظر میرسد که آنها در دو عملکرد نقش داشته باشند:
1) ذخیرهسازی یون کلسیم برای کلسیفیکاسیون
2) تنظیم رشد هیدروکسی آپاتیت با جلوگیری از کلسیفیکاسیون بیش از حد
استئوبلاستها همچنین سایتوکاینهایی از جمله فاکتور رشد شبه انسولین I، II، فاکتور رشد ترانسفورمه کننده بتا (TGF β) و پروتئین مورفوژنیک استخوان (BMPs) را تولید میکنند. این عوامل رشد، در ماتریکس استخوانی کلسیفیه ذخیره میشوند و نقش مهمی در تمایز و عملکرد استئوبلاست بازی میکنند، بنابراین ماتریکس استخوانی بهعنوان مکان ذخیرهسازی فاکتورهای رشد علاوه بر کلسیم و فسفات عمل میکند. استئوبلاستها فعالیت آلکالن فسفاتازی شدید در غشای پلاسمایی خود نشان میدهند. این ویژگی هیستوشیمیایی بهعنوان یک مارکر رده استئوبلاستی استفاده میشود.
جدول 1-1: فهرست پروتئینهای غیرکلاژنی تولیدشده توسط استئوبلاستها
ماده غيرآلي حدود 50% وزن خشك ماتريكس استخواني را تشكيل ميدهد. كلسيم و فسفر بهویژه در ماتريكس بهوفور يافت ميشوند، ولي بیکربنات، سيترات، منيزيم، پتاسيم و سديم نيز يافت ميشوند. مطالعه با روش انكسار اشعه ايكس نشان داده است كه كلسيم و فسفر، تشكيل بلورهاي هيدروكسي آپاتيت با تركيب شيميايي PO4)6(OH)2)Ca10 ميدهند؛ اما اين بلورها نقايصي دارند و مشابه هيدروكسي آپاتيت موجود در مواد معدني سخت نيستند. مقادير زيادي از فسفات كلسيم بیشکل (غيربلوري) نيز وجود دارند. در عكسهاي ميكروسكوپ الكتروني، بلورهاي هيدروكسي آپاتيت استخوان شبيه صفحاتي به نظر ميرسند كه در طول رشتههاي كلاژن قرار ميگيرند، ولي توسط ماده زمينهاي احاطه ميشوند. یونهای سطحي هيدروكسي آپاتيت هيدراته هستند و يك لايه از آب و یونها در اطراف بلور تشكيل ميشود. اين لايه كه تحت عنوان قشر آبي[12] خوانده ميشود، تبادل یونها بين بلور و مايعات بدن را تسهیل مينمايد.
ماده آلي در ماتريكس استخوان شامل كلاژن نوع I و ماده زمينهاي (كه محتوي تجمعات پروتئوگليكان و چندين گليكوپروتئين ساختماني ويژه ميباشد) است. گليكوپروتئينهاي استخوان ممكن است در پيشبرد روند كلسيفيكاسيون ماتريكس استخوان نقش داشته باشند. ساير بافتهاي محتوي كلاژن نوعI بهطور طبيعي كلسيفيه نيستند و داراي اين گليكوپروتئينها نميباشند. ماتريكس استخواني دكلسيفيه، به خاطر محتواي غني كلاژن به رنگهاي ويژه رنگآمیزی رشتههای كلاژن اتصال مييابد. همراهي مواد معدني و رشتههاي كلاژن مسئول سختي و مقاومت بافت استخوان است.
وقتي يك استخوان دكلسيفيه ميشود، شكل آن حفظ ميشود، ولي همانند يك تاندون ارتجاعپذير ميگردد. برداشت بخش آلي ماتريكس كه عمدتاً ماهيت كلاژني دارد نيز شكل اوليه استخوان را تغيير نميدهد، ولي آن را شكننده ميكند و استخوان بهسادگی در هنگام جابجايي شكسته و خرد ميگردد (16). علاوه بر این، پروتئوگلیکانهای دکورین[13] و بیگلیکان[14] از اجزای مهم ماتریکس آلی استخوانی میباشند. عملکرد این اجزای ماتریکس استخوانی این است که این پروتئینها دارای فعالیت اتصال به کلسیم هستند که احتمالاً مسئول تنظیم رسوب کریستالهای هیدروکسی آپاتیت در ماتریکس استخوانی مینرالیزه شده میباشند.
نتیجهگیری
تحلیل و تشکیل استخوان با یکدیگر مرتبط هستند؛ به این معنی که اگر یکی کاهش یابد دیگری افزایش مییابد. این ارتباط بین تشکیل و تحلیل استخوان توسط مکانیسمهای مختلفی (که هنوز بهطور کامل درک نشده است) کنترل میشوند. بهعنوان مثال، استئوبلاستها میتوانند با تولید فاکتورهای تحریککننده استئوکلاستی مانند RANKL[15] و [16] M-CSF باعث تحریک تمایز استئوکلاستها شوند (17). از طرف دیگر، استئوبلاستها و استئوسیتها متالوپروتئاز (13) ماتریکسی[17] را ترشح میکنند که نشان میدهد استئوبلاستها در تخریب کلاژن درگیر هستند (18). این یافتهها نشان میدهد که سلولهای استئوبلاستی در تخریب کلاژن در طول بازجذب استخوان همراه با استئوکلاستها شرکت میکنند.
فعالیت استئوبلاستها نیز تحتتأثیر فعالیت استئوکلاست قرار دارد. در طول بازجذب استخوان توسط استئوکلاستها، فاکتورهای متعددی از جمله IGF-I (فاکتور رشد شبه انسولینی نوع I) و TGFβ، (فاکتور رشد ترانسفورمه کننده β)، (5 و 19) از ماتریکس خارج سلولی آزاد میشود که پیش از آزاد شدن باعث کنترل تمایز و فعالیت استئوبلاستها میشوند و شکی نیست که تعامل بین این سلولهای استخوانی برای حفظ حجم و ساختار استخوان ضروری است، بنابراین شناخت فیزیولوژی، مورفولوژی و عملکرد این سلولها بهمنظور شناخت بیولوژی استخوان و توسعه درمانهایی برای بیماریهای استخوانی همچون پوکی استخوان ضروریست.
: REFERENCES
- Buckwalter JA,Glimcher MJ,Cooper RR,Recker R.Bone biology.Structure, bloodsupply,cells,matrix and mineralization.Instr Course Lect 1996; 45:371-86.
- Marks SC,Jr,Popoff SN.Bone cell biology:the regulation of development,structure and function in skeleton.Am J Anat 1988;183(1):1-44
- Aubin JE,Lian JB,Stein GS. Bone formation: maturation and functional activities of osteoblast lineage cells. In: Murray JF,ed. Primer on the metabolic bone diseases and disorders of mineral metabolism. Washington,D.C. The American society for bone and mineral research 2006;6:90-97.
- Parfitt AM. The bone remodeling compartment: a circulatory function for bone lining cells. J Bone Miner Res 2001;16(9):1583-1585.
- Harada,S. and G.A. Rodan. “Control of osteoblast function and regulation of bone mass.” Nature 2003; 423:349-355.
- Demster DW. Anatomy and function of the adult skeleton. In: Murray JF,ed. Primer on the metabolic bone diseases and disorders of mineral metabolism. Washington,D.C. The American society for bone and mineral research 2006;18:59-70.
- Ypey DL,Weidema AF,Hold KM,Van der Laarse A,Ravesloot JH,Van Der Plas A,Nijweide PJ. Voltage,calcium,and stretch activated ionic channels and intracellular calcium in bone cells. J Bone Miner Res 1992; S377-387.
- Resnick N,Collins T,Atkinson W,Bonthron DT,Dewey CF Jr,Gimbrone MA Jr. Platelet-derived growth factor B chain promoter contains a cis-acting fluid shear-stress-responsive element. Proc Natl Acad Sci U S A 1993;90(10):4591-4595.
- Klein-Nulend J,Semeins CM,Ajubi NE,Nijweide PJ,Burger EH. Pulsating fluid flow increases nitric oxide (NO) synthesis by osteocytes but not periosteal fibroblasts – correlation with prostaglandin upregulation. Biochem Biophys Res Comm 1995; 217: 640–648.
- Pitsillides AA,Rawlinson SC,Suswillo RF,Bourrin S,Zaman G,Lanyon LE. Mechanical strain-induced NO production by bone cells: a possible role in adaptive bone (re)modeling? FASEB J 1995; 9: 1614–1622.
- Winkler DG,Sutherland MK,Geoghegan JC,Yu C,Hayes T,Skonier JE,Shpektor D,Jonas M,Kovacevich BR,Staehling-Hampton K,Appleby M,Brunkow ME,Latham JA. Osteocyte control of bone formation via sclerostin,a novel BMP antagonist. Embo J 2003; 22: 6267–6276.
- Vaananen HK,Hentunen T,Lakkakorpi P,Parvinen EK.Mechanism of osteoclast mediated bone resorption.Ann Chir Gynaecol 1988;77(5-6):193-6.
- Raisz LG,Kream BE.Regulation of bone formation.N Engl J Med1983;309(1):29-35.
- Cormack D.H. Ham’s Histology 9th Edition,J.B. Lippincott Company Philadelphia 1987
- Baron R. Anatomy and ultrastructure of bone In: Primer on the metabolic bone diseases and disorders of mineral metabolism,ed. by Favus M.J.,Lippincott Williams Wilkins,Philadelphia 1990;pp3-10. Book
- Herring GM.The chemical structure of tendon,cartilage,dentin and bone matrix.Clin Orthop Relat Res 1968;60:261-99.
- Boyle WJ,Simonet WS,Lacey DL. Osteoclast differentiation and activation. Nature 2003;423(6937):337-342.
- Nakamura H,Sato G,Hirata A,Yamamoto T. Immunolocalization of matrix metalloproteinase-13 on bone surface under osteoclasts in rat tibia. Bone 2004; 34(1):48-56.
- Oreffo RO,Mundy GR,Seyedin SM,Bonewald LF. Activation of the bone-derived latent TGF beta complex by isolated osteoclasts. Biochem Biophys Res Commun 1989;158(3):817-823
[1] Lacuna
[2] Remodeling
[3] Osteocyte
[4] Osteoblast
[5] Sclerostin
[6] Osteoclast
[7] Howship’s
[8] Ruffled Border
[9] Clear Zone
[10] Osteoid
[11] Bone Apposition
[12] Hydration Shell
[13] Decorin
[14] Biglycan
[15] Receptor activator of nuclear factor kappa-B ligand
[16] Macrophage colony-stimulating factor
[17] Matrix metaloprotease 13
رهنمودهای ICSH برای استانداردسازی نمونهها و گزارشهای مغز استخوان (1)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3341892/
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام