رینوسینوزیتهای قارچی
محمد کُرد1، احمد علمی مقدم2، محمدخانی2، کیمیا میری3، صادق خداویسی4*
1: دانشجوی دکتری تخصصی قارچشناسی پزشکی، دانشگاه علوم پزشکی تهران
2: دانشجوی کارشناسی ارشد قارچشناسی پزشکی، دانشگاه علوم پزشکی تهران
3: دانشجوی پرستاری، دانشگاه علوم پزشکی تهران
4: استادیار قارچشناسی پزشکی، دانشگاه علوم پزشکی تهران
مقدمه:
در طی قرن گذشته عقاید ما راجع به بیماریهای عفونی دستخوش تغییرات بزرگی شده است که این تغییرات سینوزیت را هم مانند سایر بیماریهای التهابی در بر میگیرد. سینوزیت در فرم سادهاش یک التهاب غشای مخاطی سینوس است. این التهاب ممکن است ناشی از میکروارگانیسمها (باکتریها، قارچها و ویروسها)، آلرژی، التهاب ایمونولوژیک و یا غیرعفونی باشد (1). زیرمجموعهای از موارد رینوسینوزیت که در آن نقش اتیولوژیک قارچها ثابت شده (به خاطر جداسازی قارچ از نمونههای بیوپسی)، بهعنوان رینوسینوزیت قارچی نامیده میشود (2). سینوزیتهای قارچی با حضور هایف قارچی در داخل مخاط، زیرمخاط، استخوان و یا رگهای خونی در هیستوپاتولوژی تعیین میشوند (3). در اوایل، یک اختلال نادر بشمار میرفت اما امروزه بهکرات در نقاط مختلف دنیا گزارش میشود. زایگومایکوزیس مهاجم به همراه آسپرژیلوزیس مهاجم از فرمهای خطرناک این بیماری است. تشخیص اشتباه و یا تأخیر در تشخیص باعث افزایش مرگومیر این بیماری میشود. نتیجه موفق درمان بیمار نیازمند تشخیص احتمالی اولیه و مقدار مناسب بیوپسیهای سینوس و نتیجه میکروبیولوژی سریع و پاتولوژی و رادیولوژی است که در نهایت منجر به جراحی مناسب و درمان دارویی مناسب میشود. FRS بهطور فزایندهای در تمام گروههای سنی شناخته شده است (6-4). این بیماری اثرات اجتماعی و اقتصادی زیادی را بهصورت مستقیم و غیرمستقیم بر جوامع مختلف گذاشته است. بیماران با FRS درگیر اثرات ناخوشایند زیادی از بیماری هستند و در موارد مهاجم بیماری موارد بالای مرگومیر مشاهده میشود. این بیماری اغلب نادیده گرفته شده و بخصوص در کشورهای درحال توسعه مثل ایران و هند و… اشتباه تشخیص داده میشود (7).
تاریخچهی بیماری رینوسینوزیت قارچی
دستهبندی سینوزیتهای قارچی در چند دهه اخیر رفتهرفته تکامل یافت. دستهبندی سینوزیتها برای مدیریت صحیح بیماری و پیشبینی پیشآگهی بیماری بسیار ضروری است. اولین افتراق بین سینوزیتهای مهاجم و غیرمهاجم توسط Horav در سال 1965 صورت گرفت که بر اساس یافتههای بالینی انجام میشد (8). سینوزیتهای گرانولوماتوز مزمن برای اولین بار در سال 1967 در سودان توصیف شد و موارد بعدی از پاکستان، هند و ایالات متحده آمریکا گزارش شد (11-9). در سال 1976 Safirestein ترکیب پولیپ بینی، دلمه و گونههای آسپرژیلوس سینوسی رشدکرده روی محیطها را شبیه آنچه در آسپرژیلوزیس برونکوپولمونری آلرژیک (ABPA[1]) مشاهده میشود، گزارش کرد (12). در سال 1980، McGill و همکاران فرم برقآسای سینوزیت قارچی را در بیمارانی که دورهای از نقص ایمنی را داشتند گزارش کردند (13). همچنین در سال 1980 Talbot و همکاران دستهبندی سینوزیتهای قارچی مهاجم را ارائه دادند که شامل آسپرژیلوزیس برقآسا، موکورمایکوزیس مهاجم و آسپرژیلوما بود (14). در سال 1988 سینوزیتهای مهاجم در مرور میزبانهای نرمال که سینوزیت مزمن داشتند به دو نوع مهاجم حاد و مهاجم مزمن دستهبندی شدند (11). در ضمن پزشکان متعددی بهصورت جداگانه موارد رینوسینوزیت مزمن همراه با Mucosal plug در سینوسها در بیماران با ABPA را به رسمیت شناختند و این نامگذاری، رینوسینوزیت قارچی را به سمت رینوسینوزیت قارچی آلرژیک پیش برد (18-15). Ponikau و همکاران پیشنهاد کردند که اصطلاح رینوسینوزیت قارچی ائوزینوفیلیک برای انعکاس ویژگی مهم “ائوزینوفیلها” است (19). در سال 1997 DeShazo و همکاران برای سینوزیتهای قارچی مهاجم ویژگیهای تشخیصی و دستهبندی آن را پیشنهاد کردند و در انتشارات بعدی خود دو نوع از سینوزیتهای غیرمهاجم قارچی را پیشنهاد دادند: سینوزیت قارچی آلرژیک و مایستومای سینوس یا توپ قارچی و ۳ نوع سینوزیت قارچی مهاجم که شامل سینوزیت قارچی مهاجم برقآسای حاد، سینوزیت قارچی مهاجم مزمن و سینوزیت قارچی مهاجم گرانولوماتوز بود (3, 20, 21).
دستهبندی رینوسینوزیتهای قارچی
معیار تشخیصی برای سینوزیت قارچی مهاجم بر اساس شواهد هیستوپاتولوژیک فرمهای هایفی در داخل مخاط سینوس و زیرمخاط و عروق خونی یا استخوان است (21). سینوزیت قارچی مهاجم وقتی حاد تعریف میشود که دوره آن کمتر از 4 هفته باشد، اما بیماری با طول دوره بیشتر از 4 هفته مزمن تلقی خواهد شد (22).
سینوزیتهای قارچی مهاجم
سینوزیتهای قارچی مهاجم (IFRS[2]) معمولاً در افراد با نقص ایمنی مشاهده میشود. فاکتورهای مستعدکننده در پیشرفت بیماری به سمت سینوزیتهای قارچی مهاجم شامل اختلالات متابولیک یا سیستمیک، دیابت ملیتوس، اختلالات هماتولوژیک مثل لوسمی، لنفوم و آنمی آپلاستیک، هموکروماتوزیس و ایدز و نیز عوامل سرکوبکننده سیستم ایمنی مانند درمان استروئیدی سیستمیک، شیمیدرمانی همراه با نوتروپنی، درمان طولانی مدت آنتیبیوتیکی و پیوند مغز استخوان است (3, 4, 26-23). چندین فاکتور میزبان بهعنوان فاکتور مستعدکننده در ابتلا به سینوزیتهای قارچی مهاجم شناخته شده است و فرم برقآسا معمولاً در میزبانان با نقص ایمنی شایع است (14-8). در افراد دیابتی بخصوص کتواسیدوز (15)، شرایط هماتولوژیکی (<500μl نوتروفیل) مثل لوسمی، لنفوم، مالتیپل میلوما، سندرم میلودیسپلاستیک، آنمی آپلازی و آنمی سیدروبلاستیک و همچنین در ایدز، سیروز، کارسینوما، هپاتیت، گلومرولونفریت، اورمیا، پیوند مغز استخوان، پیوند سلول بنیادی، پیوند ارگان توپر و درمان سرکوبکننده سیستم ایمنی رخ میدهد. در این بیماران سابقهای چند ماه قبل از وقوع بیماری از این شرایط وجود داشته است (3, 21-16). سینوزیتهای قارچی مهاجم تقریباً 0/9 تا 1/9 درصد از گیرندگان پیوند مغز استخوان آلوژنیک را تحت تأثیر قرار میدهند (11). بیماران با تومور توپر بهندرت دچار سینوزیت قارچی میشوند. سرطان خون مهمترین ریسک فاکتور برای سینوزیتهای قارچی مهاجم بخصوص موکورمایکوزیس است (27). گاهی سینوزیتهای قارچی مهاجم ممکن است در افراد با ایمنی سالم نیز رخ دهد (3, 25, 26). بیماری قارچی غیرمهاجم ممکن است به سمت بیماری مهاجم پیشرفت کند و این در حالتی اتفاق میافتد که وضعیت سیستم ایمنی فرد تغییر کند. بهترین نتیجه گزارششده در سینوزیتهای قارچی مهاجم تقریباً 50 درصد بقا را نشان میدهد (3). برای بهبود میزان بقا، پزشکان باید با تظاهرات بیماری آشنایی کامل داشته باشند و برای تشخیص سریع به آزمایشگاههای قارچشناسی و پاتولوژی دسترسی داشته باشند. تنها روش مدیریت چند رشتهای (شامل پزشک، آزمایشگاه قارچشناسی، پاتولوژی و رادیولوژی) میتواند یک دستاورد موفق در درمان و نجات بیماران با سینوزیت قارچی مهاجم باشد (25).
انواع رینوسینوزیتهای قارچی مهاجم
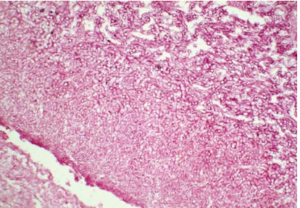
الف- رینوسینوزیت قارچی مهاجم حاد (AIFRS[3])
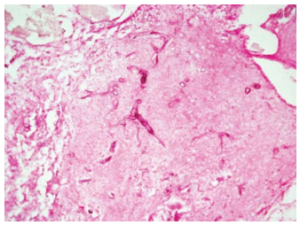
طول دوره این بیماری کمتر از 4 هفته بوده و در بیماران با نقص سیستم ایمنی دیده میشود. در این فرم از بیماری، تهاجم به عروق دیده میشود و ممکن است شامل شریانهای کاروتید و سینوسهای cavernous باشد. واسکولیت همراه با ترومبوزیس، هموراژی، انفارکتوس بافت و ارتشاح نوتروفیلیک حاد مشاهده میشود و بیماری همچنین با نام Acute necrotizing FRS نیز خوانده میشود (28) (مقدار فراوان قارچ در بافت نکروزه) (شکل 1).
شکل 1- سینوزیت قارچی مهاجم حاد (رنگآمیزی H&E )
بیماران با نقص عملکردی در نوتروفیلها یا نوتروپنی مانند بدخیمیهای خونی و آنمی آپلازی، دیابت ملیتوس کنترلنشده و هموکروماتوزیس و یا درمان با داروهای شیمیدرمانی ضدنئوپلازی و یا بدنبال پیوند، حساس به AIFRS هستند. با این حال این بیماری معمولاً در میزبانان با نقص ایمنی گزارش میشود. گونههای آسپرژیلوس و خانواده زایگومیستها جزو عوامل اتیولوژیک رایج بیماری هستند (22, 28).
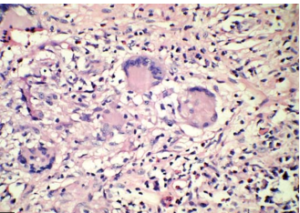
ب- رینوسینوزیت قارچی مهاجم گرانولوماتوز (GIFRS[4])
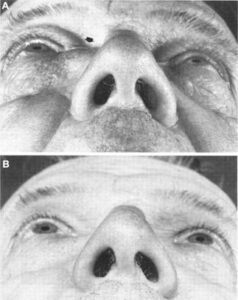
طول دوره بیماری بیش از 12 هفته بوده و همراه با توده بزرگ در گونه، بینی و یا سینوسهای پارانازال است. این بیماری نیز در افراد با نقص سیستم ایمنی رخ میدهد و ویژگی برجسته آن بیرونزدگی حدقه چشم است. خصوصیات هیستوپاتولوژیک آن شامل پاسخ گرانولوماتوز به همراه فیبروز واضح، گرانولومای غیرپنیری همراه با جسم خارجی و سلولهای غولآسا و گاهی اوقات همراه با واسکولیت، تکثیر عروقی و فیبروز در اطراف عروق و عدم رسوب آنتیبادی علیه آنتیژن قارچی است (شکل 2). بیماری ابتدا در هند و پاکستان و سودان و عربستان مشاهده شد (3, 28, 29).
شکل 2- سینوزیت قارچی مهاجم گرانولوماتوز (رنگآمیزی H&E)
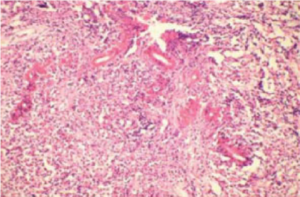
ج- رینوسینوزیت قارچی مهاجم مزمن (CIFRS[5])
رینوسینوزیت قارچی مهاجم مزمن دارای ویژگیهایی مثل پروسه تخریبی آهسته، درگیری سینوسهای اسفنوئید و اتموئید، دوره بروز علائم بیش از 12 هفته، تجمع فشرده هایفها و تهاجم عروقی، پاسخ التهابی کم و درگیری ساختارهای موضعی است (شکل 3). بیشتر در موارد AIDS و دیابت ملیتوس و درمانهای کورتیکواستروئیدی دیده میشود و عامل شایع آن Aspergillus fumigatus است (30-28).
شکل 3- رینوسینوزیت قارچی مهاجم مزمن
رینوسینوزیت قارچی غیرمهاجم
الف- رینوسینوزیت قارچی ساپروفیتی[6]
این نوع از سینوزیت بر اثر کلنیزاسیون بدون علامت قارچهای ساپروب است و بیشتر در بیمارانی که جراحی سینوس قبلی داشتهاند، دیده میشود و امکان گسترش این قارچها به سمت اشکال توپ قارچی پیشبینی میشود (22).
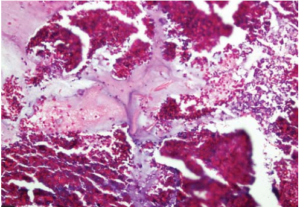
ب- توپ قارچی[7]
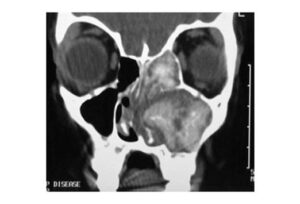
حضور تجمع فشرده و غیرمهاجم توده هایفی قارچی در یک حفره سینوس که معمولاً سینوس ماگزیلاری است باعث بوجود آمدن این فرم از بیماری میشود (شکل 4). در موارد اندکی نیز درگیری سینوسهای دیگر یا چند سینوس بهطور همزمان مشاهده میشود (31). اصطلاحات متنوعی از جمله مایستوما، آسپرژیلوما و گرانولومای مزمن غیرمهاجم بهجای آن در جاهای مختلف بکار برده شده است (22).
شکل 4: Fungal ball رنگآمیزی با PAS
ج- رینوسینوزیت قارچی آلرژیک
رینوسینوزیت قارچی آلرژیک (AFRS[8]) دارای علائم پاتولوژیک خاص مربوط به خود است که بهوسیلهی موسین آلرژیک مشخص میشود و این موسین ضخیم و سرسخت و دارای ترشحات ائوزینوفیلی با یافتههای هیستولوژیک مشخص است. (شکل 5). این موسین از لحاظ میکروسکوپی شبیه همان چیزی است که در بیماران آسپرژیلوزیس برونکوپولمونری آلرژیک (ABPA) مشاهده میشود و این امر در شناخت پاتوژنز AFRS بسیار کمککننده است.
شکل ۵: رینوسینوزیت قارچی آلرژیک به همراه موسین آلرژیک
پاتوژنز AFRS هنوز بهطور کامل شناخته نشده است و موضوعی بحثبرانگیز است. تجمع موسین ائوزینوفیلیک در سینوسهای گسترشیافته باعث افزایش مدیاتورهای التهابی از جمله MBP، پراکسیداز ائوزینوفیلی، نوروتوکسین مستقلشده از ائوزینوفیل،TNF بتا و اینترلوکینها میشود. اگرچه بروز بیماری بسیار آرام است اما در نهایت به اختلال بینایی، بدشکل شدن صورت و انسداد کامل بینی منجر میشود (32).
اپیدمیولوژی رینوسینوزیتهای قارچی
رینوسینوزیت اختلال شایعی است که تقریباً 20 درصد از افراد را در دورهای از زندگیشان تحت تأثیر قرار میدهد. تخمین زده شده که تقریباً 31 میلیون نفر (4 درصد جمعیت بالغین) در ایالات متحده سالانه تحت تأثیر این بیماری قرار میگیرند (33). در حقیقت بررسیهای اخیر گزارش میدهد که در 14/1 درصد از افراد بالغ سینوزیت تشخیص داده شده است. 5 تا 15 درصد از این سینوزیتهای مزمن را سینوزیتهای قارچی (FRS) تشکیل میدهند (34). قابل ذکر است که در مقایسه با ایالات متحده آمریکا، رینوسینوزیت قارچی در کشورهای گرمسیری مثل هندوستان و پاکستان و سودان بسیار بیشتر است (7). مناطق جغرافیایی به احتمال زیاد نقش بسیار مهمی در بروز AFRS و FRS مهاجم گرانولوماتوز دارند. AFRS بیشتر در هند و آمریکای شمالی و خاورمیانه و قسمتهایی از ایالات متحده مثل میسیسیپی و ایالتهای جنوبی شرقی و جنوب غربی رخ میدهد. آب و هوای گرم و خشک بخصوص شمال هند، سودان، عربستان صعودی و آریزونا موارد بالاتری از بیماری را نشان میدهند. FRS مهاجم گرانولوماتوز بهطور ویژه در سودان، هند، پاکستان و بهندرت در ایالات متحده مشاهده میشود. Fungal ball سینوس ممکن است محدود به مناطق خاصی باشد ولی تعداد بالای موارد بیماری از فرانسه، ایتالیا و تایوان گزارش شده است. سالانه حدود 30 مورد از Fungal ball سینوس از Poitiers و Toulouse فرانسه گزارش میشود. در طی 14 سال (1989 تا 2002) 173 مورد از این بیماری فقط در یک مرکز از Poitiers فرانسه گزارش شده است (35). ایتالیا از کشورهای جنوبی اروپا از دیگر مناطق اندمیک Fungal ball سینوس است. در طی 1 سال (1994 تا2005) 81 مورد از این بیماری فقط در یک مرکز در Paria گزارش شده است (36). در آسیا در طی 8 سال 126 بیمار با Fungal ball سینوس در یک مرکز تایوان گزارش شده اند (37). اکثر فرمهای FRS بیشتر در مردان دیده میشود و دلیل اصلی این امر هنوز مشخص نشده است. علیرغم این، Fungal ball سینوس بیشتر در میانسالی و پیری و در زنان دیده میشود (35, 36). FRS مهاجم حاد بیشتر در گروه سنی بالا شایع است و این بیشتر به خاطر ریسک فاکتورهایی مثل دیابت و شیمیدرمانی سرطانها در این گروه سنی است. در برخی از مطالعات از سودان و شمال هند ثابت شده AFRS در مردان روستایی با سنین جوانی بیشتر است. بر اساس این گزارشها، مردان بالغ جوان برای کار در مزارع در آب و هوای گرم و خشک دچار آسیب مخاط سینوسهای پارانازال میشوند (9). برای AFRS، شرایط اتوپی و افراد با ازدیاد حساسیت نوع 1 نسبت به قارچها بسیار تعیینکننده است. AFRS همچنین در افراد دارای آسم ساده و آسم حساس به آسپیرین مشاهده میشود (22, 38)، با این حال سابقهی جراحی سینوس از مهمترین ریسک فاکتورها در توسعهی Fungal ball است. تخمین زده میشود که Fungal ball سینوس بیشتر در موارد تهویه ضعیف سینوسها اتفاق میافتد (21). زایگومیستها شایعترین عامل FRS مهاجم حاد هستند. زایگومیستهای غالب در ایجاد این بیماریها Rhizopusoryzae است (3, 39). Apophysomyceselegans بهعنوان عامل FRS مهاجم حاد در میزبانان با ایمنی سالم در مناطق گرمسیری بخصوص هند است. قارچهای تیغهدار شایع در ایجاد FRS مهاجم حاد در بیماران با نقص ایمنی آسپرژیلوس فومیگاتوس و آسپرژیلوس فلاووس هستند. قارچهای عامل AFRS متنوع هستند. در مطالعهی Holman در سال 1998، 168 کشت مثبت گزارش شد که در 87 درصد موارد قارچهای سیاه جدا شد و 13 درصد دیگر گونههای آسپرژیلوس بود. گونههای شایع قارچهای سیاه شامل Alternariaalternata، گونههای Bipolaris، گونههای Drechslera، و Curvularialunata بود (40). برخلاف این مطالعه، در هند از گونههای مثبت جداشده، 80 درصد موارد AFRS را A.flavus در شمال و جنوب این کشور تشکیل داد (7). این گونه همچنین در مناطق مرکزی هند در 50 درصد از بیماران AFRS جدا شد. در مقابل، آسپرژیلوس فومیگاتوس عامل اکثر موارد FRS مزمن گرانولوماتوز است (28, 29). نمونههای بیوپسی جمعآوریشده از اکثر بیماران با Fungal ball سینوس، استریل نشان داده شده است (نتیجهی کشت منفی) در حالی که در مطالعات میکروسکوپی قابل شناسایی بودند. تنها در 30 تا 50 درصد از کشتها رشد عامل قارچی مشاهده شد و A.fumigatus و A.flavus و P.boydii بود (35). با وجود مطالعات اپیدمیولوژیکی که در بالا بدان اشاره شد، هنوز هم اپیدمیولوژی و قارچشناسی بالینی بیماری کامل نیست و نیاز به مطالعات و تحقیقات نو هست. FRS میتواند از یک کلنیزاسیون ساده تا یک بیماری مهاجم خطرناک بروز کند. گرچه هنوز تقسیمبندی FRS آشفته است، هرکدام از تنوعات کلینیکوپاتولوژی FRS با محدوده جغرافیایی و ریسک فاکتورهای مرتبط با میزبان و عوامل اتیولوژیک در ارتباط است.
تشخیص انواع رینوسینوزیتهای قارچی:
تشخیص رینوسینوزیتهای قارچی مهاجم:
علائم اولیه رینوسینوزیتهای قارچی مهاجم در اغلب موارد ملایم است. پزشک باید در بیماران با ریسک بالا همین علائم را نیز در نظر بگیرد. مهمترین علامت رایج در بیش از 90 درصد بیماران تب با شروع نامشخص است که به 48 ساعت درمان آنتیبیوتیکی وریدی جواب نمیدهد. در بین 20 تا 60 درصد از بیماران، علائم ناحیهای مثل درد صورت، تراکم بینی و آبریزش بینی و سردرد مشاهده میشود. پزشکان باید اقدامات فعال را برای بیمارانی که شکایت از مشکلات نازال دارند لحاظ نمایند. اغلب بیماران هر دو علامت تب و حداقل یکی از علائم ناحیهای را دارند. علائم و نشانههای دیگری که بعداً ظهور مییابند شامل کاهش قدرت دید، بیرونزدگی حدقه چشم، تغییر در وضعیت روانی و علائم نورولوژیک است (43-41). آزمایشهای اندوسکوپی نازال در بیماران با نقص ایمنی که دارای تب با منشأ ناشناخته و درمان 48 ساعته دارویی و عدم موفقیت درمان هستند و یا افرادی که علائم سینونازال ناحیهای دارند، باید انجام شود. گمان میرود بیماری در اکثر افراد از حفره بینی شروع شده و به سینوسهای پارانازال و قسمتهای عمیقتر مثل مراکز هوشیاری و غیره گسترش یابد. ارزیابی تمام اعصاب جمجمه بهویژه اعصاب صورت و ماهیچههای خارجی چشمها باید از نظر وضعیت ملتحمه یا اشک بررسی شوند. CT از سینوسهای پارانازال از رایجترین مدلهای عکسبرداری برای ارزیابی بیماران مشکوک به رینوسینوزیت قارچی است (42). اکثر بیماران حداقل یک CT scan از سینوسهای پارانازال قبل از مشورت متخصصین و جراحان گوش و حلق و بینی انجام میدهند. یافتههای CT در بیماران با سینوزیتهای قارچی مهاجم غیراختصاصی بوده و ارتباط خوبی با یافتههای حاصل از جراحی و پاتولوژی ندارد (44). گرچه تشخیص رینوسینوزیت قارچی مهاجم نمیتواند بر اساس یافتههای CT باشد، اما کیفیت CT scan از جنبههای دیگر بسیار ارزشمند است؛CT اسکن میتواند وجود سینوزیت را اثبات کند و نشان دهد کدامیک از سینوسها ممکن است به جراحی نیاز داشته باشد. دوم اینکه اسکن میتواند تغییرات استخوانی را در فرد نشان دهد. در آخـــــــر CT scan میتواند یافتههایی را نشان دهد که دال بر اختلالات مهاجم سینونازال مثل تخریب استخوانی، درگیری چشم و ورم چشم است. اغلب علائم آرام که میتواند باعث تشخیص شود شامل ادم یکطرفه بینی یا التهاب یک سینوس بدون شواهد بیماری مخاطی در سینوسهای درگیـــــر است. توانایی CT scan در تعیین ساختار استخوان این امکان را میدهد که در مطالعات تصویری بیمارانی که امکان داشتن رینوسینوزیت قارچی مهاجم را دارند حدس زده میشود (11, 14)، بههرحال MRI در مشخص کردن گسترش بیماری در داخل جمجمه بر CT ارجح است. MRI در ارزیابی بیمارانی که علائمی از تهاجم درون جمجمهای دارند مانند تغییر در وضعیت روانی، سندرم رأس مداری[9] و ضربه نقش مهمی دارد (45). 100 درصد از میزان مرگ در بیماران با درگیری داخل جمجمه مشاهده شده است (42, 43, 46). MRI ممکن است در برخی از بیماران که بهظاهر نیازمند جراحی هستند کارا باشد و جلوی جراحی را بگیرد. شواهد سینوزیت بر روی عکس رادیولوژیک معیارهایی را برای تشخیص رینوسینوزیت قارچی مهاجم پیشنهاد میکند. قابل ذکـــر است که CT scan نرمال در بیماران با رینوسینوزیت قارچی مهاجم غیرشایع نیست. در مطالعاتی از محققین، 12 درصد از بیماران با رینوسینوزیت قارچی مهاجم سینوسهای پارانازال با CT نرمال دارند. این مشاهدات این حقیقت را افشا میکند که CT و MRI نمیتواند جایگزین اندوسکوپی و بیوپسی در تشخیص سینوزیت مهاجم باشد (28, 42). ارزیابی هیستوپاتولوژیک روی بیوپسیهای بافتی برای تأیید تشخیص سینوزیت مهاجم موردنیاز است. بیماری قارچی زمانی مهاجم در نظر گرفته میشود که معیارهای زیر را روی آزمایش هیستوپاتولوژیک داشته باشد:
1- فرمهای هایفی در داخل زیرمخاط با یا بدون تهاجم درون عروقی
2- نکروز بافتی با حداقل انفیلتراسیون سلول التهابی
در حالت ایدهآل بافت برای انجماد و برشبرداری کامل فرستاده میشود و با رنگآمیزی GMS تشخیص را تأئید کرده و اطلاعات مورفولوژی مهمی که در تعیین گونههای قارچی است را میدهد. بیوپسیهای تشخیصی بیماران را میتوان در آزمایشهای اندوسکوپی نازال تهیه کرد. اندوسکوپی نازال امکان بیوپسی مستقیم برای شناسایی ناهنجاریهای مخاطی و لزیونهای احتمالی را میدهد. جهت جلوگیری از خونریزی، بیوپسی نازال باید در موارد پلاکتهای بالای 60000/mm3 انجام شود (42).
معیارهای تشخیصی Fungal ball
شواهد رادیولوژیک شامل کدورت سینوس با یا بدون عدم تجانس رادیوگرافیک، مواد شبه خاک رسی در سینوس و توده فشرده هایف که از مخاط سینوس جداست، هستند. التهاب مزمن غیراختصاصی مخاط و عدم ائوزینوفیلی غالب یا گرانولوما و موسین آلرژیک از علائم دیگر fungal ball است. در مطالعه هیستوپاتولوژی تهاجم قارچ به لایه مخاطی مشاهده نمیشود. بیماری بیشتر در میانسالی و پیری و بیشتر در خانمها مشاهده میشود. به دنبال نقص ایمنی، بیماری میتواند شکل مهاجم به خود بگیرد؛ مثلاً در موارد پیوند کلیه و افرادی که داروهای کورتیکواستروئیدی مصرف میکنند در اطراف fungal ball موسین آلرژیک تشکیل میشود. عامل بیماری بیشتر گونههای آسپرژیلوس هستند (21).
تشخیص AFRS:
تشخیص با گرفتن تاریخچه کامل از مریض مشخص خواهد شد. بیماران معمولاً سابقهای از بیماری سینوس و درمان مرسوم و سابقه جراحی سینوس را دارند. این بیماران چندین دوره درمان آنتیبیوتیک نیز داشتهاند. ویژگی شاخص AFRS که میتواند به پزشک کمک کند شامل بیمار با سن کم و ایمنی سالم با درگیری نامتقارن یکطرفه سینوسهای پارانازال است و همچنین فقدان درد قابلتوجه، سابقه آتوپی و داشتن پولیپ در تشخیص بیماری کمککننده خواهد بود (40, 47). وجه افتراق AFRS با دیگر اشکال سینوزیت قارچی با درگیری سینوسهای پارانازال شامل رشد قارچهای ساپروفیت، مایستوما و رینوسینوزیت با موسین ائوزینوفیلی و سینوزیتهای قارچی مهاجم است. بیماران باید از نظر تمام موارد ماژور بررسی شوند و موارد مینور برای تشخیص جنبه کمکی دارد. ویژگیهای اصلی یا ماژور بیماری شامل سابقه ازدیاد حساسیت تیپ 1، تست پوستی یا Invitro، پولیپ بینی، یافتههایCT مشخص، وجود موسین ائوزینوفیلی بدون تهاجم و رنگآمیزی قارچ مثبت روی محتویات سینوس بعد از عمل جراحی است. خصوصیات فرعی یا مینور بیماری شامل سابقه آسم، شواهد رادیولوژیک تخریب استخوان، کشت قارچی مثبت، وجود کریستالهای شارکوت لیدن روی نمونههای جراحی و ائوزینوفیلی است (48). یافتههای هیستوپاتولوژیک در AFRS برای تشخیص حیاتی است. مطالعات میکروسکوپی روی نمونههای مخاطی با رنگآمیزی H&E نشاندهنده ترکیبات انفیلتره التهابی ائوزینوفیلها، لنفوسیتها و پلاسماسلهاست. مخاط ممکن است هایپرتروفیک یا هایپرپلاستیک باشد اما اثری از نکروز و سلولهای غولآسا و گرانولوما یا تهاجم به ساختارهای اطراف به اثبات نرسیده است. در رنگآمیزی H&E کریستالهای شارکوت لیدن بهراحتی قابلمشاهده هستند، اما عناصر قارچی بهخوبی قابلرؤیت نیستند. رنگآمیزی اختصاصی شامل نقره معمولاً برای هایفهای قارچی و غیرمهاجم نیاز است. کشتهای قارچی باید با احتیاط تفسیر شوند و بهتر است برای موارد کمکی بکار برده شوند، زیرا حصول اطمینان آنها بین 64 تا 100 درصد متغیر است. تشخیص AFRS در موارد کشت منفی ممکن است و از طرفی رشد قارچهای ساپروفیت نمیتواند AFRS را در کشتهای مثبت بهتنهایی تشخیص دهد. یافتههای رادیولوژیکی مثل CT درگیری یکطرفه یا نامتقارن سینوسها را نشان میدهد. موسین آلرژیک از یافتههای اصلی در تصاویرCT است، اما در AFRS اختصاصی نیست. ناهمگونی در تصاویر CT وجود دارد و در ابتدا تصور میشد که به خاطر تجمع هموسیدرین در موسین است اما اغلب تئوریهای اخیر عقیده دارند که به خاطر فلزات سنگینی مثل آهن و منیزیم است. رایجترین سینوس درگیر در AFRS سینوس اتموئید است. در اغلب موارد در تصویر CT، تخریب استخوان و گسترش موسین قارچی مشاهده میشود که این امر به خاطر گسترش طبیعی موسین و التهاب موضعی است (50-48). بیشتر سندهای ارائهشده اعلام میکنند که تقریباً 50 درصد از کودکان تخریب اوربیتال دارند. خوشبختانه در بیشتر موارد با مدیریت درست بیماری این تخریب قابلبرگشت به حالت طبیعی است (51, 52). تصاویر حاصل از MRI بهطور اختصاصی به تشخیص AFRS کمک میکند، خصوصاً وقتی این تصاویر در کنار CT تفسیر شوند. در آخر یافتههای آزمایشگاهی در تشخیص AFRS کمککننده خواهد بود، برای مثال ارزیابی IgE توتال و اختصاصی و نیز IgG اختصاصی در این بیماران ممکن است بهطور فزایندهای افزایش یابد (48).
درمان رینوسینوزیتهای قارچی
نقطه اتکا در درمان سینوزیتهای قارچی مهاجم ترکیب آنتیبیوتیکهای ضدقارچی و عمل جراحی است. روش جراحی رینوسینوزیت قارچی مهاجم در سالهای اخیر بهبود یافته است و این به خاطر شناخت بهتر بیماری و ظهور جراحی اندوسکوپی سینوس است. جراحی میزان بقا را در بیماران نوتروپنیک که مقدار WBC خود را بهبود نمیدهند، طولانی نمیکند (42, 43). فاکتور محرک کلنی گرانولوسیتی (GCSF) در بیماران نوتروپنیک اثر بسیار محرک روی مغز استخوان برای تولید گرانولوسیتها دارد (53). بیماران نوتروپنیکی که به فاکتور محرک کلنی گرانولوسیتی ([10]GCSF) پاسخ میدهند در برابر بیماری بهتر جواب میدهند. دو توضیح احتمالی برای این مشاهدات شامل موارد ذیل است:
1) پاسخ به GCSF شاخص خوبی برای وضعیت عملکرد استخوان است
2) افزایش WBC در پاسخ به GCSF نقش فعالی در بهبود بیماری دارد.
انجام عمل جراحی به دلایل زیر مهم است:
1- سرعت پیشرفت بیماری را کم کرده و زمانی را برای بهبود مغز استخوان فراهم میکند.
2- مقدار قارچ را کم میکند و وسعت پوشش نوتروفیلی را افزایش میدهد.
3- نمونه را برای کشت فراهم میکند.
مقداری از تمام نمونههای جراحی باید کشت داده شوند تا بتوان اطلاعاتی را در مورد اپیدمیولوژی قارچها و شیوع آنها بدست آورد، بهعلاوه تعیین هویت صحیح اطلاعات بالینی بااهمیتی را فراهم میکند زیرا اغلب گونهها مثل پسودوآلشریا بوئیدی به آمفوتریسین B جواب نمیدهند (25).
دوز بالای آمفوتریسین B (بیش از 1.25mg/kg/day) مهمترین افزوده در درمان رینوسینوزیت قارچی مهاجم است. دوره کامل دوز بالای آمفوتریسین B شامل دوز کامل از 2 گرم یا بیشتر است. اکثر بیماران با نقص ایمنی و تب نوتروپنیک بهطور تجربی درمان میشوند. گمان میرود که دوز بالای آمفوتریسین B بهتنهایی در درمان رینوسینوزیت قارچی مهاجم کافی نباشد. مصرف دوز بالای آمفوتریسین B در برخی بیماران با سمیت کلیوی محدودشونده است. بیماران با عدم تحمل به دوز بالای آمفوتریسین B استاندارد ممکن است برای مصرف دوز بالای آمفوتریسین B لیپوزومال انتخاب شوند. نتیجهی ترکیب چربی دارو، تجمع دوز بالایی از دارو در ریه، کبد و طحال است که در نتیجه باعث کاهش غلظت دارو در سرم و کلیهها میشود (54). آمفوتریسین لیپوزومال (5mg/kg/day) بر آمفوتریسین B (1mg/kg/day) در درمان عفونتهای قارچی ریوی ارجح است، همچنین نشان داده شده که فرم لیپوزومال دوز بالای آمفوتریسین B در درمان رینوسینوزیت قارچی مهاجم مؤثرتر است. بیماران با رینوسینوزیت قارچی مهاجم که به دوز بالای آمفوتریسین B جواب نمیدهند بهطور موفقیتآمیز با 10 گرم کمپلکس لیپیدی به دنبال ایتراکونازول خوراکی درمان شدهاند. بهطور معمول فرم لیپوزومال برای بیماران نقص ایمنی که سطح سرمی کراتینین بالای 2.5 mg/dl دارند و یا پیشرفت بیماری قارچی در خلال درمان با دوز استاندارد دوز بالای آمفوتریسین B تجویز میشود (25).
شباهتهای بین AFRS و ABPA از نظر هیستوپاتولوژی باعث درمان مشابه آنها شده است. داروهای ضدقارچی که بهطور سیستماتیک برای درمان اولیهی AFRS و ABPA بکار میروند، اثربخش نیستند و این به این دلیل است که در این بیماریها قارچ، تهاجمی به بافت ندارد. داروهای ضدقارچی موضعی مورد مطالعه قرار نگرفته است اما، بهطور منطقی استعمال داروهای موضعی برای استفاده در سطوح سینوسها منطقی نیست. درمان اولیه برای AFRS جراحی موسین آلرژیک بهمنظور کاهش حجم مخاط هایپرتروفیک و هایپرپلاستیک است. در جراحی، مواد قارچی و بافت آسیبدیده هر دو خارج میشوند و انسداد سینوسها رفع شده و مجدداً تهویه سینوسها بهدرستی انجام خواهد شد. برداشت ناقص نواحی ملتهب و آسیبدیده توسط عمل جراحی ممکن است باعث عود بیماری شود. بعد از عمل جراحی، کورتیکواستروئیدهای خوراکی از درمانهای دارویی اولیه هستند. تاکنون گزارشی از مهاجم شدن قارچ بعد از درمان کورتیکواستروئیدی پس از جراحی سینوس گزارش نشده است. همچنین به نظر میرسد مانیتور کردن سطح کلی سرمی IgE در پروسهی درمانی بیماران مناسب باشد (55).
نتیجهگیری
رینوسینوزیت قارچی (FRS) بیماریی است که در چند قرن اخیر شناخته شده است اما توصیف دقیق این بیماری به چند دهه اخیر برمیگردد.FRS شامل تظاهرات و علائم مختلفی است و طیف وسیعی از پاسخهای ایمنی را دربر میگیرد، هر چند که اجماعی برای معنای لغوی و پاتوژنز آن وجود ندارد و فاقد مدیریت بهینه است. ISHAM گروهی را برای تلاش دستهجمعی بهمنظور ترمینولوژی و دستهبندی بیماری گرد هم آورد. بیماری بهطور رایج به دو نوع مهاجم و غیرمهاجم تقسیمبندی میشود که در نوع مهاجم قارچ به بافت زیرمخاطی سینونازال تهاجم پیدا کرده است. FRS غیرتهاجمی شامل Fungus ball (توده قارچی بدون پاسخ التهابی اطراف ناحیه سینونازال) و رینوسینوزیت قارچی آلرژیک است که نیازمند عمل جراحی و درمان دارویی است (27, 56). Fungus ball توده قارچی با حداقل واکنش التهابی و عدم تهاجم بافتی یا وجود واکنش گرانولوماتوز مشخص میشود و نیز مشخصه نوع آلرژیک وجود موسین ائوزینوفیلی به همراه سلولهای التهابی و کریستالهای شارکوت لیدن و عدم تهاجم به بافت است. نوع تهاجمی نیز به دو نوع حاد و مزمن تقسیمبندی میشود که این نوع تقسیمبندی بر اساس طول مدت زمان علائم قبل از بروز بیماری مشخص میشود. رایجترین دستهبندی رینوسینوزیت قارچی مهاجم توسط DeShazo و همکاران صورت گرفته که طبق آن شامل 3 فرم است: رینوسینوزیت قارچی گرانولوماتوز مهاجم، رینوسینوزیت قارچی مزمن مهاجم و رینوسینوزیت قارچی برقآسای حاد. در نوع گرانولوماتوز، تهاجم اشکال قارچی به ناحیه زیرمخاطی همراه با التهاب مزمن و فیبروز و تولید گرانولوما با علائم طولانی مشاهده میشود. در نوع مزمن مهاجم، تهاجم اشکال قارچی به ناحیه زیرمخاطی اغلب با احاطه التهاب مزمن و فیبروز در بیماران با علائم بیش از 3 ماه مشخص میشود و در آخر اینکه در نوع مهاجم حاد یا برقآسا تهاجم اشکال قارچی به ناحیه زیرمخاطی به همراه تهاجمهای مکرر به مویرگها و بروز نکروز مشاهده شده و علائم بالینی با بروز کمتر از یک ماه دارند. شدت نقص ایمنی فرد در زمان بروز و سرعت پیشرفت بیماری نقش اساسی دارد. سینوزیت قارچی مهاجم در افراد دارای سیستم ایمنی مناسب بهشدت نادر است اما در افرادی که سیستم ایمنی آنها دچار اختلال شده مانند سرطان خون و افراد پیوند مغز استخوان شیوعی بین 1/7 تا 2/6 درصد را دارد (28, 43, 57, 58). گونههایی که بیشتر باعث سینوزیت قارچی میشوند به تفکیک نوع سینوزیت ایجادشده عبارتند از:
در نوع Fungus ball بیشتر گونههای آسپرژیلوس و در نوع آلرژیک انواع قارچها میتوانند مسبب این نوع شوند اما در بیشتر موارد قارچهای سیاه جدا شدهاند.
چندین گونهی قارچ در بیماران با رینوسینوزیت قارچی مهاجم نیز شناسایی شده که اغلب گونههای آسپرژیلوس (فلاووس، فومیگاتوس، ترئوس و نایجر) و زایگومیستها (رایزوموکور، رایزوپوس و موکور) است (61-59). درمان سینوزیت قارچی مهاجم استفاده همزمان از جراحی و داروی ضدقارچی است، با این وجود به دلیل پیشرفت سریع بیماری هنوز میزان مرگ بین 47 تا 80 درصد است (23, 62, 63)، با این وجود هنوز هم شواهد هیستوپاتولوژیک مبنی بر وجود قارچ در نمونه موردنیاز است، همچنین در تشخیص اولیه بیماری، اندوسکوپی و شواهد رادیولوژیکی جهت تشخیص کمککننده است (64). هیستوپاتولوژی “gold standard” هم برای تشخیص است. تشخیص هیستوپاتولوژیک قارچها در نمونههای بافتی، نیازمند تجربه بسیار بالا در این زمینه بوده و همچنین این روش قادر به تعیین جنس و گونه عامل بیماری نیست، بعلاوه در بیش از 50 درصد نمونههایی که در روش هیستوپاتولوژیک مثبت تشخیص داده میشوند، ارگانیسم موجود در نمونههای بافتی قادر به رشد در محیطهای کشت قارچی نبوده و تعیین دقیق همه عوامل ایجادکننده بیماری در سطح گونه را جهت مطالعات اپیدمیولوژیک با مشکلات جدی مواجه مینماید (65)، از طرف دیگر ناتوانی در تأیید تشخیص هیستوپاتولوژیکی و تعیین گونه عامل بیماری مشکلاتی را در درمان بیماری بوجود میآورد. در مقایسه با گونههای آسپرژیلوس که بهطور معمول نسبت به وریکونازول، آمفوتریسین B و اکینوکاندینها حساس هستند، موکورالها تنها به آمفوتریسین B و به میزان کمتر به پسوکونازول حساسیت دارند، بعلاوه حساسیت جنسهای مختلف موکورالها به داروها متفاوت است. در یک مطالعه در حالی که100 درصد گونههای آبسیدیا و رایزوپوس نسبت به آمفوتریسین B حساسیت نشان دادند، در گونههای کانیگهاملا حساسیت به 60 درصد رسید (66)، بنابراین تکنیکهای جدید جهت تأیید تشخیص عوامل قارچی سینوزیت در نمونههای بافتی و تعیین گونههای مسبب عفونت ضروری است. بررسیها و گزارشهای در دسترس از ایران اکثراً بر پایه تشخیص میکروسکوپی و کشت انجام پذیرفته است، لذا انجام بررسیهای کامل با کمک روشهای مولکولی نوین جهت مشخص نمودن میزان شیوع عفونت و تعیین دقیق تمام گونههای ایجادکننده رینوسینوزیت قارچی به لحاظ اهمیت جنبههای اپیدمیولوژیک و درمانی بیماری ضروری بهنظر میرسد.
منابع:
- Meltzer EO, Hamilos DL, Hadley JA, Lanza DC, Marple BF, Nicklas RA, et al. Rhinosinusitis: establishing definitions for clinical research and patient care. Journal of Allergy and Clinical Immunology. 2004;114(6):155-212.
- Lanza DC, Dhong H-J, Tantilipikorn P, Tanabodee J, Nadel DM, Kennedy DW. Fungus and chronic rhinosinusitis: from bench to clinical understanding. Annals of Otology, Rhinology & Laryngology. 2006;115(9_suppl):27-34.
- O’brien M, Chapin K, Soto-Aguilar M, Gardner L, Swain R. A new classification and diagnostic criteria for invasive fungal sinusitis. Archives of Otolaryngology–Head & Neck Surgery. 1997;123(11):1181-8.
- Chakrabarti A, Chatterjee SS, MR S. Overview of opportunistic fungal infections in India. Nippon Ishinkin Gakkai Zasshi. 2008;49(3):165-72.
- Hawksworth DL. The magnitude of fungal diversity: the 1.5 million species estimate revisited** Paper presented at the Asian Mycological Congress 2000 (AMC 2000), incorporating the 2nd Asia-Pacific Mycological Congress on Biodiversity and Biotechnology, and held at the University of Hong Kong on 9-13 July 2000. Mycological research. 2001;105(12):1422-32.
- Mankekar G. Invasive fungal rhinosinusitis: Springer; 2014.
- Chatterjee SS, Chakrabarti A. Epidemiology and medical mycology of fungal rhinosinusitis. Otorhinolaryngol Clin Int J. 2009;1:1-13.
- Hora JF. Primary aspergillosis of the paranasal sinuses and associated areas. The Laryngoscope. 1965;75(5):768-73.
- Chakrabarti A, Sharma S, Chander J. Epidemiology and pathogenesis of paranasal sinus mycoses. Otolaryngology–Head and Neck Surgery. 1992;107(6_part_1):745-50.
- Hussain S, Salahuddin N, Ahmad I, Salahuddin I, Jooma R. Rhinocerebral invasive mycosis: occurence in immunocompetent individuals. European journal of radiology. 1995;20(2):151-5.
- Washburn RG, Kennedy DW, Begley MG, Henderson DK, Bennett JE. Chronic fungal sinusitis in apparently normal hosts. Medicine. 1988;67(4):231-47.
- Safirstein BH. Allergic bronchopulmonary aspergillosis with obstruction of the upper respiratory tract. Chest. 1976;70(6):788-90.
- McGill TJ, Simpson G, Healy GB. Fulminant aspergillosis of the nose and paranasal sinuses: a new clinical entity. The Laryngoscope. 1980;90(5):748-54.
- Talbot GH, Huang A, Provencher M. Invasiveaspergillus rhinosinusitis in patients with acute leukemia. Reviews of infectious diseases. 1991;13(2):219-32.
- Millar J. Allergic aspergillosis of the maxillary sinuses. Thorax. 1981;36:710.
- Allphin AL, Strauss M, Abdul‐Karim FW. Allergic fungalsinusitis: problems in diagnosis and treatment. The Laryngoscope. 1991;101(8):815-20.
- Manning SC, Schaefer SD, Close LG, Vuitch F. Culture-positive allergic fungal sinusitis. Archives of Otolaryngology–Head & Neck Surgery. 1991;117(2):174-8.
- BentIII JP, Kuhn FA. Diagnosis of allergic fungal sinusitis. Otolaryngology—Head and Neck Surgery. 1994;111(5):580-8.
- Ponikau JU, Sherris DA, Kern EB, Homburger HA, Frigas E, Gaffey TA, et al., editors. The diagnosis and incidence of allergic fungal sinusitis. Mayo Clinic Proceedings; 1999: Elsevier.
- Swain RE. Diagnostic criteria for allergic fungal sinusitis. Journal of Allergy and Clinical Immunology. 1995;96(1):24-35.
- O’brien M, Chapin K, Soto-Aguilar M, Swain R, Lyons M, Bryars WC, et al. Criteria for the diagnosis of sinus mycetoma. Journal of Allergy and Clinical Immunology. 1997;99(4):475-85.
- Ferguson BJ. Definitions of fungal rhinosinusitis. Otolaryngologic Clinics of North America. 2000;33(2):227-35.
- Epstein VA, Kern RC. Invasivefungal sinusitis and complications of rhinosinusitis. Otolaryngologic Clinics of North America. 2008;41(3):497-524.
- Stringer SP, Ryan MW. Chronic invasive fungal rhinosinusitis. Otolaryngologic Clinics of North America. 2000;33(2):375-87.
- Gillespie MB, O’Malley BW. An algorithmic approach to the diagnosis and management of invasive fungal rhinosinusitis in the immunocompromised patient. Otolaryngologic Clinics of North America. 2000;33(2):323-34.
- Sridhara SR, Paragache G, Panda NK, ChakrabartiA. Mucormycosis in immunocompetent individuals: an increasing trend. Journal of otolaryngology. 2005;34(6).
- Chakrabarti A, Denning DW, Ferguson BJ, Ponikau J, Buzina W, Kita H, et al. Fungal rhinosinusitis. The Laryngoscope. 2009;119(9):1809-18.
- DeShazo RD, Chapin K, Swain RE. Fungal sinusitis. New England Journal of Medicine. 1997;337(4):254-9.
- Veress B, Malik OA, El Tayeb AA, El Daoud S, Mahgoub ES, El Hassan AM. Further observations on the primary paranasal aspergillus granuloma in the Sudan: A morphological study of 46 cases. The American journal of tropical medicine and hygiene. 1973;22(6):765-72.
- Milroy C, Blanshard J, Lucas S, Michaels L. Aspergillosis of the nose and paranasal sinuses. Journal of clinical pathology. 1989;42(2):123-7.
- Grosjean P, Weber R. Fungus balls of the paranasal sinuses: a review. European archives of oto-rhino-laryngology. 2007;264(5):461-70.
- Glass D, Amedee RG. Allergic fungal rhinosinusitis: a review. The Ochsner Journal. 2011;11(3):271-5.
- Lethbridge-Çejku M, Vickerie JL. Summary health statistics for US adults; National Health Interview Survey, 2003. 2004.
- Lund V. Infectious rhinosinusitis in adults: classification, etiology and management. Anales de Otorrinolaringologia Mexicana 1998. 1998.
- Dufour X, Kauffmann-Lacroix C, Ferrie J, Goujon J, Rodier M, Klossek J. Paranasal sinus fungus ball: epidemiology, clinical features and diagnosis. A retrospective analysis of 173 cases from a single medical center in France, 1989–2002. Sabouraudia. 2006;44(1):61-7.
- Pagella F, Matti E, Bernardi FD, Semino L, Cavanna C, Marone P, et al. Paranasal sinus fungus ball: diagnosis and management. Mycoses. 2007;50(6):451-6.
- Hsiao C-H, Li S-Y, Wang J-L, Liu C-M. Clinicopathologic and immunohistochemical characteristics of fungal sinusitis. Journal of the Formosan Medical Association= Taiwan yi zhi. 2005;104(8):549-56.
- Ferguson BJ. Eosinophilic mucin rhinosinusitis: a distinct clinicopathological entity. The Laryngoscope. 2000;110(5):799-813.
- Chakrabarti A, Das A, Mandal J, Shivaprakash M, George VK, Tarai B, et al. The rising trend of invasive zygomycosis in patients with uncontrolled diabetes mellitus. Sabouraudia. 2006;44(4):335-42.
- Manning SC, Holman M. Further evidence for allergicpathophysiology in allergic fungal sinusitis. The Laryngoscope. 1998;108(10):1485-96.
- Berlinger NT. Sinusitis in immunodeficient and immunosuppressed patients. The Laryngoscope. 1985;95(1):29-33.
- Gillespie MB, O’malley BW, Francis HW. An approachto fulminant invasive fungal rhinosinusitis in the immunocompromised host. Archives of Otolaryngology–Head & Neck Surgery. 1998;124(5):520-6.
- Kennedy CA, Adams GL, Neglia JR, Giebink GS. Impact of surgical treatment on paranasal fungal infections in bone marrow transplant patients. Otolaryngology–Head and Neck Surgery. 1997;116(6):610-6.
- Wiatrak BJ, Willging P, Myer III CM. Functional endoscopic sinus surgery in the immunocompromised child. Otolaryngology—Head and Neck Surgery. 1991;105(6):818-25.
- Lueg EA, Ballagh RH, Forte V. Analysis of the recent cluster of invasive fungal sinusitis at the Toronto Hospital for Sick Children. The Journal of otolaryngology. 1996;25(6):366-70.
- Iwen PC, Rupp ME, Hinrichs SH. Invasive mold sinusitis: 17 cases in immunocompromised patients and review of the literature. Clinical infectious diseases. 1997;24(6):1178-84.
- Kuhn FA, Javer AR. Allergic fungal rhinosinusitis: perioperative management, prevention of recurrence, and role of steroids and antifungalagents. Otolaryngologic clinics of North America. 2000;33(2):419-32.
- Ryan MW, Marple BF. Allergic fungal rhinosinusitis: diagnosis and management. Current opinion in otolaryngology & head and neck surgery. 2007;15(1):18-22.
- Marple BF. Allergic fungal rhinosinusitis: current theories and management strategies. The laryngoscope. 2001;111(6):1006-19.
- Manning SC, Merkel M, Kriesel K, Vuitch F, Marple B. Computed tomography and magnetic resonance diagnosis of allergic fungal sinusitis. The Laryngoscope. 1997;107(2):170-6.
- Campbell JM, Graham M, Gray HC, Bower C, Blaiss MS, Jones SM. Allergic fungal sinusitis in children. Annals of Allergy, Asthma & Immunology. 2006;96(2):286-90.
- McClay JE, Marple B, Kapadia L, Biavati MJ, Nussenbaum B, Newcomer M, et al. Clinical presentation of allergic fungal sinusitis in children. The laryngoscope. 2002;112(3):565-9.
- Denning DW, Stevens DA. Antifungal and surgical treatment of invasive aspergillosis: review of 2,121 published cases. Reviews of infectious diseases. 1990;12(6):1147-201.
- Kline S, Larsen TA, Fieber L, Fishbach R, Greenwood M, Harris R, et al. Limited toxicity of prolonged therapy with high doses of amphotericin B lipid complex. Clinical infectious diseases. 1995:1154-8.
- SchubertMS. Medical treatment of allergic fungal sinusitis. Annals of Allergy, Asthma & Immunology. 2000;85(2):90-8.
- Chakrabarti A, Das A, Panda NK. Controversies surrounding the categorization of fungal sinusitis. Medical Mycology. 2009;47(Supplement_1):S299-S308.
- Drakos P, Nagler A, Or R, Naparstek E, Kapelushnik J, Engelhard D, et al. Invasive fungal sinusitis in patients undergoing bone marrow transplantation. Bone marrow transplantation. 1993;12(3):203-8.
- Deshazo RD. Syndromes of invasive fungalsinusitis. Medical mycology. 2009;47(Supplement_1):S309-S14.
- Schubert MS. Fungal rhinosinusitis: diagnosis and therapy. Current allergy and asthma reports. 2001;1(3):268-76.
- Michael RC, Michael JS, Ashbee RH, Mathews MS. Mycological profile of fungal sinusitis: An audit of specimens over a 7-year period in a tertiary care hospital in Tamil Nadu. Indian Journal of Pathology and Microbiology. 2008;51(4):493.
- Montone KT, Livolsi VA, Feldman MD, Palmer J, Chiu AG, Lanza DC, et al. Fungal rhinosinusitis: a retrospective microbiologic and pathologic review of 400 patients at a single university medical center. International journal of otolaryngology. 2012;2012.
- Hachem R, Boktour M, Hanna H, Husni R, Hanna E, Keutgen X, et al. Sinus surgery combined with antifungal therapy is effective in the treatment of invasive Aspergillus sinusitis in neutropenic patients with cancer. Infection. 2008;36(6):539-42.
- DelGaudio JM, Swain RE, Muller S, Hudgins PA. Computed tomographic findings in patients with invasive fungal sinusitis. Archives of Otolaryngology–Head & Neck Surgery. 2003;129(2):236-40.
- DelGaudio JM, Clemson LA. An early detection protocol for invasive fungal sinusitis in neutropenic patients successfully reduces extent of disease at presentation and long term morbidity. The laryngoscope. 2009;119(1):180-3.
- Roden MM, Zaoutis TE, Buchanan WL, Knudsen TA, Sarkisova TA, Schaufele RL, et al. Epidemiology and outcome of zygomycosis: a review of 929 reported cases. Clinical Infectious Diseases. 2005;41(5):634-53.
- Almyroudis NG, Sutton DA, Fothergill AW, Rinaldi MG, Kusne S. In vitro susceptibilities of 217 clinical isolates of zygomycetes to conventional and new antifungal agents. Antimicrobial agents and chemotherapy. 2007;51(7):2587-90.
[1] Allergic bronchopulmonary aspergillosis
[2] Invasive fungal rhinosinusitis
[3]Acute invasive fungal rhinosinusitis
[4] Granulomatous invasive fungal sinusitis
[5]Chronic invasive fungal rhinosinusitis
[6]Saprophytic fungal rhinosinusitis
[7]Fungal ball
[8]Allergic fungal rhinosinusitis
[9]orbital apex syndrome
[10]Granulocyte colony stimulating factor
بررسی آئروسلهای قارچی آلودهکننده محیط آزمایشگاه جانورشناسی دانشگاه پرند
اهمیت ارزیابی D-β-Glucan-3-1 در تشخیص عفونتهای مهاجم قارچی
عفونتهای قارچی در گیرندگان پیوند اعضاء جامد(2)
برای دانلود پی دی اف برروی لینک زیر کلیک کنید
ورود / ثبت نام