آئین کار کنترل ریسکهای میکروبی در محیط تولید فرآوردههای مراقبت بهداشتی مبتنی بر سلول
مرجان حیدرزاده
عضو هیئت علمی گروه بیولوژی پژوهشکده صنایع غذایی و کشاورزی پژوهشگاه استاندارد
فرآورده مراقبت بهداشتی مبتنی بر سلول(CBHP[1]) ، سلولهای پروکاریوتی یا یوکاریوتی یا مواد مشتقشده از سلول زنده بهعنوان یک عنصر ضروری را، شامل میشود. مواد اولیه مبتنی بر سلول و یا مشتقشده مورد استفاده در تولید انواع CBHP، میتواند قابل رشد یا غیرقابل رشد با منشأ انسانی، حیوانی، میکروبی و یا گیاهی باشد. یکی از ویژگیهای مشترکCBHP ها، مؤثر بودنشان بر پایه ویژگیهای زیستی آنها است. این فرآوردهها بهعنوان دارو، وسایل پزشکی، فرآوردههای زیستی یا ترکیبی طبقهبندی میشوند که تولید آنها با قوانین بینالمللی، ملی و/ یا منطقهای حمایت میشود.
CBHPهای دارای برچسب «سترون[2]»
یک CBHP که با عنوان «سترون» برچسبگذاری میشود توسط یک فرآیند سترونسازی نهایی یا طی فرآیند آسپتیک، بهدست میآید.
تضمین سترونی برای این CBHP ها از طریق طراحی مناسب و کنترل محیط، کنترل مواد اولیه و بستهبندی، طراحی مناسب و بهینهسازی فرآیندهای تولید، استفاده مناسب از کنترل حین فرآیند در طول تولید و آزمون برای نشان دادن دستیابی به شرایط فرآیند آسپتیک، صورت میگیرد.
CBHPهای بدون برچسب ادعای سترونی
برای یکCBHP که بدون برچسب ادعای سترونی عرضهشده، برای مثال، بافت قرنیه یا پیوند پوست زنده، فرآوری شامل استفاده از روشهای آسپتیک مناسب در تمام مراحل، در طول فرآیند است.
ممکن است اجزاء در طی آمادهسازی قبل از تجمیع و یا ترکیب برای ایجاد فرآورده نهایی، در معرض کاهش بار میکروبی قرار گیرند که این برای به حداقل رساندن پتانسیل آلودگی ذاتی فرآورده برای جلوگیری از آلودگی در طول فرآوری و جلوگیری از آلودگی ذاتی فرآورده لازم است. کنترلها و روشهای حفظ کیفیت فرآورده در طول فرآیند تولید اینCBHP ها ممکن است متفاوت از آنهایی باشد که برای فرآوری یکCBHP با برچسب «سترون» بهکار میرود.
تضمین کیفیت میکروبیولوژیکی برای یک CBHP بدون برچسب ادعای سترونی، از طریق کنترل محیط، کنترلهای مواد اولیه و بستهبندی، طراحی و کیفیت مناسب فرآیندهای تولید، تأیید فرآیند و مطالعات شبیهسازی فرآیند و بکارگیری کنترلها و آزمونهای داخلی مناسب بدست میآید. ارزیابی ریسک، انتخاب معیارهای کیفیت میکروبیولوژیکی مناسب برای یکCBHP بدون برچسب ادعای سترونی را حمایت میکند. این ضوابط برای اطمینان از اینکه فرآورده نهایی یک ریسک میکروبیولوژیکی بیماریزا محسوب نمیشود، قابلقبول بودن آن را بر اساس حضور یا عدم حضور یا تعداد میکروارگانیسمها، در هر مقدار مشخص از فرآورده برای بیمار تعریف میکند.
هدف از این مقاله، بیان حداقل الزامات و راهنماییهای لازم برای محیط فرآوری فرآوردههای مراقبت بهداشتی مبتنی بر سلول (CBHPs) بهمنظور کنترلهای لازم برای آلودگیهای میکروبی زنده یا غیرزنده است.
محیط تولید
الزامات زیر باید مورد بررسی قرار گیرند:
الف- قرنطینه کردن مواد آلوده بالقوه؛
ب- استفاده از هوابستها برای تجهیزات، مواد و کارکنان؛
پ- مناسب بودن ظروف و بستهبندیها؛
ت- نیاز به تجهیزات محافظتکننده از کارکنان؛
ث- نیاز به دفع تخصصی و مدیریت خطرات بالقوه و مواد زائد خطرناک؛
ج- نیاز به معیارهای بهداشتی اختصاصی؛
چ- نیاز به محصورسازی شامل مکان قابل اجرا، اتاقهای فشار هوای منفی؛
ح- کنترل سطح محیطی بر اساس مرحله فرآیند و درجه ریسک آلودگی (برای مثال نواحی فرآوری سلول)؛
خ- نیاز به استفاده ترکیبات یکبار مصرف و/ یا قابل دفع؛
د- نیاز به مستندات کنترل آلودگیهای بالقوه پوشاننده ورودی، خروجی و بایگانی
طراحی محیط تولید
ناحیهی محصورشده
نتایج بررسیها باید ارائهدهنده الزامات محصورسازی باشند. ناحیه محصورشده باید مطابق با تعیین فرآیند و ارزیابی ریسک، طراحی شود. طرح بازنگری باید مستند شود.
ویژگیهای محصورسازی ساختمان
الف- تسهیلات باید طوری ساخته شود که از فرار هوای آلودهشده و انتشار آن از تسهیلات محصورشده به سایر تسهیلات و محیط خارجی ممانعت به عمل آورد. برای اطلاعات بیشتر در مورد تسهیلات محصورشده به پیوست مراجعه شود.
ب- تسهیلات باید بهگونهای طراحی شود که در صورت نیاز بتواند بهآسانی پاکسازی و یا آلودگیزدایی شود.
یادآوری- برای طراحی تسهیلات محصورشده باید به قوانین ملی و/ یا منطقهای توجه شود.
چیدمان
الف- تسهیلات باید مطابق تعیین فرآیند و بر پایه مدیریت ریسک طراحی شوند (مثالها در اشکال 1 تا 8 ذکر شدهاند). یک بازنگری طراحی باید اجرا و برای هریک از تسهیلات، بهعنوان بخشی از تعیین فرآیند، ثبت شود.
ب- علاوه بر تولید، آزمون CBHP (برای مثال کنترل کیفی، سرویس تشخیصی) هم در همان ساختمان انجام شود، باید سیستمهای محصورشده جداگانه، تعبیه و نگهداری شوند. سطح محصورشده موردنیاز باید بر اساس مدیریت ریسک باشد.
پ- محلهایی که فشار هوای منفی یا کابینتهای ایمن زیستی در فرآوری CBHP مورد استفاده قرار میگیرند، باید با اتاقهای تمیز احاطه شوند.
ت- کابینتهای ایمن زیستی باید دارای گواهی سالیانه بر اساس الزامات ملی و/ یا منطقهای باشند. سیستمهای گرمایی، تهویه و کولرها (سیستم HVAC) نباید با جریان هوای کابینتهای ایمن زیستی تداخل داشته باشند.
ث- مدیریت صحیح و کنترل جریان هوا و اختلاف فشار در تسهیلات محصورشده، یک جنبه اساسی در تضمین محصورسازی مؤثر است. هوابستهای برای تسهیلات محصورشده باید ناحیه محصورشده را از سایر بخشهای تسهیلات، یا سایر فضاهای بیرون از تسهیلات جدا نماید. این هوابستها باید بهگونهای طراحی شوند که بدون تأثیر بر روی جریان هوای داخلی ناحیه محصورشده، به کارکنان، تجهیزات و مواد، اجازهی عبور را بدهند.
ج- در هر کجا که امکانپذیر باشد، فرآیندهای تصفیه ویروس باید مسیر یکطرفه بوده و جداسازی فیزیکی نواحی قبل و پس از تولید ویروسی اعمال شود.
چ- نیاز به تعبیه یک رختکن شامل محل سینکهای شستشو و/ یا دوشهای کارکنان باید مورد بررسی قرار گیرد.
مسیر عبور مواد و کارکنان
اصول روشهای اجرایی مسیر عبور مواد و کارکنان باید مطابق تعیین فرآیند مشخص شود تا از موارد زیر اطمینان حاصل شود:
الف- جلوگیری از آلودگی متقاطع و
ب- عدم نقص در محصورسازی
تجهیزات
فرآیندهای انتقال تجهیزات به/ یا از تسهیلات محصورشده باید بهگونهای طراحی شود که از آلودگی جلوگیری کند.
چنانچه یک دستگاه سترونکننده حرارت مرطوب دو درب، حدفاصل دو کلاس اتاق تمیز نصب شود، باید دارای درهای از درون قفلشونده باشد.
یادآوری- آلودگیزدایی زیستی میتواند توسط روشهای حرارتی و یا شیمیایی انجام شود.
جابهجایی مواد زاید
الف- مسیر عبور مواد زاید باید بهگونهای طراحی شود تا از هرگونه آلودگی متقاطع جلوگیری بهعمل آورد.
ب- مواد مصرفی آلودهشده (برای مثال فیلترها) باید با استفاده از یک روش ایمن حذف شوند.
پ- مواد زائد آلودهشده (برای مثال پسماند جامد یا مایع مواد سلولی، مواد مبتنی بر غیرسلولی، میعانات آلوده از دستگاه سترونکننده، فرمانتور و غیره) باید طبق قوانین ملی یا منطقهای دفع شوند.
سیستم HVAC[3]
الف- یک سیستم تصفیه هوای مناسب، باید بر اساس تعیین فرآیند تهیه شود.
ب- دستگاه تهویه هوا باید بررسی و هر کجا که لازم بنظر میرسد برای جلوگیری از انتشار آلودگی یا احتمال آلودگی متقاطع، نصب شود.
یادآوری- در طراحی HVAC اتاق تمیز، جداسازی نرمال نواحی با استفاده از نصب یک سیستم تصفیه هوای جداگانه برای هر ناحیه از انجام فرآیند در نظر گرفته میشود.
پ- علائم دیداری و شنیداری بیانگر نقص در تهویه، باید فراهم شود.
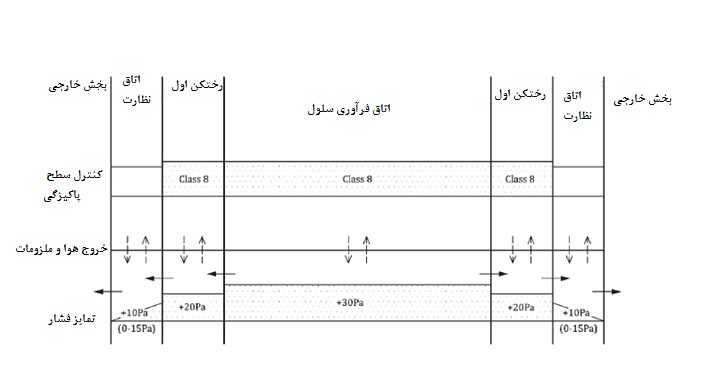
ت- تمام خروجیهای هوا از ناحیه محصورشده به محیط آزاد باید از فیلترهای مناسب بر اساس ماهیت آلودگی شناساییشده حین فرآیند ارزیابی ریسک برخوردار باشند (برای مثال فیلترهای HEPA کلاس H45 برای آلودگیهای باکتریایی).
ث- هوای خارجشده از ناحیه محصورشده، نباید دوباره به نواحی دیگر از تسهیلات محصورشده بازگردد.
یادآوری- برای اطلاعات بیشتر در ارتباط با تسهیلات محصورشده به پیوست مراجعه نمایید.
سرویسهای مصرفی و تجهیزات فرعی
مواد مصرفیای که به تسهیلات محصورشده وارد میشوند باید از کیفیت مناسب برای جلوگیری از آلودگی زیستی فرآورده، تجهیزات و کارکنان برخوردار باشند.
یادآوری- خطوط مصرف (برای مثال بخار، هوا، آب، خلأ) که با تجهیزات فرآیند در ارتباط مستقیم هستند در ریسک آلوده شدن هستند یا میتوانند منبع مهمی از آلودگیهای زیستی باشند.
برنامههای نظارتی کارکنان و محیط
تسهیلات و کارکنان برای آلودگی زیستی ناشی از فرآیند، بر اساس یک برنامه مستندشده باید نظارت شوند.
پیوست اطلاعاتی
تسهیلات محصورسازی
1- طراحی محیط تولید با کمدهای ایمنی زیستی
شکلهای 1 تا 4 مثالهایی از چیدمان را نشان میدهند؛ اگرچه، بسته به فرآیند تولید، چیدمانهای دیگر نیز ممکن است مورد ملاحظه قرار گیرند.
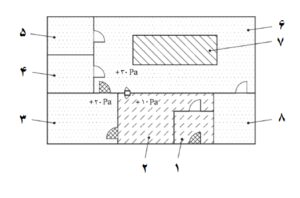
شکل 1- مثالی از تسهیلات محصورسازی برای CBHP دارای کمدهای ایمنی
کلید:
1 ورودی 5 اتاق آمادهسازی 9 کمد ایمنی
2 اتاق نظارت 6 اتاق انبارش مواد 10 رختکن دوم (کندن گان)
3 رختکن اول 7 رختکن دوم (پوشش گان) 11 اتاق انبارش نمونه
4 ناحیه بافری 8 اتاق فرآوری سلول
یادآوری 1- این چیدمان اجازه ورود و کار با مواد اولیه غیرسترون تحت شرایط مناسب اتاق تمیز در یک ناحیه طراحیشده بدون ایجاد خطر برای منطقه فرآوری آسپتیک را میدهد.
یادآوری 2- برای تمایز فشار به شکل 4 مراجعه شود.
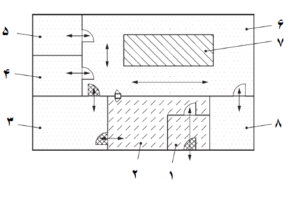
شکل 2- مثالی از عبور کارکنان به یک بخش محصورشده دارای کمد ایمنی
کلید:
1 ورودی 5 اتاق آمادهسازی 9 کمد ایمنی
2 اتاق نظارت 6 اتاق انبارش مواد 10 رختکن دوم (کندن گان)
3 رختکن اول 7 رختکن دوم (پوشش گان) 11 اتاق انبارش نمونه
4 ناحیه بافری 8 اتاق فرآوری سلول
شکل 3– مثالی از مسیر عبور مواد به ناحیه محصورشده دارای کمد ایمنی
کلید:
1 ورودی 5 اتاق آمادهسازی 9 کمد ایمنی
2 اتاق نظارت 6 اتاق انبارش مواد 10 رختکن دوم (کندن گان)
3 رختکن اول 7 رختکن دوم (پوشش گان) 11 اتاق انبارش نمونه
4 ناحیه بافری 8 اتاق فرآوری سلول
شکل 4– مثالی برای جداسازی داخل ناحیه محصورشده دارای کمدهای ایمنی که توسط عمل مکش هوا، تمایز فشار و سدهای فیزیکی حاصل میشود
کلید:
2- طراحی محیط تولید با ایزولاتورها یا سیستم (های) بسته
شکلهای 5 تا 8 مثالهایی از چیدمان را نشان میدهند؛ اگرچه، بسته به فرآیند تولید سایر چیدمانها میتوانند موردنظر قرار گیرند.
شکل 5– مثالی از ناحیه محصورشده برای CBHP، با ایزولاتورها
کلید:
1 ورودی 4 اتاق آمادهسازی 7 ایزولهکنندهها یا سیستمهای بسته
2 اتاق نظارت 5 اتاق انبارش مواد 8 اتاق انبارش نمونه
3 رختکن اول 6 اتاق فرآوری سلول
یادآوری 1- این چیدمان اجازه ورود و کار با مواد اولیه غیرسترون را تحت شرایط مناسب اتاق تمیز در یک ناحیه طراحیشده بدون ایجاد خطر برای منطقه فرآوری آسپتیک را میدهد.
یادآوری 2- برای تمایز فشار به شکل پ-8 مراجعه شود.
شکل 6– مثالی از مسیر عبور کارکنان در ناحیه محصورشده همراه با ایزولاتورها
کلید:
1 ورودی 4 اتاق آمادهسازی 7 ایزوله کنندهها یا سیستمهای بسته
2 اتاق نظارت 5 اتاق انبارش مواد 8 اتاق انبارش نمونه
3 رختکن اول 6 اتاق فرآوری سلول
شکل 7– مثالی از عبور مواد در ناحیهی مهاری همراه با ایزولهکنندهها
کلید:
1 ورودی 4 اتاق آمادهسازی 7 ایزولهکنندهها یا سیستمهای بسته
2 اتاق نظارت 5 اتاق انبارش مواد 8 اتاق انبارش نمونه
3 رختکن اول 6 اتاق فرآوری سلول
شکل 8– مثالی برای جداسازی در داخل ناحیه محصورشده دارای ایزولاتورها که توسط عمل مکش هوا، تمایز فشار و سدهای فیزیکی حاصل میشود
کلید:
منابع:
[1] ISO 11737-1, Sterilization of medical devices — Microbiological methods — Part 1: Determination of a population of microorganisms on products
[2] ISO 13408-2, Aseptic processing of health care products — Part 2: Filtration
[3] ISO 14161:2009, Sterilization of health care products — Biological indicators — Guidance for the selection, use and interpretation of results
[4] ISO/TS 17665-2, Sterilization of health care products — Moist heat — Part 2: Guidance on the application of ISO 17665-1
[5] ISO 29463-1, High-efficiency filters and filter media for removing particles in air — Part 1: Classification, performance testing and marking
[6] COMMISSION DIRECTIVE 2003/94/EC of October 2003 laying down the principles and guidelines of good manufacturing practice in respect of medicinal products for human use andinvestigational medicinal products for human use
[7] DIRECTIVE 2001/83/ EC OF THE EUROPEAN PARLIAMENT AND OF THE COUNCIL OF 6November 2001 on the communit y code relating to medicinal products for human use
[8] EMEA/CHMP/410869/2006 11. January 2007 Draf t; Guideline on human cell-based medicinal products (COMMITTEE FOR HUMAN MEDICINAL PRODUCT (CHMP))
[9] EMEA/CHMP/CPWP/83508/2009, 22 October 2009; Guideline on xenogeneic cell-basedmedicinal products
[10] GMP EU-Guide to Good Manufacturing Practice for Medicinal Products
[11] FDA 21 CFR Part 1271, Human cells, t issues, and cellular and tissue-based products
[12] GCP Good Clinical Practice Ph.Eur. European Pharmacopeia, 5th Edition
[13] Australian Regulatory Guidelines for Biologicals (ARGB) – Part 1 – Introduction to the Australian Regulatory Guidelines for Biologicals, June 2011
[14] Australian Regulatory Guidelines for Biologicals (ARGB) – Part 2 – Regulatory life cycle for biologicals that are included on the Australian Register of Therapeutic Goods, June 2011
[15] Australian Code of Good Manufacturing Practice for human blood and blood components, human tissues and human cellular therapy products, Version 1.0, April 2013
[16] EU guidelines for Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use – Annex 2: Manufacture of Biological active substances and Medicinal Pro or animal origin
[17] ICH Q5A(R1), Viral safet y evaluation of biotechnology products derived from cell lines of human
[18] ICH Q8, Pharmaceutical Development
[19] AAMI TIR 37, Sterilization health care products – Radiation – Guidance on sterilization of human tissue based products
[1]- Cell-based health care products
[2]- Sterile
[3]- Heating, Ventilation and Air Conditioning
مواد شیمیایی ضدعفونی کننده مورد استفاده در فضاهای تمیز
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام