اصول و روشهای نشان دادن قارچها در نمونههای کلینیکی
(دستورالعمل تأییدشده)
ترجمه سند CLSI M54-A اکتبر 2012
ترجمه و تنظیم: دکتر محمد قهری
www.ghahri.ir
بخش هفتم
9/2- روشهای میکروسکپی
9/2/1- نمونههای قابل قبول برای آزمایش مستقیم میکروسکپی
بافت و آسپیرههای بدستآمده از نواحیی که در حالت نرمال باید استریل باشند، عالیترین نمونهها هستند. موها، تراشههای پوست و خردههای ناخن که عفونی شدهاند، نمونههای مفیدی برای آزمایش مستقیم میکروسکپی بهمنظور جداسازی درماتوفیتها و سایر قارچهایی که عامل عفونت در این نواحی هستند، میباشند، همچنین لازم است میکروبیوتای قارچی و باکتریایی که با ارگانهای معینی مرتبط هستند را در نظر داشت، زیرا این عوامل بهصورت نامطلوبی جداسازی و بدست آوردن پاتوژنها از این نواحی را تحت تأثیر قرار میدهند و ممکن است بر پیچیدگی تفسیر آزمایش مستقیم و کشت بیفزایند، بهعنوان مثال نمونههای خلط و BAL ممکن است حاوی میکروبیوتای نرمال از ناحیهی اوروفارنکس باشند که ممکن است روی پاتوژنهای کند رشد را بپوشانند و تفسیر آزمایش مستقیم و کشت را با مشکل مواجه سازند. نمونهی وسط ادرار و نمونه ادراری که از کاتتر مستقیم (سوند سوپراپوبیک) و بدنبال رعایت استانداردها بدست میآید، قابل قبول هستند، اگرچه ادرار بدستآمده از کاتترهای کارگذاشتهشده در مجاری ادراری غیر قابلقبول هستند. آزمایش مستقیم CSF ممکن است برای آزمایشگاههایی که روی گروههای جمعیتی خاصی از بیماران (بهعنوان مثال گروههایی که در آنها شیوع بالای HIV وجود دارد) کار میکنند، مفید باشد. بهاستثنای آزمایشهای مربوط به واژن، آزمایش مستقیم برای سایر نمونهها نباید با سواب انجام گیرد (ضمیمه A را مشاهده فرمایید).
9/2/2- تهیهی اسلاید
اسلایدها باید تمیز بوده و اثرات باند و تنزیب روی آن نباشد. آمادهسازی اختصاصی اضافی لزوم ندارد.
9/2/3- روشهای رنگآمیزی
9/2/3/1- هیدروکسید پتاسیم/ کلرازول بلک Chlorazol Black
قارچهایی که در نمونههای کلینیکال حضور دارند اغلب بهوسیلهی آزمایش مستقیم با استفاده از میکروسکوپ نوری معمولی قابل مشاهده هستند. متأسفانه سلولها، دبریهای سلولار و پروتئینی و سایر موادی که حضور دارند (مانند موکوس) ممکن است عناصر قارچی را در خود پنهان کنند و روی آنها را بپوشانند. این مسئله ممکن است موجب نقص در نشان دادن قارچ موجود در نمونه گردد (مثلاً سلولهای قارچ کاملاً پوشانده شود) و حساسیت تست کاهش یابد، از طرف دیگر عناصر قارچی ممکن است مشاهده شوند اما بعلت مبهم ماندن (یا کدر ماندن) توسط مواد، بهدقت تشخیص داده نشوند. این مسئله روی اختصاصیت روش آزمایش مستقیم اثر میگذارد، بنابراین استفاده از رنگهای فلئورسانت توصیه میشود.
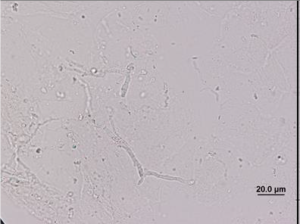
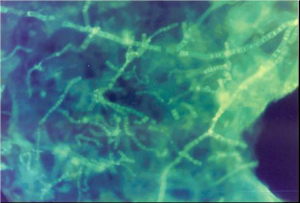
معمولاً از غلظت 10 درصد محلول هیدروکسید پتاسیم استفاده میشود. نمونه و هیدروکسید پتاسیم باید توسط لامل پوشانده شود و بعد از 15 الی 30 دقیقه (بسته به غلظت اولیهی نمونه) آزمایش شود. گرم کردن آهستهی نمونه تا دمای 35 الی 37 درجه میتواند مفید باشد. باید مراقب بود که اسلاید خشک نشود. تأثیر و کارآمدی هیدروکسید پتاسیم را میتوان بهوسیلهی حضور یا عدم حضور سلولهای اپیتلیال انسانی که باید هضم شده باشند، مورد ارزیابی قرار داد (تصویر شماره 1). برای اجتناب از گزارش نتایج منفی کاذب به دلیل شفافسازی با تأخیر، نمونههای منفی باید نگهداری شده و روز بعد مجدداً آزمایش شوند.
تصویر شماره 1: لام تهیهشده با KOH که نشاندهندهی عناصر هایفال است و سلولهای اپیتلیال انسانی هضم شدهاند
محلول 20% با دی متیل سولفوکساید نیز میتواند مورد استفاده قرار بگیرد. دی متیل سولفوکساید تجزیهی سریع بافتهای کراتینیزه را تسهیل میکند، در حالی که کلرازول بلک یک رنگ sulfonated acid tris-azo است که عناصر قارچی را رنگ میکند.
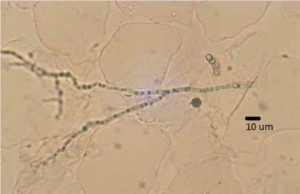
در ارتباط با درصد بالای موارد منفی یا مثبت کاذب با تستهای KOH توسط افراد کمتجربه رنگ Chlorazol Black E برای بهبود عملکرد KOH معرفی شده است. این رنگ لیپوفیلیک است و بنابراین نسبت به سایر عناصری که در میکروسکوپ مشاهده میشوند (و پتانسیل اشتباه گرفتن با سلولهای قارچی را دارند) به دیواره سلولی قارچی جذب میشود. هنگامیکه جذب دیواره سلولی قارچ شدند، عناصر قارچی با آرایش رنگینکمانی به رنگ سبز- سیاه درآمده و بهآسانی از ماتریکس بافتی اطراف تشخیص داده میشوند (تصویر شماره 2).
تصویر شماره 2: لام تهیهشده با KOH/ کلرازول بلک E که عناصر هایفال را بهوضوح نشان میدهد
روش تهیه محلول هیدروکسید پتاسیم/ کلرازول بلک:
هیدروکسید پتاسیم: 10 گرم
گلیسرول: 10 میلیلیتر
Chlorazol Black E 0.1%: 10 میلیلیتر
آب مقطر: 80 میلیلیتر
ابتدا هیدروکسید پتاسیم را در آب مقطر حل کنید. سپس گلیسرول و کلرازول بلک را به آن اضافه کنید. گلیسرول از کریستالیزاسیون پتاس و نیز از خشک شدن نمونه جلوگیری مینماید.
9/2/3/2- هیدروکسید پتاسیم/ سفید کالکوفلور
ترکیب KOH با سفید کالکوفلور عموماً برای نشان دادن قارچها در نمونههای کلینیکال استفاده میشود، بعلاوه سفید کالکوفلور اجازه میدهد که قارچها در محیطی که حاوی سلولهای انسانی هضمشده و یا سایر مواد هستند بسیار راحتتر خود را نشان دهند. سفید کالکوفلور یک عامل درخشانکنندهی منسوجات است و به کیتین موجود در دیوارهی سلولی قارچها باند میشود، هرچند که باند شدن غیراختصاصی نیز رخ میدهد (رجوع شود بهضمیمهی B). با استفاده از میکروسکوپ فلئورسنت عناصر قارچی را میتوان با بزرگنمایی نسبتاً پائین بهآسانی مشاهده کرد. استفاده از سفید کالکوفلور مشاهدهی مقادیر بزرگتری از نمونهی کلینیکی را در یک زمان کوتاه تسهیل میکند و حساسیت تست را افزایش داده و زمان پاسخدهی آن را کاهش میدهد.
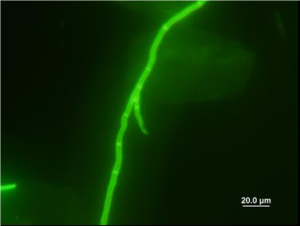
پیگمانتاسیون دیوارههای سلولی در اسلاید KOH/CFW دیده نمیشود، بنابراین موقعی که عناصر قارچی آشکار گردیده و به لحاظ مرفولوژیکال مشخص شد، ارزیابی آن با کمک میکروسکوپ نوری برای تعیین دیماتیاسئوس بودن قارچ باید انجام گیرد (تصاویر شماره 3 و 4).
تصویر شماره 3: لام تهیهشده با کمک KOH و CFW از تراشههای پوست که نشاندهندهی هایفای درماتوفیت است
تصویر شماره 4: لام تهیهشده با کمک KOH و CFW از تراشههای پوست که نشاندهندهی هایفای قارچی منشعب و دارای دیواره عرضی (مربوط به میکروسپوروم کنیس) است
معرفهای CFW از سازنده (کارخانه) به سازندهای دیگر فرق میکند و بنابراین آزمایشگاه باید در این رابطه محتاط باشد و دستورات اختصاصی هر سازنده را پیگیری نماید. برای کسب اطلاعات بیشتر در مورد مواد درخشانکنندهی فلئورسنت بهضمیمهی B رجوع فرمایید.
9/2/3/3- آنتیبادی فلئورسنت مستقیم (DFA)
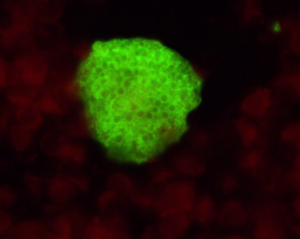
کیتهای DFA برای جستجوی سریع پنموسیستیس جیرووسی در نمونههای فیکسنشده بهصورت تجارتی در دسترس است. تست DFA برای آشکار کردن پنموسیستیس جیرووسی در نمونههای خلط القاء شده، BAL و نمونهی بافت میتواند مورد استفاده قرار گیرد. آنتیبادیهای منوکلونال ضد پنموسیستیس جیرووسی با ایزوتیوسیانات فلئورسین چسبیده شده (tagged) است و درصورتیکه ارگانیسم در نمونه حضور داشته باشد به معرف متصل میشود، سپس کمپلکس ارگانیسم و آنتیبادی– FITC در زیر نور ماوراءبنفش قابل مشاهده میگردد و در این صورت این کمپلکس (organism-ab-FITC) فلئورسانس به رنگ سیب سبز نشان میدهد. هر دو مرحلهی کیست و تروفوزوئیت پنموسیستیس جیرووسی در این روش قابل آشکارسازی است (تصویر شماره 5).
از روشهای ملکولی (مانند PCR) نیز میتوان برای آشکار کردن پنموسیستیس جیرووسی در نمونه استفاده کرد.
تصویر شماره 5: لام تهیهشده به روش DFA از نمونهی BAL که نشاندهندهی ساختمان لانهزنبوری بزرگ کیستهای پنموسیستیس جیرووسی است
9/2/3/4- آکریدین نارنجی (AO) یا Basic Orange 14
بهصورت یک محلول 0.01% وزنی- حجمی مورد استفاده قرار میگیرد. آکریدین نارنجی در بافر استات سدیم (pH: 3.5-4.0) قارچها را اعم از قارچهای رشتهای و مخمری رنگ میکند و فلئورسانس نارنجی/ قرمز روشن در طولموج 440 الی 510 نانومتر نشان میدهد.
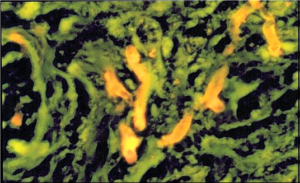
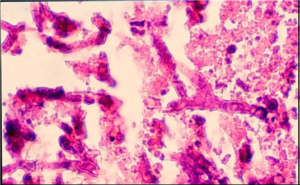
اسمیرهایی که در مجاورت هوا خشک شدهاند به مدت یک دقیقه با متانول فیکس شده و سپس با آکریدین نارنجی با pH پائین به مدت 2 دقیقه رنگآمیزی میشوند. رنگ اضافی به کمک آب شسته شده و سپس با قرار دادن یک لامل بر روی آب اضافی باقیمانده بر روی اسلاید و یا یک مادهی مونتکنندهی دیگر و یا با کمک روغن ایمرسیون مورد بررسی میکروسکپی قرار میگیرد. مقاطع بافتی را به کمک آب، رهیدره کرده و با همین روش میتوان رنگآمیزی نمود. بهطور تیپیک قارچها رنگ نارنجی/ قرمز روشن در یک زمینهی تاریک یا سبزرنگ– برحسب اینکه چه مواد دیگری در نمونه حضور داشته باشد- نشان میدهند. برخلاف قارچها که با رنگهای فلئورسنت رنگآمیزی میشوند، هایفیهای رنگآمیزی شده با آکریدین نارنجی ساختمانهای دیوارهای (شامل دیوارههای هایفی و یا تیغههای عرضی) را بهخوبی نشان نمیدهند. حضور دیوارههای عرضی را با مشاهدهی باندهای نازکشده یا تیره که رنگ نشدهاند و در فواصل متناوبی در عرض هایفیها دیده میشوند میتوان استنباط کرد. اختلاف بین انشعاب حقیقی و انشعاب کاذب معمولاً آشکار است (تصویر شماره 6).
تصویر شماره 6: بافت ریه رنگآمیزیشده با آکریدین نارنجی نشاندهندهی هایفیهای آسپرجیلوس (با برانگیختگی نور آبی روشن)
9/2/3/5- مرکب هندی
نمایش حضور کپسول با استفاده از مرکب هندی میتواند بهعنوان یک روش سریع و مستقیم برای شناسایی احتمالی عنصر مخمری بهعنوان گونههای کریپتوکوکوس مطرح باشد، هرچند که روشهای بسیار حساس دیگری مانند سنجش آنتیژن وجود دارند.
در این روش یک قطره از رسوب سانتریفیوژ شده را در کنار یک قطره مرکب هندی قرار داده با لامل روی آن را پوشانده سپس با بزرگنمایی ضعیف و قوی میکروسکپی بررسی مینمایند.
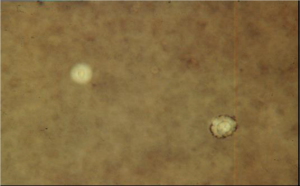
توجه: نتایج منفی کاذب هنگامی حاصل میشود که نواحی با غلظت بالا و متراکم مرکب هندی بررسی شده باشد. سلولهای کریپتوکوکوس نئوفرمنس و کریپتوکوکوس گتی در اندازه متنوع هستند و جوانهها با اتصال باریک به سلول مادری متصل و اغلب این سلولها کاملاً گرد میباشند. حضور یک هاله در اطراف سلولهای مخمری گواه و شاهدی از وجود کپسول است (کپسول از نزدیک شدن ذرات مرکب هندی به دیوارهی سلول مخمر جلوگیری میکند). مخمرهای کپسولدار که در نمونهی مایع مغزی نخاعی نشان داده میشوند به احتمال زیاد بیانگر حضور کریپتوکوکوس نئوفرمنس یا کریپتوکوکوس گتی هستند، البته سایر گونههای کریپتوکوکوس، رودوترولا و سایر مخمرها نیز ممکن است کپسول داشته باشند؛ بنابراین با این روش تنها یک شناسایی فرضی و احتمالی صورت میگیرد. برای اجتناب از تفسیر نادرست در اثر انکسار نور که ممکن است در اطراف سلولهای مخمری یا لنفوسیتها پدید آید و منظرهی کاذب کپسول را نشان دهد، لازم است نهایت دقت و احتیاط بعمل آید (تصویر شماره 7)، همچنین برای جلوگیری از اینگونه خطاها باید از کنترلهای مثبت و منفی استفاده کرد. برخی آزمایشگاهها از کاندیدا آلبیکنس بهعنوان کنترل منفی و کریپتوکوکوس نئوفرمنس بهعنوان کنترل مثبت استفاده میکنند. هرچند که حضور کپسول یک شاهد احتمالی برای کریپتوکوکوس است غیاب کپسول نمیتواند بهطور قطعی احتمال وجود کریپتوکوکوس در نمونه را رد کند. واریانتهایی از کریپتوکوکوس وجود دارند که ممکن است دارای کپسول کوچک و نازکی (diminutive) باشند که با این روش قابل نشان دادن نیستند؛ بنابراین حتی در مواردی که نتیجهی تست مرکب هندی منفی است، احتمال حضور کریپتوکوکوس وجود دارد. همچنین باید در نظر داشت که سایر مخمرها نظیر گونههای رودوترولا نیز دارای کپسول هستند.
تصویر شماره 7: لام تهیهشده با مرکب هندی از نمونهی مایع مغزی نخاعی، در سمت چپ کریپتوکوکوس نئوفرمنس کپسولدار و در سمت راست یک سلول لنفوسیت منکسرکنندهی نور مشاهده میشود. به هستهی کناری لنفوسیت و ذرات کلامپشدهی مرکب در اطراف لنفوسیت توجه فرمایید
9/2/3/6- رنگآمیزی گرم
به دلیل اینکه مخمرها و کپکها بهصورت متنوع میتوانند با تکنیک رنگآمیزی گرم رنگ شوند، برای قارچها یک رنگ بسیار اختصاصی توصیه میشود. هرچند که رنگآمیزی گرم برای نشان دادن سریع حضور یک ارگانیسم در نمونه میتواند کمک مؤثری بنماید (تصویر شماره 8).
تصویر شماره 8: بافت ریه رنگآمیزیشده با گرم نشاندهندهی هایفیهای آسپرجیلوس. توجه نمایید که هایفیهای قارچ بهصورت ضعیف رنگ گرفتهاند
9/2/3/7- رنگهای هیستوپاتولوژیکال
یکی از درخواستهایی که از آزمایشگاههای قارچشناسی میشود از نظر رنگآمیزیهای هیستولوژیکال است که اغلب برای نمونههایی که کشت نشدهاند و یا برای بررسی همبستگی بین نتایج کشت و هیستوپاتولوژی از آنها استفاده میشود. برای کسب اطلاعات در رابطه با رنگهای هیستولوژیکال بهضمیمه C مراجعه شود.
9/3- روشهای ملکولار
روشهای ملکولار متنوعی وجود دارد که از آنها برای آشکار ساختن عناصر قارچی در نمونههای بالینی استفاده میشود. این روشها اغلب شامل روشهای آمپلیفیکاسیون اسیدهای نوکلئیک– که در برخی از آنها نیاز به استخراج اسیدهای نوکلئیک است– میباشند. دستورالعملهای راهنما برای سنجشهای خاص ممکن است با یکدیگر تفاوت داشته باشند اما باید اختلافهای مربوط به انواع نمونهها را مورد ملاحظه قرار داد؛ بهعنوان مثال برای تهیه نمونههای مخاطی تنفسی ممکن است به موکولایزین و یا برای آمادهسازی بافت ممکن است به هضم پروتئولیتیکی نیاز باشد. هر آزمایشگاه قبل از انجام تست باید موارد خاص اجرایی را مشخص و معتبر نماید.
آزمایشگاه تشخیص پزشکی و قارچشناسی کلینیکی (1)
پیشرفتهای جدید در درک مکانیسمهای بیماریزایی قارچهای فرصت طلب (4)
چالشهای آزمایشگاهی تشخیص عفونتهای قارچی
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام