پیشرفتهای اخیر در درمان لیشمانیوز
محسن قماشلویان1، پروین رمضانی1، احمدرضا براهیمی2، مهدی اعظمی3، سیدحسین حجازی4
- دانشجوی کارشناسی ارشد انگل شناسی، دانشکده پزشکی، گروه انگل شناسی و قارچ شناسی، دانشگاه علوم پزشکی اصفهان
- دانشجوی کارشناسی ارشد قارچ شناسی، دانشکده پزشکی، دانشگاه تربیت مدرس تهران
- دانشجوی دکتری انگل شناسی، مرکز تحقیقات پوست و سالک، دانشگاه علوم پزشکی اصفهان
- استاد گروه انگل شناسی و مرکز تحقیقات پوست و سالک، دانشگاه علوم پزشکی اصفهان
مقدمه:
لیشمانیوز یک بیماری عفونی ناشی از ابتلا به انگلی از جنس لیشمانیا در خانواده Trypanosomatidae است. این بیماری به سه شکل آشکار میشود: جلدی، جلدی مخاطی و احشایی که به عنوان کالاآزار مشهور است. لیشمانیوز جلدی رایجترین شکل این گروه از بیماریهاست که با طیف متنوعی از تظاهرات بالینی، از گرههای پوستی کوچک تا تخریب بافت مخاطی متغیر است. لیشمانیوز احشایی شکل شدید بیماری است که در آن انگل به اندامهای حیاتی مهاجرت میکند و یک بیماری ناتوان کننده شدید به وجود میآورد که با تبهای طولانی مدت، بزرگی طحال، افزایش گاماگلوبولینها و پانسیتوپنی همراه است.
بیماران به تدریج و پس از یک دوره چند ماهه علائم بیماری را نشان میدهند و اغلب در صورت عدم درمان مناسب جان خود را از دست میدهند. بیماری از طریق نیش پشه خاکی جنس فلوبوتوموس ماده آلوده به تک یاخته به انسان منتقل میشود و سپس از طریق ماکروفاژهای آلوده در کبد، طحال و مغز استخوان مستقر میشود. این انگل موجودی دو شکلی است؛ به عبارت دیگر در چرخه زندگی خود دارای دو مرحله اصلی است: فرم آماستیگوتی در سلولهای فاگوسیت کننده تک هستهای میزبان پستاندار و فرم پروماستیگوت در اندامهای گوارشی ناقل.
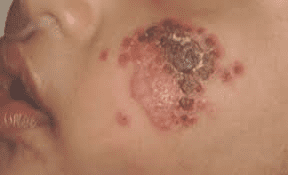
تصویر 1: ضایعات ناشی از فرم جلدی لیشمانیا موسوم به لیشمانیوز پوستی
درمانهای کنونی و پیشرفتهای اخیر:
در سال 1945، آنتیموآنهای پنج ظرفیتی به سرعت گسترش یافت و خط اول درمان انتخابی برای هر دو نوع لیشمانیوز احشایی و جلدی در بسیاری از نقاط جهان باقی ماند. آمفوتریسین B و پنتامیدین به عنوان خط دوم دارویی علیه لیشمانیا مطرح هستند، اگرچه نیاز به یک دوره تزریقی طولانی مدت دارند، ضمن آن که انتخاب خط درمانی به گونه لیشمانیا نیز بستگی دارد.
شایعترین فرم، سندرم لیشمانیوز جلدی لوکالیزه (CL) است که اغلب توسط گونههای لیشمانیا ماژور و لیشمانیا تروپیکا و در دنیای قدیم (حوزه مدیترانه، خاورمیانه و آفریقا) و به واسطه گونههای لیشمانیا برازیلینس و لیشمانیا مکزیکانا در دنیای جدید (مکزیک، آمریکای مرکزی و آمریکای جنوبی) ایجاد میشود. اگرچه در مورد این بیماری بهبودی خود به خودی مطرح است، اما این میزان بهبودی بسته به گونه انگل متفاوت است و ممکن است ماهها یا سالها نیاز به درمانهای تکمیلی داشته باشد.
بسیاری از داروهای معمول که امروزه در درمان بیماری مورد استفاده قرار میگیرند سمی بوده و حتی قادر به درمان بیماری نیستند. عدم درمان موفقیت آمیز لیشمانیوز را میتوان در افزایش مقاومت انگل به داروهای شیمیایی نسبت داد.
از آن جا که درمان این بیماری در حال حاضر به یک معضل بهداشتی تبدیل شده است، توسعه داروهای جدید به منظور جایگزین شدن یا مکمل درمانهای در دسترس امروزی ضروری به نظر میرسد. در سالهای اخیر شیمیدرمانی پیشرفتهای دلگرم کنندهای داشته است. همزمان با توسعه فرمولاسیون لیپیدی آمفوتریسین B که در رابطه با عفونتهای قارچی نیز به یک داروی مناسب با سمیت بسیار پایین تبدیل شده است، استفاده از آن در شیمیدرمانی بر علیه لیشمانیوز نیز مورد توجه قرار گرفته است. فرمولاسیون لایه لایهای لیپوزومی (AmBisome1)، کمپلکس لیپیدی (1 (Abelcetو انتشار کلوییدی (AmphocilTM) همگی در مطالعات بالینی در رابطه با لیشمانیوز احشایی و پوستی مخاطی مورد بررسی قرار گرفته است.
یاردلی و کرافت در سال 2000 با آزمایشاتی که روی مدل حیوانی انجام دادند دریافتند که فرمولاسیون لیپوزومی و انتشار کلوییدی (0/3و 0/7 میلیگرم/ کیلوگرم) نسبت به کمپلکس لیپیدی (2/7 میلیگرم/ کیلوگرم) در برابر لیشمانیا دونووانی بسیار مؤثرترند. فرمولاسیون لیپوزومال (25 میلیگرم/ کیلوگرم) در کاهش اندازه ضایعات ناشی از لیشمانیا ماژور موفق بود ضمن آن که انتشار کلوییدی (12/5 میلیگرم/ کیلوگرم) نیز اثرات خوبی را نشان داد اما کمپلکس لیپیدی در برابر این گونه نیز ناموفق ظاهر شد.
با این حال، هزینههای بالای این گونه آماده سازی آمفوتریسین B مانع از استفاده گسترده آنها درکشورهای در حال توسعه شده است. فرمولاسیون جدید که شامل میکروکپسولهای ساخته شده از آلبومین بوده و به عنوان یک سیستم انتقال دهنده ارزان و مؤثر بکار میرود و یک محافظ مناسب در برابر سلولهای فاگوسیتوز کننده را فراهم میکند، مورد آزمایش قرار گرفت. این میکروکپسولهای آبدوست با تجمعی از سه شکل منومریک، دیمریک و پلیمریک آمفوتریسین B در برابر هر دو فرم پروماستیگوت و آماستیگوتی لیشمانیا اینفانتوم مورد آزمایش قرار گرفت.
عملکرد این کپسولها بدون ایجاد هر گونه سمیت در سلولهای موش و با مقادیر بسیار پایینتر (0/003 میکروگرم/ میلیلیتر) بر علیه آماستیگوتها موفقیتآمیز بود. این نتایج امیدوار کننده توجه استفاده از آمفوتریسین B محصور در میکروکپسولهای آلبومینی را در رویکردهای جدید شیمیدرمانی به خود جلب کرد.
Miltefosine، یک آلکیل فسفولیپید خوراکی است که به جهت اثرات ضد سرطانی در مواجهه با سرطان پوست و پس از آن درمان لیشمانیوز مورد استفاده قرار گرفته است.
کشف اثربخشی این دارو در برابر لیشمانیا منجر به شناسایی یک گروه مدرن از داروهای ضد انگلی شد. پس از انجام مطالعات بالینی، miltefosine به عنوان ImpavidoTM تصویب شد و تبدیل به اولین درمان خوراکی برای لیشمانیوز در برخی از کشورها گردید. این یک درمان مؤثر برای لیشمانیوز احشایی و جلدی، از جمله برای عفونتهای مقاوم در برابر آنتیموانهاست. هر چند این دارو الزاماً نمیتواند بهترین عامل نسبت به داروهای تزریقی برای تمام اشکال لیشمانیوز باشد. استفاده از این دارو برای یک دوره درمانی طولانی مدت (28 روزه) نیاز به شرایط مقتضی جهت تدوین یک فورمولاسیون برای استفاده منطقی از دارو دارد تا بیش از این شاهد افزایش تعداد بیماران مقاوم به دارو نباشیم.
طبق مطالعات انجام شده پیرامون مکانیسمهای ایجاد مقاومت در انگلها، مکانیسمهای امکان پذیر شامل کاهش جذب دارو، اختلاف در نفوذ پذیری غشاء، متابولیسم سریع دارو و خارج کردن دارو از سلول میباشند. در سال 2002 با استفاده از Miltefosine در هند به منظور درمان لیشمانیوز احشایی، مشخص شد که این دارو یک داروی تراتوژن است. به همین منظور نباید در زنان باردار مورد استفاده قرار گیرد.
سایر فسفولیپیدهای آلکیلی مانند edelfosine و ilmofosine مثل پریفوزین نیز در شرایط آزمایشگاهی اثرات ضد انگلی از خود نشان دادهاند. در سال 2008، کابررا سرا و همکارانش، ادلفوزین و پریفوزین را به صورت خوراکی روی موشهای Balb/c آلوده به گونه لیشمانیا آمازوننسیس مورد آزمایش قرار دادند. این مطالعه نشان داد پریفوزین در شرایط In vivo فعالیت مؤثری علیه این انگل داشته و میتواند یک درمان جایگزین احتمالی برای لیشمانیوز جلدی باشد.
Sitamaquine یک درمان خوراکی امیدوار کننده برای لیشمانیوز احشائی در آفریقا است. در کنیا 61 بیمار مبتلا به لیشمانیا دونووانی با این دارو ( 2میلیگرم/ کیلوگرم/ روز به مدت 28روز) مورد درمان قرار گرفتند که امیدوار کننده بود ولی مطالعات بیشتر برای دستیابی به یک دز مطلوب مورد نیاز است. برخی عوارض جانبی این دارو مربوط به دردهای شکمی، سردرد و اختلالات شدید کلیوی است که البته اثر دارو بر کلیه نیاز به بررسیهای دقیقتری دارد.
پارومومایسین تنها آمینوگلیکوزید با فعالیت بالینی مهم بر ضد لیشمانیا است. هر دو فرم احشایی و جلدی با این دارو قابل درمان است، اما جذب خوراکی پایین این دارو باعث گسترش فرمولاسیون تزریقی و موضعی به ترتیب برای فرمهای احشایی و جلدی شد. در مطالعهای که در سال 2007 توسط سوندار و همکاران روی مبتلایان به لیشمانیوز احشایی در هند صورت گرفت مشخص شد تزریق عضلانی پارومایسین (11میلیگرم/ کیلوگرم/ روز به مدت 21 روز) با تزریق عضلانی آمفوتریسین B (1میلیگرم/ کیلوگرم/ روز به مدت 30 روز) برابری میکند. در سال 1992 در مرکز تونس، بیماران مبتلا به لیشمانیوز جلدی ناشی از لیشمانیا ماژور تحت درمان با پماد موضعی پارومایسین قرار گرفتند ولی تفاوتی در گروه مورد و گروه شاهد مشاهده نشد.
با این حال، فرمولاسیونهای موضعی جدید از پارومومایسین نتایج خوبی را نشان دادهاند. یک مطالعه تصادفی کنترل شده به منظور مقایسه اثر درمانی دو فرآورده موضعی پارومومایسین با گلوکانتیم انجام شد. نتایج نشان داد که پارومومایسین موضعی میتواند یک جایگزین مناسب برای درمان لیشمانیوز جلدی باشد، هر چند مدت زمان بیشتری برای بهبود بالینی مورد نیاز است.یک ژل آبدوست حاوی 10% پارومومایسین در موش c /Balb آلوده به لیشمانیا آمازوننسیس و همستر آلوده به لیشمانیا برازیلینس مورد بررسی قرار گرفت. در مقایسه با درمان با آنتیموانها، فعالیت ژل پارومومایسین علیه لیشمانیا آمازوننسیس به طور قابل توجهی بالاتر بود، در حالی که این دو دارو به یک اندازه در برابر لیشمانیا برازیلینس مؤثر بوده است. فرمولاسیون ژل ممکن است به عنوان یک درمان موضعی جایگزین برای سالک مورد استفاده قرار گیرد.
گیاهان به عنوان دارو بر علیه لیشمانیوز:
تصویر 2:“مایتنوس پوترلیکوئیدس“
گیاهان را میتوان به وضوح یک منبع بالقوه دارویی جدید علیه انگلها قلمداد کرد. فعالیت بیولوژیکی عصارههای گیاهی را میتوان به ترکیبات متعلق به گروههای شیمیایی مختلف از قبیل آلکالوئیدها، فلاونوئیدها، فنیل، استروئیدها و ترپنوئیدها نسبت داد. برای به دست آوردن یک داروی گیاهی و یا یک ترکیب فعال جدا شده از آن، استراتژیهای مختلف را میتوان مورد استفاده قرار داد. در میان آنها، بررسی کاربردهای سنتی، ترکیب شیمیایی، سمیت گیاهان و یا ترکیبی از معیارهای مختلف را میتوان برشمرد.
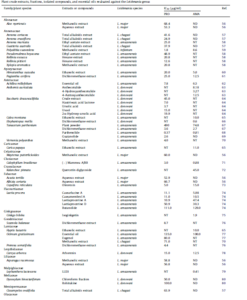
به طور کلی در فرایند استخراج، قسمتهای مختلف گیاه و حلالهای مختلف مورد استفاده قرار گرفته است. معمولاً حلالها از قطبهای مختلف برای استخراج به کار گرفته میشوند. از پروماستیگوتها، آماستیگوتهای آگزنیک و آماستیگوتهای داخل سلولی انگل میتوان برای شناسایی مواد فعال بیولوژیکی گیاهی استفاده کرد. به منظور ارزیابی پتانسیل داروهای جدید ضد لیشمانیایی روی فرم داخل سلولی انگل، از روش کلرومتریک بتا-لاکتاماز در ایزولههای بالینی استفاده شده است.در جدول شماره 1 به مقایسه برخی از تولیدات ضد لیشمانیایی که در 5 سال گذشته گزارش شده است میپردازیم.
بررسیهای آزمایشگاهی اولین گام برای تشخیص اثربخشی و ایمن بودن گیاهان دارویی برای استفاده در درمانهای ضد لیشمانیایی هستند. علاوه بر این، تنوع در اثر داروها در درمان لیشمانیوز اغلب ممکن است به تفاوت در حساسیت به دارو در گونههای لیشمانیا، وضعیت ایمنی بیمار و یا خواص فارماکوکینتیک دارو منجر شود. با بررسی مقالات و متون مختلف که در آنها از محصولات طبیعی (عصاره خام گیاهی، اجزاء، ترکیبات جدا شده و اسانس) برای یافتن ترکیباتی به منظور مبارزه با لیشمانیوز توسط محققین در سراسر جهان صورت گرفته است، ما با تلاشهای بسیار آنان به منظور مبارزه با این بیماری کهن بیشتر آشنا خواهیم شد که ثمره این تلاشها به دست آوردن نتایج معتبر از محصولات طبیعی به عنوان منابع واقعی برای تولید دارو میباشد.
ترکیبات مصنوعی به عنوان جایگزینهای درمانی:
در سالهای اخیر علاقه رو به رشدی در درمانهای جدید و استفاده ازمحصولات طبیعی، به ویژه ترکیبات مشتق شده از گیاهان، به عنوان منابع ترکیبات شیمی درمانی جدید با فعالیت بیشتر و عوارض جانبی کمتر دیده میشود. با توجه به شرایط نامطلوب حاضر، به نظر میرسد مطالعه و بررسی ملکولهای جدید به دست آمده از ترکیبات گیاهی برای درمان لیشمانیوز امری ضروری است.
تحقیقات در سراسر جهان برای یافتن یک ترکیب ملکولی جدید برای درمان لیشمانیوز همچنان ادامه دارد.
به عنوان مثال برنزان و همکاران به بررسی عصاره برگ گیاه Calophyllumbrasiliense بر روی پروماستیگوتها و آماستیگوتهای داخل سلول انگل لیشمانیا آمازوننسیس پرداختند که ترکیبات مشتق شده از این گیاه اثرات قابل توجهی بر روی فعالیت ضد انگلی به نمایش گذاشت.
بررسیهای پوررجب و همکاران در شرایط آزمایشگاهی از فعالیت ضد انگلی نیتروایمیدازول-1،3،4-تیادیازول بر علیه لیشمانیا ماژور خبر میدهد که بسیاری از این ترکیبات و ترکیبات مشابه آن دارای فعالیت ضد انگلی علیه فرم پروماستیگوتهای لیشمانیا ماژور با غلظتهای مختلف و غیر سمی است که در جدول شماره 1 به تفصیل به آنها اشاره شده است.
این مطالعات از نیاز فوری به توسعه داروهای مؤثر و جدید و همچنین بهبود ویژگیها و کیفیت داروهای فعلی خبر میدهد. اگرچه پیشرفتهای زیادی در رابطه با درمان لیشمانیوز بدست آمده است اما مطمئناً راز و رمزهای بسیاری برای درک عمیقی از فعالیت بیولوژیکی انگل هنوز حل نشده باقی مانده است.
ترکیبات ضد لیشمانیایی در آینده چگونه خواهد بود؟
به دلیل شکل داخل سلولی و مکانهای انتشار انگل، امروزه لیشمانیوز به عنوان یک بار جهانی و یک چالش بزرگ برای کشف دارو و تحویل آن به جامعه جهانی مبدل شده است. پتانسیل برخی از ترکیبات کلوئیدی برای حمل دارو مانند امولسیونها، لیپوزومها و حتی نانوذرات که عمدتاً به دلیل ماهیت چند منظوره و توانایی جذب آنها توسط سلول مورد توجه قرار گرفتهاند یکی از مزیتهای مهم درمانی خصوصاً در ارتباط با بیماریهای انگلی است.
توانایی تحویل دارو بر اساس کنترل میزان آزاد سازی دارو به خصوص در مورد نانوذرات امروزه بسیار مورد توجه است. نانوذرات ترکیباتی بسیار کوچک (بین 1 تا 100 نانومتر) هستند. ذراتی هوشمند که از یک هسته مغناطیسی، یک لایه مشخص و قسمتی برای بارگیری دارو تشکیل شدهاند. آنها از مواد آلی یا معدنی تشکیل شده که میتوانند تجزیه پذیر یا تجزیه ناپذیر باشند.
نانوذرات زیست تخریبپذیر (مانند PLGA، PLA، کیتوزان، ژلاتین،polycaprolactone ، وpolyalkylcyanoacrylates ) به دلیل ارزش درمانی آنها در کاهش خطرات ناشی از مسمومیت با برخی از داروها، غالباً به عنوان حامل دارویی استفاده میشوند. همچنین آنها میتوانند فراهمی زیستی، انحلال و زمان ماندگاری بیشتری نسبت سایر داروهایی که به سختی حتی به صورت خوراکی تجویز میشوند را به ما ارائه کنند.
دانشمندانی که با فنآوریهای مدرن برای فرمولاسیونهای خوراکی سر و کار دارند باید به حلالیت آبی پایین بسیاری از داروها فائق آیند. بسیاری از گزارشها از مزایای استفاده از فرمولاسیونهای نانویی برای بهبود فراهمی زیستی خوراکی در داخل بدن حکایت دارند. اندازههای نانومتری میتواند به تهیه یک فرمولاسیون مناسب برای رهاسازی فوری دارو پس از مصرف خوراکی به ما کمک کند.
نانوذرات میتوانند در درمان برخی از بیماریهای مرتبط با ماکروفاژ مؤثر واقع شوند. سلولهای بیگانه خوار تک هستهای با مواجهه با انگل لیشمانیا آنها را میبلعند، اما گاهی این سلولها اقدام به برداشت عوامل دارویی از گردش خون میکنند. ویژگی مهم ماکروفاژ توانایی شناسایی لیگاندهای سطح سلول است که ما در سیستم نانوذرهای از آن بهره برداری کرده و نانوذره را وارد سلول ماکروفاژ میکنیم.
لیپوزومها و نانوذرات پتانسیل بسیار زیادی برای بهبود اثربخشی و قابلیت پذیرش داروهای ضد لیشمانیایی مانند آمفوتریسین B لیپوزومی نشان دادهاند. نانوذرات جامد لیپیدی و سایر حامل چربی نانو ساختاری که از نسل دوم حاملهای کلوئیدی هستند، عمدتاً به دلیل ثبات بهتر و سهولت در تولید امروزه به صورت تجاری وارد بازار مصرف شدهاند.
آمفوتریسین B دارویی با حلالیت بسیار پایین است و در دستگاه گوارش جذب نمیشود و باید آن را به صورت آهسته و داخل وریدی تزریق کرد. با این حال جذب خوراکی این دارو میتواند بسیار مفیدتر باشد و مطالعات مدرن امروزی به دنبال جذب سوسپانسیون خوراکی دارو به صورت نانو هستند. گواه این ادعا آزمایشهایی است که بر روی موشهای Balb/c مبتلا به لیشمانیا دنووانی با کمک نانوسوسپانسیون آمفوتریسینB صورت گرفت و منجر به کاهش قابل توجه تعداد انگلها در کبد موش گردید.
Cochleates یک سیستم تحویل مبتنی بر ذرات چربی است که میتواند برای مصرف خوراکی داروهای آبگریز مانند آمفوتریسین B مورد استفاده قرار گیرد. سیستم cochleate منجر به افزایش جذب آمفوتریسین B از دستگاه گوارش میشود که در آزمایشات روی کاندیدیازیس مدل موشی این امر به تحقق پیوسته است.
مندوزا و همکاران در سال 2008 با توسعه این سیستم نانوذرات لیپیدی، یک فرمولاسیون جدید برای edelfosine با هدف کاهش سمیت سیستمیک و بهبود پتانسیل درمانی این دارو ارائه دادند.
پروتئینهای انتقال دهنده چربی غیر اختصاصی (nsLTPs) از پروتئینهای گیاهی اولیه و کوچک هستند که میتوانند با توجه به وزن مولکولی به nsLTP1 (10 کیلو دالتون) و nsLTP2 (7 کیلو دالتون) تقسیم شوند. این پروتئینها میتوانند به طیف گستردهای از مولکولهای چربی متصل شوند و آنها را به خود جذب کرده و به عنوان یک حامل دارویی انجام وظیفه نمایند. nsLTPs را میتوان از گیاهانی مانند دانه جو، برنج، گوجه فرنگی و زیره سبز جداسازی نمود.
نتیجه:
تحقیقات دارویی روی محصولات طبیعی نشان دهنده یک استراتژی عمده برای کشف و تولید داروهای جدید است. امروزه امکانات فراوانی برای تحقیقات در این زمینه وجود دارد، اما اولویت ما باید بر بیماریهای عفونی و گرمسیری مزمن که البته داروهای فعلی در مورد آنها با مشکلات عدیدهای مواجه است، متمرکز شود. یک ارزیابی علمی از داروهای گیاهی میتواند بسیار ارزانتر، ایمنتر و کم خطرتر از داروهای موجود باشد.
کشور عزیز ما ایران یک منطقه غنی از انواع پوششها و گونههای طبیعی است که منبع عظیمی برای مواد با قابلیت آزمایشات مختلف را برای ما فراهم میکند و آنچه در حال حاضر مورد نیاز است اختصاص بودجه برای حمایت از این نوع پژوهشهاست.
مسائل بیولوژیکی و زیست دارویی باید در طراحی استراتژیهای تحویل دارو برای درمان عفونتهای انگلی مانند سالک بیش از پیش در نظر گرفت
/www.who.int/news-room/fact-sheets/detail/leishmaniasis
https://medlabnews.ir/%d9%84%db%8c%d8%b4%d9%85%d8%a7%d9%86%db%8c%d8%a7/
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام