چکلیستی برای جلوگیری از بروز خطاهای تشخیصی پریآنالیتیکال در کارآزماییهای بالینی
دکتر حمیدرضا هجرانی:دکترای علوم آزمایشگاهی
اگرچه اهمیت تضمین بالا بودن سطح کیفیت پری آنالیتیکال در تستهای تشخیصی روتین، در طول دهههای گذشته کاملاً مورد تصدیق قرار گرفته است، اما در حال حاضر این واقعیت که عملکرد دقیق و استانداردسازی بسیاری از فعالیتهای پریآنالیتیکال در کارآزماییهای بالینی نیز یک ویژگی لازم و ضروری بهشمار میآیند؛ کمتر مورد تأکید قرار میگیرد. شواهد قابلاعتمادی وجود دارند دال بر اینکه در حال حاضر بسیاری از پروتکلهای کارآزمایی بالینی فاقد نشانهها و راهنماییهای شفاف در مورد چگونگی مدیریت مراحل مختلف پریآنالیتیکال هستند و اسناد معتبری نیز در این باره منتشر یا تأئید نشدهاند که به افزایش آگاهی ما کمک کنند. برای پر کردن این خلأ، کارگروه مرحله پریآنالیتیکال (WG-PRE) وابسته به فدراسیون شیمی بالینی و پزشکی آزمایشگاهی اروپا (European Federation of Clinical Chemistry and Laboratory Medicine; EFLM) در این مقاله یک چکلیست اختصاصی را برای جلوگیری از خطاهای تشخیصی پریآنالیتیکال در کارآزماییهای بالینی (PREDICT) preanalytical diagnostic errors in clinical tarials ارائه کرده است که بهطور خاص بر بررسی مهمترین ابعاد پریآنالیتیکال مدیریت نمونههای خونی در مطالعات بالینی متمرکز گردیده است و در نتیجه شامل انتخاب تست، آمادهسازی بیمار، جمعآوری نمونه، مدیریت و ذخیرهسازی، حملونقل نمونه و همچنین بازیابی نمونه قبل از انجام تست میشود. اعضای WG-PRE صمیمانه امیدوار هستند که این توصیهها نقش مفیدی در افزایش میزان موفقیت کارآزماییهای بالینی داشته باشند.
واژگان کلیدی: کارآزمایی بالینی، خطاها، پزشکی آزمایشگاهی، تغییرپذیری پریآنالیتیکال، مطالعات
خطاهای آزمایشگاهی
پزشکی آزمایشگاهی در روند تاریخ طولانی خود از زمان شکلگیری یعنی بیش از 100 سال پیش، بهعنوان یکی از فعالترین رشتههای پزشکی در ایجاد فرهنگ کیفیت (culture of quality) بهحساب میآید. اگرچه تلاشهای زیاد و چندجانبه برای بهبود استانداردسازی و یا هماهنگسازی در فعالیتهای مختلف فرایند انجام تستهای آزمایشگاهی، باعث شده است تستهای تشخیصی in vitro (IVD) در مقایسه با سایر فعالیتهای تشخیصی، به یک محیط نسبتاً صحیح تبدیل شوند، با این حال برخی از فرصتهای بروز خطا همچنان وجود دارند که بیشتر آنها از فعالیتهای فرا آزمایشی (extra-analytical) ناشی میشوند. بر اساس اطلاعات بهدستآمده از مقالات علمی فعلی، نرخ بروز خطا در تشخیص آزمایشگاهی تقریباً 0/3% است، بنابراین بسیار پایینتر از احتمال بروز خطا در سونوگرافی (یعنی 0/8)، رادیولوژی (یعنی 4%) و آسیبشناسی سلولی است. نیازی به گفتن نیست که اکثر این خطاها (تقریباً 70-60%) ناشی از فعالیتهای دستی زیاد در فاز پریآنالیتیکال هستند و پس از آن خطاهای پستآنالیتیکال قرار دارند (تقریباً ۳۰-۲۰%)، این در حالی است که خطاهای آنالیتیکال، مقدار اندک باقیمانده را به خود اختصاص میدهند. عواقب مختلف این خطاهای احتمالی شامل افزایش خطر برای بیمار (بهعنوان مثال تأخیر در تشخیص، نادیده گرفتن تشخیص، تشخیص نادرست، اقدامات تشخیصی یا پیگیری غیرضروری)، اتلاف منابع اقتصادی (بهعنوان مثال اتلاف وقت خونگیر، جمعآوری نمونه خون و لولههای خونی جدید برای جمعآوری مجدد نمونههای نامناسب) و همچنین موارد داخل سازمانی (مانند از دست رفتن زمان برای شناسایی و مدیریت مشکلات پریآنالیتیکال) و خارج سازمانی (بهعنوان مثال دادخواستهای قضایی احتمالی برای متوقف کردن دادههای آزمایشگاهی در نمونههای نا مناسب) .
اگرچه مشکل کیفیت پریآنالیتیکال در آزمایشهای بالینی تشخیصی در طول دهههای گذشته تا حد زیادی مورد تأئید و بررسی قرار گرفته است، اما تأکید اندکی بر این نکته شده است که کیفیت پریآنالیتیکال باید یک ویژگی ضروری در کارآزماییهای بالینی هم باشد، در نتیجه ، این خطر محسوس وجود دارد که برخی از مطالعات بالینی ممکن است به دلیل بروز انواع مختلف خطاهای آزمایشگاهی، از جمله مواردی که از فاز پریآنالیتیکال ناشی میشوند، نتوانند نتایج واقعی خود را تولید کنند.
تستهای آزمایشگاهی در کارآزماییهای بالینی
طب آزمایشگاهی معمولاً بهعنوان دانشی متمرکز بر تولید اطلاعات بالینی از طریق آنالیز غلظت، ترکیب و یا ساختار بسیاری از آنالیتهای مختلف در مایعات مختلف بیولوژیک تعریف میشود. مطابق این تعریف مشخص، تستهای آزمایشگاهی سهم بیبدیلی در مراقبتهای بالینی مدیریتشده را به خود اختصاص میدهند، بهعلاوهی اینکه بخش اعظمی از تصمیمگیریهای بالینی اکنون بهشدت تحت تأثیر دادههای آزمایشگاهی است. تشخیص آزمایشگاهی در کارآزماییهای بالینی نیز نقش اساسی دارد، زیرا بسیاری از تستهای تشخیصی برای تعیین معیارهای واجد شرایط بودن شرکتکنندگان در مطالعه ، ارزیابی مقادیر پایه بسیاری از پارامترها که بعداً با مداخله بالینی قابلاصلاح هستند، اثبات کارایی تولیدات تحقیقاتی (که بهعنوان مثال با تغییر در برخی پارامترهای آزمایشگاهی منعکس میشود) و آخرین نکته مهم، برای نظارت بر ایمنی شرکتکنندگان در مطالعه در طول کارآزمایی بالینی، بهکار میروند.
بنابراین بدیهی است که اتخاذ الزامات دقیق پریآنالیتیک، همانگونه که در تستهای تشخیصی بالینی یک اقدام الزامآور در نظر گرفته میشود، باید در کارآزماییهای بالینی هم به همان اندازه مهم تلقی گردد، چرا که ریسک بروز خطا در سناریوی اخیر (کارآزمایی بالینی) ممکن است پیامدهای نامطلوبی به دنبال داشته باشد. بهطور خلاصه، رد نمونهها یا توقیف نتایج آزمایش در کارآزماییهای بالینی، به جمعآوری مجدد نمونه نیاز دارد، بنابراین باعث آزار بیمار و هدر رفتن منابع مالی شده و میتواند تأثیر عمیقی بر ترکیب و اندازه جمعیت مورد مطالعه داشته باشد (بهعنوان مثال ورود و یا کنار گذاشتن برخی از افراد مورد مطالعه بهطور نادرست)، همچنین منجر به تعریف نادرست مقادیر پایه آزمایشگاهی میشود که بعدها برای پایش تغییرات در کارآزمایی بالینی مورد استفاده قرار میگیرند و میتواند عدم تشخیص یا تشخیص نادرست اثرات جانبی و عوارض احتمالی را نیز در پی داشته باشد، بهعلاوه میتواند با تولید نتایج مثبت کاذب یا منفی کاذب باعث اختلال در نقطه نهایی (endpoint derangement) گردد (جدول ۱). علاوه بر این، در اکثر کارآزماییهای بالینی، جمعآوری نمونه با هدف مورد آزمایش قرار دادن مقدار پایه یا پیگیری (follow up)، باید در نقاط زمانی کاملاً مشخصشده انجام شود تا با نتایج دیگر افراد (subject) مورد مطالعه قابل مقایسه باشد. کنار گذاشتن نمونه به دلیل عدم انطباق پریآنالیتیکال (preanalytical unconformity) میتواند منجر به حذف نهتنها این نمونه خاص بلکه کل دادههای فرد مربوطه شود.
شکست کارآزماییهای بالینی
کارآزماییهای بالینی معمولاً مطالعاتی هستند که در تحقیقات بالینی و بر روی افراد انجام میشوند و برای پاسخ به سؤالات خاص در مورد مداخلات بیومدیکال یا رفتاری طراحی شدهاند و از این رو بر روی درمانهای جدید (بهعنوان مثال عوامل دارویی، واکسنها، مکملهای غذایی)، تغییرات سبک زندگی، دستگاههای پزشکی یا تحقیقات تشخیصی جدید متمرکز هستند. در حال حاضر شواهد محکمی وجود دارد که نشان میدهد ریسک کسب یک نتیجه گمراهکننده از یک کارآزمایی بالینی (به معنای مثبت یا منفی) بسیار زیاد است، اتفاقی که آن را میتوان بهصورت «شکست خوردن در انتقال از میز آزمایش به بالین بیمار» بیان کرد، به این معنا که یافتههای پژوهشهای پایهای (یعنی همان میز آزمایش) نتوانسته منجر به مداخلات بالینی مؤثر (یعنی بالین بیمار) شود. اگرچه هیچ آمار رسمی در مورد شکست کارآزماییهای بالینی وجود ندارد و دادهها میتوانند بسیار ناهمگن باشند اما شواهد جالبی از گزارش Wong و همکارانش به دست آمده است. آنها اخیراً بیش از 400 هزار مدخل داده کارآزمایی بالینی شامل بیش از 21 هزار عوامل دارویی بالقوه را بین سالهای 2000 تا 2015 آنالیز کردهاند. بهطور کلی، پیشرفت از مطالعات فاز 1 تا تأئید بالینی، با میزان موفقیتهای نسبتاً متفاوت در تخصصهای مختلف تنها در 5/7% کارآزماییهای بالینی ثبت شده است (برای مثال از میزان بالایی مثل 13/5% برای داروهای چشمپزشکی و میزان پایینی مثل 2/2% برای درمانهای ضد سرطان). نرخ شکست (attrition rate) برای برخی از بیماریهای خاص پاتولوژیک انسانی بهطور چشمگیری بالا گزارش شده است؛ مثلا در بیماری آلزایمر میزان شکست فاز 1 برابر 72%، فاز 2 برابر با 92% وفاز 3 معادل 98% می باشد که در نهایت به نرخ شکست کلی 99/6% در این شرایط بالینی خاص منجر میشود. قابلتوجه است که Ioannidis و Bossuyt نیز اخیراً تأکید کردهاند که مسیر فعلی بیومارکرها بهطور چشمگیری در برابر شکست آسیبپذیر است، زیرا تنها تعداد محدودی از آزمایشهای تشخیصی، کاربرد بالینی پیدا میکنند، بنابراین در نهایت 85% سرمایهگذاریهای تحقیقاتی در این زمینه به هدر میروند.
عوامل متعددی منجر به شکست کارآزماییهای بالینی میشوند (فراتر از عدم اثربخشی یا نگرانیهای مربوط به ایمن بودن مداخله)؛ از جمله این موارد میتوان به پاسخ متفاوت افراد به مداخلات در مقایسه با آنچه در مدلهای پریکلینیکال مشاهده میشود، کمبود منابع انسانی و یا اقتصادی، طراحی ضعیف مطالعه (بهعنوان مثال معیارهای صلاحیت نامناسب، اندازه نمونه، نقاط پایانی و روشهای آماری)، انتخاب نادرست جایگاه (شامل امکانات بالینی و امکانات موردنیاز برای انجام تست)، فراخوان ضعیف یا کنار گذاشتن بیش از حد افراد، مسائل ایمنی بیمار و همچنین اجرای نامناسب مطالعه یا آنالیز (آماری) نامناسب دادهها اشاره کرد. در میان این عوامل مختلف، معمولاً خطاهای تشخیصی (از جمله اشتباهات پریآنالیتیکال) بهعنوان علت احتمالی عدم موفقیت کارآزمایی بالینی نادیده گرفته میشود، درحالیکه به نظر میرسد شواهد جدید گواه این هستند که ممکن است اینگونه نباشد؛ بهعنوان مثال، Crucitti و همکاران یک کارآزمایی بالینی فاز 3 که در 5 مکان مختلف در آفریقا و هند انجام شده بود را گزارش کردند که در آن اثربخشی سولفات سلولز بهعنوان گزینه ضد میکروبی برای جلوگیری از HIV و سایر عفونتهای منتقله جنسی مورد آزمایش قرار گرفته بود. نکته قابلتوجه اینکه این مطالعه به دلیل عدم تطابق نتایج تست HIV و PCR Amplicor CT / NG بین آزمایشگاه مرجع و آزمایشگاههای همان محل شکست خورد که بعداً به آلودگی نمونه حین آمادهسازی آن نسبت داده شد. بنابراین مواردی از این دست لزوم تأکید بیشتر بر اهمیت کیفیت پریآنالیتیکال در بیولوژی مولکولی را نشان میدهد.
در گزارش اخیر دیگری که توسط Schultze و Irizarry منتشر شده است، منابع اصلی عدم قطعیت در دادههای آزمایشگاهی تولیدشده در مطالعات ارزیابی ایمنی (safty asseeement studies) بهطور دقیق و اندیشمندانه مورد بررسی قرار گرفته است و نویسندگان اینگونه نتیجه گرفتهاند که این موارد عمدتاً شامل نادیده گرفتن فرایندهای عملیاتی استاندارد (Standard Operating Procedures; SOPs)، شناسایی اشتباه (misidentification) نمونه، عملکرد نامناسب ابزارها و نقایص کنترل کیفی و تداخل درآزمایش هستند. نکته قابلتوجه اینکه خطر شکست کارآزمایی بالینی به دلیل تأخیر در فراوری نمونههای خون برای تست گلوکز نیز برجسته شده است. در حقیقت، لولههای خونی که تا 24 ساعت پس از خونگیری سانتریفیوژ نشوند، دچار کاهش تدریجی (کاذب) غلظت گلوکز میشوند که در نهایت ممکن است تفسیر دادهها را برای ارزیابی وضعیت سلامتی شرکتکنندگان احتمالی در مطالعه مختل کنند. در کارآزماییهای چندمرکزی (multicenter)، استفاده از انواع مختلف لولههای جمعآوری خون یا مواد افزودنی ممکن است باعث ایجاد نتایج واگرا (diverging) شود که بهشدت بر ارزیابی آماری تأثیر میگذارد.
مسائل مهم در مدیریت برخی متغیرهای پریآنالیتیکال در بیوبانک، همراه با مشکلات احتمالی ناشی از به دست آوردن، آمادهسازی و نگهداری مواد بیولوژیک بهصورت نامناسب یا نادرست بهطور گسترده در بسیاری از نشریات و همچنین توسط استاندارد اعتباربخشی ISO 20387:2018 مورد توجه قرار گرفته است. صرفنظر از این اسناد، شواهدی ارائه شده است که استفاده از روشهای ناکارآمد پریآنالیتیکال یا نادیده گرفتن SOPها برای جمعآوری، فراوری و ذخیرهسازی نمونههای زیستی ممکن است باعث ایجاد اثر منفی در نتایج تجربی شود و همچنین میتواند تکرارپذیری دادههای علمی را مختل کند.
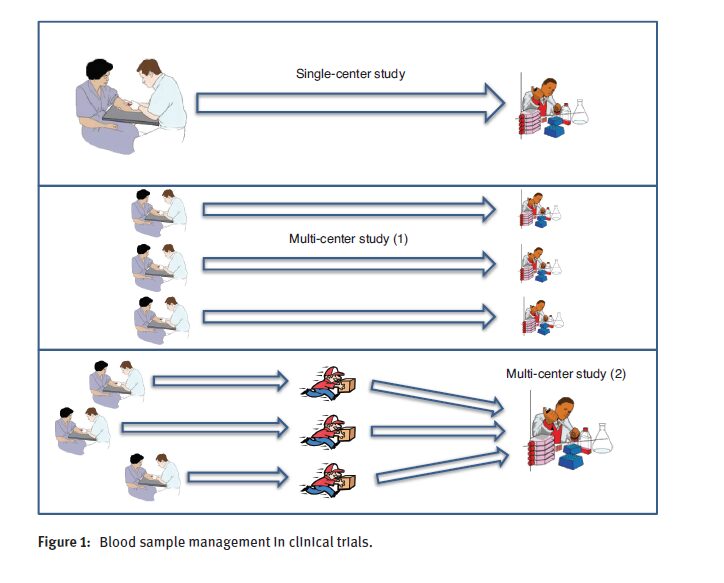
جمعآوری استانداردسازیشده و مستندسازی همه وضعیتهای پریآنالیتیکال طی فرایند آمادهسازی بیمار، جمعآوری و ذخیرهسازی نمونههای زیستی یک امر ضروری است تا بتوان احتمال هرگونه سوگیری پریآنالیتیکال در نتایج مطالعات آینده را کنار گذاشت. نکته قابلتوجه اینکه بهموازات افزایش پیچیدگی مطالعه، ریسک انباشته (cumulative risk) سوگیری پریآنالیتیکال نیز بهتدریج افزایش مییابد، بهگونهای که کمترین ریسک در مطالعات تک مرکزی (single- center)، ریسک متوسط در مطالعات چندمرکزی (که مشخصه آنها وجود سایتهای جمعآوری محیطی متعدد و آزمایشهای محلی است) و بیشترین ریسک همانطور که انتظار میرود در مطالعات چندمرکزی با سایتهای جمعآوری محیطی بسیار زیاد و یک آزمایشگاه مرجع واحد میباشد (به معنای انجام تست بهصورت متمرکز). در این مورد آخر، نهتنها روشهای محلی مورد استفاده برای جمعآوری و مدیریت نمونه خون نیاز به استانداردسازی دارند، بلکه مدیریت محلی و انتقال نمونه به آزمایشگاههای مرجع نیز نیاز به هماهنگی دقیق دارد (شکل 1).
مدیریت تغییرپذیری پریآنالیتیکال در کارآزماییهای بالینی
صرفنظر از اهمیت عمومی تعریف مناسب الزامات پریآنالیتیکال برای کلیه تستهای تشخیصی بالینی، بنا بر اطلاعات فعلی ما، هیچ گایدلاینی در مورد نحوه مدیریت تغییرپذیری پریآنالیتیکال در مطالعات بالینی وجود ندارد؛ بهعنوان مثال، جدیدترین گایدلاینهای انستیتوی ملی سلامت (NIH)، انستیتوی ملی آلرژی و بیماریهای عفونی با عنوان استانداردهای عملیات خوب آزمایشگاههای بالینی (GCLP)، تعدادی از ابعاد پیشبالینی و بالینی عملیات خوب آزمایشگاهی (GLP) را دربرمیگیرد، بنابراین بسیاری از الزامات سازمانی و تکنیکی که تقریباً بهطور کامل بر روی مشخصات کیفیت آنالیتیکال و مسائل پست آنالیتیکال متمرکز شدهاند را فهرست کرده است. تنها مرجع حملونقل و مدیریت نمونه این ضرورت را گوشزد میکند که «آزمایشگاهها باید دارای روشی مستند باشند که روشهای انجام اقدامات بعدی در ارتباط با جمعآوری نمونه، ردیابی، برچسب زدن، نگهداری، شرایط حملونقل، ذخیرهسازی و نابودکردن نمونه را توصیف کند. پروتکلهای مستندشده اختصاصی هر فرایند باید برای آمادهسازی و آنالیز نمونه در دسترس باشند». اگرچه این مقدمه در واقع ضروری است، اما نه توصیه GCLP دقیقی در راستای آگاه کردن آزمایشگاه برای ایجاد SOPهای خاص برای مدیریت پریآنالیتیکال نمونههای مورد استفاده در کارآزماییهای بالینی ارائه شده است و نه تأکیدی بر استانداردسازی/ هماهنگسازی روشها در بین مراکز مختلف صورت گرفته است.
سازمان بهداشت جهانی (WHO) نیز سندی با عنوان «عملیات خوب آزمایشگاه بالینی (GCLP)» منتشر کرده است که باز هم تقریباً بهطور کامل بر روی مباحث سازمانی و آنالیتیکال متمرکز شده و بحث و بررسی درباره مدیریت پریآنالیتیکال نمونه را به یک جمله مبهم محدود کرده است: «مواد آزمایشی در کارآزمایی باید در یک بازه زمانی سازگار با مسائل ایمنی بیمار و پروتکل آزمایشی، طرح آنالیزی، روش عملکرد استاندارد و هرگونه الزامات قراردادی، آنالیز و گزارش شوند»، بنابراین آنچه میتوان بهوضوح از این دو سند مهم برداشت کرد این است که اگرچه دستورالعملهای نوشتهشده باید بهگونهای انجام شوند که همه فعالیتهای کل فرآیند انجام تست را پوشش دهند، اما هیچگونه راهنمایی خاصی برای استانداردسازی یا هماهنگ کردن مراحل مختلف پریآنالیتیکال در یک کارآزمایی بالینی تکمرکزی یا چندمرکزی ارائه نشده است. اسناد مشابه دیگری نیز منتشر گردیده، اما هیچکدام حاوی دستورالعملهای کافی و دقیق در مورد مدیریت پریآنالیتیکال نمونه نیستند.
ریسک قابلتوجه به دست آوردن نتایج نادرست و به خطر انداختن ایمنی بیمار به همراه شواهدی مبنی بر اینکه مبلغ هنگفتی (تا 10 میلیون یورو) بودجه تحقیقاتی ممکن است هر ساله در اتحادیه اروپا به دلیل جمعآوری نمونههای خون نامناسب در کارآزمایی بالینی هدر برود؛ ما را بر آن داشت که برخی از توصیههای خاص را در قالب یک «چکلیست» ارائه دهیم که باید در هنگام تهیه پروتکل مطالعه مورد توجه قرار گیرد (تحت عنوان PREDICT؛ که مخفف جلوگیری از خطاهای تشخیصی پریآنالیتیکال در کارآزماییهای بالینی[1] است). مطابق با ساختار متعارف فاز پریآنالیتیکال، این توصیهها در دستههای انتخاب تست، آمادهسازی بیمار، جمعآوری نمونه خون، مدیریت و ذخیرهسازی، حملونقل نمونه خون و همچنین بازیابی نمونه قبل از آزمایش طبقهبندی شدهاند. در بخشهای بعدی این مقاله، به اختصار در مورد این جنبههای مختلف صحبت کرده و خصوصیات بالقوه مربوط به نمونه خون در کارآزماییهای بالینی را برجسته خواهیم کرد.
انتخاب تست
انتخاب تستهای آزمایشگاهی مناسب، معمولاً به «اقتضا» یا «مدیریت تقاضا» تعبیر میگردد، همان قدر که در اقدامات روتین بالینی موردتوجه است در کارآزماییهای بالینی هم حیاتی و ضروری است. در کارآزماییهای بالینی، بررسی پروتکلهای تحقیقاتی اغلب مدنظر قرار میگیرد تا تستهای منسوخ، زائد و حتی بیفایده استفاده نشوند که این امر به دلیل تداوم عادتهای قدیمی هنگام تدوین پروتکلها و همچنین اطلاعات نادرست یا به روز نشده در مورد اهمیت یک تست است. آزمایش بارداری، مثالی از این موارد است؛ بسیاری از پروتکلهای تحقیقاتی فاز ۳-۱ هنوز هم برای بررسی آزمایشگاهی حاملگی از ادرار یا ارزیابی کیفی گنادوتروپین جفتی انسانی (beta- hCG) استفاده میکنند. صرفنظر از این واقعیت که روشهای ایمونوشیمیایی برای اندازهگیری کمی بتا- HCG در ادرار در حال حاضر در بسیاری از آزمایشگاههای بالینی در سراسر جهان در دسترس نیست، این آزمایش برای شناسایی زودهنگام بارداری، منسوخ و ازکارافتاده است و از این رو ممکن است به اندازه کافی از جنین یا رویان در برابر قرار گرفتن در معرض دارو محافظت نکند و همچنین سلامتی شرکتکنندگان را در معرض خطرات غیرضروری قرار دهد. دریافت پروتکلهای مطالعاتی حاوی تعدادی تست آزمایشگاهی منسوخ یا نامناسب، برای برخی از ما یک تجربه مستقیم است. بررسی وجود ایزوآنزیم MB کراتین کیناز (CK-MB) بهجای تروپونینهای قلبی برای تشخیص انفارکتوس میوکارد و/یا آسیب قلبی، یا درخواست محاسبه نرخ فیلتراسیون گلومرولی تخمینی (eGFR) به همراه فرمول اصلاح رژیم غذایی در بیماری کلیوی (MDRD) بهجای استفاده از معادلهی Chronic Kidney Disease Epidemiology Collaboration; CKD-EPI) که بهتازگی توصیه شده است و موارد دیگری از این دست ،مثالهایی در این زمینه هستند. با توجه به کاربرد بالقوه تستهای آزمایشگاهی برای تعیین صلاحیت شرکتکنندگان، برای شناسایی عوارض جانبی و تعیین پیامدهای بالینی، استفاده از مناسبترین و بهروزترین تحقیقات آزمایشگاهی بهاندازهای که در اقدامات روتین بالینی الزامی است در کارآزماییهای بالینی نیز ضروری و الزامآور است.
هرچند این مسئله ارتباطی جزئی با مفهوم تناسب دارد اما اشاره به آن خالی از لطف نیست که روش آنالیتیکال نیز باید با توجه به هدف آزمون انتخاب شود، بنابراین باید از قبل مشخص شود که آیا از این روش برای غربالگری، تشخیص، پیشآگهی، نظارت درمانی یا پیگیری استفاده میشود یا خیر؛ بنابراین نوع آنالیز، تکنیک آنالیتیکال و غلظت cut-off تست را باید مطابق عملکرد تشخیصی انتخاب کرد و برای استفاده در نظر گرفتهشده در پروتکل مطالعه، سفارشیسازی (customized) کرد. به بیان سادهتر، راحتترین استراتژی برای ارتقاء متناسب بودن تست آزمایشگاهی در کارآزماییهای بالینی، حضور فعال متخصصان آزمایشگاه در کمیتههای مسئول تهیه پروتکل مطالعاتی است.
آمادهسازی بیمار
همانگونه که توصیههای اخیر فدراسیون اروپایی شیمی بالینی و پزشکی آزمایشگاهی (EFLM) و کنفدراسیون بیوشیمی بالینی آمریکای لاتین (COLABIOCLI) در مورد خونگیری وریدی تصریح کرده است، نمونه خون باید دقیقاً بازتابی از وضعیت in vivo بیمار باشد و از این رو آمادهسازی بیمار همواره یک مسئله پریآنالیتیکال حیاتی و مهم بوده است؛ بنابراین، اگرچه بدیهی است که توصیههای اساسی و پایهای ارائهشده برای جمعآوری روتین نمونه باید در مورد کارآزماییهای بالینی نیز اعمال شوند، اما برخی اقدامات احتیاطی اضافی نیز لازم است. از آنجا که نتایج یک شرکتکننده منفرد با نتایج بسیاری از شرکتکنندگان دیگر در دیتابیس کارآزمایی بالینی ادغام میشود، الزامی است که فرایند آمادهسازی بیمار برای جمعآوری نمونه بهدقت استانداردسازی شود. این امر نهتنها مستلزم استانداردسازی دقیق فعالیتهای جمعآوری خون از یک بیمار به بیمار دیگر در یک مرکز نمونهگیری واحد است، بلکه یکپارچگی فعالیتهای جمعآوری خون هنگام نمونهگیری در مراکز مختلف جمعآوری نیز الزامی است. این امر نیاز به جمعآوری دقیق اطلاعات بالینی دارد (بهعنوان مثال استفاده از داروها و مکملها، پاتولوژیها) و به دنبال آن (در صورت لزوم) استانداردسازی دقیق مدت زمان ناشتا بودن، زمان جمعآوری، پرهیز از مصرف سیگار و قهوه، مدت استراحت قبل از خونگیری و موقعیت بیمار در هنگام نمونهگیری (جدول 2).
جمعآوری و مدیریت نمونه خون
مفاهیم بیانشده در پاراگراف قبلی در مورد آمادهسازی بیمار، در مورد برچسب زدن نمونهها، جمعآوری، مدیریت و حملونقل نیز صادق است. کلیه این فعالیتها باید استانداردسازی شده و بهطور دقیق در پروتکل مطالعه توصیف شوند، بهطوریکه فلبوتومیستها و سایر اپراتورهای مراقبتهای بهداشتی همواره همان روشهای ثابت و یکسان را دنبال کنند؛ بنابراین، بهطور خلاصه، پروتکل مطالعه باید دربرگیرنده راهنماییهای واضح در مورد نوع و حجم نمونه، ماتریس نمونه، وسیله جمعآوری خون و لولههای جمعآوری خون و مواد افزودنی، مدت زمان استفاده از تورنیکت، محل ترجیحی خونگیری سیاهرگی (venipuncture)، شیوه خونگیری و مخلوط کردن نمونه باشد (جدول ۲). استفاده از دستگاههای یکسان برچسبزنی اتوماتیک بر روی لوله، گزینه مناسب برای ارتقاء استانداردسازی هستند.
آمادهسازی نمونه خون، حملونقل و یا ذخیرهسازی
این بخش از مرحله پریآنالیتیکال عمدتاً در مورد مطالعات چندمرکزی مبتنی بر اندازهگیریهای متمرکز در یک آزمایشگاه مرجع واحد، یعنی محلی که نمونهها از مراکز جمعآوری دوردست به آنجا منتقل میشوند، یا مطالعاتی که آنالیز همه نمونههای آنها بهصورت دستهای انجام میگردند، صدق میکند. اگرچه توضیحات کامل در مورد جوانب مثبت و منفی آزمایشهای محلی در مقایسه با آزمایشهای متمرکز، خارج از حوصله این مقاله است و در مقاله دیگری بهطور جامع مورد بررسی قرار گرفته است، باید توجه داشت که در آزمایشهای متمرکز، ریسک سوگیری آنالیتیکال کمتر است، از سوی دیگر آنالیز محلی خطر سوگیری پریآنالیتیکال ناشی از حملونقل نمونه را محدود میکند. هر دو راهحل مناسب هستند، مشروط به اینکه یک پروتکل دقیق، دربرگیرنده روشهای آنالیتیکال یا پریآنالیتیکال بهدقت استانداردسازی شده، در دسترس محققان قرار گیرد. برای آن دسته از کارآزماییهای بالینی که شامل انتقال نمونه از مراکز جمعآوری دوردست به آزمایشگاه مرجع هستند، در صورت وجود یک ریسک ملموس مبنی بر اینکه پایداری آنالیتها در سرم یا پلاسما ممکن است در حین حملونقل در معرض خطر قرار گیرد، سانتریفیوژ نمونهها بهصورت محلی الزامی است. اگر سانتریفیوژ بهصورت محلی یا در آزمایشگاه مرجع انجام گیرد، شرایط سانتریفیوژ باید استانداردسازی شود (جدول 2)، ضمن اینکه سرم یا پلاسما باید در سریعترین زمان ممکن پس از سانتریفیوژ جدا شوند. در مرحله بعد وضعیت حملونقل نمونه (یعنی زمان و دما) باید بهطور دقیق استانداردسازی، ثبت و پایش گردد.
برای نمونههایی که آنالیز آنها بلافاصله انجام نشده است، آنها باید مطابق شواهد موجود برحسب پایداری آنالیت در دماها و زمانهای مختلف ذخیره شوند. بهطور معمول ترجیحاً با تقسیم کردن نمونهها قبل از ذخیرهسازی، در حجمهای متناسب با نیاز آنالیتیکال طبق پروتکل مطالعاتی، باید از چرخههای انجماد و ذوب مکرر جلوگیری شود.
بازیابی نمونه قبل از انجام تست
در آن دسته از کارآزماییهای بالینی که به استفاده از بیوبانکها برای ذخیره طولانیمدت مواد بیولوژیکی نیاز دارند، بازیابی نمونه قبل از آزمایش میتواند موضوع حیاتی دیگری باشد. شواهد معتبری ارائه شده است که روشهای مختلف برای مخلوط کردن و یا مدیریت نمونههای ذوبشده ممکن است نتایج برخی از تستهای آزمایشگاهی را بهطور قابل ملاحظهای تغییر دهد؛ از این رو توصیه میشود که SOPها با هدف استانداردسازی فرایندهای مورد استفاده در تهیه نمونهها برای انجام آزمایش، برای کلیه آزمایشگاههای شرکتکننده در دسترس باشند و روشهای ذوب و مخلوط کردن نمونهها و همچنین اندیکاسیونهای واضح مبنی بر اینکه نمونههای نامناسب نباید مورد آنالیز قرار گیرند را دربر بگیرند. این توصیه اخیر توسط شواهدی حمایت میشود که تصریح میکنند کسب یک نتیجه آزمایش نادرست در یک نمونه کارآزمایی بالینی نهتنها ممکن است ایمنی سوژه موردمطالعه را تحت تأثیر قرار دهد، بلکه ممکن است نقاط پایانی مطالعه را نیز مختل کند؛ بنابراین منجر به عدم موفقیت یا بیاساس شدن اعتبارسنجی مداخله بهداشتی میشود که ممکن است به اشتباه به عرصه بالینی راه پیدا کند. (جدول 2). این امر بهویژه برای نمونههای همولیزشده که اولین عامل توقف تست در آزمایشگاههای بالینی است، اهمیت دارد.
نتیجهگیری
اگرچه برخی از موانع نظری در فرآیند «عبور از آزمایش به بالین» وجود دارد، این نیز غیرقابل انکار است که ممکن است برخی از کارآزماییهای بالینی به دلیل مشکلات عملی مانند استفاده از تستهای تشخیصی نامناسب برای ارزیابی کارایی، اثربخشی یا ایمنی یک مداخله بالینی خاص یا به دلیل پایین بودن کیفیت فرایند انجام تست بهویژه در مرحله پریآنالیتیکال واقعاً نتایج نادرستی را ارائه دهند. اکنون بهطور گستردهای پذیرفته شده است که خطاهای پریآنالیتیکال در مقایسه با اشتباهات آنالیتیک و پستآنالیتیکال تا حد زیادی کمتر از حد واقعی برآورد میشوند و این مسئله بهوضوح با اندک بودن توصیههای رسمی ارائهشده برای جمعآوری و مدیریت نمونههای زیستی در کارآزمایی بالینی منعکس میشود. حتی در سناریوهای واقعی، هماهنگكنندگان كارآزماییهای بالینی اغلب بر برخی عوامل آنالیتیکال و فنی (یعنی نظارت بر دمای فریزرها) تأکید دارند و بنابراین بهنظر میرسد مشكلات واقعی که میتواند باعث كاهش كیفیت یا قابل اطمینان بودن نمونه شود، مانند چرخه انجماد و ذوب مکرر، علیرغم این واقعیت که دمای فریزرها بهطور دقیق کنترل شده است، یا عملکرد بسیار دقیق تستها در بیمارانی که نباید ثبتنام میکردند (بهعنوان مثال مطالعات تجمع پلاکتی در بیمارانی که نمیپذیرند داروهای ضد پلاکت را مصرف کنند) را دستکم میگیرند.
از این رو آنچه اکنون واضح است این است که دادههای آزمایشگاهی غیرقابل اعتماد بهدستآمده در کارآزماییهای بالینی، از جمله مواردی که تحت تأثیر مشکلات پریآنالیتیکال بهدست آمدهاند، نهتنها با تفسیر ناکافی یافتههای مطالعه همراه خواهند بود، بلکه ممکن است منجر به تشخیص نادرست عوارض یا اثرات جانبی و در نتیجه عدم ارائه اطلاعات مفید شود و بهطور بالقوه به شرکتکنندگان در مطالعه آسیب برسانند و همچنین هزینههای تجاری را برای حامیان مالی بهطور نامناسب افزایش دهند که در نهایت باعث عدم سرمایهگذاری تحقیقات توسط شرکتها و سیاستگذاران میشود. بهمنظور کاهش احتمال عدم موفقیت کارآزمایی بالینی به دلیل مشکلات پریآنالیتیکال، ما یک چکلیست آزمایشی را تهیه کردهایم که دربردارنده نکات کلیدی است که هنگام طراحی یک کارآزمایی بالینی باید بهصورت پیشکنشگرانه ارزیابی و سپس بهطور رسمی در SOPهای آن اجرا و تأکید شود و هرگونه انحراف از پروتکل باید بهطور واضح ثبت گردد. ما عمیقاً امیدواریم که این توصیهها نقش مفیدی در افزایش قابل اطمینان بودن نتایج آزمایشگاه پزشکی در کارآزماییهای بالینی داشته باشند.
این مقاله ترجمهای است از:
PREDICT: a checklist for preventing preanalytical diagnostic errors in clinical Trials
Clin Chem Lab Med 2019; aop
[1] preventing preanalytical diagnostic errors in clinical trials
منابع بالقوه خطاهای آزمایشگاهی
استانداردسازی در روشهای ایمونواسی (1)
مباحثی پیرامون استانداردسازی در روشهای ایمونواسی (2)
چالشهای استقرار و اجرای موفق چرخه مدیریت خطا (نامنطبق) در آزمایشگاه بالینی بخش اول
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام