نکتههای کلیدی آزمایشگاهی در سنجشهای ایمونواسی و بیماریهای اتوایمیون
دکتر حبیباله گلافشان عضو هیئت علمی دانشگاه علوم پزشکی شیراز
محمد اسماعیل خدمتی کارشناس ارشد بیوشیمی دانشکده پیراپزشکی شیراز
سنجشهای بر پایه ایمونواسی
سنجشهای ایمونولوژیک بر پایه واکنش آنتیژن و آنتیبادی بنا شده است و کیتهای اندازهگیری پروتئینها، هورمونها، مارکرهای سرطانی، فاکتور روماتوئیدی و سایر مارکرهای اتوایمیون، تروپونین، پروتئینهای ریز و داروها در دسترس است. با وجود گستردگی استفاده از روشهای ایمونولوژیک، آشنایی با مداخلهکنندهها که مثبت یا منفی کاذب را به دنبال میآورند، الزامی است.
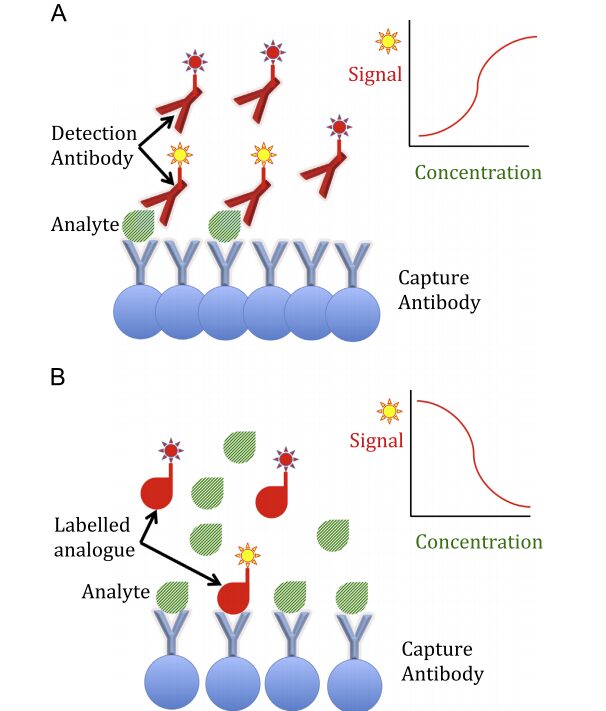
در سنجش ساندویچی ایمونواسی سیگنال سنجش از طریق واکنش آنتیبادی نشاندارشده به آنتیژن اختصاصی که به آنتیبادی فاز جامد متصل شده است ارسال میگردد. سیگنال ممکن است از طریق واکنش آنزیمی (الیزا)، ساطع شدن اشعه توسط مواد رادیواکتیو (RIA)، ساطع شدن نور فلورسانس یا لومینسانس و یا الکترو کمیلومینسانس و یا واکنش قابل رؤیت با ذرات طلا و یا لاتکس باشد.
در تصویر فوق نمای A سنجش ایمونواسی را به روش ساندویچ نشان میدهد. در این روش مقدار آنالیت ارتباط مستقیم با سیگنالهای ارسالی توسط آنتیبادی نشاندار دارد. در نمای B ایمونواسی بر مبنای رقابتی انجام شده است. در این حالت آنالیت نشاندارشده در کیت آزمایش با آنالیت موجود در سرم برای چسبیدن به آنتیبادیهای فاز جامد رقابت کرده و مقدار آنالیت نسبت عکس با سیگنالهای ارسالی توسط آنتیبادیهای نشاندار دارد.
مداخلهگرها:
- اثرات ماتریکس ناشی از تداخل مواد آندوژن از قبیل همولیز، بیلیروبین، لیپیدها و پاراپروتئینها در سرم یا پلاسما است. نمونه همولیز ممکن است برای سنجشهای ایمونولوژی مناسب نباشد، رها شدن آنزیمهای پروتئولیز رهاشده از همولیز گلبولهای قرمز دارای اثرات تخریبی روی آنالیتهایی مانند انسولین، گلوکاگون، کلسیتونین و هورمون پاراتیروئید، ACTH و گاسترین است و از طرف دیگر هموگلوبین آزادشده با خاصیت آنزیمی پراکسیداز ممکن است بر روی تستهای الیزا که آنتیبادی نشاندار با آنزیم پراکسیداز دارد، مداخله کند.
- تداخل مواد آندوژن یا اگزوژن (مواد خارجی همراه با کیت) که به علت واکنش متقاطع با آنتیبادیها در سنجش آنالیت دخالت میکنند.
- خطاهای سیستم یا روش آزمایش از طریق آلودگی پروب، برداشت نمونه با پیپت، خطای انتقال نمونه به نمونه دیگر
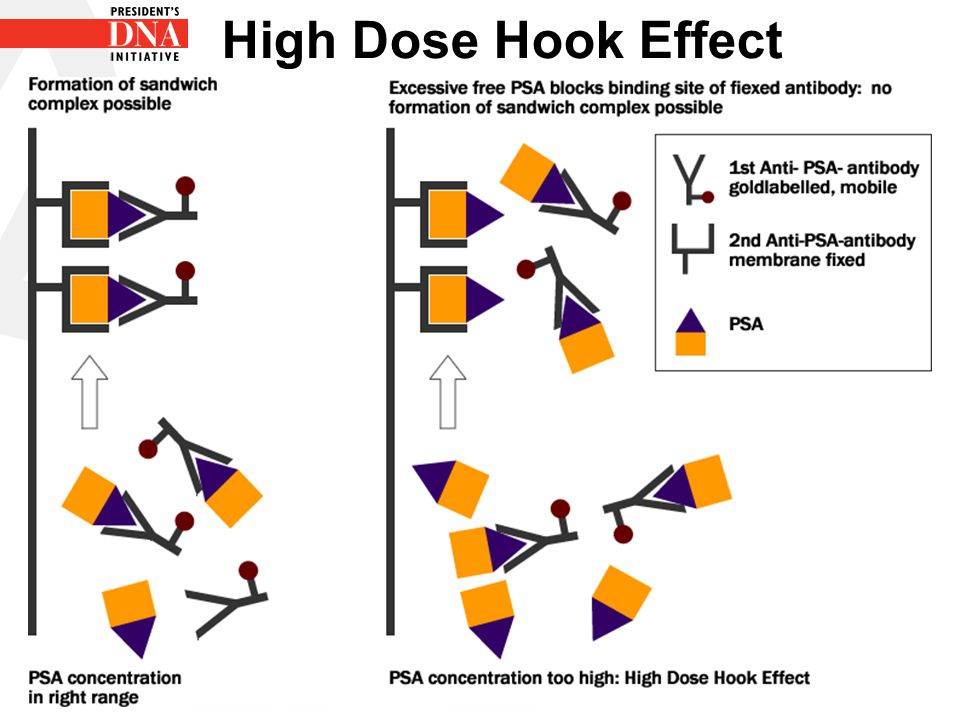
- اثرات پروزون (Prozone)یا اثرات هوک بستگی به غلظت آنتیبادیها در معرف روش سنجش دارد. سطح زیاد آنتیژن تولید کمپلکسهای ساندویچی را کاهش میدهد. ساندویچ ایمنی از احتباس آنتیژن بین آنتیبادیهای فاز جامد و آنتیبادیهای نشاندار شکل میگیرد. حضور آنتیژنهای زیادی در سرم بیمار موجب تشکیل کمپلکسهای تکی آنتیژن- آنتیبادی میشود و از این رو اثرات هوک با نتایج منفی کاذب همراهی دارد.
در سنجش ایمونواسی به روش ساندویچی غلظت فوقالعاده زیاد یک هورمون برای مثال PSA موجب پدیده هوک گردیده که بهطور کاذب غلظت آنالیت کاهش مقدار را نشان میدهد. در این حالت غلظت زیاد آنالیت موجب پیوند رقابتی آن با آنتیبادیهای فاز جامد و نشاندار میگردد که با پروسه شستشو از محیط واکنش حذف میگردد و در نتیجه سیگنال کمتری به آشکارگر آنالیزور ارسال میشود.
- تداخل آنتیبادیهای هتروفیل که با پیوند به اجزای معرف سیستم آزمایش نتایج کاذب را به دنبال دارند. اتوآنتیبادیها، ماکرو آنزیمها و فاکتورهای روماتوئید هم با همین سازوکار نتایج مثبت کاذب میدهند. در سنجش سطح داروها، متابولیتهای غیرفعال دارو با آنتیبادی سیستم سنجش واکنش داده و مانع از اندازهگیری دقیق دارو میگردد. آنتیبادیهای هتروفیل یا ناجور منبع مهم خطاهای کاذب مثبت یا منفی در آزمایشهای ایمونواسی هستند.
آنتیبادیهای هتروفیل پلیکلونال بوده و شامل موارد زیر هستند:
- آنتیبادیهای هتروفیل که بهطور ضعیف یا غیراختصاصی با معرفهای سیستم آزمایش واکنش میدهند.
- آنتیبادیهای ضد حیوانی که بهطور شدید و اختصاصی با آنتیبادی بهکار گرفتهشده در تست واکنش میدهند.
- اتوآنتیبادیها
- آنتیبادیهای دارویی درمانی
- ماکروآنالیتها یا ماکروآنزیمها که آنالیتهای کانژوگه شده با آنتیبادیهای اندوژن یا سایر مواد اندوژن هستند که بهصورت الیگومر یا پلیمر درآمدهاند.
- فاکتورهای روماتوئید
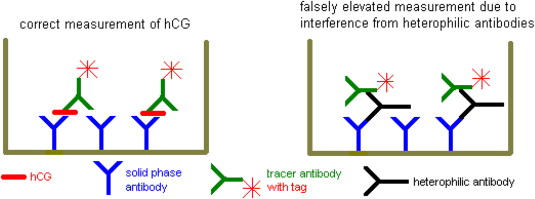
تصویر سمت چپ سنجش هورمون HCG را به روش ساندویچی در چاهک الیزا بدون تداخل آنتیبادی هتروفیل نشان میدهد. در تصویر سمت راست آنتیبادیهای هتروفیل (آنتیبادیهای ناجور) بهطور غیراختصاصی به آنتیبادیهای فاز جامد و نشاندار پیوند داده شده و بهجای آنالیت مورد سنجش قرار میگیرند. در فرایند واکنش حقیقی، هورمون HCG بین این دو آنتیبادی احتباس شده و سیگنال سنجش از طریق آنتیبادی نشاندار به شناساگر دستگاه ارسال میگردد
آنتیبادیهای ضد حیوانی از طریق پرورش حیوان یا تماس با فرآوردههای حیوانی شکل میگیرند. گرچه بسیاری از کلونهای آنتیبادی در انسان دارای ویژگی ضد آنتیبادیهای حیوانی است، ولی تداخل زمانی آشکار میشود که آنتیبادی دارای عیار بالا باشد. بیشترین آنتیبادی ضد حیوانی در انسان آنتیبادیهای ضد موش (HAMA) است که از طریق آنتیبادیهای درمانی یا از طریق تماس با فرآوردههای پروتئینی ساخته شده است. با توجه به اینکه آنتیبادی هتروفیل در ادرار وجود ندارد، سنجش ادراری آنالیتها با تداخل همراه نیست؛ برای مثال موارد زیادی از مثبت کاذب هورمون βHCG گزارش شده است، ولی چنانچه همزمان در ادرار هم مورد سنجش قرار میگرفت، با مشکلات و عواقب گزارش مثبت کاذب همراه نمیشد. برای مثال ممکن است از βHCG بهعنوان یک مارکر سرطان استفاده شده باشد که گزارش مثبت کاذب آن میتواند دارای عواقب خطرناک برای بیمار باشد.
آنتیبادیهای هتروفیل در روشهای سنجش ساندویچی تداخل بیشتری نسبت به روشهای رقابتی دارند بهطوریکه آنتیبادی هتروفیل حتی در غیاب آنتیژن یا آنالیت میتواند با آنتیبادی بهکار گرفته شده در سیستم آزمایش کمپلکس ساندویچی دهد و افزایش کاذب آنالیت را به دنبال داشته باشد و یا گاهی با یکی از آنتیبادیهای (capture or label) سیستم واکنش داده و منفی کاذب بدهد ولی موارد مثبت کاذب بیشتر است و بیشترین دخالت آنتیبادیهای هتروفیل در سنجش تروپونین I و βHCG به روش ساندویچی است.
آنتیبادیهای هتروفیل در 0/2 تا ۱۵ درصد بیماران بدحال بستری ممکن است یافت شود و گزارشهای اخیر حاکی از شیوع تداخل 0/2 تا 3/7 درصدی است. آنتیبادیهای هتروفیل ممکن است به نقاط مختلف آنتیبادیهای سیستم آزمایش مانند FC، ایدیوتایپ و یا به بازوی آنتیبادی وصل شوند.
گاهی آنتیبادیهای هتروفیل در پاسخ به عفونتهای میکروبی ساخته میشوند و استفاده از مواد مسدودکننده آنتیبادی هتروفیل در کیت، ضمانت صددرصدی به همراه ندارد. آنتیبادیهای ضد حیوانی در انسان بهویژه از طریق درمان با آنتیبادی موش و افرادی که در خانه در تماس با پروتئینها یا حیوانات خانگی قرار دارند ساخته میشود، برای مثال در درمان مسمومیت با دیژیتالها (DIGOXIN) از قسمتهای Fab آنتیبادی که از گوسفند تهیه شده است، استفاده میشود و یا استفاده از انسولین خوک ممکن است با ساخته شدن آنتیبادی ضد خوکی همراه شود. بیشتر واکسنها در جوجه یا خرگوش تولید میشود. فاکتور ۸ غیر از مهندسی ژنتیک انسانی دارای منبع خوکی نیز هست. عبور آنتیبادی حیوانی ممکن است از روده صورت گیرد که برای مثال میتوان به عبور آن در بیماری سیلیاک اشاره کرد.
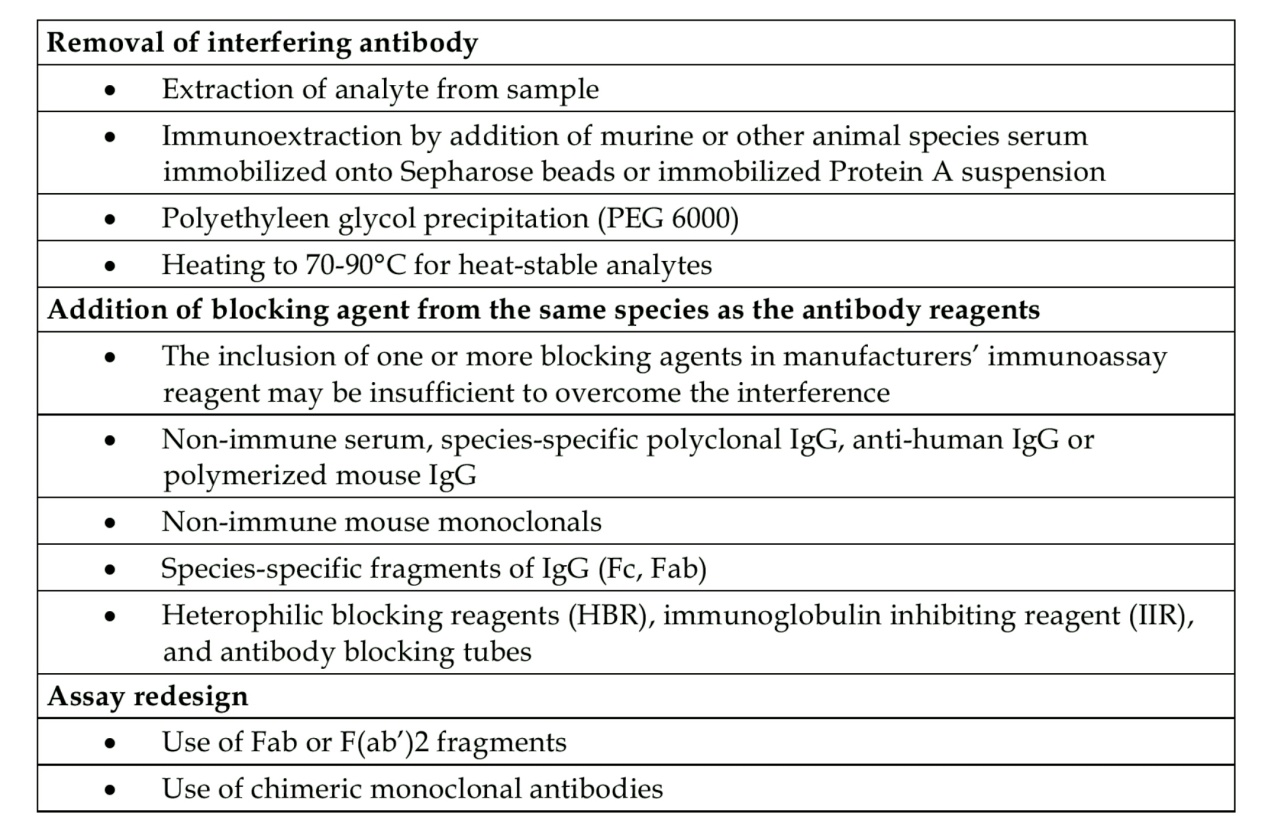
تابلوی فوق سازوکارهای برداشت آنتیبادیهای مداخلهگر در سنجشهای ایمونواسی را نشان میدهد
جدول فوق لیست پپتیدهای دارویی که برای درمان بیماریهای سرطان و اتوایمیون بهکار میرود را نشان میدهد. بخشی از این پپتیدها (قسمت Fab) دارای منشأ حیواناتی از قبیل موش هستند و بخشی (قسمت Fc) منشأ انسانی دارد. تزریق آنها ممکن است موجب شکلگیری آنتیبادی علیه آنتیبادیهای موش در انسان گردد.
آنتیبادیهای HAMA (ضد موش) در روشهای سنجش که از آنتیبادیهای موشی استفاده میشود دخالت میکنند. غلظت HAMA در غالب موارد کمتر از ۱۰ میکروگرم در سیسی است ولی بیشتر از ۱۰۰۰ هم گزارش شده است.
آنتیبادیهای تهیه شده از بز و خرگوش در سیستم ایمونواسی نیز کاربرد دارد و ساخته شدن آنتیبادیهای انسان علیه بز و خرگوش نیز در آزمایشهای ایمونولوژی دخالت دارد. آنتیبادیهای ضد حیوان در انسان از هر گروه آنتیبادی امکان دارد.
فاکتور روماتوئید:
فاکتور روماتوئید از جنس IgM و علیه قسمت FC ایمونوگلوبولین IgG است. این فاکتور در ۷۰ درصد موارد روماتیسم مفصلی، بیماریهای عفونی و التهابی و حتی گاهی در افراد سالم بدون علامت یافت میشود. فاکتور روماتوئید با پل زدن بین آنتیبادیهای کپچر ( Capture) و نشاندارشده (Lable) در روش ساندویچ، افزایش کاذب آنالیت را به دنبال دارد. علاوه بر روشهای ساندویچی، در روشهای رقابتی که از یک آنتیبادی استفاده میشود، فاکتور روماتوئید به آنتیبادی چسبیده و از پیوند آن با معرف نشاندارشده جلوگیری میکند که نتیجه آن افزایش کاذب سطح آنالیت است. فاکتور روماتوئید را میتوان با استفاده از Anti RF از سرم برداشت کرد.
اتوآنتیبادیها:
برای کاهش تداخل اتوآنتیبادیها که در بیماریهای اتوایمیون یافت میشود میتوان از روش ژل فیلتراسیون یا رسوب با پلیاتیلن گلایکول در سرم شناسایی را انجام داد. اتوآنتیبادیها ممکن است با پیوند به آنالیت کانژوگه شده موجب افزایش کاذب شوند و یا به آنالیت چسبیده و منفی کاذب دهند؛ برای مثال حضور آنتیبادی علیه تروپونین I، منفی کاذب را به دنبال دارد. گاهی اتوآنتیبادیها با پیوند به آنالیتها ایجاد ماکروآنالیت میکنند. برای مثال میتوان از ماکروآمیلاز و ماکروپرولاکتین نام برد. ماکروآنالیتها از نظر فیزیولوژی غیرفعال بوده و اغلب در سنجش، تداخل ایجاد میکنند و افزایش کاذب آنالیت را سبب میشوند.
با رسوب با پلیاتیلن گلیکول میتوان ماکروآنالیتها را از سرم جدا کرد. اتوآنتیبادی علیه داروی دیجوکسین که در درمان ازدیاد مصرف دارو بهکار میرود در روش سنجش دارو دخالت میکند. برای شناسایی انواع مداخلهگرها در روشهای ایمونولوژیک بهویژه وقتی که جواب آزمایش با شرایط بالینی تطابق ندارد میتوان از روشهای رقیقسازی و خطی شدن، گرفتن تاریخچه از بیمار، استفاده از روش دیگر سنجش و برداشت یا مسدود کردن مداخلهگرها استفاده کرد. انکوباسیون سرم با سرم حیوانی غیر ایمونیزه یا آنتیبادیهای جوجه تداخل آنتیبادیهای هتروفیل را کاهش میدهند.
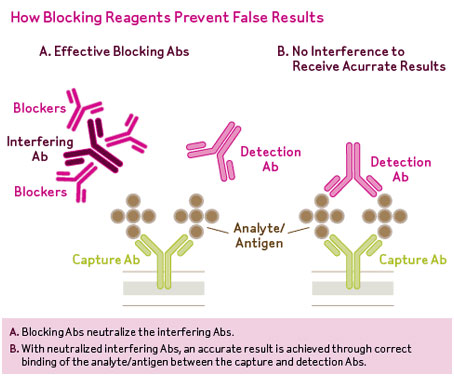
تصویر فوق کاهش تداخل آنتیبادیهای غیراختصاصی توسط معرفهای مسدودکننده را نشان میدهد. در این موارد سرم بیمار نخست با آنتیبادیهای اختصاصی مسدودکننده (برای مثال آنتیبادی علیه آنتیبادیهای هتروفیل و فاکتور روماتوئید) مجاور شده و سپس به چاهک الیزا اضافه گردیده تا آنالیت موردنظر را به آنتیبادی فاز جامد و نشاندار پیوند دهد و مقدار واقعی آنالیت مشخص گردد. آنتیبادیهای غیراختصاصی و تداخلگر از طریق ایمونوسوربنت (Immunosorbent) جذب میشوند
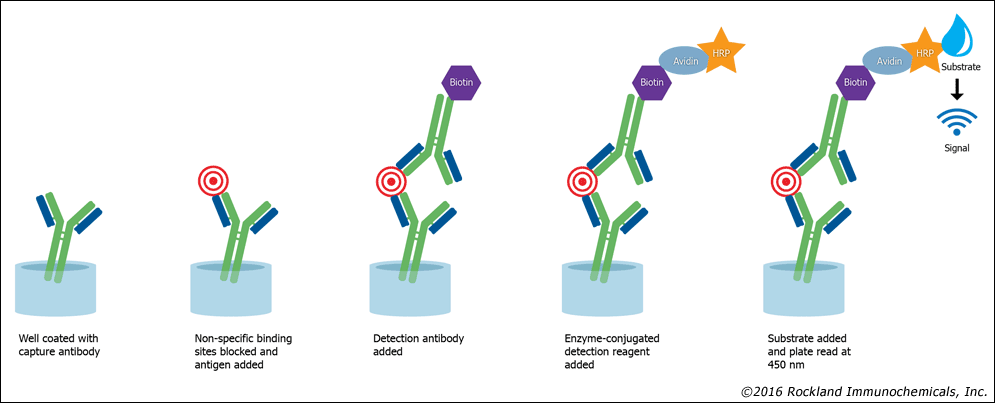
شکل فوق سنجش ساندویچی با پیوند بیوتین با آویدین به آنتیبادی نشاندار را نشان میدهد. در این روش بهجای اینکه آنتیبادی ثانویه بهطور مستقیم با آنزیم نشاندار شود با بیوتین نشاندار میگردد و پس از شستشو، آویدین کانژوگه شده با آنزیم پراکسیداز به چاهک الیزا افزوده میشود و به دلیل میل ترکیبی بالای آویدین به بیوتین واکنش رنگسنجی دقیقتری برای سنجش آنالیت به دست میدهد
روش سنجش الکترو کمیلومینسانس:
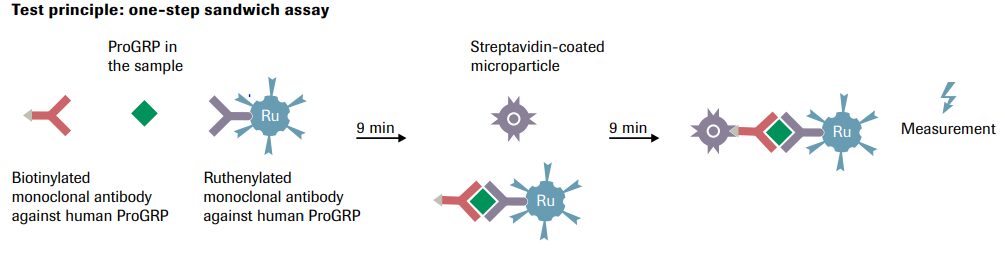
شکل فوق اصول سنجش آنالیت به روش الکترو کمیلومینسانس (ECLIA) در سیستمهای کوباس را نشان میدهد. در این روش از دو آنتیبادی اختصاصی علیه آنالیت موردنظر که یکی از آنها به بیوتین و دیگری به روتنیوم (Ruthenium) پیوند دارد، استفاده میشود. پس از ساندویچ شدن آنالیت توسط آنتیبادیها، میکرو پارتیکلهای مغناطیسی آغشته به استرپ آویدین به مخلوط فوق اضافه میشود. استرپ آویدین با اتصال به بیوتین به کمپلکس ساندویچی متصل شده و مخلوط از مسیری عبور داده میشود تا کمپلکسها توسط یک صفحهی مغناطیسی جذب شود.
در این مکان میدان الکتریکی برقرار گشته که منجر به اکسید شدن روتنیوم میشود (Ru2+ › Ru3+). در قدم بعد با اضافه کردن تریپروپیل آمین یا TPrA به محیط، واکنش الکترو کمیلومینسانس آغاز میشود، بهطوریکه TPrA بهصورت رادیکال آزاد درآمده و بهعنوان دهندهی الکترون به روتنیوم عمل میکند و روتنیوم را بهصورت Ru2+ درآورده که این پدیده منجر به ساطع شدن نور در طولموج 620 نانومتر شده و این سیکل تا اندازهگیری آنالیت ادامه مییابد
بیماریهای اتوایمیون:
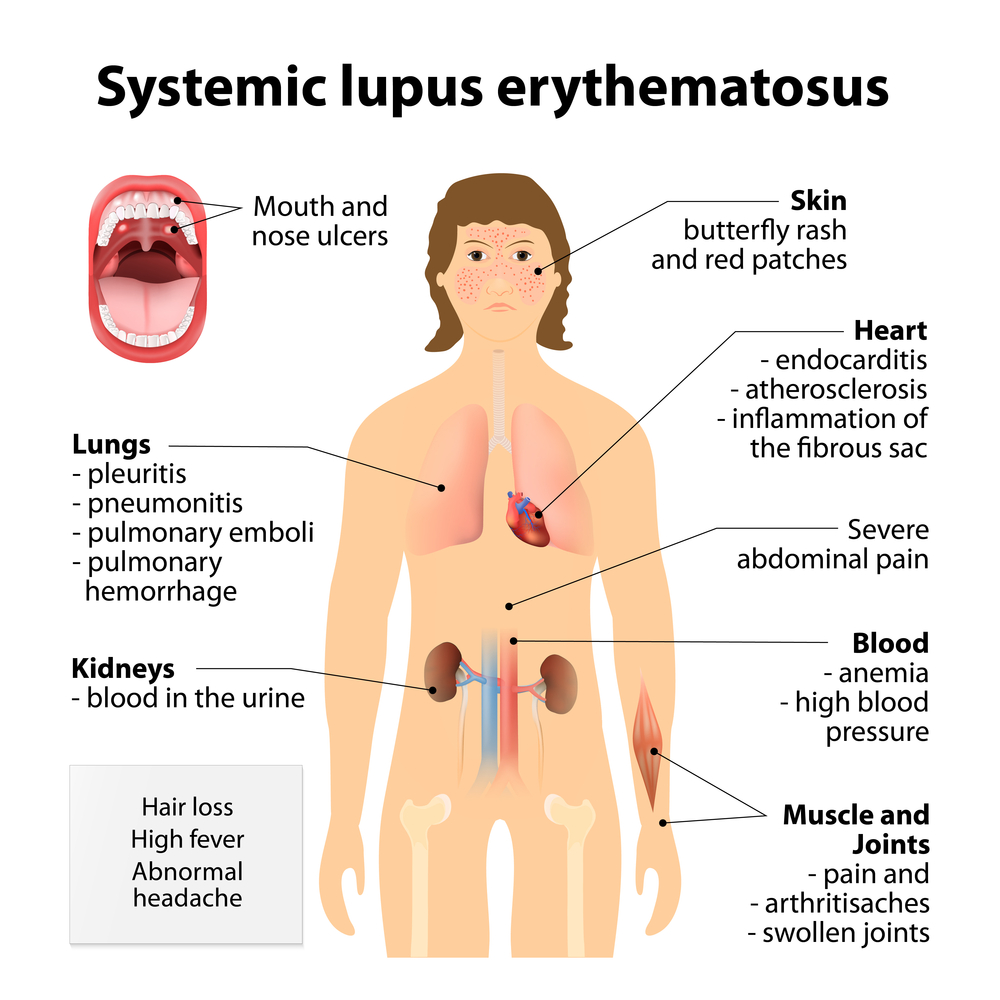
بیماری لوپوس سیستمیک یک بیماری فراگیر است که مربوط به ارگان خاصی نیست. آسیب بافتی در نتیجه سنتز آنتیبادی علیه DNA و تخریب بافتی به دنبال کمپلکسهای DNA با آنتی DNA صورت میگیرد. از نظر آزمایشگاه هماتولوژی، برای هر فرد بهویژه برای هر خانم در سن بارداری که با کمخونی همولیتیک با کومبز مثبت و یا لکوپنی کمتر از ۴۰۰۰ یا لنفوپنی کمتر از 1000 و یا ترومبوسیتوپنی کمتر از ۱۰۰۰۰۰ در میلیمترمکعب مراجعه نماید، سفارش به انجام آزمایشهای ANA و Anti-ds DNA میگردد.
آرتریت روماتوئید نیز از بیماریهای اتوایمیون فراگیر است که با التهاب مزمن مفاصل همراه است و با آزمایشهای فاکتور روماتوئید و آنتیبادی علیه اپیتوپهای پروتئین سیترولیندار (Anti CCP) به همراه علائم بالینی میتوان بیماری را تشخیص داد. ارتباط نزدیکی بین سیگاریها و افزایش عیار Anti CCP و بیماری پیشرونده آرتریت روماتوئید مشاهده شده است. دود سیگار امکان تبدیل آرژنین به سیترولین و پیدایش Anti CCP از نوع تخریبی را مطرح کرده است.
بیماریهای لوپوس و آرتریت روماتوئید از مثالهای بیماریهای اتوایمیون فراگیر است، در حالی که بیماریهای خود ایمن دیگر مانند کمخونی همولیتیک و هاشیموتوز اختصاصی بافت است. بیماری اتوایمیون تیروئید در طیفی از التهاب هاشیموتوز تیروئیدی که کمکاری تیروئید را به دنبال دارد تا بیماری گریوز که با پرکاری تیروئید همراه است قرار میگیرد. هاشیموتوز ناشی از ایمنی سلولار و تهاجم لنفوسیتها و تخریب فولیکولهای تیروئید است در حالی که گریوز ناشی از اتوآنتیبادیهای سیستم هومورال است که با تحریک گیرنده TSH پرکاری میدهد.
از سنجش اتوآنتیبادی علیه تیروپراکسیداز (Anti TPO)، آنتیبادی علیه تیروگلوبولین، سنجش ایمونوگلوبولینهای محرک تیروئید و ایمونوگلوبینهای بازدارنده اتصال به تیروتروپین (TB II) برای تشخیص بیماریهای اتوایمیون تیروئید استفاده میشود.
بیماری اتوایمیون کبد با افزایش آنزیمهای AST و ALT و افزایش سطح ایمونوگلوبینها و حضور اتوآنتیبادی بروز میکند. اتوآنتیبادیهای درخواستی شامل ANA، anti SMA،anti LKM و anti LC است. سیروز اولیه کبدی یک بیماری خودایمن با تهاجم سیستم لنفاوی به مجاری صفراوی داخل کبد و تخریب و فیبروز آنهاست که در نهایت سیروز کبدی و نارسایی را به دنبال دارد. این بیماری بهطور عمده در خانمها در سنین ۵۰ تا ۶۰ سالگی مشاهده میگردد.
لیست آنتیبادیها برای تشخیص بیماریهای اتوایمیون کبد و مجاری صفراوی
مثبت شدن آنتیبادی علیه میتوکندری (AMA) و افزایش فسفاتاز قلیایی از راههای تشخیص بیماری است. بیماری سیلیاک یک بیماری گوارشی خودایمن است که ناشی از پاسخ غیرطبیعی سیستم ایمنی به اپیتوپهای گلوتن گندم در بیمارانی است که از نظر HLA-DQ2 و HLA-DQ8 مثبت هستند. سنجش ایمونوگلوبولین A علیه ترانس گلوتامیناز (Anti TTG) با حساسیت ۹۴% و اختصاصیت ۹۷ درصد از آزمایشهای تشخیص این بیماری است که با اسهال، درد شکم، از دست دادن چربی در مدفوع و کاهش وزن همراه است.
بیماریهای اتوایمیون منحصر به عضو در جدول فوق مشاهده میشود. بیماری سیلیاک یا سوء جذب به علت پاسخ غیرطبیعی سیستم ایمنی به اپیتوپهای گلوتن گندم است
در جدول زیر بیماریهای خودایمنی اختصاصی ارگانها با آنتیبادیهای تشخیصی مشاهده میشود.
تابلوی فوق طیف برخی از بیماری اتوایمیون سیستمیک از قبیل لوپوس و روماتیسم مفصلی و بیماریهای روماتیسمی منحصر به یک ارگان مانند هاشیموتوز و سیروز صفراوی اتوایمیون را نشان میدهد
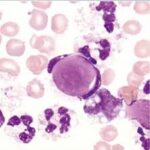
سلول LE یا سلول لوپوس در تراوشات التهابی مایع پلور یا مایع شکم یا مایع دور قلبی در بیماران مبتلا به لوپوس یا اتو ایمیون ممکن است مشاهده شود. سلول LE نوتروفیلی با لوبهای کناررفته بنفش رنگ است که یک جسم بزرگ هستهای به رنگ پوست پیاز را فاگوسیت کرده است
بیماری لوپوس سیستمی با آزمایش آنتیبادی علیه DNA دو رشتهای و علائم بالینی تظاهر میکند. کمپلکسهای ایمنی با فعال کردن کمپلمان، تحریک و التهاب در بافتهای مختلف از قبیل پوست، مفاصل، کلیه، ریه و قلب را ایجاد میکنند
چگونه تداخل در ایمنیسنجی را شناسایی و برطرف کنیم
https://www.sciencedirect.com/topics/neuroscience/immunoassay
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام