(بخش سوم)
دكتر رضا ميرنژاد (استاد تمام دانشگاه)
تشخیص عفونتهای مایکوپلاسماها
شناسایی و تشخیص آزمایشگاهی عفونتهای مایکوپلاسماها بر اساس تستهای باکتریولوژیک شامل مورفولوژی، خصوصیات کشت، خواص فیزیولوژی و سرولوژی است. با وجود اينكه این تستها هنوز بخش مهمی از تشخیص مایکوپلاسماها را تشکیل میدهند، ولی تستهای جدید بر اساس آنالیز مولکولی DNA ژنومی، RNAهای ریبوزومی، پروتئینهای سلولی و لیپیدها، تستهای کلاسیک را در تنگنا قرار داده و به دلیل رشد آرام و سختگیر بودن گونهها، استفاده از تستهای مولکولی که به زمان كمتري جهت تشخيص نياز دارند، محبوبتر میشود.
با توجه به روشهای تشخیصی، بایستی سلولهای جمعآوریشده که حاوی مایکوپلاسماهای چسبیده هستند، تهیه گردند. بیشتر نمونههایی که برای کشت مناسب هستند، برای PCR هم مناسبند. انواع روشهای متفاوت نمونهگیری برای دستگاه تنفسی ارائه شده است. خلط چون دارای آلودگی است زیاد مناسب نیست، سوآب گلو و آسپیره نازوفارنژیال برای کودکان بسیار مناسب است. ميتوان براي شناسایی مايكوپلاسما پنومونيه از نمونههاي شستشوي گلو، خلط، آسپيره ناي و تكههاي بافت ريه نیز استفاده كرد.
برای مایکوپلاسماهای ژنیتال، سوآبهای مجاری ادراری، ادرار اولیه (FVU)، منی، ترشحات پروستات، سوآب واژن – سرویکس، بیوپسی اندومتریک، برس زدن توبول، مایع آمنیوتیک، جفت، نمونههای اندوتراكئال و CSF از نوزادان نمونههای مناسبی هستند.
مایکوپلاسماها از نمونههای دیگر مانند CSF، مایع مفصلی، بیوپسی، نمونههای جلدی مخاطی و خون جدا میشوند. باید توجه داشت که محیطهای کشت خون حاوی آنتیکواگوالانت هستند که برای رشد مایکوپلاسماها بازدارنده هستند.
سوآب باید از جنس داکرون، کلسیم آلژینات یا پلیاستر با دسته پلاستیکی یا آلومینیمی باشد. سوآب پنبهای و سوآبهای با دسته چوبی به دلیل اینکه برای اورهآپلاسماها سمی هستند، مورد استفاده قرار نمیگیرند. هرچند که در کشور ما به دلیل گرانی سوآبهای پلیاستری از سوآبهای پنبهای و سوآبهایی با دسته چوبی استفاده میشود. اگر پاتوژنهای دستگاه ژنیتال دیگر بهطور همزمان مدنظر باشند، سوآب داکرون یا رایون با دسته پلاستیکی بسیار مناسب است، چرا که آنها برای این گونه پاتوژنها غیر سمی هستند. بعد از گرفتن نمونه نباید اجازه دهیم سوآب خشک شود و سریعاً باید در محیط کشت انتقال یا محیط کشت مناسب قرار بگیرند.
دیگر مایعات بدن و بیوپسی بافت باید در ظروف استریل جمعآوری شوند. نمک برای نمونههای بافتی مرطوب بکار نمیرود، چرا که سبب لیز ارگانیزمها میشود.
در آزمایشگاه، نمونههای بافتی میبایستی در محیطهای انتقال استریل جهت تهیه سوسپانسیون 10% (W/v) و رقتهای یکدهم و یکصدم قطعهقطعه شوند. این کار ضروری است، چرا که سبب از بین رفتن اثر بازدارندگی هموگلوبین، فسفولیپیدهای سمی، آنتیبادی یا کمپلمان که در نمونههای بافتی وجود دارند، میشود. این رقتها سپس باید به محیط رشد تلقیح شوند. نمونههای خون برای مایکوپلاسما با تلقیح محیط رشد در میزان یک بخش خون به 9 بخش محیط مایع (رقت یکدهم) کشت داده میشوند. به طور اپتیمال حداقل ml10 خون از فرد بالغ بایستی کشت داده شود. بهطور ایدهآل محیط رشد نبایستی حاوی سدیم پلی آنتون سولفونات (SPS) که بازدارنده رشد گونههای مایکوپلاسما است، باشد. همانند کشت نایسریا گونورهآ میتوان اثرات بازدارندگی SPS را با اضافه کردن ژلاتین استریل در حجم نهائی 1% از بین برد. بایستی محیط براث تلقیحشده بهصورت کور سابکالچر شود.
مایکوپلاسماها باکتریهای بسیار حساس به شرایط محیط جانبی مانند خشکی و گرما هستند، بطوریکه نمونهها میبایستی بعد از جمعآوری سریعاً به محیط انتقال یا کشت مناسب انتقال داده شوند. انواع مختلفی از محیطهای انتقال برای کشت مایکوپلاسماهای ژنیتال بکار میروند. این محیطها شامل تریپتیکاز سوی براث با 0/5 درصد آلبومین سرم گاوی، 2SP براث (10% سرم جنین گاوی غیرفعال شده با سوکروز M0/2 در فسفات بافر M0/02 با 7/2=pH)، یا انواع مختلفی از محیطهای رشد مایکوپلاسماها (مانند SP-4، 2SP، B10 براث شپرد و PPLO براث) هستند. سایر محیطهای کشت عبارتنــــد از: محیط کشت Stuart، محیط کشت Amie’s و Trypticase soy broth با 5٪ آلبومین سرم گاو.
آنتیبیوتیکها و عوامل ضد قارچی و پنیسیلین (100/000- 50/000 واحد در میلیلیتر)، پلیمیکسین B (5000 میکرولیتر در میلیلیتر) و آمفوتریسین B (2 میلیگرم در میلیلیتر) (در غلظت نهایی محیط کشت) عموماً جهت کاهش آلودگی توسط سایر باکتریها و قارچها به محیط کشت و انتقال اضافه میشوند. نمونهها سریعاً بایستی به آزمایشگاه ارسال شوند، ولی میتوان نمونهها را در یخچال در 4 درجه سلسیوس به مدت 48-24 ساعت نگهداری کرد. اگر کشت بیشتر از این زمان به تأخیر انجامد، بایستی نمونهها را در منفی 7 درجه سلسیوس فریز کرد. بایستی قبل از کشت، این نمونههاي فریزشده در بنماری 37 درجه سلسیوس حرارت ببینند.
نمونههای ادرار برای کشت بایستی سانتریفوژ و رسوب آن 1:1 قبل از فریز با محیط انتقال رقیق شوند. به دلیل اینکه در محیط انتقال، پروتئینها پایدار باقی میمانند، لذا تعداد ارگانیسمهاي زنده در فریز کاهش نمییابد.
از آنجایی که مایکوپلاسماها به عنوان پاتوژن سطح 2 در نظر گرفته شدهاند، میز کار آزمایشگاهی و یا کابینت ایمنی کلاس 2 برای کار بر روی این میکروارگانیسم ها کفایت میکند.
در آزمایشگاه، PPLO brothحاوی سوآبها، ورتکس شده و سپس سوآبها دور انداخته میشوند، سپس نمونهها به مدت 30 دقيقه در g 500 سانتريفوژ و تا ده برابر تغلیظ شده و از فيلتر غشاء μm 0/45 عبور داده میشوند.
تشخیص آزمایشگاهی مایکوپلاسماها با بکارگیری جداسازی مستقیم بوسیله کشت، روشهای مولکولی، تست حساسیت آنتیبیوتیکی و سرولوژی انجام میشود. تقریباً همه این روشها برای مایکوپلاسما پنومونیه و مایکوپلاسماهای ژنیتال در دسترس هستند.
کشت
کشت مایکوپلاسماها برای گونههای خاص مانند مایکوپلاسما هومینیس و اورهآپلاسماها و مایکوپلاسما پنومونیه است، ولی برای مایکوپلاسماهای سختگیر مانند مایکوپلاسما ژنیتالیوم و مایکوپلاسما فرمنتانس و پنترانس با موفقیت کمی همراه است.
به دلیل محدودیت مقدار اطلاعات ژنتیکی که بوسیله این ارگانیسمها حمل میشود، قدرت بیوسنتز محدودی دارند. کشت آنها در خارج از بدن احتیاج به محیطهای پیچیده برای تهیه مواد موردنیاز آنها دارد، به همین جهت محیطهای کشتی که برای کشت مایکوپلاسماها مورد استفاده قرار میگیرند، پیچیده بوده و با اضافه کردن آنتیبیوتیکهای ß لاکتام (پنیسیلین یا آمپیسیلین)، پلیمیکسین A و آمفوتریسین B انتخابی میشوند. از محیطهای مختلفی مانند PPLO آگار و براث، SP-4 براث و آگار، U-9 اورهآز، 2-S بوستون براث، A7 شپرد (محیط آگاردار و یک نوع محیط افتراقی)، A7B، A8 و محیط دیفازیک گلوکز- متیلن بلو برای کشت مایکوپلاسماها استفاده میشود. بعضی از مایکوپلاسماها همانند ویروسها میتوانند در کشت سلولی اثر سایتوپاتیک (CPE) ایجاد نمایند، مانند مایکوپلاسما پنترانس که در in vitro ایجاد CPE میکند، لذا از ردههای سلولی مختلف میتوان برای کشت این مایکوپلاسماها استفاده کرد.
محیط SP-4 و یا محیط Edward غنی شده با 5-3 درصد سرم اسب برای جداسازی مایکوپلاسما پنومونیه و مایکوپلاسما ژنیتالیوم که دیررشد هستند، توصیه میشود.
به دلیل اینکه مایکوپلاسما هومینیس و اورهآپلاسما اورهآلیتیکوم سوبسترای مختلفی را در pHهای متفاوت متابولیز میکنند، بیشتر آزمایشگاهها دو نوع محیط آگار را با سوبسترای مختلف (گلوکز و آرژینین) برای کشت آنها استفاده میکنند. بهعلاوه از محیط دیفازیک براث و آگار میتوان استفاده کرد.
محیط H براث و H آگار برای ایزوله کردن مایکوپلاسما هومینیس در pH خنثی (حدود 7) مورد استفاده قرار میگیرد. بعضی از محیطها ممکن است حاوی آرژینین به عنوان سوبستراي رشد باشند که پس از رشد باکتری در این محیط، کدورت و تغییر رنگ فنل رد به سمت قلیائی مشاهده میگردد.
محیط U براث و U آگار برای ایزوله کردن اورهآپلاسما اورهآلیتیکوم بکار میرود که pH پائین (6/5-5/5) دارد و از اوره به عنوان سوبستراي رشد در آن استفاده شده است. میتوان با اضافه کردن لینکومایسین به محیطها، آنها را برای اورهآپلاسما اورهآلیتیکوم انتخابی کرد، چرا که اورهآپلاسما اورهآلیتیکوم به این آنتیبیوتیک مقاوم است، ولی مایکوپلاسما هومینیس به آن حساس است.
محیطهای PPLO براث و آگار حاوی محیط پایه (محیط پایه Heart infusion peptone broth)، عصاره مخمر (10%)، سرم اسب (20%)، فنل رد (0/4%) بهعنوان معرف تغییر pH محیط و محلول متیلن بلو (1%)، محلول تالیوم استات (10%)، محلول اوره یا آرژینین یا گلوکز (10%)، محلول پنیسیلین (100-50 هزار واحد در میلیلیتر حجم نهائی محیط کشت) هستند که برای جداسازی مایکوپلاسماها مورد استفاده قرار میگیرند. این محیطها را میتوان با تغییراتی به عنوان U براث یا آگار یا H براث یا آگار برای جداسازی مایکوپلاسماهای ژنیتال استفاده کرد.
مثلاً در U براث و H براث هم سرم اسب و هم اوره یا آرژینین بجای گلوکز استفاده میشود. لازم به ذکر است که معمولاً پنیسیلین و استات تالیوم را برای جلوگیری از رشد باکتریهای دیگر به محیط اضافه میکنند، اما به دلیل حساسیت اورهآپلاسما اورهآلیتیکوم و مایکوپلاسما ژنیتالیوم و به میزان کمتری مایکوپلاسما هومینیس به استات تالیوم، باید از افزودن این ترکیب به محیط کشت ارگانیسمهای نامبرده خودداری نمود. این محیطها که توسط کارخانه بهصورت پودر آماده میشوند، بهصورت تجاری در دسترس هستند.
بسیاری از نژادهای مایکوپلاسما روی آبگوشت Heart infusion peptone با 20% آگار (با pH=7.8) که به آن حدود 30% مایع آسیت انسانی یا سرم حیوانی (اسب یا خرگوش) اضافه شده است، رشد میکنند. بعد از 48 تا 96 ساعت نگهداری محیط کشت در دمای 37 درجه سلسیوس ممکن است کدورتی وجود نداشته باشد، اما رنگآمیزی گیمسای رسوبات سانتریفوژ شده، ساختمانهای مشخصی با اشکال متنوع را نشان میدهد و کشتهای بعدی آن، در محیطهای جامد منجر به تشکیل کلنیهای کوچک به نام اسفرول (Spherolos) میگردد.
سرم اسب ترکیب ضروری محیطهای مایکوپلاسما است که اسیدهای چرب و کلسترول را تأمین میکند. منبع تهیه سرم، حیواناتی مانند اسب، خرگوش و گاو هستند. عصاره مخمر که منبع تأمین پیشسازهای اسیدهای نوکلئیک است همراه با دیگر ترکیبات مانند کوآنزیمها و عصاره بافتی (برحسب گونه مورد بررسی مایکوپلاسما) به محیطهای کشت افزوده میشود.
به دلیل اینکه بعضی گونهها سختگیر هستند، بهتر است نمونهها هم در محیط مایع و هم در محیط جامد کشت داده شوند (کشت اولیه و بعد روی آگار سابکالچر شوند). محیطهای مایع میبایستی در رقت یکدهم تا یکهزارم رقیق شده تا بازدارندهها از بین بروند، همچنین در ارزیابی کمی باید این رقتها تهیه گردند. در خصوص مایکوپلاسماهای سختگیر، داشتن کنترل کیفی از محیط کشت ضروری است.
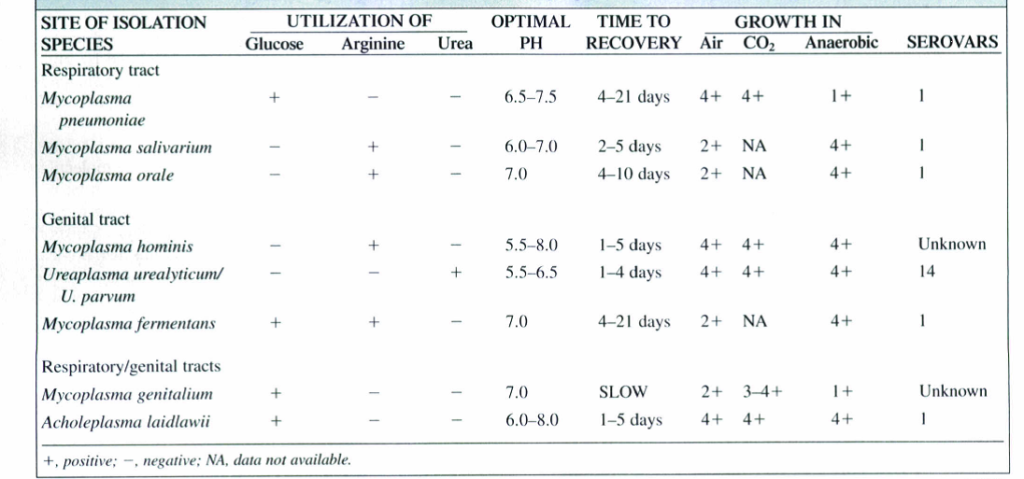
بطورکلی در محیط کشت مایع، شرایط اتمسفر معمولی برای رشد آنها مطلوب است، ولی در محیطهای کشت جامد، در بسیاری از موارد حضور 5% گاز کربنیک ضروری است. برخی از گونههای مایکوپلاسما، هوازی یا بیهوازی اختیاری هستند و بعضی از انواع نیز دارای رشد بهتری در محیطهای حاوی هیدروژن یا نیتروژن 95% همراه با 10-5% گاز کربنیک هستند (جدول 1).
از فاکتورهای مؤثر در رشد مایکوپلاسماها، pH محیط کشت است که برای آن دسته که گلوکز، آرژینین یا اوره مصرف میکنند به ترتیب شامل7/8-7/3، 8-7 و 6/5-6 است (جدول 1).
محدوده درجه حرارت برای رشد مایکوپلاسماها از گونهای به گونه دیگر متفاوت و از 40-20 درجه سلسیوس است. درجه حرارت اپتیمم برای بیشتر مایکوپلاسماهای انسانی و حیوانات خونگرم حدود 37-36 درجه سلسیوس است.
جدول (1): ويژگيهاي گونههاي مايكوپلاسما و اورهآپلاسماي انساني
جداسازی و شناسایی مایکوپلاسماها
در محیط مایع حاوی گلوکز، رشد گونههای تخمیری بهخصوص مایکوپلاسما پنومونیه بهراحتی از روی مشاهده تغییر رنگ اندیکاتور pH (اسیدی شدن محیط) مشخص میشود و این مایکوپلاسماي مهم انسانی بر اساس خواص بیوشیمیایی خاص (تخمیر گلوکز و فقدان هیدرولیز آرژینین)، همادسوپوریشن یا هماگلوتیناسیون اریتروسیتهای مرغ با خوکچه هندی (در نبود مایکوپلاسماهای کومنسال منفی) و همولیز سرد شناسایی میشود. در گذشته با اینکه سرم ایمن تجارتی وجود نداشت، شناسایی آنتیژن مایکوپلاسما پنومونیه (قبلاً بهعنوان روش رفرانس شناخته میشد) انجام میشد. با این روش خیلی مشکل است که این مایکوپلاسما را از مایکوپلاسما ژنیتالیوم که از نظر آنتیژنی بههم نزدیک هستند و خواص بیوشیمیایی مشابه دارند، جدا کرد. امروزه از روشهای مولکولی مانند PCR جهت افتراق این دو استفاده میگردد.
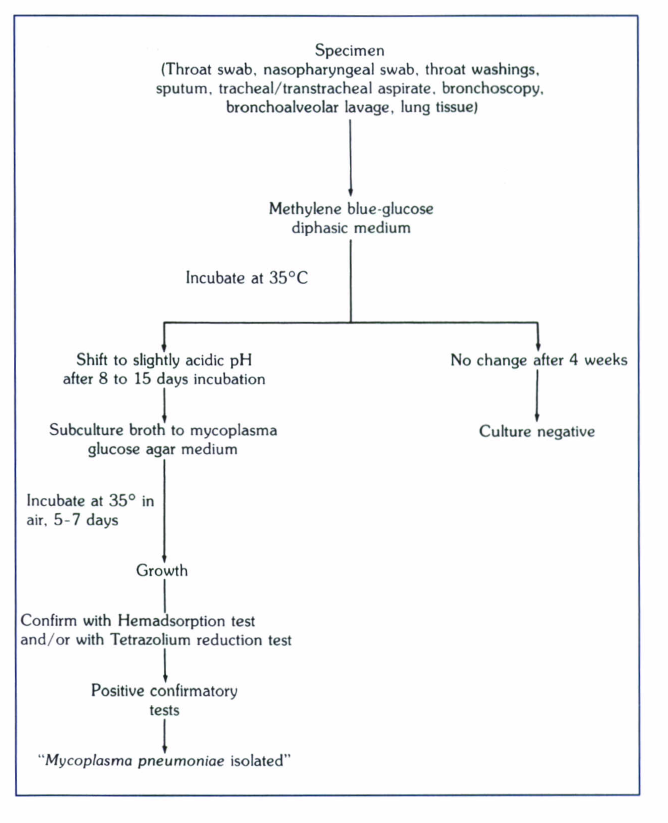
بطوركلي مایکوپلاسما پنومونیه توانايي تبديل گلوكز به اسيد، رشد آهسته (8 تا 15 روز) بر روي محيطهاي ديفازيك، توليد هموليز بتا بر روي محيط مناسب و قدرت احياء تريفنيل تترازوليوم به مادة قرمزي به نام فورمازان كه از مشخصات مايكوپلاسما پنومونيه است را دارد. بر روي آگار خوندار خوكچه هندي، مايكوپلاسما پنومونيه ميتواند اريتروسيتها را جذب كند، در ضمن ميتوان كلنيهاي مشكوك به مايكوپلاسما پنومونيه را با آنتيبادي فلورسين نشاندار مجاور كرده و سپس آن را با ميكروسكوپ اپيفلورسنت مورد بررسي قرار داد. شكل (1) پروتكل جداسازي اين باكتري را از نمونههاي دستگاه تنفسي نشان ميدهد.
شكل (1): پروتكل جداسازي مايكوپلاسما پنومونيه از نمونههاي دستگاه تنفسي
مایکوپلاسماهایی که از نمونههای دستگاه ژنیتال جداسازی میشوند عبارت از مایکوپلاسما هومینیس، مایکوپلاسما ژنیتالیوم، مایکوپلاسما فرمنتانس و اورهآپلاسما اورهآلیتیکوم و غیره هستند، درحالیکه مایکوپلاسما هومینیس و اورهآپلاسما اورهآلیتیکوم به آسانی کشت داده میشوند، مایکوپلاسما ژنیتالیوم و فرمنتانس رشد آرامی دارند و به سختی از طریق کشت جداسازی میشوند، بنابراین روشهاي کشتی که امروز استفاده میشوند برای جداسازی آنها از دستگاه ژنیتال مفید نیستند. برای مثال محیط SP-4 که حاوی گلوکز است، مناسب برای جداسازی مایکوپلاسما ژنیتالیوم است.
اگرچه خیلی از آزمایشگاهها تاکنون نتوانستهاند از محیطهای حاوی گلوکز برای جداسازی مایکوپلاسماهای ژنیتال استفاده نمایند. مایکوپلاسما فرمنتانس هم از گلوکز استفاده میکند، ولی رشد آرامی دارد، لذا بطورکلی با توجه به کشت، بسیاری از مایکوپلاسماهای ژنیتال بهجز مایکوپلاسما هومینیس و اورهآپلاسما اورهآلیتیکوم تشخیص داده نمیشوند. لازم به ذکر است كه مایکوپلاسما ژنیتالیوم بهسختی توسط روشهای کشت جداسازی میشود.
برای کشت مایکوپلاسما هومینیس و اورهآپلاسما اورهآلیتیکوم نمونههای مناسب که از طریق محیط انتقال دریافت میشود به محیط مایع و جامد تلقیح میشود. عموماًًً ml0/2 از نمونه بایستی به محیط آگار یا محیط براث تلقیح شوند. محیطهای براث میتوانند در شرایط هوازی در 35 درجه سلسیوس انکوبه شوند، ولی محیطهای جامد باید در شرایط بیهوازی در کندل جار در مجاورت CO2 انکوبه شوند. در محیط مایع تغییر رنگ به طرف قلیائی و کدورت (در مورد مایکوپلاسما هومینیس) مثبت در نظر گرفته میشود و بایستی روی محیط جامد سابکالچر شوند.
در اینجا باید توجه شود که بازدید روزانه محیط مایع ضروری است، چرا که اگر تغییر رنگی مشاهده شود و پاساژ روی محیط جامد انجام نگردد، چون pH بالا برای باکتری مضر است سبب کاهش تعداد باکتریهای زنده میشود، لذا ممکن است در محیط جامد کلنی تشکیل نشود. مشاهده تغییر رنگ برای گونههای اورهآپلاسماها 24-18 ساعت و برای مایکوپلاسما هومینیس 48 ساعت و 20-6 روز برای مایکوپلاسما پنومونیه و برای مایکوپلاسماهای سختگیر بیشتر طول میکشد.
در سطح محیطهای جامد، مایکوپلاسماها بهتدریج یک کلنی گنبدی شکل را در سطح آگار ایجاد میکنند. بخش مرکزی کلنی به درون آگار به سمت پایین رشد کرده و یک هسته مرکزی متراکمتر را به وجود میآورد. اگر کلنی را از بالا مشاهده کنیم، شبیه به ظاهر تخممرغ نیمرو (Fried egg) به نظر میرسد. برای مشاهده آنها اغلب به میکروسکوپ نیاز خواهد بود. این فرم از کلنی مشخصه مایکوپلاسماهای کلاسیک است که به نام مایکوپلاسماهای Large colony forming معرفی میگردند. اورهآپلاسماها قادر به تشکیل چنین کلنیهایی نیستند، ولی با افزودن برخی از مواد بافری میتوان امکان تشکیل چنین کلنیهایی را فراهم کرد.
اندازه کلنی برای مایکوپلاسماهای کلاسیک 600-200 میکرون و برای اورهآپلاسما که قبــلاً به نام مایکوپلاسماهای T-strain یا T-mycoplasma (T اول کلمه Tiny به معنی ریز و کوچک است) شناخته میشد، حدود 30-15 میکرون است. کلنیهای اخیر فاقد حاشیه رشد سطحی بوده و در نتیجه ظاهر تخممرغ نیمرو شده را ندارند. بطورکلی، اگر کلنی با ظاهر تخممرغ نیمرو (Fried egg) روی محیط جامد مشاهده شد، مایکوپلاسما هومینیس تأیید میگردد، ولی اگر کلنیهای کوچک و متراکم مشاهده گردید، اورهآپلاسما اورهآلیتیکوم تأیید میشود.
پیشنهاد میگردد جهت تفکیک کلنیهای تیپیک مایکوپلاسماها از کلنیهای L- form باکتریها، هر ایزوله جدیدی که در آزمایشگاه جدا میشود و به نظر میرسد مایکوپلاسما است را حداقل 5 مرتبه بر روی محیطی که فاقد پنیسیلین یا آنتیبیوتیک مؤثر بر دیواره سلولی هستند، کشت مجدد دهند؛ زیرا واریانتهای L- form پس از حذف آنتیبیوتیک، مجدداً به شکل والدین خود برگشته و شکل تخممرغ نیمرویی را از دست میدهند.
اگر بخواهند باکتریها را از محیط جامد، به محیطهای تازهای منتقل کنند، باید یک ورقه نازک چهارگوش از آگار را که در آن یک یا چند پرگنه وجود داشته باشد بردارند و بر روی محیط جامد بمالند یا در محیط مایع بیندازند. هرگاه بخواهند آنها را رنگآمیزی نمایند ورقه مزبور را برروی یک لام گذاشته و پس از قرار دادن یک لامل بر روی آن مقداری محلول گیمسا در میان لام و لامل بریزند و صبر کنند تا خشک شود.
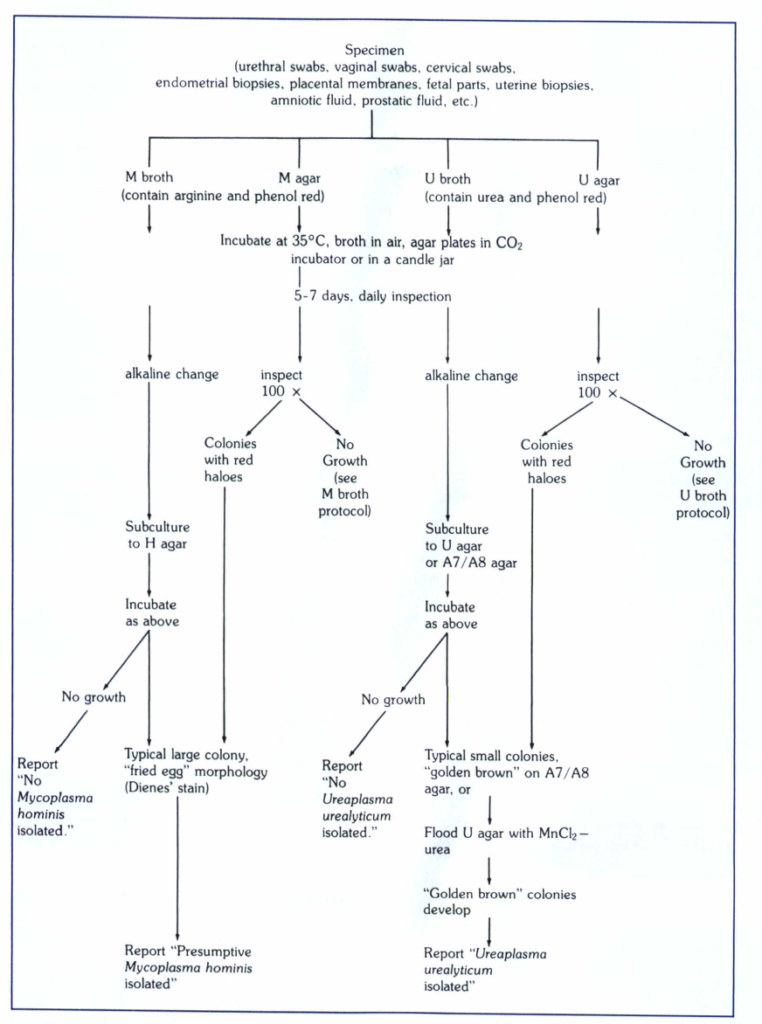
اگر رشدی در طی 7-5 روز در محیط مایع سابکالچر شده یا جامد مشاهده نگردید، کشت از نظر مایکوپلاسماهای ژنیتال منفی گزارش میشود. بهتر است یک حجم از محیط مایع اولیه مثبت شده در فریز منفی 70 تا تعیین نتیجه کشت روی محیط جامد یا سابکالچر مایع نگهداری شود. در ادامه پروتکل جداسازی مایکوپلاسما هومینیس و اورهآپلاسما اورهآلیتیکوم از نمونههای ژنیتال ارائه شده است.
شكل 2: پروتكل جداسازي مایکوپلاسما هومینیس و اورهآپلاسما اورهآلیتیکوم از نمونههای ژنیتال
شناسایی مایکوپلاسما هومینیس بهآسانی صورت میگیرد، چرا که با دیدن کلنی با نمای تخممرغ نیمرو شده و کوچک (300- 50 میکرومتر) بعد از 5-1 روز روی محیط جامد میتوان بهطور قطع گفت که مایکوپلاسما هومینیس جداسازی شده است. کلنیها با روش Dienes رنگآمیزی میشود و این نوع رنگآمیزی وضوح دیدن کلنی را بهتر میکند. هرچند که در خصوص مایکوپلاسما هومینیس با توجه به رشد سریع، مصرف آرژینین و تولید کلنی تخممرغ نیمرو شناسایی بیشتر ضروری نیست، ولی شناسایی قطعی مایکوپلاسما هومینیس میتواند با بررسی اثرات بازدارندگی رشد با آنتیسرمهای خاصی صورت بگیرد.
کلنیهای کوچک اورهآپلاسما اورهآلیتیکوم از آرتیفکتها (مانند سلول پستانداران و دبریدهای سلولی و مواد موجود در سرم) بهسختی متمایز میشوند، به همین دلیل کلنیهای اورهآپلاسما اورهآلیتیکوم باید تأیید شوند. برای این منظور بایستی توانائی اورهآپلاسما اورهآلیتیکوم در مصرف اوره ارزیابی گردد. اگر محیط U آگار حاوی اوره و فنلرد استفاده شود، اورهآپلاسما اورهآلیتیکوم روی آن تولید کلنیهایی با هاله قرمز میکند. کلنیهای مشکوک اورهآپلاسما اورهآلیتیکوم با تست اوره کلرید منیزیم تأیید میشود.
محیط افتراقی A7 شپرد و محیطهای اصلاحشده A8 و A7B آگار دارای اوره هستند و سویههای هیدرولیزکننده اوره را جداسازی میکنند و دیگر نیازی به استفاده از کلرید منیزیم برای دیدن کلنی نیســـــت. A7 آگار دارای سولفات منیزیم بهعنوان عامل رسوبدهنده همراه با پنیسیلین (1 هزار واحد در میلیلیتر) و آمفوتریسین B (2/5 میکروگرم در میلیلیتر) است. A7B افتراقی آگار همانند A7 آگار است با این تفاوت که دارای پلی آمین پوتریسین دی هیدروکلراید (mm10) برای افزایش رشد و تشدید رسوب روی کلنی است. A8 افتراقی آگار دارای کلرید کلسیم (mm1) به عنوان اندیکاتور کاتیونی دو ظرفیتی برای جداسازی تشکیل آمونیوم از اوره همراه با کلستین (7/5 میکروگرم در میلیلیتر)، آمپیسیلین (1میکروگرم در میلیلیتر) و آمفوتریسین B (2/5 میکروگرم در میلیلیتر) است.
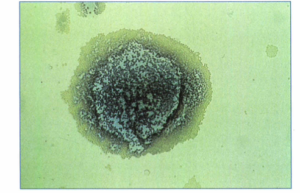
در همه این 3 محیط، مایکوپلاسما هومینیس بعد از 3-1 روز تشکیل کلنیهای با ظاهر تخممرغ نیمرو میدهد (شکل 3). کلنیهای اورهآپلاسما اورهآلیتیکوم بعد از 3-1 روز تشکیل میشود که 50-15 میکرومتر قطر دارند. کلنیهای اورهآپلاسما اورهآلیتیکوم روی محیط A7B و A7 آگار سیاه است (شکل 4)، زيرا اکسید منیزیم روی آن رسوب کرده است، درحالیکه کلنی روی محیط A8 افتراقی آگار طلائی یا قهوهای روشن است. چندین مطالعه نشان دادهاند که محیطهای A8، A7B و A7 بهخصوص زمانی که با یک محیط مایع (مانند برموتیمول براث یا بوستون براث) بکار میروند، احتمالاً انتخاب مناسبی برای کشت مایکوپلاسماهای ژنیتال هستند.
شکل (3): کلنیهای تخممرغی مایکوپلاسما هومینیس روی محیط PPLO آگار
شکل (4): کلنیهای اورهآپلاسما اورهآلیتیکوم (متراکم و سیاه) و مایکوپلاسما هومینیس (تخممرغی) روی محیط A7B افتراقي. رنگ آبي اطراف كلني مايكوپلاسما هومينيس در ارتباط با رنگآميزي داينس ميباشد
جداسازی مایکوپلاسما پنومونیه از افراد بیمار با عفونت تنفسی مهم است چرا که این باکتری نمیتواند جزء فلور دستگاه تنفسی باشد.
گزارش جداسازی گونه اورهآپلاسماها و مایکوپلاسما هومینیس مشکل است. جداسازی این باکتری از سایر نمونههای استریل معنیدار بوده ولی اگر از سایر نمونهها جداسازی شوند باید با شک به آن نگاه کرد و با روشهای کمی تعداد باکتریها ارزیابی شوند. بالاترین رقت که نشان دهنده تغییر رنگ است، بیانگر تعداد موجودات حاضر در نمونه در واحد تغییر رنگ در هر میلیلیتر (CCU/ml) است (شکل 5)؛ مثلاً در اورتریت غیرگنوککی شاخص زیر باید در نظر گرفته شود:CCU/ml 104 (بخش تغییر رنگ) در میلیلیتر برای سوآب مجاری ادراری و CCU/ml 103 برای FVU. گزارش حضور گونههای اورهآپلاسما در سوآب سرویکس- واژن مشکل است، چرا که بهطور طبیعی آنها در این نواحی به فراوانی یافت میشوند.
مایکوپلاسما هومینیس میتواند در واژینوز به تعداد بیشتر از CCU/ml 104 جداسازی شود. حضور بالای آن میتواند دلیلی بر عفونت دستگاه تناسلی باشد. در این موارد علائم کلینیکی و مطالعات باکتریولوژی باید انجام شود. حضور مایکوپلاسما در نمونههای نوزادان میتواند ناشی از آلودگی باشد. جداسازی مایکوپلاسما از نمونههای اندوتراکئال در تعداد بالا (بالای CCU/ml 103) بسیار مهم است.
شکل 5: کشت گونههای اوره آپلاسما در PPLO broth حاوی اوره
لوله 1: کشت مثبت، لوله 2: کشت منفی
(Kokkayil P,et.al. Indian J Med Microbiol. 2015;33(2):205-14.)
تست (ELiTech Diagnostic, France) Mycofast Revolution
یک تست تجاری جدید است که شناسایی و شمارش آسان گونه های اورهآپلاسما و مايکوپلاسما هومينيس را در عرض 24 تا 48 ساعت فراهم میکند. این روش یک روش مایع بر اساس توانایی گونه های اورهآپلاسما در متابوليزه کردن اوره و مايکوپلاسما هومينيس در متابولیزه کردن آرژینین است که متشکل از 20 چاهک هستند که از قبل با يک محيط کشت دهیدراته پوشانده شده (سرم اسب، عصاره مخمر، سيستئين، آرژینين، اوره، فنلرد و آنتيبيوتيکها) و حاوي يک محیط براث جداگانه با عوامل ضد ميکروبي برای انتقال و حفظ مایکوپلاسماهای ژنیتال است (UMMt) (ELiTech Diagnostic, France).
سایر تستهای تجاری تشخیصی با روشهای مشابه شناسایی، آزمایش حساسیت ضد میکروبی و سهولت استفاده، شامل کیت Mycoplasma Duo (Sanofi Diagnostics Pasteur France), کیت آزمایش (Ivagen) Mycoview و (BioMérieux MycoIST2) نیز قابل دسترسی هستند. مزیت آزمایش Mycofast Revolution این است که آزمایش حساسیت ضد میکروبی بر علیه عوامل مختلف ضد میکروبی با حداقل غلظت مهارکنندگی (MICs) انجام میشود که طبق استانداردهای مؤسسه استاندارد بالینی و آزمایشگاهی 2011 (CLSI) تعریف شده است. تست حساسیت ضد میکروبی علیه پنج عامل ضد میکروبی شامل لووفلوکساسین، موکسی فلوکساسین، اریترومایسین، کلیندامایسین و تتراسایکلین انجام میگردد.
در مطالعه Redelinghuyhs و همکارانش، آزمایش Revolution mycofaste را با PCR برای تشخیص مایکوپلاسماهای ژنیتال در زنان باردار مقایسه کردند. آنها نشان دادند که کیت Revolution mycofaste دارای حساسیت 77/3٪ و اختصاصیت 80٪ نسبت به آزمایش PCR بود.
رنگآمیزی Dienes
Azure II 0.25g
Methylene blue 0.5g
Na2CO3 0.05g
Maltose 2g
Benzoic acid 0.04g
Distilled water 20ml
مواد فوق را در آب مقطر مخلوط نموده و بعد از صاف کردن آن را هنگام استفاده، به نسبت 1 به 10 رقیق نمایید. این رنگآمیزی به دو روش انجام میشود:
الف) در این رنگآمیزی رنگ داینس مستقیماً روی سطح آگار ریخته میشود. این رنگآمیزی غیراختصاصی فقط برای بهتر شدن وضوح کلنیها در سطح آگار استفاده میشود. برای رنگآمیزی ml 1 از رنگ داینس را روی سطح آگار میریزند و سریعاً با آب مقطر رنگ را از سطح آگار شستشو میدهند. در مرحله بعد با اتانول 95 درصد، محیط رنگزدائی میشود (1دقیقه اتانول روی سطح آگار باقی بماند) و سپس شستشو انجام میگیرد. بعد از خشک کردن، سطح پلیت با عدسی ×4 یا ×10 میکروسکوپ از نظر ظاهر کلنیها بررسی میشود. در این رنگآمیزی سطح پلیت شفاف است. تمام مایکوپلاسماها بهجز مایکوپلاسما پنومونیه، رنگی باقی میمانند، ولی مایکوپلاسما پنومونیه بعد از مدتی بیرنگ میشود. اورهآپلاسماها به رنگ آبی مایل به قرمز یا مایل به سبز و مایکوپلاسماها به رنگ آبی تیره و اطراف آن آبی شفاف دیده میشوند (شکل 4).
ب) روش دیگر این است که پس از رشد مایکوپلاسماها در سطح محیط جامد، یک لامل تمیز روی کلنی قرار داده و آن را فشار میدهیم تا کلنی کاملاً به لامل بچسبد، سپس لامل را برداشته و بر روی یک لام تمیز قرار میدهیم بطوریکه اثر کلنی روی لام مشخص باشد. لامل را از روی لام برمیداریم تا لام در حرارت اتاق خشک شود و سپس با لامل فیکس میکنیم؛ آنگاه از محلول آمادهشده، رنگ بر روی لام میریزیم و به مدت 35 دقیقه نگه میداریم و پس از شستشو و خشک شدن با میکروسکوپ مشاهده میکنیم.
کلنیهای مایکوپلاسماها با این روش رنگ خود را تا دو روز حفظ میکنند، در حالیکه تقریباً تمام کلنیهای سایر باکتریها در مدت نیم ساعت رنگ خود را از دست میدهند.
محلول استوک: حجم معینی از آب مقطر را با اسید استیک گلاسیال (5-1 قطره به ازای 100 میلیلیتر) به 3/7=pH میرسانیم، سپس یک گرم از پودر Crystal-fast violet را در 100 میلیلیتر آب مقطر حل کرده و 48 ساعت نگهداری میکنیم. به مدت یک دقیقه تکان میدهیم، فیلتر کرده و سپس مالتوز (7 گرم) را اضافه میکنیم.
محلول کار (باید روزانه تهیه شود):
Stock solution 20ml
NaCl 0.05g
محلول فوق را به مدت یک دقیقه تکان میدهیم، فیلتر کرده و سپس مالتوز (7 گرم) را اضافه میکنیم.
رنگآمیزی به همان روشی که در مورد Dienes stain شرح داده شد، صورت میگیرد. کلنیهای مایکوپلاسما و اورهآپلاسما هر دو به رنگ قرمز ارغوانی درمیآیند.
قطعاتی از آگار محتوی کلنی را بر روی سطح یک لام برگردانیده و به مدت یک شب در محلول ثابتکننده بویون (Bouins fixative) قرار میدهیم؛ سپس بلوک را خارج کرده و لام را به مدت یک ساعت با آب جاری شستشو میدهیم. آنگاه لام را بر روی دو میله شیشهای نگهدارنده در داخل یک پلیت قرار میدهیم و رنگ رقیقشده به نسبت 1 به 20 را به داخل آن میریزیم. نمونه را به مدت یک شب به همین حالت میگذاریم، سپس لام را شسته و پس از خشک نمودن، آن را با میکروسکوپ مشاهده میکنیم. در این روش مایکوپلاسماها به رنگ ارغوانی دیده میشوند.
رنگآمیزی کلرید منگنز – اوره (Manganous Chloride-Urea)
این رنگآمیزی برای کلنیهای اورهآپلاسما اختصاصی است و شامل ترکیبات زیر است:
اوره g1
کلرور منگنز g0/8
آب مقطر ml100
محلول را بوسیله فیلتر استریل نموده و در مقادیر 4 میلیلیتر در لوله تقسیم میکنیم و در دمای 20- درجه سلسیوس نگهداری میشود. پس از استفاده از معرف، باقیمانده آن باید دور ریخته شود.
طریقه مصرف:
3-2 میلیلیتر از محلول را برروی پلیت دارای کلنی میریزیم. پس از گذشت 1 تا 5 دقیقه در دمای اتاق، کلنیها را با بزرگنمایی ×40 بررسی مینماییم. در صورتیکه کلنی مربوط به اورهآپلاسما باشد به رنگ قهوهای تیره دیده میشود. هیدرولیز اوره بوسیله اورهآز تولید گروههای هیدروکسیل از آب میکند که این گروههای هیدروکسیل، کلرید منیزیم را اکسید میکند و در نتیجه اکسید منیزیم غیرمحلول تولید میگردد و بهصورت رسوبهای قهوهای تیره روی کلنی در عرض چند دقیقه مشاهده میشود.
در آزمایشگاههای کلینیکی انواع مختلفی از تستهای سرولوژی جهت شناسایی سویه و گونههای مایکوپلاسما مورد استفاده قرار میگیرد. تست کلاسیک توصیهشده شامل آگلوتیناسیون سرد، ممانعت از هماگلوتیناسیون، آزمون همولیز، تستهای ایمنوفلورسانس مستقیم و غیرمستقیم، میکروایمونوفلورسانس، آزمون بازدارندگی از رشد و متابولیسم توسط آنتیسرم و آزمون فیکساسیون کمپلمان با آنتیژنهای مایکوپلاسمائی هستند. انواع دیگر تستها که در بعضی موارد دارای حساسیت بالاتر هستند و در تشخیص مایکوپلاسما بکار میروند عبارتند از: الیزا، EIA، ایمونوبلاتینگ، ایمنوباندینگ و تستهای ایمنوپراکسیداز. استفاده از آنتیبادیهای پلیکلونال یا منوکلونال به دلیل حساسیت و اختصاصیت بالاتر این تستها قادر به شناسایی سویه گونههای مختلف هستند.
فایدهای که تکنیکهای ایمنوفلورسانس کلنی و ایمنوپراکسیداز ایمنوباندینگ دارند، این است که قدرت تمایز گونههای خاص مایکوپلاسما در یک کشت مخلوط و يا قدرت تمایز ایزولههای اولیه را در محیط کشت دارند. هرچند بعضی مطالعات نشان میدهند که تعدادی از آنتیژنهای ایمنی غالب موجود در سطح سلولی مایکوپلاسما تحت تغییرات سریع در اندازه و فاز قرار میگیرند که این امر استفاده از آنتیبادی منوکلونال را در ایمنوبلاتینگ محدود میسازد.
در 50% موارد، سرم مبتلایان به عفونت مایکوپلاسما پنومونیه محتوی مادهای است که میتواند گلبولهای قرمز گروه O انسان را در سرما (از 0 تا 4 درجه) آگلوتینه نماید. این آزمایش که بنام آگلوتیناسیون سرد نامیده میشود اختصاصی نیست و ممکن است در سایر مواردی هم که بافت ریه آسیب میبیند، مثبت باشد. عیار این آگلوتینین بهتدریج افزایش یافته و در هفتههای سوم و چهارم پس از شروع بیماری به حداکثر میرسد. عیار معادل یا بیش از 1:64 تأئیدی بر تشخیص عفونت مایکوپلاسما پنومونیه است. نکته دیگری که علت آن هنوز روشن نشده این است که سرم مبتلایان به پنومونی آتیپیک میتواند استرپتوکوکهای MG را آگلوتینه نماید. از این آزمایش هم برای تشخیص استفاده میشود.
پاسخ آنتیبادی در پنومونی مایکوپلاسمائی بهآسانی توسط فیکساسیون کمپلمان (CF) و واکنش سرم فاز حاد و مقاومت با باکتری کامل یا عصاره لیپیدی به عنوان آنتیژن اثبات میشوند. این آنتیژن را توسط کلروفرم و متانول از کشت مایکوپلاسما به دست میآورند. 4 برابر شدن تیتر آنتیبادی یا بیشتر نشاندهنده عفونت فعال یا اخیر است و این آزمون میتواند تیتر 4 برابر را در سرم بیمار پس از 3-2 هفته با یک تیتر بالاتر از 1:32 نشان دهد. هرچند که تیتر آنتیبادی بالا ممکن است اختصاصی نباشد، چرا که میزان نسبتاً بالای آنتیبادی برای حداقل 1 سال بعد از عفونت باقی میماند.
مشکلاتی که آزمونهای سرولوژیک بخصوص فیکساسیون کمپلمان دارد عبارتند از:
1- تیتر فیکساسیون کمپلمان تا یک سال بعد از عفونت هم باقی میماند.
2- آنتیژنهای گلیکولیپیدی که در این آزمون استفاده میشوند، برای مایکوپلاسماها غیراختصاصی هستند و در بافتهای مختلفی مانند عضله قلب، مغز، پانکراس و برگ سبزیجات یافت میشوند.
بنابراین نتایج مثبت کاذب در موارد پانکراتیک و سندرمهای نورولوژیک دیده میشوند.
3- واکنشهای مثبت کاذب در هر دو آزمون فیکساسیون کمپلمان و ELISA مشاهده میگردد. برخی از بزرگسالان فقط IgG میسازند؛ بنابراین، آزمون فیکساسیون کمپلمان که اساساً IgM را ردیابی میکند به احتمال زیاد منفی کاذب خواهد بود.
4- آنتیبادیهای ایجادشده برعلیه عفونت، 7 تا 10 روز بعد از بیماری ظاهر میشوند، بنابراین این آزمونها، تستهای مفیدی در تشخیص سریع بیماری نیستند.
5- نهایتاً، اندازهگیری IgM عفونت کنونی را ثابت نمیکند، زیرا IgM برای ماهها باقی میماند؛ بنابراین بهجای عفونت کنونی میتواند یک عفونت قبلی را نشان دهد.
آزمون ممانعت از هماگلوتیناسیون
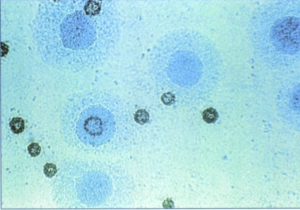
این آزمون را میتوان بوسیله جذب آنتیژن مایکوپلاسما روی گلبولهای قرمز انجام داد. اساس این واکنش مبتنی بر پیوند غیراختصاصی گلبولهای قرمز تعدادی از گونههای حیوانی و انسان، با کلنی انواعی از مایکوپلاسماهای انسانی است. در این روش معمولاً از اریتروسیتهای گروه خونی o انسان، گوسفند، خوکچه هندی و ماکیان استفاده میشود. برای انجام این آزمون، آگار و یا قطعهاي از آن را بوسیله سوسپانسیون (V/V) 1% اریتروسیتهای مزبور پوشانده و پس از نیم ساعت، سوسپانسیون اریتروسیتی را آسپیره کرده و سطح آگار را با محلول نمکی شستشو میدهیم. در این حالت نمونه تهیهشده برای مشاهده میکروسکوپی آماده است. کلنیهایی از مایکوپلاسما که اریتروسیتها را جذب میکنند، از نظر این آزمون مثبت محسوب میشوند (شکل 6).
شكل 6: كلني مايكوپلاسما پنومونيه روي گلوكز آگار
در اين شكل مشاهده ميشود كه يك كلني باكتري تعدادي از گلبول هاي قرمز خوكچه هندي را جذب كرده است. اين پديده همادسوربشن در بين مايكوپلاسماها تنها در مايكوپلاسما پنومونيه مشاهده ميشود
برخی از انواع مایکوپلاسماها بهواسطه تولید پراکسید هیدروژن (H2O2)، قابلیت همولیز کامل و ناقص گلبولهای قرمز گوسفند یا خوکچه هندی را دارا هستند. در این روش، آگار یا قطعهای از آن را بوسیله لایه نازکی از سوسپانسیون 8% اریتروسیتهای حیوان پوشانده و پس از 24 ساعت یک منطقه کامل یا ناقص همولیز را در اطراف کلنی مایکوپلاسماها میتوان مشاهده کرد. معمولاً همولیز کامل با ایجاد هاله زرد رنگ و همولیز ناقص با هاله سبز رنگ قابل تشخیص است. مثلاً مایکوپلاسما پنومونیه با اریتروسیتهای گوسفند همولیز کامل ایجاد میکند. مایکوپلاسما پنترانس در اثر هیدرولیز RBCهای گونههای مختلف (گوسفند، اسب، جوجه و انسان)، رسوب قهوهای ایجاد میکند که به دلیل اکسیداسیون هموگلوبین توسط کلنیهای این باکتری است.
ایمونوفلورسانس غیرمستقیم (IFA)
این تست در شناسایی مایکوپلاسماها بخصوص در تشخیص مایکوپلاسما پنومونیه و مایکوپلاسما ژنیتالیوم، موقعی که بهصورت مخلوط با هم دیده میشوند (زیرا از نظر سرولوژیک با هم واکنش متقاطع دارند) بکار میرود. ضمناً این تکنیک در مورد نمونههای اروفارنکس نیز که بیش از یک نوع مایکوپلاسما در آن وجود دارد از اهمیت خاصی برخوردار است. این تکنیک همراه با ایمونوپراکسیداز قادر به تشخیص مستقیم کلنیهای موجود برروی آگار بوده و جهت استفاده در محیط حاوی مخلوطی از گونههای مایکوپلاسما یا سروتیپهای اورهآپلاسما مفید است که رنگ فلورسانس سبز را نشان میدهند.
در واقع دقیقترین روش متوقف ساختن رشد باکتریها با افزودن آنتیبادی اختصاصی و یا استفاده از دیسکهای حاوی آنتیسرم روی محیط جامد است که با هاله عدم رشد باکتری مشخص میشود. آزمون ممانعت از رشد به همراه ایمونوفلورسانس کلنی روی آگار، بهعنوان تکنیکهای اختصاصی و سریع در شناسایی بیشتر گونهها بخصوص اورهآپلاسما اورهآلیتیکوم و اسپیروپلاسما بکار میرود.
آزمون میکرو ایمونوفلورسانس
این تکنیک جهت تشخیص مایکوپلاسما پنومونیه و مایکوپلاسما ژنیتالیوم بکار رفته است که حساسیت بیشتری در مقایسه با روش ممانعت از متابولیسم دارد. همچنین، آنتیبادیی که با این روش اندازهگیری میشود، هیچگونه واکنش متقاطعی را بین مایکوپلاسما پنومونیه و مایکوپلاسما ژنیتالیوم نشان نمیدهد و در مقایسه با تستهای دیگر مایکوپلاسما پنومونیه نیز کمتر واکنش میدهد.
تکنیک ELISA
استفاده از منوکلونال آنتیبادی در روشهای ELISA، موجب توسعه جداسازی آنتیژنهای مولیکوتسها از مواد بیولوژیکی و کشتها بهویژه در برخی از عفونتهای حیوانات و گیاهان گردیده است؛ چرا که تعیین عوامل اتیولوژیکی این عفونتها از طریق کشت بسیار مشکل است.
استفاده از تکنیک ELISA غیرمستقیم، بر روی نمونههای شیر جهت تشخیص ورم غدد پستانی ناشی از مایکوپلاسما بوویس در گاوهای ماده اهمیت دارد. اساس تشخیص عفونتهای ناشی از مایکوپلاسما پنومونیه هنوز هم بر پایه پاسخ سرولوژیک است، اما حساسیت و ویژگی بالای تکنیک EIA با هماگلوتیناسیون غیرمستقیم، بحث جایگزینی این تکنیکها را بجای روش مرسوم ثبوت مکمل مطرح کرده است. تکنیک ELISA مزایای مختلفی دارد؛ از جمله اینکه قدرت سنجش هر سه کلاس آنتیبادی را دارا است، در تعیین آنتیژنهای لیپوپروتئینی استفاده میشود و در تشخیص عفونتهای ادراری– تناسلی بهطور مکرر بکار میرود و به فراوانی کیت تست EIA در دسترس است.
امروزه ترکیب PCR اختصاصی مایکوپلاسما پنومونیه در آسپیره نازوفارنژیال با ایمنواسی (که IgM در آن گیر افتاده است) در سرم فاز حاد، تشخیص سریع آزمایشگاهی مایکوپلاسما پنومونیه را حساستر میکند و ما را قادر میسازد که در طی یک یا دو روز جواب آزمایش را پاسخ دهیم. البته باید توجه داشت که تستهای سرولوژیکی مثبت، گاهی در افراد سالم هم دیده میشوند، بنابراین فقط افزایش 4 برابر میزان آنتیبادی در تأیید بیماری دارای ارزش تشخیصی است. ضمناً مایکوپلاسما پنومونیه و مایکوپلاسما ژنیتالیوم دارای واکنشهای متقاطع سرمی هستند.
وجود شباهت بالای ژنومی بین مایکوپلاسما ژنیتالیوم و مایکوپلاسما پنومونیه سبب شده که واکنشهای متقاطع سرولوژی در بین این دو پاتوژن انسانی رخ دهد؛ بنابراین تست میکروایمنوفلورسانس (MIF)،CF و هماگلوتیناسیون غیرمستقیم (IHA) قدرت تمایز این دو گونه مایکوپلاسما را از همدیگر ندارند. امروزه برای تمایز این دو گونه مایکوپلاسما از همدیگر از تکنیک ایمنوبلاتینگ استفاده میگردد.
بههرحال کاربرد پروبهای اختصاصی گونه PCR در روشهای سرولوژی برای تمایز عفونتهای مایکوپلاسما ژنیتالیوم و مایکوپلاسما پنومونیه قابل استفاده است.
نكته: در جمعبندی تستهای سرولوژی بایستی گفت که امروزه اگرچه PCR بهطور قابل ملاحظهای در تکنیکهای آزمایشگاهی رسوخ پیدا کرده است، ولی تستهای سرولوژی هنوز در تشخیص عفونتهای مایکوپلاسما پنومونیه مهم هستند. بهخوبی مشخص شده که اندازهگیری تیتر آنتیبادی IgM جهت تشخیص عفونت در بچهها استفاده میشود، زیرا آنها احتمالاً بیشتر با بیماری اولیه برخورد دارند. در بالغین، آنتیبادی IgM بهتنهایی تشخیصدهنده نیست. استفاده از جداسازی سرولوژی آنتیبادی IgG و IgA هنوز یک روش انتخابی برای شناسایی عفونت حاد در بالغین باقی مانده است.
امروزه به تستهای کلاسیک برای شناسایی و طبقهبندی مایکوپلاسماها، انواع مختلفی از تستهاي مولكولي مانند آنالیز آنزیم محدودالاثر (REA) ژنوم مایکوپلاسما، AFLP، ريبوتايپينگ، انواع مختلف PCR (PCR معمولي، موئي، Multiplex، Nested، Real-time و غيره) اضافه شده است و در آزمايشگاههاي باليني مدرن و تحقيقاتي مورد استفاده قرار ميگيرند.
برای شناسایی اورهآپلاسماها، ژل مبتنی بر PCR رایج، توالیهای هدف از S rRNA 16 و برای نواحی فاصلهانداز بین ژنی S rRNA 16 تا S rRNA23، ژن اورهآز و MBA را بررسی میکند، در حــــالی که تســتهای Real Time PCR عمدتاً ژنهای اورهآز و زیرواحدهای آنها یا MBA را هدف قرار میدهند.
در مطالعه انجامشده توسطDhawan و همکاران، شیوع U.urealyticum را در بیماران دارای ترشحات ژنیتال توسط هر دو روش کشت و PCR تعیین نمودند. در مطالعه این افراد،PCR یک قطعه bp 429 را در ژن ساختاری اورهآز در U.urealyticum هدف قرار داد. شيوع U.urealyticum به واسطه کشت 32٪ و با استفاده از PCR 45٪ تعيين شد. در یکی دیگر از مطالعات، یک multiplex PCR که ژن اورهآز را برای شناسایی اورهآپلاسما و S rRNA 16 را برای شناسایی M. hominis هدف قرار داده بود، استفاده شد. اورهآپلاسماهای مثبت شده، با استفاده از PCR ژن آنتیژن چند بانده (MBA) بیوتایپینگ شدند.
اکثریت ایزولههای اورهآپلاسما متعلق به بیووار 1 (U. parvum) بودند. پرایمرهایی مانند: UMS83 /UMA269،UMS125 /UMA269 و UMS54 /UMA269 بیشتر برای شناسایی سرووارها مورد استفاده قرار گرفتند و سرووارهای 3 تا 14 به عنوان شایع ترین آنها شناسایی شدند. آزمایشگاه تشخیصی مایکوپلاسمای UAB، تست Real Time PCR را برای تشخیص و تمایز گونههای اورهآپلاسما مبتنی بر UU063 (NP_077893) (که پروتئین فرضی محافظتشده بوده و در هر چهار سرووار U. parvum همسان هستند) و ORF، bp 15072 UUR10_0680(NC_011374.1) را که در تمام 10 سرووار U.urealyticum محافظت شدهاند، بکار برده است.
تشخیص STD6 و STD6B ACE (Seegene Inc)، یک آزمایش مولکولی است که فقط در کشورهای مختلف اروپایی در دسترس است. این تست به طور همزمان Trichomonas vaginalis، M. hominis، M. genitalium، C. trachomatis، N.gonorrhoeae و گونههای اورهآپلاسما را در سوآب های اندوسرویکال و مجاری ادراری تشخیص میدهد. ویژگی جدید تکنولوژی این تست این است که در آن یک سیستم dual‑priming بکار رفته که این پرایمرها توسط یک لینکر از جنس پلی داکسی اینوزین با یکدیگر ارتباط دارند. این کیت با هر ترموسایکلری کار میکند و آزمایش پس از PCR برای الکتروفورز ژل دستی یا خودکار طراحی شده است. آزمایش Ureaplasma STD6 یک منطقه bp 130 از کاست ureD را تکثیر میکند. نسخه جدید آن (STD6B) با استفاده از ژنهای ureC دو گونه U. urealyticum و U. parvum را از یکدیگر افتراق میدهد.
گونه های اورهآپلاسما در دستگاه ادراری تناسلی تحتانی افراد سالم بهصورت فلور نرمال هستند؛ بنابراین، معمولاً مثبت شدن آزمایش PCR از نمونههای این قسمتها جای تعجب ندارد، ولی افزایش میزان تعداد باکتریهایی که توسط Real Time PCR تعیین میشوند، به عنوان نشاندهنده عفونت بالینی، ارزشمندتر است. نتایج مثبت PCR برای گونههای اورهآپلاسما از مجاری ادراری در مردان مبتلا به اورتریت، از آسپیره نای نوزادان مبتلا به بیماریهای تنفسی، از جریان خون یا مایع مغزی نخاعی در نوزادان مبتلا به پلئوسیتوزیس و از محلهای خارج از دستگاه تناسلی بهصورت نرمال، بایستی از نظر بالینی مهم در نظر گرفته شود.
درمان:
مایكوپلاسماهای تناسلی، مانند مولیکوتسهای دیگر، به طور ذاتی به آنتیبیوتیكهایی كه بر اجزای دیواره سلولی اثر میگذارند (بتالاكتامها)، مقاوم هستند. گونههای اورهآپلاسما دارای مقاومت ذاتی نسبت به لینکوزآمیدها هستند (مانند کلیندامایسین). مقاومت مشاهده شده به ماکرولیدها مرتبط با جهش در ژن S rRNA23 است، درحالی که مقاومت به تتراسایکلین با حضور ترانسپوزون متحرک M tet همراه است. ژنtet M ، پروتئینی را کد میکند که به ریبوزوم متصل میشود و در مورد U.urealyticum نشان داده شده است که در کروموزوم، با Tn916 که یک ترانسپوزون کونژوگه است، مرتبط میباشد. مطالعات قبلی نشان دادند که مقاومت اورهآپلاسما به کینولونها عمدتاً به علت جهشهای هدف آنزیم DNA هلیکاز {ریشههای نواحی 107-68 که نواحی مقاومت به کینولونها (QRDR) هستند} است.
علاوه بر بتالاکتام ها، مايكوپلاسماها همچنین در برابر سولفوناميدها، تريمتوپريم و ريفامپيسين مقاومت نشان ميدهند. مقاومت به ریفامپیسین به حضور یک اسید آمینه تکی در موقعیت 526 زیرواحد بتا RNA پلیمراز مربوط میشود. در یک مطالعه اخیر که توسط Dhawan و همکارانش انجام گردید و شامل بیماران مبتلا به ناباروری و ترشحات دستگاه تناسلی بودند، تمام ایزولههای M. hominis مقاوم به اریترومایسین، ولی حساس به داکسی سایکلین، ژوزامایسین و افلوکساسین بودند. همه ایزولههای گونههای اورهآپلاسما به داكسي سايكلين و ژوزامايسين، 77٪ از ایزولهها به افلوکساسين و 71٪ به آزيترومايسين حساس بودند. اگرچه بیشتر مطالعات، میزان مقاومت کمتری نسبت به تتراسایکلینها (کمتر از 5٪) گزارش دادهاند، ولی مطالعه اخیر توسط Redelinghuyhs و همکارانش نشان دادند که تنها 27٪ ایزولههای اورهآپلاسما به تتراسایکلین حساس هستند.
در مطالعه Chiang-tai و همکارانش در شانگهای چین نشان دادند که بیووار 1 میزان حساسیت بالایی (بیش از 90٪) را به تمام عوامل ضد میکروبی دارند؛ اما بیووار 2، حساسیت بالائی (بیش از 95٪) تنها به داکسی سایکلین و مینوسایکلین دارند. در واقع فقط تعداد کمی از سويههای بیووار 2، به روکسی ترومایسین و کینولونها حساس بودند.
از آنجا که سندرمهای مشخص عفونتهای دستگاه ادراری تناسلی، تنها توسط مایکوپلاسماهای تناسلی ایجاد نمیشوند، بلکه توسط ارگانیسمهای مختلف دیگر نیز ایجاد میگردند، حساسیت آنتیبیوتیکی به همه آنها باید در هنگام تجویز درمان تجربی در نظر گرفته شود. با توجه به این موضوع، درمان ترجیحی، آزیترومایسین 1 گرم به صورت خوراکی یک دوز، یا داکسی سایکلین 100 میلیگرم خوراکی دو بار در روز به مدت 7 روز میباشد. با این حال، از آنجا که مقاومت به تتراسایکلینها در حال افزایش است، بیمارانی که قادر به پاسخ به داکسی سایکلین نیستند، ممکن است به مدت 7 روز با اریترومایسین 500 میلیگرم نیز به صورت خوراکی درمان شوند.
فلوروکینولونها همچنین اثربخشی برابر با داکسی سایکلین در درمان اورتریت غیر گنوکوکی را نشان میدهند. اثربخشی و ایمنی یک دوره 7 روزه اسپارفلوکساسین نیز قابل مقایسه با داکسی سایکلین است. تجویز عوامل ضد میکروبی به زنان باردار مبتلا به پارگی زودرس غشاها (PROM) ممکن است دوره بارداری را افزایش داده و خطر عوارض مرتبط و عفونت نوزادان را کاهش دهد. ماکرولیدها اغلب به صورت تجربی استفاده میشوند زیرا تتراسایکلینها و فلوروکینولونها در دوران بارداری منع مصرف دارند. با این حال اریترومایسین به طور مؤثر نمیتواند به کیسه آمنیوتیک نفوذ کند و اورهآپلاسما از واژن و سرویکس توسط این عامل ریشهکن نمیشود. درمان با آزیترومایسین نیز در مقایسه با اریترومایسین به همان اندازه موفق بوده ولی عوارض جانبی کمتری دارد.
نوزادانی که به علت گونههای اورهآپلاسما بهطور بالینی مبتلا به پنومونی شدهاند، با اریترومایسین درمان میشوند.
Waitesو همکارانش، مطالعهای بر روی اثربخشی فارماکوکینتیک (اثر دارو در بدن) و میکروبیولوژیکی اریترومایسین داخل وریدی در نوزادان نارس که دستگاه تنفسی تحتانی آنها توسط گونههای اورهآپلاسما کلونیزه شده بودند، انجام دادند. این مطالعه اطلاعاتی فراهم کرد که مصرف mg/kg/day 40 اریترومایسین برای درمان داخل وریدی نوزادان نارس مفید است.
تعداد محدودی از مطالعات، استفاده از ماکرولیدها را برای ریشهکن کردن اورهآپلاسما در نوزادانی که در معرض خطر ابتلا به BPD هستند، گزارش کرده است.
Ballard و همکارانش، 220 نوزاد نارسی که وزن آنها 1250≥ بوده و تهویه تنفسی آنها بهصورت مکانیکی انجام میشد را بهطور تصادفی انتخاب کرده و به مدت 6 هفته با آزيترومايسين يا پلاسیبو آنها را درمان کردند. در زیرگروه نوزادانی که اورهآپلاسما را از آسپیراسیون نای آنها جدا کرده بودند، آزیترومایسین میزان BPD را از 94% در دسته پلاسیبو به 73% در دسته آنتیبیوتیک کاهش داد. اخیراً در یک مطالعه تصادفی در ترکیه، اثر کلاریترومایسین را در 74 نوزاد نارس بررسی کردند و دریافتند که درمان برای 10 روز میزان بروز BPD را کاهش میدهد. اگرچه در این مطالعات هیچ عوارض قابل توجهی گزارش نشده است، اما از آنجایی که مصرف طولانی مدت آنتیبیوتیک با افزایش انتروکولیت نکروزه شونده، یا با شروع تأخیری بیماری سپسیس همراه است، آنتیبیوتیکها باید با احتیاط در نوزادان نارس استفاده شوند.
برای عفونتهای تهاجمی مايکوپلاسما نیز مانند عفونت CSF، تتراسایکلینها بهترین درمان هستند.
تعیین حساسیت داروئی:
به دلیل تغييرات در حساسيت ضدميكروبي در بين مايكوپلاسماها بايستي تستهاي تعيين حساسيت ضد ميكروبي در شرايط in vitro انجام شوند. هرچند كه اين تستها بدليل سخترشد بودن باكتري در محيطهاي معمولي و نياز به محيطهاي اختصاصي، عدم وجود شرايط و زمان انكوباسيون استاندارد، نبود ميزان استاندارد تلقيح باكتري اوليه و نياز به تجهيزات گرانقيمت در آزمايشگاههاي باليني بهصورت روتين انجام نميشوند. همچنین امروزه تستهای حساسیت آنتیبیوتیکی معمولی به تستهای بر اساس اسید نوکلئیک برای شناسایی ژنهای مقاوم به آنتیبیوتیک مانند tetM (شاخص مقاومت به tet) اضافه شده است.
در ادامه به روشهای متعدد برای تشخیص حساسیت آنتی بیوتیکی روی مایکوپلاسماهای ژنیتال اشاره میگردد.
روش میکرودایلوشن براث
عملیترین و اقتصادیترین روشی که به طور گسترده مورد استفاده قرار میگیرد، تست میکرودایلوشن براث است. در این روش از میکروپلیت 96 خانهای استفاده میشود که در آن رقتهایی از آنتیبیوتیک با غلظتهای مختلف با غلظت استاندارد موجودات زنده (معمولاً 104/ میلیلیتر) در محیط کشت براث مخلوط شده و انکوبه میشوند. محيط مورد استفاده broth B10 يا PPLO broth حاوي اوره است. ارگانیسمها در صورت تکثیر، اوره را در محیط متابولیزه میکنند که این امر موجب تغییر pH و در نهایت منجر به تغییر رنگ (قرمز شدن) میگردد. این تغییر رنگ معمولاً 18-16 ساعت پس از انکوباسیون رخ میدهد.
اگر ارگانیسم، حساس به غلظت آنتیبیوتیک موجود در چاهک باشد، رشد مهار شده و تغییر رنگ رخ نمیدهد. MIC بالاترین رقت آنتیبیوتیک است که مانع تغییر رنگ در زمان میگردد؛ زمانی که تغییر در کنترل بدون آنتیبیوتیک رخ داده و بهتازگی رشد کرده باشد (شکل 7). از محاسن این روش این است که میتوان حساسیت باکتری را به چند آنتیبیوتیک بهطور همزمان مشخص کرد، اما زمان خواندن و میزان تلقیح به محیط، به استانداردسازی نیاز دارد. لازم به ذکر است که جمعیت ناهمگن ارگانیسمها با سویههای مقاوم و حساس میتواند در محیط تکثیر شده و حساسها نادیده گرفته شوند، لذا مهم است که نقطه پایانی MIC را در اولین بروز تغییر رنگ در چاهک کنترل رشد به خوبی بررسی کنیم. به این نکته نیز باید توجه شود که دوره انکوباسیون طولانی، MIC را تغییر داده و به همین ترتیب MIC را به اشتباه افزایش میدهد.
روش رقت آگار:
روش رقت آگار برای تعیین MIC بر اساس ترکیب رقتهای دو برابر شده عوامل ضد میکروبی به پلیتهای آگار مایع است که هر پلیت حاوی غلظتهای مختلف میباشد. در این روش از محیطهایA8 آگار یا PPLO آگار با اوره میتوان استفاده کرد. رقتهای مناسب داروها، با آگار مخلوط میشوند. پس از سفت شدن آگار پلیتها، μl 10 از مایع تلقیح ارگانسیم معین که از 104 تا 105 CFU/ml در براث مناسب تهيه شده، به پلیت آگار اضافه میگردد. پلیتها در حضور 5٪CO2 در دمای 37 درجه سلسیوس انکوبه میشوند. MIC به عنوان پایینترین غلظت عامل آنتیبیوتیک، رقتی است که مانع تشکیل کلنی (زمانی که در زیر استریومیکروسکوپ بررسی شود) میگردد که در زمان مشابه در پلیت کنترل بدون آنتیبیوتیک، رشد تقریبی 30 تا 300 CFU در هر نقطه از تلقیح مشاهده گردد. طول مدت زمانی کهMICها میتوانند خوانده شوند، مشابه روش میکرودایلوشن براث است.
این روش اگرچه دشوار و وقتگیر است، ولی دارای مزایایی است که نقطه پایان نسبتاً پایدار بوده و این باعث تشخیص کشتهای مخلوط میگردد.
دو کار برای سادهسازی این روش میتوان انجام داد:
روش اولE تست است که با استفاده از یک نوار که حاوی یک آنتیبیوتیک خاص در یک گرادیان غلظت میباشد. MICها به عنوان غلظت آنتیبیوتیک روی نوار، در نقطه تقاطع با منطقه مهار کلنی مشخص میشوند. روش دوم شامل استفاده از دیسکهای کاغذی فیلتردار است که حاوی غلظتهای دو برابر کاهشیافته متوالی آنتیبیوتیک است. پایینترین غلظت آنتیبیوتیک که منجر به مهار رشد آن ناحیه باشد، MIC در نظر گرفته میشود.
هیچ دستورالعمل کلی از هیچ سازمان نظارتی برای انجام این آزمایشها و نیز تفسیر نقاط ضعف اجرا و نتایج MIC وجود ندارد. روش میکرودایلوشن براث به طور معمول برای تست حساسیت آنتیبیوتیکی ایزولههای M.hominis و گونههایUreaplasma استفاده میشود. این ارگانیسمها علیه آزیترومایسین، ژوزامایسین، افلوکساسین و داکسی سایکلین تست شدهاند. Cut off غلظتMICs برای حساس، متوسط و مقاوم در آزیترومایسین، ژوزامایسین و افلوکساسین به ترتیب 4 و 2 ≥ میکروگرم در میلیلیتر و 8 ≤ میکروگرم در میلیلیتر و برای داکسی سیکلین به ترتیب 4 و 8 ≥ میکروگرم در میلیلیتر و 16≤ میکروگرم در میلیلیتر است. گونههای مقاوم به تتراسایکلین دارای MIC 8 ≥ میکروگرم در میلیلیتر و سویههای حساس معمولاً دارای MIC 2 ≥ میکروگرم در میلی لیتر هستند.
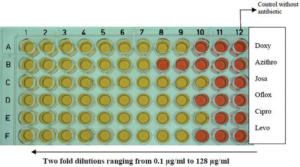
شکل 7: میکرودایلوشن براث در میکروتیترپلیت 96 خانهای برای گونه استاندارد U. urealyticum NCTC 10177 و ایزوله بالینی
داکسی: داکسی سایکلین، آزیترو: آزیترومایسین، ژوزا: ژوزامایسین، افلوکس: افلوکساسین
سیپرو: سیپروفلوکساسین، لوو: لووفلوکساسین
(Kokkayil P,et.al. Indian J Med Microbiol. 2015;33(2):205-14.)
تازههایی از مايكوپلاسماها (2)
ویژگیهای مربوط به جنس مالاسزیا (بخش دوم)
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام