تشخیص سریع عوامل میکروبی با بیوسنسورها
(قسمت سوم)
فاطمه صابری (دانشجوی کارشناسی ارشد بیوتکنولوژی)- دکتر رضا میرنژاد (دانشیار دانشگاه)
در قسمتهای گذشته مروری بر ساختار بیوسنسور و انواع بیوسنسورها داشتیم، در این قسمت نیز با معرفی سنسورهای نوری به شرح یکی از انواع سنسورهای نوری که بیشتر در تحقیقات پزشکی و میکروبی مورد استفاده قرار میگیرد، میپردازیم.
معرفی زیست حسگرهای نوری:
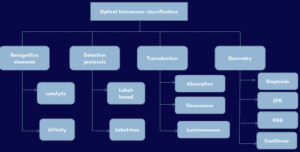
بیوسنسورهای نوری دارای اشکالی میباشند که در جدول زیر انواع آن ارائه گردیده است.
جدول 1: طبقه بندی زیست حسگرهای نوری
اندازه سیگنال به طریق نوری (Optical readout)
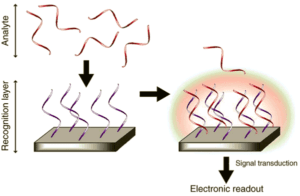
بیوسنسورهای نوری که بر پایه نور فلورسانس کار میکنند دارای ویژگیهایی میباشند. این نوع بیوسنسورها حساس هستند، بطوریکه حد شناسایی آنها تقریباً 107 مولکول در هر سانتیمتر مربع است. از ردیفهایی تشکیل شدهاند که از هزاران پروب و یا آنتیبادی ساخته شده است. بخاطر اینکه ابزارهایی که در این زمینه (بیوسنسور فلورسانس) مورد استفاده قرا میگیرند، پیچیده و گران هستند، تکنولوژی چیپس ژنی بیشتر برای کارهای آزمایشگاهی کاربرد مناسب دارد. چیپسهای ژنی در مواردی که همزمان کار زیادی میخواهد انجام شود، مانند بررسی پروفایل نسخه برداری (Transcriptional profiling) یا بررسی پلیمورفیسم نوکلئوتید منفرد (Single Nucleotide Polymorphism Discovery)، مناسبترند. آنچه برای تشخیص مولکولی مهم است، قابلیت اطمینان به تشخیص و همچنین عمومی بودن بدون توجه به ترتیب بازی میباشد، لذا چیپسهای ژنی برای تشخیص کلینیکی به دلایل گرانی و پیچیدگی دستگاه و عدم دقت بالا در خوانش ارجح نیستند (شکل 1).
شکل 1: ساختار بیوسنسور نوری
یکی از روشهای اندازهگیری سیگنال بطریق نوری که بسیار مشخص میباشد روش خواندن نوری است که در آن DNA های تک رشته با نانو ذرات طلا نشاندار گردیده، آنگاه براحتی در اثر هیبریداسیون با ترتیب بازی هدف تغییر رنگ میدهند. با استفاده از رنگ آمیزی نقره میتوان آنالیز DNA را با این روش نوری در صفحات بسیار کوچک با حساسیت بالا انجام داد. اگرچه ممکن است استفاده از نانو ذرات طلا گران باشد، ولی این روش حساسیت و سادگی لازم برای تشخیصهای کلینیکی را دارد.
روش دیـگر بـرای انــدازهگــیری ســیگنال بطــریق نــوری روش رزنــانس پلاســـــمون سطحی (Surface plamon resonance) میباشد که در بخش بعدی بیشتر توضیح داده خواهد شد. در این روش در ضریب شکست یک سوبسترا فیلم فلزی نازک تغییر ایجاد میشود که این عمل در اثر جذب آنالیت بوده و برای تشخیص هدف در حالتهایی که بصورت خانه- خانه، شیار شیار میباشد. برای اینکه در این روش بتوانیم به حد تشخیص مولکول هدف برسیم که در آن حد، ایجاد سیگنال میگردد، باید سیگنال هیبریداسیون را تقویت نمود. این عمل را میتوان بوسیله افزایش مقدار مواردی که بر روی سطح فیلم میباشد قبل یا بعد از اتصال به DNA هدف انجام داد. روش رزنانس پلاسمون سطحی (SPR) مانند روش فلورسانس گران قیمت و پیچیده است که این اشکالات سبب شده است که این روش نیز بیشتر برای کارهای تحقیقاتی بکار رود تا کارهای روتین تشخیصی.
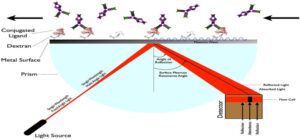
رزونانس پلاسمون سطحی (SPR)
شکل 2: نمای کلی از دستگاه SPR
رزونانس پلاسمون سطحی (SPR) یک روش حساس برای دنبال کردن کوچکترین تغییرات ضریب شکست یا ضخامت فیلمهای نازک است. این روش عمدتاً برای دنبال کردن برهمکنشهای دو جزئی استفاده میشود (مثل برهمکنش بین لیگاند و گیرنده). یکی از اجزا روی سطح تراشه حسگر تثبیت شده، مثلاً لایهای از هیدروژل روی اسلاید شیشهای، از طریق برهمکنش بیوتین– آویدین یا جفت شدن کووالانسی با استفاده از معرفهای آمینی یا تیول مشابه با همانی که برای جفت شدن عرضی رزینهای کروماتوگرافی استفاده میشود. غلظتهای نوعی سطح جزء متصل به پروتئین در محدوده یک تا پنج ng/mm2 است. تراشه حسگر به شکل یک دیواره سلولی میکروجریان است به طوری که محلول آبی لیگاند به طور مداوم و با سرعت پالس آزاد در سراسر سطح میتواند پمپ شود. این عمل باعث میشود که غلظت لیگاند در سطح ثابت باقی بماند. عوامل محیطی از قبیل دما، pH، و قدرت یونی در مدت زمان در معرض قرار گرفتن جزء ساکن مربوط به لیگاند دقیقاً کنترل میشوند. عوض کردن محلول لیگاند با یک محلول بافر بررسی جداسازی لیگاند متصل را ممکن میسازد.
اتصال لیگاند به جزء تثبیت شده باعث افزایش جرم در سطح تراشه شده و برعکس، جدا شدن لیگاند باعث کاهش جرم میشود. این تغییرات جرم، به نوبه خود روی ضریب شکست محیط در سطح تراشه اثر میگذارد که آن هم سرعت انتشار اشعه الکترومغناطیس در آن محیط را تعیین میکند.
پلاسمون در واقع بخشی برای جمعآوری الکترونهای هدایت در یک فلز یا نیمه هادی است. وجود پلاسمون سطحی برای اولین بار در سال 1957 توسط Ritchie پیشبینی شد. در دهههای بعدی پلاسمون سطحی بطور گسترده توسط Raether، Kretsehman و Otto مطالعه شد.
تحریک موج پلاسمون مستلزم یک منشور نوری با یک لایه فلزی به ضخامت 50nm است. زمانی که پرتو نور از یک محیط با ضریب شکست بالاتر (مثل منشور شیشهای پوشیده شده با طلا) به محیطی با ضریب شکست پایینتر (مثل نمونه آبی) وارد میشود، زاویه تابش بزرگتر از زاویه بحرانی میشود و بازتابش داخلی کلی (TIR) رخ میدهد. بازتابش داخلی کلی یک پرتو نور تابشی در مرز فلز– منشور موجب انتشار یک موج پلاسمون از طریق کاهش شدت میدان الکتریکی میشود که موج محو شونده نامیده شده و در محیط با ضریب شکست پایینتر شدت آن نسبت به فاصله لبهای که موج در آن ایجاد شده به طور نمایی کاهش مییابد (شکل 3).
شکل 3: نحوه عملکرد روش رزونانس پلاسمون سطحی (SPR)
از آنجایی که مرز بین منشور و محیط با لایه نازکی از طلا پوشیده شده، فوتونهای تابشی حالت ارتعاشی الکترونهای نوار هدایت فلز را تحریک میکنند، در فیلمهای فلزی نازک این پدیده به صورت ارتعاش طولی منتشر میشود. الکترونها با یک فرکانس رزونانسی ارتعاش میکنند که به خواص فلز و منشور و همچنین طول موج و زاویه پرتو ورودی وابسته است. تحریک موج پلاسمون منجر به کاهش شدت نور بازتابیده شده میشود، بنابراین SPR در شدت نور بازتابیده شده در یک زاویه خاص انعکاس، شیب ایجاد میکند. انتشار موج پلاسمون سطح باعث افزایش دامنه موج محو شونده میشود که در ناحیه نمونه گسترش مییابد.
زمانی که اتصال به تراشه صورت میگیرد، ضریب شکست در سمت نمونه افزایش مییابد. افزایش ضریب شکست، زاویه تابش مورد نیاز برای ایجاد اثر SPR را تغییر میدهد و در نتیجه زاویه نور منعکس شده هم تغییر میکند. تغییر در زاویه باعث تغیــــیر موقعیت آشکارساز میشود که میتواند نسبت به زمان رسم شود و سنسور گرام مربوطه را بدهد. زاویه بر اساس واحدهای رزونانس (RU) بیان میشود، به طوری که RU 1000 مربوط به تغییر جرم در سطح تراشه حدود 1ng/mm² است.
از آنجایی که در دستگاههای SPR زاویه و طول موج پرتو تابش ثابت است، تغییر در رزونانس پلاسمون منجر به تغییر در شدت پرتو بازتابیده شده یا منعکس شده میشود. تغییر منطقهای است و فقط در نواحیی که خواص نوری تغییر میکند اتفاق میافتد. استفاده از آرایهای از آشکارسازها به جای یک تک سلول آشکارساز، اندازهگیری تصویر SPR را مجاز میسازد. SPR تغییرات کمتر از 10-4 ضریب شکست و یا حدود 1nm در ارتفاع لایهها را تشخیص میدهد، بنابراین نه تنها تشخیص ارتباطات پیوندی مابین بیومولکولها را قادر میسازد، بلکه پیوندهای حوزه پروتئینها و یا تغییر در تک لایههای مولکولی با دقت عرضی در حد چند میلیمتر هم ممکن میشود. برای SPR طول موجی مابین مادون قرمز و مادون قرمز نزدیک (نزدیک مادون قرمز) ممکن است استفاده شود. به طور کلی، استفاده از طول موجهای بالاتر با اینکه حساسیت را بالا میبرد ولی دقت عرضی را کم میکند. برعکس، اگر دقت عرضی بالا مدنظر باشد، نور قرمز استفاده میشود زیرا طول انتشار موج پلاسمون تقریباً متناسب با طول موج نور برانگیخته است.
اندازهگیری ثابت اتصال:
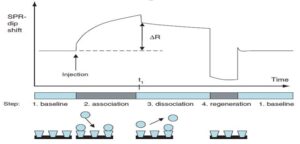
هنگامی که باید تمایل دو لیگاند اندازهگیری شود، ثابت اتصال باید محاسبه گردد. این مقدار میتواند با استفاده از پارامترهای دینامیک SPR بدست آید. همانگونه که در هر واکنش شیمیایی، مقدار آن عبارتست از حاصل تقسیم نرخ تفکیک (Dissociation rate) بر نرخ تجمع (Association rate).
برای این منظور، یک لیگاند بر روی سطح کریستال SPR تثبیت میشود. از طریق یک سیستم میکروفلو، محلولی حاوی آنالیت رسپتور بر روی لایه لیگاند تزریق میشود. از آنجا که لیگاند به رسپتور متصل میشود، افزایش در سیگنال SPR مشاهده میگردد (که به صورت واحد پاسخ، RU بیان میشود). پس از زمان مجاورسازی مناسب، یک محلول بدون آنالیت رسپتور (معمولاً بافر) بر روی میکروفلوئیدیک تزریق میشود که موجب تفکیک مجموعه پیوند بین لیگاند و رسپتور از هم میگردد. با این اتفاق، کاهشی در سیگنال SPR مشاهده میشود (که به صورت واحد پاسخ، RU بیان میشود). از روی این نرخ تجمع (Ka, on rate) و نرخ تفکیک (Kd, off rate)، ثابت تفکیک (ثابت اتصال، KD) میتواند محاسبه گردد.
نمودار 1: نمودار اندازهگیری ثابت اتصال
افزایش حساسیت حسگرهای زیستی:
به منظور ساخت یک حسگر زیستی پایدار، باید جزء بیولوژیکی به طرز خاصی به مبدل متصل گردد، چنین فرآیندی را تثبیت گویند که به دو روش کلی شیمیایی و فیزیکی، که هر کدام انواع مختلفی دارد، تقسیم میشود و هدف اصلی ما تثبیت اتصال کووالانسی مولکولها به سطح حسگر میباشد. با طراحی و بهینه سازی روش مناسب تثبیت میتوان به حسگری با حساسیت بالا دست پیدا کرد.
بررسىها بطور كلى نشان میدهد كه نانو ذرات از ويژگیهاى منحصر به فردى در كاربردهاى بيوآناليز و بيوتكنولوژى برخوردارند.
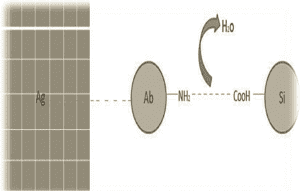
روش نوين اصلاح نانو ذرات در روش اتصال آنتیبادى به نانو پارتيكل به تشكيل يك پيوند آميدى بين نانو ذره و آنتیژن منجر شده است (شکل 4). اين پيوند از طريق يك واكنش فعال استرى بين گروه آمينى زنجيره آنتیژن و عامل كربوكسيليك اسيد صورت میگيرد. با این روش میتوان حساسیت حسگرهای نوری را به میزان زیاد افزایش داد (1).
شکل 4: روش نوين اصلاح نانو ذرات
همچنین با استفاده از گرافن، حساسیت حسگرهای زیستی رزونانس پلاسمون سطحی (SPR) را میتوان افزایش داد. گرافن یک شبکه کربنی است که تنها یک اتم ضخامت دارد.
اضافه کردن چند لایه گرافن به یک حسگر زیستی SPR (رزونانس پلاسمون سطحی) که از فیلم طلا ساخته شده است، حساسیت آن را به شدت افزایش میدهد. این افزایش حساسیت از جذب بالای مولکولهای زیستی روی لایههای گرافن و همچنین تغییر اُپتیکی اعمال شده توسط لایههای گرافن روی SPR نشأت میگیرد.
حسگرهای رزونانس پلاسمون سطحی حسگرهای اُپتیکی هستند که از امواج پلاریتون پلاسمون سطحی برای تشخیص برهمکنشهای میان مولکولهای زیستی و سطح حسگر بهره میبرند. در حسگرهای SPR معمول یک لایه فلزی روی یک سمت منشور نشانده شده و محیط حسگری را از منشور جدا میکند. لایه فلزی معمولاً از فلزات بیاثری همچون طلا و نقره ساخته میشود که میتوانند موجب انتشار پلاریتون پلاسمون سطحی در فرکانسهای مرئی نور شوند. اغلب طلا برای این کار استفاده میشود، زیرا مقاومت بالایی در برابر اکسید شدن و خوردگی در محیطهای مختلف از خود نشان میدهد. با این حال جذب مولکولهای زیستی روی طلا ضعیف است که این امر حساسیت حسگرهای زیستی SPR معمولی را محدود میکند. روکشدهی سطح طلا با گرافن، ثابت انتشار پلاریتون پلاسمون سطحی را تغییر داده و در نتیجه حساسیت تغییر ضریب شکست را تغییر میدهد.
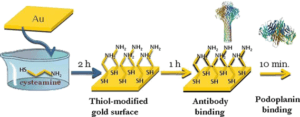
یکی از راههای جذاب برای افزایش حساسیت این حسگرها، عاملدار کردن فیلم طلا با عناصر تشخیص زیست مولکولی(BRE) که تمایل بالایی به طلا دارند، است تا بدین وسیله جذب مولکولهای زیستی روی سطح طلا افزایش یابد.
شکل 5: نحوه افزایش حساسیت حسگرها
کاربردهای SPR:
از آنجایی که تکنیک SPR الزامات خاصی از قبیل خاصیت فلوئورسانس، علائم طیفی یا علائم رادیویی برای مولکولهای مورد مطالعه ندارد، به طور مکرر در آزمایشگاههای علوم زیستی پیشرفته مورد استفاده قرار میگیرد. تکنیک SPR حتی میتواند با محلولهای رنگی یا کدر مورد استفاده قرار گیرد. به طور کلی تمام واکنشهای اتصالی دو جزئی که کاربردهای متنوعی در زمینه طراحی دارو (برهمکنشهای پروتئین– لیگاند) و مکانیسمهای پروتئینهای وابسته به غشا (اتصال پروتئین– غشا) و پروتئینهای متصل به DNA دارند، میتوانند بوسیله این تکنیک مورد بررسی قرار گیرند، بنابراین SPR به طور موفقیت آمیزی در مطالعه کینتیک بر همکنش لیگاند– گیرنده، آنتیژن–آنتیبادی و همچنین در برهمکنش پروتئین– پروتئین استفاده شده است. این روش به طور گسترده در تحقیقات پروتئین و توسعه دارو نیز استفاده میشود.
رفرنس:
1.Mashhadizadeh MH, Talemi RP. Used gold nano-particlesas an on/off switch for response of a potentiometric sensor to Al (III) or Cu (II) metal ions. Anal Chim Acta. 692: 109-15
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام