مروری بر روشهای تشخیص سرولوژیک بیماری توکسوپلاسموزیس
اسماعیل عباسی[1]، پیمان خضری[2]، شهرام خادم وطن[3]
1: گروه انگلشناسی و قارچ شناسی، دانشگاه علوم پزشکی ارومیه، ارومیه، ایران
2: گروه انگلشناسی و قارچ شناسی، دانشگاه علوم پزشکی ارومیه، ارومیه، ایران
3: دانشيار، گروه انگلشناسی و قارچ شناسی، دانشگاه علوم پزشکی ارومیه، ارومیه، ایران
نویسنده مسئول: شهرام خادم وطن
khademvatan@yahoo.com Email
مقدمه
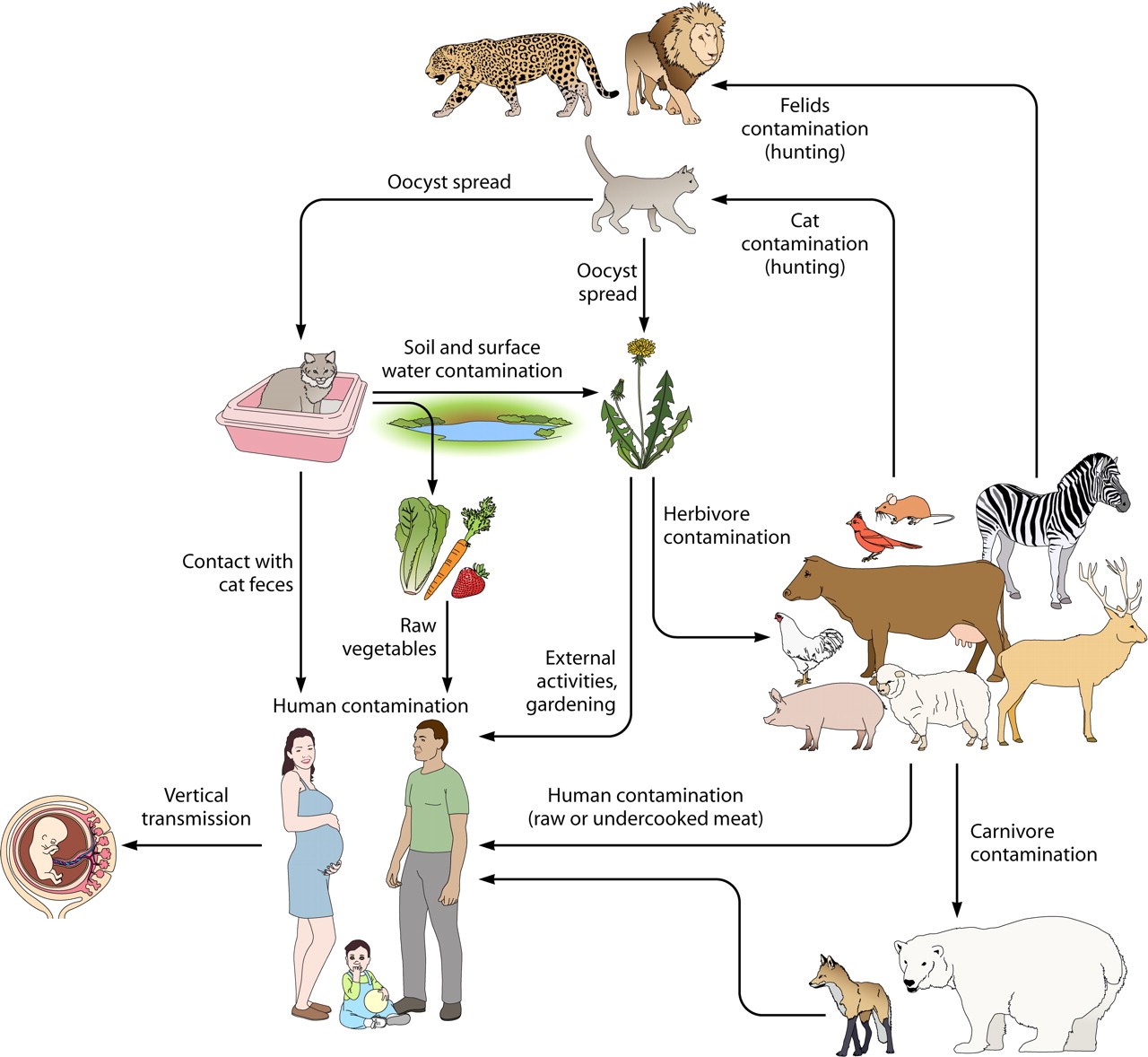
توکسوپلاسما گوندی یک انگل تکیاختهای داخل سلولی اجباری و زونوز میباشد. در چرخه زندگی آن گربه و گربهسانان بهعنوان میزبان نهایی و طیف وسیعی از مهرهداران خونگرم از جمله جوندگان، انسان، چهارپایان اهلی، پرندگان و پستانداران دریایی بهعنوان میزبانان واسط در نظر گرفته میشوند[1]. عفونتهای انسانی معمولاً بهواسطه مصرف گوشت خام یا ناپخته حیوانات آلوده به کیست نسجی و خوردن سبزیجات و یا آب آلوده به اواوسیست گربه اتفاق میافتد (شکل 1). توکسوپلاسموزیس در افراد با ایمنی سالم در هفتاد تا هشتاد درصد موارد بدون علامت است و پس از سپری شدن یک دوره کوتاه فاز حاد بیماری شامل تب ملایم، لنفادنوپاتی و راشهای پوستی( در بیست تا سی درصد موارد) ، با کیسته شدن انگل در سیستم اعصاب مرکزی و عضلات ، فاز مزمن آغاز میشود که معمولاً میتواند تا آخر عمر میزبان ادامه یابد.
اما در اشخاص با ایمنی ناکارآمد نظیر افراد HIV مثبت ، افرادی که ایمنی آنان سرکوب شده است و نیز در انتقال مادرزادی بیماری احتمال مشاهده تظاهرات جدی بیماری نظیر آنسفالوپاتی، درگیری سیستم عصبی مرکزی، تشنج، ذاتالریه، میوکاردیت، نشانههای کلسیفیکاسیون و … وجود دارد[2].
بر اساس مطالعات سرولواپیدمیولوژیک، توکسوپلاسموزیس در بسیاری از کشورهای جهان شایع میباشد. توکسوپلاسموزیس همچنین میتواند از راه جفت به جنین (بهشرط ابتلای اکتسابی مادر در اوایل حاملگی و نه در اثر فعال شدن توکسوپلاسموزیس در خانمهای سرم مثبت با ایمنی سالم) اتفاق بیافتد که میتواند عواقب و عوارض خطرناکی نظیر سقط، تولد زودرس، درجات مختلفی از عقبماندگیهای ذهنی و جسمی، هیدروسفالی، میکروسفالی و نابینایی در طول زندگی را به دنبال داشته باشد[3] ازآنجاییکه توکسوپلاسموزیس در اکثر مبتلایان علائمی ایجاد نمیکند و حتی در صورت ایجاد علائم، بیشتر آنها غیراختصاصی هستند، پس همواره به روشهای تشخیصی نیاز است که تعدادی از آنها شامل: روشهای سرولوژیکی، بیولوژیک، مولکولی و نشان دادن ارگانیزم در بافت و مایعات بدن توسط رنگآمیزی بافتی و واکنش زنجیرهای پلیمراز است [4]. در این مطالعه، مروری بر روشهای مختلف تشخیص بیماری توکسوپلاسموزیس انجام میشود.
شکل 1: چرخه زندگی و راههای انتقال توکسوپلاسما گوندی
روشهای تشخیص توکسوپلاسموزیس
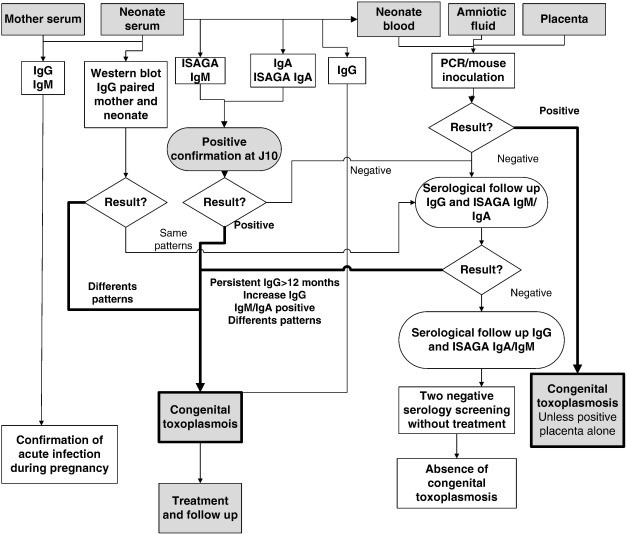
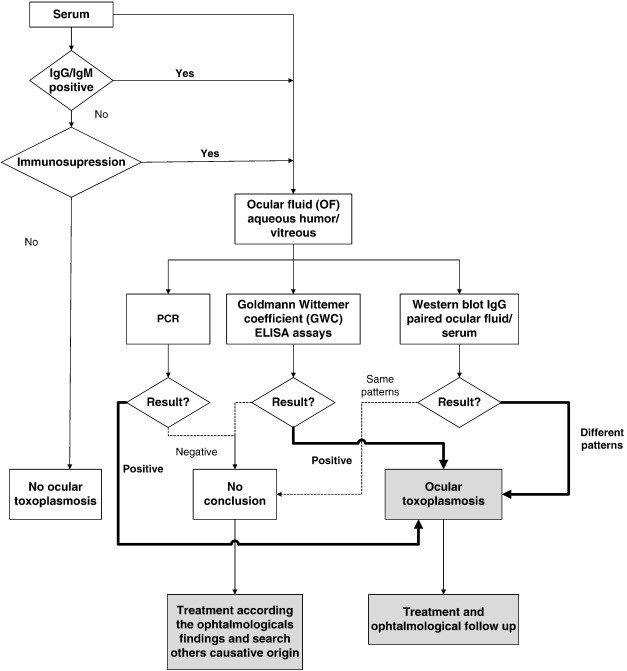
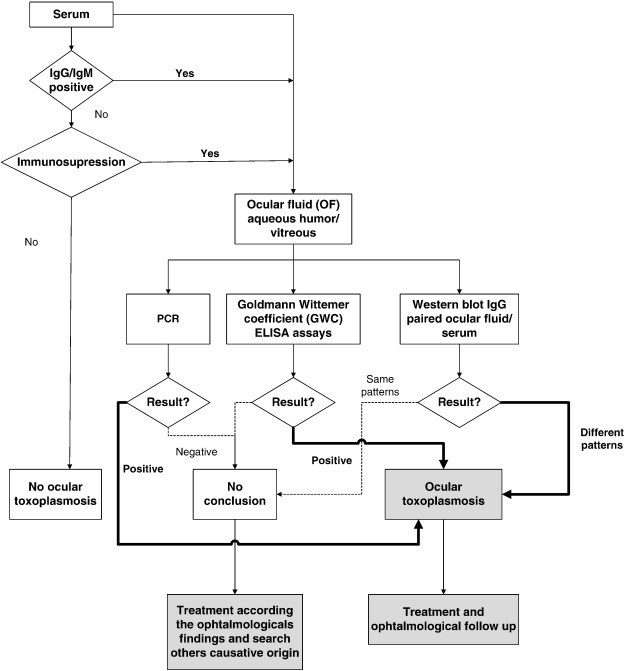
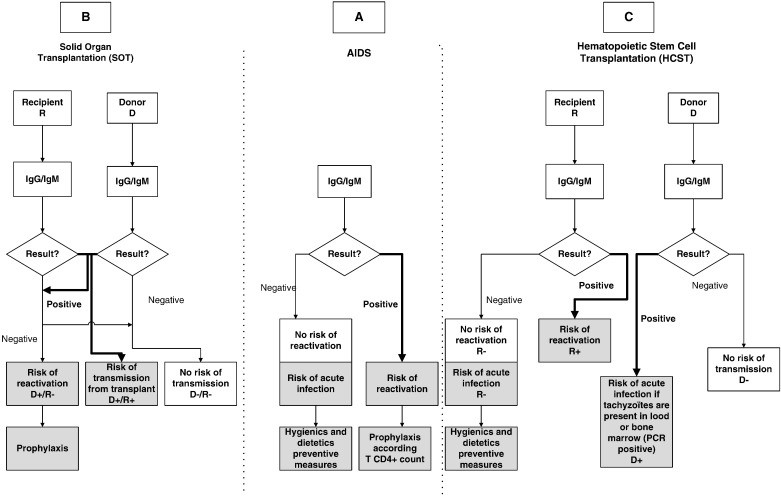
ازآنجاییکه توکسوپلاسموزیس در اکثر مبتلایان علائمی ایجاد نمیکند و حتی در صورت ایجاد علائم، بیشتر آنها غیراختصاصی هستند، پس همواره به روشهای تشخیصی نیاز است که تعدادی از آنها شامل: روشهای سرولوژیکی، بیولوژیک، مولکولی و نشان دادن ارگانیزم در بافت و مایعات بدن توسط رنگآمیزی بافتی و واکنش زنجیرهای پلیمراز است [4] الگوریتم شناسایی توکسوپلاسموزیس در مدلهای مختلف این بیماری در شکلهای 2، 3 و 4 نشان داده شده است [5].
شکل 2: الگوریتم شناسایی توکسوپلاسموزیس در سرم نوزادان با تکنیکهای مختلف
شکل 3: الگوریتم شناسایی توکسوپلاسموزیس در افراد مبتلا به کوریورتینیت مزمن
شکل 4: الگوریتم شناسایی توکسوپلاسموزیس در افراد مبتلا به نقص ایمنی
1- روشهای سرولوژیک
از میان روشهای سرولوژیک متعددی که برای تشخیص آنتیبادیهای ضد توکسوپلاسما گوندی در نمونههای انسانی و حیوانی وجود دارد، قدیمیترین تست، روش سابین فلدمن[4] میباشد که در سال 1948 شرح داده شده است. این روش هنوز هم بهعنوان استاندارد طلایی در تشخیص سرولوژیک بیماری در انسانها استفاده میشود. این روش بر اساس سیتولیز با واسطه کمپلمان بنا نهاده شده است و برای انجام آن به تاکیزوئیتهای زنده نیاز است. در این آزمایش، تاکی زوئیتهای زنده با فاکتور فرعی (کمپلمان سرم انسان) و سرم مورد آزمایش به مدت یک ساعت در دمای 37 درجه سانتیگراد انکوبه میشوند و رنگ متیلن بلو به آن افزوده میشود.
درصورتیکه تاکیزوئیتها تحت تأثیر آنتیبادی قرار نگرفته باشند، بهطور یکنواخت با متیلن بلو رنگ میگیرند، ولی در صورت وجود آنتیبادی، تاکیزوئیتها تحت تأثیر سیستم کمپلمان لیز شده و در نتیجه، به علت تخلیه مواد سیتوپلاسمی، با رنگ متیلنبلو رنگ نگرفته و تاکیزوئیت بیرنگ خواهد بود که با میکروسکوپ نوری قابلمشاهده خواهد بود.
نتیجه مثبت، زمانی حاصل میشود که بیشتر از 55 درصد تاکیزوئیتها رنگ نگرفته باشند و درصورتیکه کمتر از 55 درصد تاکی زوئیت ها رنگ گرفته باشند، نتیجه منفی قلمداد خواهد شد (در تیتر موردنظر) [6]. با وجود اینکه این تست از حساسیت بسیار بالایی در آشکارسازی سطوح پایینی از آنتیبادیهای ضد توکسوپلاسما گوندی برخوردار است ولی برای انجام آن، تاکیزوئیتهای زنده موردنیاز است و باید همواره به نگهداری این فاز انگل در صفاق موش و یا محیط کشت مبادرت شود. روش مشابه این تست که از تاکیزوئیت زنده استفاده میکند، روش تشخیص با روش ایمنوفلورسنت غیرمستقیم میباشد.
1-2– روش آگلوتیناسیون اصلاحشده[5]
این روش در ابتدا توسط Fulton و Turk در سال 1959 شرح داده شد. در این روش با بهکارگیری تاکیزوئیت فیکس شده با فرمالین، آنتیبادیهای IgG در مقابل آنتیژنهای توکسوپلاسما گوندی سنجش میشوند. از 2ME برای از بین بردن هر گونه آنتیبادیهای IgM غیراختصاصی استفاده میشود. مزیت استفاده از این روش، در مقایسه با سایر روشهای تشخیصی، در عدم نیاز آن به کونژوگه اختصاصی گونه است که این روش را قادر میسازد که آنتیبادیهای IgG در مقابل توکسوپلاسما گوندی را در همه انواع میزبانهای این انگل از قبیل انسانها، میزبانهای ذخیره و حیوانات وحشی آشکار کند [7].
1-3- آزمایش ایمنوفلورسنت غیرمستقیم[6]
این تست توسط Fletcher در سال 1965 شرح داده شده است. در این روش، از تاکیزوئیتهایی که قبلاً در محیطهای کشت سلولی کشت داده شده و برای زمانهای طولانی قابل نگهداری هستند استفاده میشود. در این تست، تاکیزوئیتهای فیکس شده بر روی لام میکروسکوپی با رقتهای مختلف از سرم موردنظر انکوبه میشوند. یک آنتیبادی ثانویه که با fluorescein isothiocyanate (FITC) جفت شده است، برای قابلمشاهده کردن نتیجه در زیر میکروسکوپ فلورسنت استفاده میشود. این روش، برای آشکارسازی آنتیبادیهای ضد توکسوپلاسما گوندی، بهویژه در فاز حاد عفونت (در کنار تست رنگی سابین فلدمن) بسیار مفید است و تصور میشود که در مقایسه با روشهایی نظیر الایزا و آگلوتیناسیون مستقیم بسیار حساستر و اختصاصیتر باشد [8].
1-4- روش همآگلوتیناسیون غیرمستقیم[7]
اصول تست IHA این است که RBCهای تانندار که با آنتیژنهای محلول توکسوپلاسما گوندی حساس شدهاند، در مجاورت سرم مثبت، آگلوتینه خواهند شد؛ اما آنتیبادیهای IgG در این روش نسبت به Dye test، با تأخیر تشخیص داده میشوند و بنابراین، عفونتهای حاد و عفونتهای مادرزادی تا حدودی توسط این روش تشخیص داده نخواهند شد. تیترهای پایین آنتیبادی در سرم جانوران در این روش احتمالاً حکایت از یک واکنش غیراختصاصی دارند. این تست، با توجه بهسادگی و سرعت بالا برای بررسیهای اپیدمیولوژیکی مناسب میباشند[9].
1-5- روش الایزا[8]
روش الایزا، پرکاربردترین تست مورداستفاده در آزمایشگاهها برای تشخیص آنتیبادیهای ضد توکسوپلاسما گوندی میباشد (بهویژه IgG و IgM). این تست با توجه به حساسیت بالا و سادگی تفسیر آن، در مورد سایر بیماریهای انگلی نیز کاربرد دارد. در آزمایش الایزا از میکروپلیت هایی با جنس پلیاستیرن که دارای حفرههای متعددی است استفاده میشود. در تشخیص توکسوپلاسموزیس، بیشتر از روش الایزای غیرمستقیم و الایزای دولایه یا ساندویچ استفاده میشود. از روش الایزا برای تشخیص آنتیبادیهای IgA و IgE اختصاصی علیه توکسوپلاسما گوندی نیز استفاده میشود.
یک تست اویدیتی نیز در مورد تست الایزا توسعه یافته است که از ترکیب یک عامل تقلیب کننده نظیر اوره با رقتهای سرم، برای سنجش اویدیتی آنتیبادی استفاده میکند. میزان اویدیتی در طول فاز حاد پایین است و با گذشت زمان افزایش مییابد؛ بنابراین از این تست برای تعیین عفونت جدید و یا عفونت گذشته استفاده میشود تا تعیین کند که تغییر فاز سرمی از حاد به مزمن چه زمانی اتفاق افتاده است که بهویژه در مورد توکسوپلاسموزیس مادرزادی بسیار اهمیت دارد [10].
1-6-روش آگلوتیناسیون جذب ایمنی[9]
در این روش میکروپلیتها توسط آنتیبادی ضد IgM انسانی پوشانده شده، نمونه سرم افراد بر روی آن افزوده شده و به مدت 2 ساعت در 37 درجه سانتیگراد انکوبه میشود تا اتصال بین IgM و anti-Human IgM برقرار گردد. پس از انجام شستشو، سوسپانسیونی از تاکیزوئیتهای فیکس شده به چاهکها افزوده شده، به مدت یک شب در شرایط مرطوب قرار داده میشود. اگر در سرم IgM علیه تاکیزوئیتها بوده باشد، در مرحله قبل به anti-Human IgM متصل شده است و بنا براین، تاکیزوئیتهای فیکس شده را آگلوتینه میکند، واکنشی مشابه با آنچه در روش MAT اتفاق میافتد.
انجام این روش از IgM-ELISA آسانتر و سادهتر است ولی به تعداد زیادی تاکیزوئیت احتیاج دارد؛ بنابراین روش IgM-ISAGA با جایگزینی تاکیزوئیتهای توکسوپلاسما گوندی توسط ذرات لاتکس پوشیده شده توسط آنتیژنهای محلول اصلاح شده است[11]. از IgM-ISAGA برای تشخیص توکسوپلاسموزیس اکتسابی حاد و نیز توکسوپلاسموزیس مادرزادی استفاده میشود.
1-7- روش لاتکس آگلوتیناسیون[10]
در این روش، آنتیژنهای محلول بر روی ذرات لاتکس سوار شدهاند و با اضافه شدن سرم دارای آنتیبادی علیه توکسوپلاسما گوندی، شاهد ایجاد واکنش آگلوتیناسیون خواهیم بود. LAT یک روش سریع و آسان برای آشکارسازی آنتیبادیهای IgG ضد توکسوپلاسما گوندی محسوب میشود. حساسیت و ویژگی آن در انسانها به ترتیب 86 تا 94 درصد و 100 درصد میباشد ولی در گوسفندان میزان حساسیت 78/6 و میزان اختصاصیت 61/9 درصد میباشد. به دلیل سهولت انجام، از LAT برای انجام مطالعات شیوع سرمی بیماری استفاده میشود ولی نتایج مثبت آن بایستی با دیگر تستهای سرولوژیک بررسی شوند [9].
1-8-Piezoelectric immunoagglutination assay (PIA)
آگلوتیناسیون نانوپارتیکلهای طلای پوشیده شده با آنتیژن در حضور آنتیبادیهای اختصاصی توسط یک دستگاه piezoelectric قابل آشکارسازی است که از این روش برای آشکارسازی عفونت انگلی استفاده کردهاند. نتایج این تست در مقایسه با الایزا رضایتبخش بوده است. در مقابل روشهای مرسوم piezoelectric، بیحرکت کردن آنتیژن یا آنتیبادی بر روی یک کریستال piezoelectric ضرورتی ندارد[12].
1-9-روش وسترن بلات[11]
وسترن بلات میتواند بهعنوان یک روش کمکی برای روشهای مرسوم سرولوژیک که در بالا شرح داده شدند استفاده شود. در این روش نمونههای سرمی با آنتیژن توکسوپلاسما گوندی بر روی یک دیواره که از روی ژل پلیاکریلامید منتقل شده است واکنش میدهند و الگوی باندهای حاصله با وزنهای مولکولی معلوم مطابقت داده میشوند. حساسیت روش ایمنوبلات در آشکارسازی آنتیبادی IgG اختصاصی توکسوپلاسما گوندی در بزاق انسان 98/5 درصد است ولی ویژگی آن در تشخیص کوریورتینیت توکسوپلاسمایی، پایینتر و برابر 83 درصد است. وسترن بلات یک روش تکمیلی مفید برای تشخیص توکسوپلاسموزیس مادرزادی، پس از تولد میباشد، بطوریکه ترکیبی از الایزای IgM و IgA، IgM و IgG وسترن بلات و ترکیب هر دوی این روشها، به ترتیب حساسیتهای 94 درصد، 94، 94 و 100 درصد را در طول سهماهه اول زندگی نشان میدهند[13].
1-10-روشهای ایمنوکروماتوگرافیک[12]
روش ایمنوکروماتوگرافیک، یک تکنیک آشکارسازی سریع است که در آن، آنتیژن و یا آنتیبادی نشاندار شده با طلای کلوئیدال بهعنوان ردیاب و دیواره نیتروسلولزی بهعنوان فاز جامد به کار میرود. آنتیبادیها و یا آنتیژنهای آشکارساز، در پد نمونه در دیواره نیتروسلولزی قرار داده میشوند که بر اساس خاصیت مویینگی، پد کونژوگه شده اینفیلتره شده و کمپلکسهای آنتیژن-آنتیبادی واکنشهای کلوئیدی طلاییرنگ را نشان میدهند.
یک استریپ تشخیص سریع ایمنوکروماتوگرافیک که از آنتیبادیهای IgG ضد آنتیژنهای دفعی ترشحی توکسوپلاسمای کونژوگه شده با طلای کلوئید برای آشکارسازی آنتیژنهای دفعی ترشحی در فاز حاد عفونت با توکسوپلاسما گوندی در طی 2 تا 4 روز اول عفونت استفاده میکند، هماهنگی بالایی در حساسیت و ویژگی با تست الایزا نشان داد. نتایج آشکارسازی آنتیبادی علیه GRA7 و SAG-2 با روش ICT با نتایج تستهای LAT و ELISA همخوانی داشت [14, 15] ICT به دلیل سهولت انجام و نیز عدم نیاز به تجهیزات خاص گزینه مناسبی برای استفاده میباشد.
1-11-تست اویدیتی[13]
وجود IgG عفونت توکسوپلاسموزیس را تائید میکند ولی زمان ابتلا را مشخص نمیکند و البته وجود IgM فاکتور دقیقی برای ابتلای اخیر به توکسوپلاسموزیس نمیباشد؛ و البته IgA نیز نشاندهنده عفونت حاد نیست. امروزه تست اویدیتی IgG برای افتراق دادن میان عفونت جدید و قدیم توکسوپلاسما گوندی بهطور گسترده انجام میشود. اویدیتی آنتیژن توکسوپلاسما گوندی به آنتیبادیهای اختصاصی بسته به زمان ابتلا فرق خواهد کرد. در مراحل اولیه ابتلا اویدیتی پایین است ولی با دوام عفونت میزان آن افزایش مییابد؛ بنابراین تست اویدیتی میتواند عفونت جدید و گذشته را از هم افتراق دهد. در این تست نمونههای سرم با اوره و یا دیگر محلولهای دگرگونکننده پروتئین مواجه میشوند و تفاوت در تیترهای حاصله بهعنوان معیاری از عفونت اخیر قلمداد میشود.
تست برای IgG, IgA, IgE با روشهای سرولوژیک مختلف نظیر الایزا و وسترن بلات قابل انجام است. ولی محدودیتهایی هم برای این تست وجود دارد. آنتیبادیهای IgG اختصاصی علیه توکسوپلاسما گوندی با اویدیتی پایین در خانمهای باردار ممکن است تا ماهها دوام داشته باشند. وجود توکسوپلاسما گوندی ممکن است بلوغ میل پیوندی در حاملگی را به تأخیر بیاندازد. غلظتهای بالای آنتیبادیها در نمونههای سرم ممکن است نتایج تست اویدیتی را تحت تأثیر قرار دهد که لزوم تدوین روشهایی برای آشکار کردن اویدیتی آنتیبادی را ایجاب میکند [16]. جدول 1، خلاصهای از روشهای سرولوژی مورداستفاده در تشخیص توکسوپلاسموزیس را نشان میدهد.
جدول 1: خلاصهای از روشهای سرولوژیک استفادهشده برای تشخیص بیماری توکسوپلاسموزیس
| نام روش سرولوژیک | آنتیژن یا آنتیبادی استفادهشده | نوع آنتیژن یا آنتیبادی تستشده |
| DT | Live tachyzoite | IgG, IgM, IgA |
| MAT | Formalin-fixed tachyzoite | IgG |
| IFAT | Killed whole tachyzoite | IgG, IgM |
| IHA | Tanned red blood cells sensitized with soluble antigens | IgG |
| ELISA | Tachyzoite lysate antigen, recombinant antigens, specific antibodies | IgG, IgM, IgA, antigens |
| ISAGA | anti-human IgM antibodies | IgM |
| LAT | Soluble antigen coated latex particles | IgG, IgM |
| PIA | Antigen coated gold nanoparticles | IgG |
| WB | Tachyzoite lysate antigen, recombinant antigens | IgG, IgM |
| ICT | Antigens or antibodies labeled with colloidal gold | IgG, ESA |
| Avidity test | tachyzoite lysate antigen, recombinant antigens | IgG, IgA, IgE |
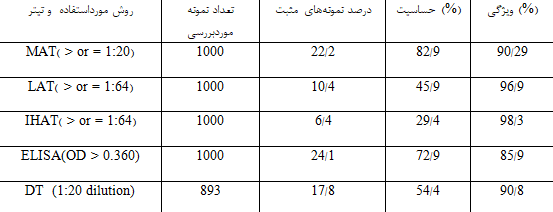
حساسیت و ویژگی تعدادی از روشهای سرولوژیک در تشخیص آنتیبادیهای توکسوپلاسما گوندی در نمونه خون گرفتهشده از قلب 1000 خوک ماده که در معرض آلودگی با انگل قرار گرفتند، بررسی شد. از قلب 170 خوک ماده از 1000 خوک موردبررسی، با روش bioassay در موش و گربه، توکسوپلاسما گوندی جدا شد. درصد نمونههایی که با هر کدام از این روشهای سرولوژیک، مثبت گزارش شدند در جدول 2 ارائه شده است. مطابق نتایج این بررسی، از میان روشهای آگلوتیناسیون اصلاحشده (MAT)، لاتکس آگلوتیناسیون (LAT)، هماگلوتیناسیون غیرمستقیم (IHAT)، تست رنگی (DT) و ELISA که در این مطالعه استفاده شد، بیشترین حساسیت مربوط به روش MAT بوده است[17].
جدول 2: مقایسه نتایج چند روش سرولوژیک استفادهشده برای تشخیص بیماری توکسوپلاسموزیس
References:
[1] Saki J, Khademvatan S. Detection of Toxoplasma gondii by PCR and mouse bioassay in rodents of Ahvaz District, Southwestern Iran. BioMed research international. 2014;2014.
[2] Gharavi M, Jalali S, Khademvatan S, Heydari S. Detection of IgM and IgG anti-Toxoplasma antibodies in renal transplant recipients using ELFA, ELISA and ISAGA methods: comparison of pre-and post-transplantation status. Annals of Tropical Medicine & Parasitology. 2011;105:367-71.
[3] Saki J, Mohammadpour N, Moramezi F, Khademvatan S. Seroprevalence of Toxoplasma gondii in women who have aborted in comparison with the women with normal delivery in Ahvaz, southwest of Iran. The Scientific World Journal. 2015;2015.
[4] Hill D, Dubey J. Toxoplasma gondii: transmission, diagnosis and prevention. Clinical microbiology and infection. 2002;8:634-40.
[5] Villard O, Cimon B, L’Ollivier C, Fricker-Hidalgo H, Godineau N, Houze S, et al. Serological diagnosis of Toxoplasma gondii infection: recommendations from the French National Reference Center for Toxoplasmosis. Diagnostic microbiology and infectious disease. 2016;84:22-33.
[6] STILL TFAI. IS SABIN-FELDMAN DYE TEST USING T. GONDH TACHYZOITES FROM ANIMAL INOCULATION STILL THE BEST METHOD FOR DETECTING TOXOPLASMA GONDH ANTIBODIES? 2010.
[7] Forbes LB, Parker SE, Gajadhar AA. Performance of commercial ELISA and agglutination test kits for the detection of anti-Toxoplasma gondii antibodies in serum and muscle fluid of swine infected with 100, 300, 500 or 1000 oocysts. Veterinary parasitology. 2012;190:362-7.
[8] Piergili FD. [Problems and limitations of conventional and innovative methods for the diagnosis of Toxoplasmosis in humans and animals]. Parassitologia. 2004;46:177-81.
[9] Liu Q, Wang Z-D, Huang S-Y, Zhu X-Q. Diagnosis of toxoplasmosis and typing of Toxoplasma gondii. Parasites & vectors. 2015;8:1.
[10] Lappalainen M, Koskela P, Koskiniemi M, Ämmälä P, Hiilesmaa V, Teramo K, et al. Toxoplasmosis acquired during pregnancy: improved serodiagnosis based on avidity of IgG. Journal of Infectious Diseases. 1993;167:691-7.
[11] Remington JS, Eimstad WM, Araujo FG. Detection of immunoglobulin M antibodies with antigen-tagged latex particles in an immunosorbent assay. Journal of clinical microbiology. 1983;17:939-41.
[12] Liu Q, Wang Z-D, Huang S-Y, Zhu X-Q. Diagnosis of toxoplasmosis and typing of Toxoplasma gondii. Parasites & vectors. 2015;8:292.
[13] Villard O, Filisetti D, Roch-Deries F, Garweg J, Flament J, Candolfi E. Comparison of enzyme-linked immunosorbent assay, immunoblotting, and PCR for diagnosis of toxoplasmic chorioretinitis. Journal of clinical microbiology. 2003;41:3537-41.
[14] Huang X, Xuan X, Hirata H, Yokoyama N, Xu L, Suzuki N, et al. Rapid immunochromatographic test using recombinant SAG2 for detection of antibodies against Toxoplasma gondii in cats. Journal of clinical microbiology. 2004;42:351-3.
[15] Terkawi MA, Kameyama K, Rasul NH, Xuan X, Nishikawa Y. Development of an immunochromatographic assay based on dense granule protein 7 for serological detection of Toxoplasma gondii infection. Clinical and Vaccine Immunology. 2013;20:596-601.
[16] Bonyadi MR, Bastani P. Modification and evaluation of avidity IgG testing for differentiating of Toxoplasma gondii infection in early stage of pregnancy. Cell Journal (Yakhteh). 2013;15:238.
[17] Dubey J, Thulliez P, Weigel R, Andrews C, Lind P, Powell E. Sensitivity and specificity of various serologic tests for detection of Toxoplasma gondii infection in naturally infected sows. American Journal of Veterinary Research. 1995;56:1030-6.
[4] Dye Test(DT)
[5] Modified agglutination test (MAT)
[6] Indirect Immunofluorescent antibody testing
[7] Indirect hemagglutination
[8] Enzyme Linked Immunosorbent Assay
[9] Immunosorbent agglutination assay (ISAGA)
[10] Latex Agglutination(LAT)
[11]Western blotting (WB)
[12]Immunochromatographic test (ICT)
[13] Avidity test
https://www.sciencedirect.com/science/article/pii/S0732889315003302
https://www.cdc.gov/parasites/toxoplasmosis/diagnosis.html
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام