منابع خطا در تستهای Coombs
گردآوری و نگارش:
ناصر شاگردی اسماعیلی- دانشجوی سال سوم دکتری تخصصی هماتولوژی و علوم انتقال خون دانشگاه علوم پزشکی شهید بهشتی- عضو هیئت علمی دانشگاه
سهیل فرجاللهی- کارشناس آزمایشگاه
آزمایش کومبس اولین بار در سال 1906 توسط Moreschi و سپس در سال 1945 توسط Mournat، coombs و race برای تشخیص آنتیبادیهایی که به گلبولهای قرمز متصل شده و آنها را حساس میکنند ولی توانایی آگلوتینه کردن گلبولها را ندارند، پیشنهاد شد. این تست به دو صورت لولهای مستقیم (جهت شناسایی آنتیژنهای موجود روی گلبولهای قرمز) و لولهای غیرمستقیم (جهت شناسایی آنتیبادیهای موجود در سرم یا پلاسمای بیمار) صورت میگیرد. البته استفاده از روشهایی مانند IRMA (immuno radiometric assay)، ELAT (enzyme-linked immunoassay test)، ELISA (Enzyme-Linked Immunosorbent Assay) و فلوسایتومتری علیرغم ارزش بالینی و حساسیت بیشتر به دلیل هزینههای بالا کمتر مورد استفاده قرار میگیرند.
کاربرد استفاده از تستهای کومبس
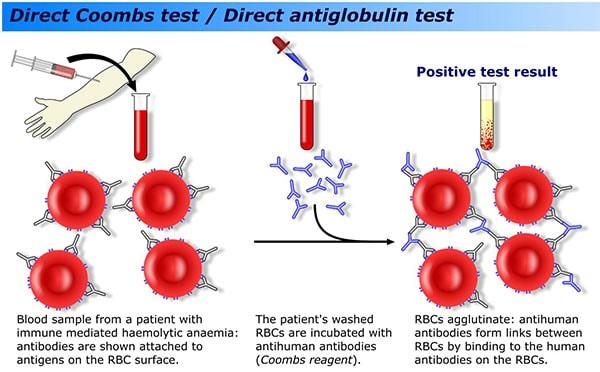
الف) آزمایش coombs مستقیم برای تشخیص بیماریهای زیر انجام میگیرد:
- بیماریهای همولیتیکی نوزادان مانند اریتروبلاستوز جنینی
- آنمی همولیتیک اتوایمیون
- انتقال خون نادرست
- حساس شدن گلبولهای قرمز به علت عفونتهای ویروسی، مصرف دارو یا سایر علل ناشناخته
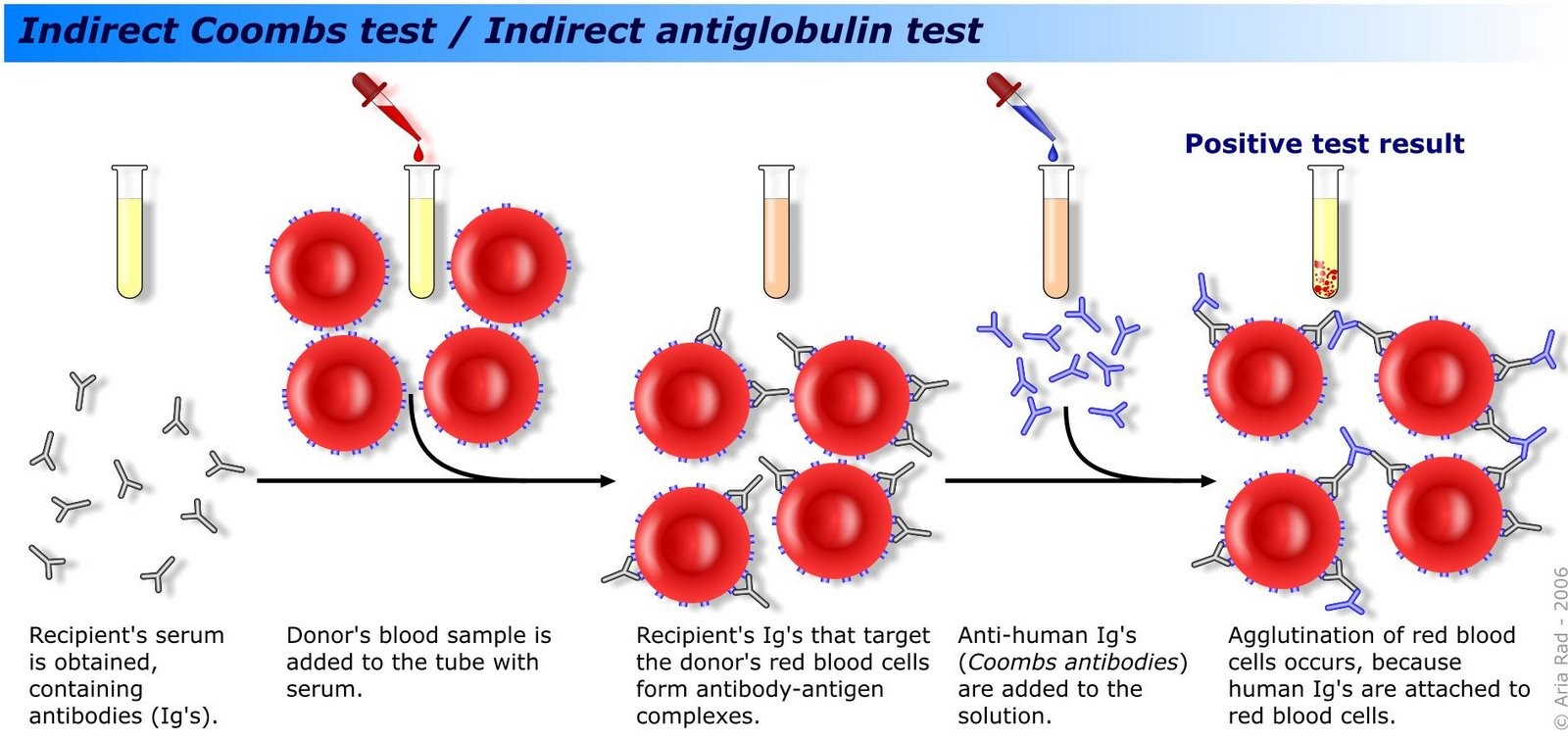
ب) آزمایش coombs غیرمستقیم در موارد زیر انجام میگیرد:
1) پیشبینی یا تشخیص بیماری همولیتیک نوزادان از سرم مادران Rh منفی یا Du مثبت
2) تشخیص آنتیژن Rh Du
3) آزمایش کراسمچ
4) تشخیص گروههای خونی kidd، Duffy، kell و … در سطح گلبولهای قرمز مخصوصاً قبل از جراحیهای قلب باز
5) تشخیص آنتیبادیهای ناقص یا غیرمعمول در سرم علیه آنتیژنهای گروههای خونی سیستمهای kidd، Duffy، kell و …
6) تشخیص حساسیت دارویی در مواردی که بیمار بیش از یک نوع دارو مصرف کرده
7) تشخیص آنتیبادیهای ضدپلاکتی گلبولهای سفید در سرم
منابع خطا:
الف) واکنشهای مثبت کاذب (False – Positive Reaction)
1) در واکنش کومبس غیرمستقیم، اگر در مرحله حساس کردن گلبولهای قرمز آگلوتیناسیون ایجاد شود احتمال درگیر شدن آنتیبادیهای کامل وجود دارد.
2) آلوده شدن ظروف شیشهای یا تمیز نبودن آنها (وجود پرزهایی داخل لوله)
3) آلوده شدن آلبومین گاوی یا آنتیگلبولین انسانی
4) مناسب نبودن غلظت نمک سرم فیزیولوژی
5) اضافه کردن مواد تثبیتکننده مانند caprylate به آلبومین گاوی
6) گلبولهای قرمز کهنهشده یا شستن بیش از حد RBCها با آنزیم
7) وجود یونهای فلزی و موادی مثل polybrene در سرم
8) استفاده از موادی چون پلیاتیلن گلیکول جهت افزایش حساسیت آنتیگاماگلبولین انسانی
9) افزایش بیش از حد سرعت سانتریفیوژ (این خطا در صورت مقایسه با نمونه کنترل منفی قابل تشخیص است)
10) آگلوتیناسیون خودبهخودی RBCها حین آزمایش به علت وجود اتوآنتیبادیهای دور از انتـــــــــــــــــــــظار مثل anti-Transferrin
11) افزایش بیش از حد رتیکولوسیتها
12) عدم شستشوی مناسب RBCها
13) نمونه نامناسب (سلولهای لختهشده)
14) افزایش اوره نیتروژن خون
15) خطاهای تکنیکی
ب) واکنشهای منفی کاذب (False – Negative Reaction)
- ضعیف بودن یا غیرفعال شدن آنتیگلبولین انسانی
- آلوده شدن یا کهنه بودن آنتیگلبولین انسانی
- آلودگی میکروبی یا سرمی ظروف شیشهای مورد استفاده
- متناسب نبودن آنتیژن و آنتیبادی و ایجاد پدیده منطقهای (Prozone or Postzone)
- شستشوی نامناسب RBCها (کم شستشو دادن یا شستشوی بیش از حد)
- عدم مناسب بودن زمان انکوبه و سانتریفیوژ
- به اندازه کافی حساس نشدن گلبولهای قرمز (گلبولهای قرمز باید حداقل از 100 تا 500 مولکول آنتیبادی پوشیده شده باشند تا بتوانند با آنتیگاماگلبولین انسانی آگلوتینه شوند)
- عدم تأئید نتایج منفی (جهت تأئید هم باید زیر میکروسکوپ عدم آگلوتینه دیده شود، هم با اضافه کردن RBCهای حساسشده یا اضافه کردن قطعات کمپلمان آگلوتیناسیون ظاهر شود)
- تأخیر در اضافه کردن آنتیگلبولین بعد از مرحله شستشو
10) خطاهای تکنیکی
References:
- Go RS, Winters JL, Kay NE (2017) How I treat autoimmune hemolytic anemia. Blood 129: 2971-2979
- Kay NE, K. Anderson (1978) Direct antiglobulin “Coombs'” test. Incidence of positive findings in normal population: retrospective study N Y State J Med 78: 1244-1246
- Gorst DW, Rawlinson VI, Merry AH, Stratton F (1980) Positive direct antiglobulin test in normal individuals. Vox Sang 38: 99-105.
- Bicakci Z, Ozturkmen S, Akyay A, Olcay L (2012) False positive result of the direct antiglobulin test (DAT): the role of the elevated level of immunoglobulin G. PediatrHematolOncol 29: 611-619
- Robertson VM, Dickson LG, Romond EH, Ash RC (1987) Positive antiglobulin tests due to intravenous immunoglobulin in patients who received bone marrow transplant. Transfusion 27: 28-31.
- Toy PT, Chin CA, Reid ME, Burns MA (1985) Factors associated with positive direct antiglobulin tests in pretransfusion patients: a case-control study. Vox Sang 49: 215-220.
- Zantek ND, Koepsell SA, Tharp DR Jr, Cohn CS (2012) The direct antiglobulin test: a critical step in the evaluation of hemolysis. Am J Hematol 87: 707-709.
- Huh YO, Liu FJ, Rogge K, Chakrabarty L, Lichtiger B (1988) Positive direct antiglobulin test and high serum immunoglobulin G values, Am J ClinPathol 90: 197-200.
- Pakzad, P., 2004. Principles and interpretation of clinical serology experiments. Nooredanesh press, 169, pp.294-304
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام