بیوفیلم باکتریایی
معین حمیدی، کارشناس ارشد میکروبیولوژی
میعاد بنی طرفی، دانشجوی کارشناس ارشد بیوتکنولوژی میکروبی
در طبیعت باکتریها به دو شکل پلانکتونیک و بیوفیلم یافت میشوند (1). بیوفیلم باکتریایی، تجمعات پیچیده باکتریها هستند که در یک پوشش گلیکوکالیکس محصور شده و به سطوح مخاطی میچسبند (2). بیوفیلم را میتوان بهعنوان استراتژی دانست که بعضی از میکروارگانیسمها از آن استفاده میکنند تا بتوانند خود را از اثرات و نیروهای زیانباری که در محیط طبیعی و بدن میزبان است حفظ کرده و اینگونه شانس بقای خود را افزایش دهند. زیست لایه توسط گروههای مختلفی از باکتریها ساخته میشود و به علت مشکلاتی که به وجود میآورند در پزشکی و صنعت از اهمیت بالایی برخوردارند. بیوفیلمها در سال 1978 توسط کاسترتون در مورد باکتریها شرح داده شدند.
در بیوفیلمهای باکتریال، باکتریها میتوانند از اجتماع یک گونه واحد باکتریایی باشند یا میتوانند اجتماعی از چند گونه متفاوت باشند (3،4). مهمترین خاصیت متمایز بیوفیلم ها تفاوت در رشد آنها میباشد که سبب مقاومت دارویی و نیاز به درمان متفاوت و روشهای متمایز شناسایی بیوفیلم ها میگردد (5).
بیوفیلم ها مانند اسپور باکتریها به آنتیبیوتیکها مقاوم بوده (6) بهطوریکه برخی از محققین ادعا میکنند که مقاومت بیوفیلم نسبت به آنتیبیوتیکها هزار برابر پلانکتونیک است (7،8،9). بیوفیلمها با عوامل ضد باکتریایی مثل ضدعفونیکنندهها، حرارت، خشک کردن از بین نمیروند بر روی سطح باقی مانده و خصوصاً در بیمارستانها سبب آلودگی و انتقال بیماریهای عفونی میگردند (10) و بهطور فیزیکی از باکتریها در برابر سیستم ایمنی میزبان و آنتیبیوتیکها محافظت میکند (11،13). این پدیده یکی از علل عود بیماریهای عفونی است. باکتریهای موجود در سطح بیوفیلم توسط آنتیبیوتیک و سیستم ایمنی میزبان، نابود شده ولی باکتری موجود در عمق بیوفیلم زنده میماند (6). پس از قطع آنتیبیوتیک، باکتریهای مقیم بیوفیلم رشد و تکثیر پیدا نموده و بیماری عفونی برگشت دوبارهای خواهد داشت. از طرفی اگر سیستم ایمنی میزبان مشکل داشته باشد مقاومت دارویی و عود زودتر مشاهده میشود(13،6).
دلایل ایجاد بیوفیلم:
بیوفیلم به سطوح چسبیده و در بین آنها تقسیم کار صورت میگیرد. درواقع، قابلیت متابولیکی جامعه سلولی در سطح مطلوبی افزایش مییابد. کلونیزاسیون راحتتر صورت میگیرد و در برابر جریان خون و ادرار پابرجا مانده و باکتریهای بیوفیلم از دسترس سیستم ایمنی میزبان مانند فاگوسیتوز در امان میمانند. انتقال ژن راحتتر صورت میگیرد و به دنبال آن ژنهای ویرولانس تولید و غلظت بالایی از سم خارجی (اگزوتوکسین) ایجاد میشود. کوروم سنسینگ (Quorum Sensing)یک نوع ارتباط خاص بین باکتریها است و به تشکیل بیوفیلم باکتریها کمک نموده و آنها را در برابر آنتیبیوتیکها محافظت میکند (14،9).
مراحل تشکیل بیوفیلم
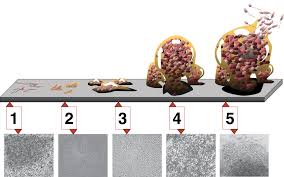
تشکیل بیوفیلم 3 مرحلهی کلی دارد،1- تشکیل 2- گسترش 3- پراکندگی
- تشکیل: تشکیل بیوفیلم با اتصال میکروارگانیسمهای آزاد شناور به سطوح اتفاق میافتد.
- گسترش: گسترش بیوفیلم شامل 5 مرحله میباشد: الف) اتصال اولیه ب) اتصال برگشتناپذیر ج) بلوغ د) پراکندگی.
- پراکندگی: جدا شدن سلولها از کلنی بیوفیلم، یک مرحلهی ضروری از چرخهی زندگی بیوفیلم است که بیوفیلم را قادر میسازد که سطوح جدید را کلنیزه کنند.
شکل مراحل تشکیل بیوفیلم
مقاومت در بیوفیلم باکتریها:
- محدودیت نفوذ عوامل میکروبی: پوشش پلیساکاریدی همانند سدی نفوذ بیوسایدها، آنتیبیوتیکها و پپتیدهای ضد میکروبی را محدود میکند.
- تغییرات فیزیولوژیکی و اثر آن بر میزان رشد و فعالیت متابولیکی: میزان دسترسی به مواد غذایی و اکسیژن موجب تراکم باکتریایی متفاوت در سرتاسر بیوفیلم میشود. بهطوریکه باکتریهای واقع در پیرامون بیوفیلم دسترسی بهتری به مواد غذایی و اکسیژن نسبت به باکتریهای واقع در عمق اجتماع بیوفیلم دارند. تفاوت در میزان دسترسی به مواد غذایی و اکسیژن در بیوفیلم موجب فعالیت متابولیکی متفاوت در میان باکتریها میشود؛ زیرا بیشتر آنتیبیوتیکها در ابتدا بیوفیلم که فعال است اثر میگذارند.
- فنوتیپ اختصاصی بیوفیلم: باکتریها پس از اتصال به سطح مورد نظر تحت تأثیر تغییرات فیزولوژیک، متابولیک و فنوتیپیک متعددی قرار میگیرند. ایجاد فنوتیپ اختصاصی بیوفیلم میتواند منجر به فعالسازی مکانیسمهایی شود که برای ایجاد فعالیت نسبت به ضد میکروبها ضروری میباشد (15).
هتروژنیتی بیوفیلمی:
شیبهای مواد غذایی، ترکیبات زائد و فاکتورهای سیگنال دهنده باعث این ناهمگنی درون بیوفیلم میشوند. پیشرفتهای اخیر تکنولوژی، امکان تصویرسازی هتروژنیتی درون بیوفیلم را به محققان داده است. بهعنوانمثال رنگآمیزی با acridin orange برای شناسایی نواحی بیوفیلم که دارای سرعت رشد متفاوت هستند به کار میرود. اساس روش نسبت محتویات RNA-DNA میباشد. این متد در ابتدا روی کلنیهای باکتریایی به کار گرفته شد. نواحی نارنجی (نسبت RNA بالا) به سرعتهای بالای رشد مربوط بودند و نواحی سبز زرد (نسبت RNA پایین) سلولها را با سرعت رشد آرام نشان میدادند. زمانی که این متد روی بیوفیلمهای 7 روزه آزمایش شد، رنگ نارنجی، سطوح مجاور محیط را رنگ کرد و مرکز بیوفیلم به رنگ سبز زرد درآمد. این هتروژنیتی درون بیوفیلم برای سنتز پروتئینها و فعالیتهای تنفسی وجود داشت درحالیکه محتویات DNA درون بیوفیلم نسبتاً ثابت بود.
روشهای مبارزه با بیوفیلم:
- باکتریوفاژها بهعنوان روشی نوین برای مقابله با بیوفیلم مورد استفاده قرار گرفتند (16،17). فاژتراپی در گذشته مطرح بوده، بر استفاده از فاژهای لایتیک و مقابله با عفونت باکتریایی استوار میباشد.
- استفاده از پوشش ضد باکتریایی روی وسایل پزشکی مانند کاتتر و آنژیوکت که به نام پوشش سطحی فعال معروف است. با این کار، از اتصال باکتری در اولین قدم جلوگیری میشود.
- بیوالکتریکها از تشکیل بیوفیلم جلوگیری و از طرفی سبب افزایش فعالیت آنتیبیوتیکها میشوند. در این روش به همراه تجویز آنتیبیوتیک از جریان الکتریکی ضعیف 2- 1/5 ولتی استفاده میشود (18).
- امواج اولتراسوند با فرکانس پایین (70 کیلوهرتز) سبب تسهیل انتقال آنتیبیوتیکها به داخل بیوفیلم میگردند. اولتراسوند احتمالاً باعث افزایش انتقال مواد غذایی و اکسیژن شده و درنتیجه رشد باکتریها را افزایش میدهد و به همین دلیل آنتیبیوتیکها مؤثرتر خواهند بود (19).
- سیستم پلیمری: ذرات نانو پلیاستر، هیدروژل، میسلها و فیبرها ناقلین مؤثر داروها میباشند (22).
- ترکیب درمانی: تعدادی از دانشمندان فعالیت همافزایی و ترکیب درمانی را علیه بیوفیلم سودوموناس ایروژینوزا پیشنهاد میکنند (20).
- ان- استیل سیتوزین: ان- استیل سیتوزین ماده ضد باکتریایی غیر آنتیبیوتیکی است (9).
- استفاده از عسل
- شلاتورهای فلزات: مانند EDTA سبب لیز و افزایش حساسیت به عوامل ضد میکروبی در شکل پلانکتونیکی باکتریها میشود (21).
مشکلات بیوفیلم های باکتریایی:
بیوفیلمهای باکتریایی قادرند گسترهی عظیمی از مشکلات را در محیطهای صنعتی و پزشکی و غیره ایجاد کنند، در اینجا تعدادی از مشکلات بهوجود آمده از بیوفیلم باکتریایی مطرح میشود.
- آسیبهای ناشی از بیوفیلم در صنعت: بیوفیلم ها میتوانند داخل لولهها رشد و تکثیر یابند که سبب مسدود شدن و خراب شدن تدریجی وسایل و تجهیزات شوند.
- آسیبها در صنعت غذایی: بیوفیلم ها باعث کاهش کیفیت شیر یا آلودگی در مواد غذایی میشوند.
- تشکیل پلاک دندانی
- ایجاد بیماری عفونی و مقاومت آنتیبیوتیکی
References:
1) Lewis K. Riddle of biofilm resistance. Antimicrob Agents and Chemother 2001; 45(4): 999-1007.
2) Gilpin DF, Graham J, Elborn JS, Tunney MM. Biofilm foundation and antimicrobial susceptibility of Pseudomonas aeruginosa isolates cultured before and after antibiotic treatment of an acute exacerbation of pulmonary infection. J Cyst Fibros 2008; 7(2): S39.
3) Hall-Stoodley L, Costerton JW, Stoodley P (February 2004). “Bacterial biofilms: from the natural environment to infectious diseases”. مجله نیچر 2 (2): 95–108.doi:10.1038/nrmicro821. PMID 15040259.
4) Lear, G; Lewis, GD (editor) (2012). Microbial Biofilms: Current Research and Applications. انتشارات دانشگاهی کایستر. ISBN 978-1-904455-96-7.
5) Hoiby N, Bjarnsholt T, Givskov M, Molin S, Ciofu S. Antibiotic resistance of bacterial biofilms. Intern J Antimicrob Agents 2010; 35 322-32.
6) Stewart PS, Costerton JW, “Antibiotic resistance of bacteria in biofilms”. Lancet 2001, 358, 135-8.
7) Mulcahy H, Charron-Mazenod L, Lewenza S. Extracellular DNA chelates cations and induces antibiotic resistance in Pseudomonas aeruginosa Biofilms. PLoS Pathog 2008; 4(11): e1000213.
8) Fricks-Lima J, Hendrickson CM, Allgaier M, Zhuo H, Wiener-Kronish JP, Lynch SV, et al. Differences in biofilm formation and antimicrobial resistance of Pseudomonas aeruginosa isolated from airways of mechanically ventilated patients and cystic fibrosis patients. Intern J Antimicrob Agents 2011; 37, 309- 15.
9) Bjarnsholt T, Jensen PO, Fiandaca MJ, Pedersen J, Hansen CR, Andersen CB, Pseudomonas aeruginosa biofilms in the respiratory tract of cystic fibrosis patients. Pediatr Pulmonol 2009; 44: 547-58.
10) Branda SS, Vik S, Friedman L, Kolter R. Biofilms: the matrix revisited. Trends Microbiol 2005; 13(1): 20-6.
11) Hoyle BD, Jass, Costerton JW. The biofilm glycocalyx as a resistance factor. J Antimicrob Chemother1990; 26: 1-5
12) Von Eiff C, Heilmann C, Peters G. New aspects in the molecular basis of polymer-associated infections due to staphylococci. Eur J Clin Microbiol 1999; Infect Dis 18: 843-6.
13) Lewis K. Riddle of biofilm resistance. Antimicrob Agents and Chemother 2001; 45(4): 999-1007.
14) Mulcahy H, Charron-Mazenod L, Lewenza S. Extracellular DNA chelates cations and induces antibiotic resistance in Pseudomonas aeruginosa Biofilms. PLoS Pathog 2008; 4(11): e1000213.
15) M. Whiteley, M.G. Bangera, R.E. Bumgarner, M.R. Parsek, G.M. Aeruginosa biofilms, nature.2001:413:860 -865.
16) Azeredo J, Sutherland IW. The use of phages for the Removal of infectious biofilms. Curr Pharm Biotechnol 2008;9:261-6.
17) O’Toole G, Kaplan H, Kolter R. Biofilm formation as microbial development. Annu Rev Microbiol 2000;54:49-79.
18) Costerton W, Ellis B, Lam K, Johnson F, Khoury “Mechanism of electrical enhancement of efficacy of antibiotics in killing biofilm bacteria”. Antimicrob Agents Chemo 1994; 38: 2803-9.
19) Rediske AM, Roeder BL, Nelson JL, Robison RL, Schaalje GB, Robison RA. “Pulsed ultrasound enhances the killing of Escherichia coli biofilms by aminoglycoside antibiotics in vivo”. Antimicrob Agents Chemo 2000; 44: 771-2.
20) Abdi-Ali A, Mohammadi-Mehr M, Agha Alaei Y. Bactericidal activity of various antibiotics against biofilm-producing Pseudomonas aeruginosa. Int J Antimicrob Agents 2006; 27: 196-200.
21) Turakhia MH, Cooksey KE, Characklis WG. Influence of calcium-specific chelant on biofilm removal. Appl Environ Microbiol 1983; 46: 1236-8.
(23 ) قوطاسلو، رضا؛ صلاحی اشلقی، بهناز؛1391. بیوفیلم پسودوموناس ایروژینوزا و روش های پیشگیری و درمان های تازه آن. مجله دانشگاه علوم پزشکی رفسنجان. 12(9).
https://medlabnews.ir/quorum-sensing-2/
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام