اختلالات غده آدرنال (2)
بیماری آدیسون
مراد رستمي: کارشناس ارشد بیوشیمی بالینی، دانشگاه علوم پزشكي جندیشاپور اهواز
معصومه جرفی: کارشناس ارشد میکروبشناسی، دانشگاه علوم پزشكي جندیشاپور اهواز
بیماری آدیسون (Addison’s disease)
مقدمه:
لایه فاسیکولاتای غده فوق کلیوی، مسئول سنتز گلوکوکورتیکوئیدها است که مهمترین آنها، کورتیزول میباشد که بر روی متابولیسم پروتئینها، لیپیدها و بهویژه کربوهیدراتها اثر دارد. در لایه رتیکولاریس نیز، سنتز کورتیزول و تولید مقادیر کم هورمونهای جنسی صورت میگیرد. ACTH با اتصال به گیرندههای موجود در سطح سلولهای سنتز کننده کورتیزول، موجب افزایش غلظت سیتوزولی cAMP شده که خود از طریق فعالسازی پروتئین کیناز A، منجر به فسفریلاسیون و فعالسازی “پروتئینهای تنظیمکننده حاد سنتز استروژن” (StAR) میشوند.
بیوسنتز گلوکوکورتیکوئیدها:
گلوکوکورتیکوئیدها شامل مجموعهای از هورمونهای استروئیدی 21 کربنه هستند که کورتیزول، مهمترین آنها میباشد. هورمونهای تولیدشده در قسمت خارجی (کورتکس) غده فوق کلیه، از کلسترول مشتق میشوند.
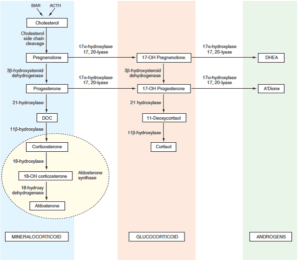
تصویر: مسیرهای دخیل در سنتز هورمونهای استروئیدی آدرنال (مینرالوکورتیکوئیدها، گلوکوکورتیکوئیدها و آندروژنها)
ACTH: Adrenocorticotropic hormone; هورمون آدرنوکورتیکوتروپیک
DHEA: Dehydroepiandrosterone; دهیدرواپی آندروسترون
DOC: Deoxycorticosterone; داکسی کورتیکواسترون
StAR: Steroidogenic acute regulatory; (پروتئینهای) تنظیمکننده حاد سنتز استروژن
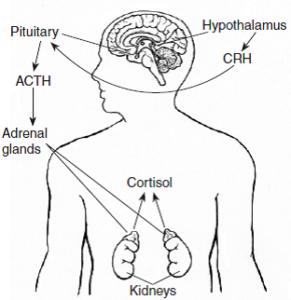
سنتز و کنترل ترشح کورتیزول:
سنتز کورتیزول در کورتکس آدرنال، تحت کنترل ACTH (Adrenocorticotropin hormone) (هورمون آدرنوکورتیکوتروپین) از بخش قدامی غده هیپوفیز قرار دارد.
ACTH دارای هر دو اثر استروئیدوژنیک (سنتز استروژن) و تروفیک (تغییر اندازه سلول) بر روی کورتکس آدرنال میباشد. برعکس، کمبود ACTH موجب آتروفی (کوچک شدن اندازه سلولها) این لایهها خواهد شد.
ترشح ACTH خود تحت تأثیر CRH (Corticotropin-releasing hormone) (هورمون آزادکننده کورتیکوتروپین) از غده هیپوتالاموس میباشد.
ترشح CRH، ACTH و کورتیزول با یک ریتم شبانهروزی صورت میگیرد. بیشترین مقدار ترشح کورتیزول در اوایل صبح (8-4 صبح) بوده و سپس در طی روز، میزان ترشح آن کاهش مییابد. ترشح کورتیزول بهصورت ضربانی بوده و تعداد این ضربآنهای ترشحی در صبح، بیشتر میباشد.
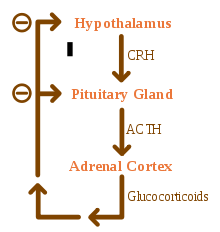
تولید کورتیزول از طریق فیدبک منفی، موجب مهار آزاد شدن CRH و ACTH میگردد. مصرف مقادیر زیاد گلوکوکورتیکوئیدهای اگزوژن (خارجی) نیز از طریق مهار فیدبک منفی بر هیپوتالاموس و هیپوفیز موجب کاهش سطح CRH و ACTH میشوند. در صورت سرکوب طولانی (بیش از چند هفته) گلوکوکورتیکوئیدهای خارجی، ممکن است سرکوب دائمی هیپوفیز و درنتیجه، آتروفی غدد فوق کلیه رخ دهد.
تصویر: حلقه فیدبک منفی گلوکوکورتیکوئیدها روی کنترل ترشح CRH و ACTH
انتقال کورتیزول در گردش خون:
حدود 75% کورتیزول موجود در خون به CBG (گلبولین متصل شونده به کورتیزول) و حدود 15% آن به آلبومین متصل میشود. حدود 10% کورتیزول موجود در گردش خون به فرم آزاد وجود دارد.
کاتابولیسم کورتیزول:
اولین مرحله در غیر فعالسازی کورتیزول، اکسیداسیون عامل هیدروکسی کربن شماره 11 به عامل کتونی و تولید کورتیزون است. حدود 1% کورتیزول و کورتیزون بدون تغییر از طریق ادرار دفع میشده؛ درحالیکه اغلب آنها دستخوش تغییراتی دیگر در کبد (گلوکورونیده شدن و سولفاته شدن) میشوند و سپس از طریق ادرار دفع میگردند.
اغلب متابولیتهای موجود در مسیر سنتز و کاتابولیسم کورتیزول شامل داکسی کورتیکواسترون، کورتیزول، کورتیزون و متابولیتهای احیاء شده آنها، داستروئیدهای 21 کربنهای هستند که دارای 2 گروه هیدروکسی بر روی کربنهای 17 و 21 بوده و به “17- هیدروکسی کورتیکواستروئیدها ” (17-OHCS) موسوم هستند. در بررسی اختلالات متابولیسم گلوکوکورتیکوئیدها از اندازهگیری 17-OHCS استفاده میشود.
هیپوکورتیزولیسم:
علل نارسایی آدرنال یا کاهش کورتیزول خون به 3 نوع اولیه (آدرنالی)، ثانویه (هیپوفیزی) و ثالثیه (هیپوتالاموسی) تقسیمبندی میشوند. علل ثانویه و ثالثیِه کاهش کورتیزول خون، تحت عنوان “علل مرکزی ” نیز نامیده میشوند.
شایعترین علت نارسایی اولیه آدرنال که بیماری آدیسون نیز نامیده میشود، آدرنالیت اتوایمیون (بیش از 70% موارد) میباشد. توبرکولوز، سپسیس، ناهنجاریهای گرانولوماتوز، بیماری متاستاتیک، خونریزی و ایدز جزو سایر علل ایجادکننده بیماری آدیسون هستند.
شایعترین علت نارسایی مرکزی آدرنال، سرکوب محور هیپوتالاموس- هیپوفیز به علت درمان طولانیمدت با استروئیدها است. اصلیترین اختلاف نارسایی مرکزی آدرنال با نارسایی اولیه آدرنال، طبیعی بودن تولید مینرالوکورتیکوئیدها و فعالیت رنین به همراه میزان پایین ACTH در نارسایی مرکزی آدرنال میباشد.
نارسایی مرکزی آدرنال بهمراتب شایعتر از نارسایی اولیه آدرنال (بیماری آدیسون) میباشد.
تعریف بیماری آدیسون:
بیماری آدیسون یا نارسایی اولیه آدرنال، درنتیجه نارسایی آدرنال در تولید کورتیزول و همچنین گاهی آلدوسترون رخ میدهد. اصلیترین علت آن در کشورهای توسعهیافته، آدرنالیت اتوایمیون (آسیب غده آدرنال توسط سیستم ایمنی خود فرد) و در کشورهای درحالتوسعه، توبرکولوز میباشد.
شیوع:
وقوع بیماری آدیسون به میزان 1 تا 4 مورد در هر 100 هزار نفر در سال در همه سنین و در هر دو جنس میباشد.
علل ایجادکننده کمکاری غده فوق کلیوی (آدرنال):
1- نارسایی اولیه آدرنال (بیماری آدیسون):
1-1: بیماریهای اتوایمیون: تخریب کورتکس آدرنال توسط سیستم ایمنی میتواند مسئول بیش از 80% موارد نارسایی این غده باشد. نارسایی آدرنال زمانی رخ میدهد که حداقل 90% کورتکس آدرنال از بین رفته باشد. در این موارد، اغلب کورتیزول و آلدوسترون هر دو کاهش مییابند.
در موارد اتوایمیون، گاهی فقط غده آدرنال بهتنهایی درگیر میشود؛ درحالیکه در برخی موارد دیگر، سایر غدد اندوکراین (Polyendocrine deficiency syndrome) نیز تحت تأثیر قرار میگیرند.
2-1: توبرکولوز: عفونت توبرکولوز میتواند موجب تخریب غده آدرنال شود. توبرکولوز مسئول کمتر از 20% موارد نارسایی آدرنال در کشورهای توسعهیافته و بیشترین عامل نارسایی آدرنال در کشورهای درحالتوسعه میباشد.
در سال 1849 که دکتر توماس آدیسون (Thomas Addison) برای نخستین بار نارسایی آدرنال را تشخیص داد، توبرکولوز شایعترین عامل این بیماری بود.
3-1: سایر علل کمتر شایع: عفونتهای مزمن بهویژه عفونتهای قارچی، گسترش سلولهای سرطانی از سایر بافتها به غدد آدرنال، آمیلوئیدوز (یک بیماری که موجب ساخت یک پروتئین غیرطبیعی و آسیب به بافتهای مختلف میشود)، برداشت غده آدرنال توسط جراحی، عفونتهای وابسته به ایدز، خونریزی درون غدد آدرنال، سپسیس (عفونت باکتریایی خون)، ناهنجاریهای گرانولوماتوز، نقایص ژنتیکی مرتبط با تکامل غدد آدرنال و … نیز از جمله سایر علل کمتر شایع نارسایی اولیه غدد آدرنال هستند.
2- نارسایی ثانویه و ثالثیه آدرنال (نارسایی مرکزی آدرنال):
نارسایی ثانویه آدرنال، درنتیجه کمبود تولید ACTH به وجود میآید. بدون وجود ACTH، غدد آدرنال تحریک نشده و تولید کورتیزول متوقف میشود. در این موارد، برخلاف نارسایی اولیه آدرنال، تولید آلدوسترون تحت تأثیر قرار نمیگیرد.
2-1: مصرف داروهای گلوکوکورتیکوئیدی سنتتیک: در مواقعی که فرد برای درمان بیماریهای التهابی از قبیل آرتریت روماتوئید، آسم و کولیت زخم شونده (Ulcerative colitis)، داروهایی از قبیل پردنیزون برای مدت طولانی مصرف مینماید، آزاد شدن CRH و ACTH، متوقف میگردد. درنتیجهی عدم تولید ACTH، این غدد شروع به آتروفی و کوچک شدن کرده و به دلیل عدم وجود اثر تحریکی ACTH روی غدد آدرنال، این غدد قادر به تولید کورتیزول نیز نخواهند بود.
2-2: کاهش اندازه غده هیپوفیز و توقف تولید ACTH درنتیجهی تومورها و عفونتهای غده هیپوفیز، نرسیدن جریان خون به غده هیپوفیز، رادیوتراپی درمانی غده هیپوفیز، برداشت غده هیپوفیز توسط جراحی و ….
2-3: برداشت قسمتی از غده هیپوتالاموس توسط جراحی.
2-4: آسیب محور هیپوتالاموس- هیپوفیز.
علائم و نشانههای بیماری آدیسون:
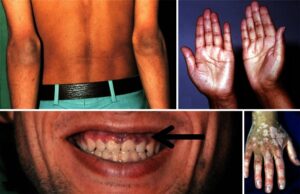
علائم و نشانهها بهتدریج ظاهرشده و ممکن است شامل درد شکم، ضعف (weakness)، خستگی، بیاشتهایی، کاهش وزن، تهوع، اسهال و … شود. درنتیجه افزایش مقادیر ACTH، تیره شدن پوست (به دلیل افزایش رنگدانههای پوست) در برخی از نواحی بدن نیز ممکن است رخ دهد.
به علت کمبود مینرالوکورتیکوئیدها، فرد دچار هیپوناترمی، هیپرکالمی، اسیدوز متابولیک، کاهش حجم خون و کاهش فشارخون میگردد.
آلدوسترون که اصلیترین مینرالوکورتیکوئید است باعث افزایش بازجذب سدیم و دفع پتاسیم و هیدروژن در ادرار میگردد؛ بنابراین، کاهش آلدوسترون باعث از دست رفتن سدیم ادرار (کاهش سدیم خون؛ هیپوناترمی)، کاهش از دست دادن پتاسیم از طریق ادرار (افزایش پتاسیم خون؛ هیپرکالمی) و کاهش دفع یونهای هیدروژن از طریق ادرار (افزایش یونهای هیدروژن خون و درنتیجه، کاهش pH خون و ایجاد اسیدوز متابولیک) میگردد.
هیپرکالمی (افزایش پتاسیم خون) از طریق اختلال در تولید آمونیوم (+NH4) و دفع اسید در ادرار، نقش مهمی در ایجاد اسیدوز متابولیک ایفا میکند. هیپرکالمی موجب اختلال در تولید آمونیوم در توبول پروگزیمال از طریق القاء “آلکالوز داخل سلولی” در سلولهای توبولار میگردد. این اختلال ناشی از مبادله سلولی پتاسیم با هیدروژن (ورود پتاسیم به درون سلول و خروج یونهای هیدروژن از سلول) میباشد.
افزایش دفع سدیم در ادرار باعث از دست دادن آب بیشتری از طریق ادرار (کاهش آب بدن) و درنتیجه کاهش حجم خون و کاهش فشارخون میگردد.
تظاهرات بیماری در نارسایی مرکزی آدرنال (نارسایی ثانویه و ثالثیه)، مشابه بیماری آدیسون است؛ با این تفاوت که در اینجا به دلیل سطح ACTH پایین، افزایش رنگدانههای پوست مشاهده نمیشود.
در برخی شرایط، کریز آدرنال (Adrenal crisis) ممکن است رخ دهد که با علائمی از قبیل کاهش فشارخون، استفراغ، درد در ناحیه پایین کمر و از دست دادن هوشیاری میتواند همراه باشد. کریز آدرنال میتواند توسط استرس (صدمه، جراحی و یا عفونت) تحریک گردد.
تصویر: هیپرپیگمنتاسیون ناشی از بیماری آدیسون
تستهای آزمایشگاهی:
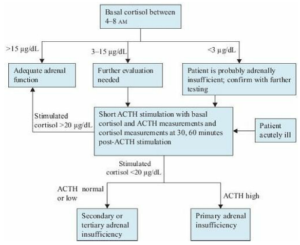
در برخی موارد میتوان با اندازهگیری میزان پایه کورتیزول سرم، امکان تشخیص و یا رد هیپوکورتیزولیسم و هیپرکورتیزولیسم را مطرح نمود. در برخی موارد نیز برای تشخیص قطعی و یا تشخیص افتراقی نارسایی اولیه از نارسایی مرکزی آدرنال میتوان از اندازهگیری مقادیر پلاسمایی ACTH، تستهای تحریکی ACTH، متیراپون و یا انسولین استفاده کرد.
- اندازهگیری میزان پایه کورتیزول:
میزان کورتیزول سرمی ساعت 8 صبح کمتر از 3 میکروگرم در دسی لیتر، نشانه نارسایی آدرنال بوده و نیازی به آزمایشهای دیگر نیست. در مبتلایان به هیپوکورتیزولیسم، چنانچه خونگیری در هنگام استرس انجام شود، سطح کورتیزول در دامنه طبیعی قرار میگیرد؛ ازاینرو، میزان طبیعی کورتیزول، تشخیص هیپوکورتیزولیسم را رد نمیکند. از طرفی، میزان کورتیزول تصادفی بیش از 25 میکروگرم در دسی لیتر در هنگام استرس، نارسایی آدرنال را رد مینماید.
ترشح کورتیزول بهصورت طبیعی، دارای یک الگوی روزانه میباشد؛ بدینصورت که در ساعت 8-6 صبح دارای بیشترین مقدار بوده و در نیمهشب به کمترین مقدار خود میرسد.
- اندازهگیری میزان ACTH پلاسمایی:
اندازهگیری میزان ACTH در ساعت 8 صبح (ACTH پایه)، ممکن است برای تمایز نارسایی اولیه آدرنال (مقادیر بیش از 100- 50 پیکوگرم در میلیلیتر) از نارسایی مرکزی آدرنال (کمتر از 10 پیکوگرم در میلیلیتر) مفید باشد.
میزان ACTH دارای تغییرات روزانه میباشد؛ بهنحویکه میزان آن در ساعت 10- 8 شب، نصف تا دوسوم مقدار آن طی ساعات 8- 4 صبح میباشد.
برای اندازهگیری ACTH، لوله نمونه باید روی ظرف حاوی آب یخ قرار گرفته و در صورت نیاز به نگهداری، در دمای 20- درجه سانتیگراد ذخیره شود.
جدول: افتراق انواع هیپوکورتیزولیسم بر اساس مقادیر پلاسمایی کورتیزول، ACTH و CRH
| نوع هیپوکورتیزولیسم | کورتیزول | ACTH | CRH |
| آدرنالی (اولیه) | پایین | بالا | بالا |
| هیپوفیزی (ثانویه) | پایین | پایین | بالا |
| هیپوتالاموسی (ثالثیه) | پایین | پایین | پایین |
- تست تحریکی ACTH با کوسینتروپین:
تست تحریکی ACTH، رایجترین تست برای ارزیابی بیماران مشکوک به هیپوکورتیزولیسم میباشد. در این آزمایش، ابتدا سطح کورتیزول خون یا ادرار (و یا هر دو) (بهعنوان میزان پایه) اندازهگیری شده و سپس به بیمار کوسینتروپین (Cosyntropin) (یک ACTH سنتتیک تجارتی) تزریق میشود. کورتروسین (Cortrosyn) یا سیناکتن (Synacthen)، نامهای تجاری کوسینتروپین هستند.
پس از تزریق، در فواصل زمانی مشخص، سطح کورتیزول خون یا ادرار (و یا هر دو) اندازهگیری میشود.
این تست ممکن است بهصورت تست تحریکی سریع (Rapid stimulation test) و یا 3 روزه انجام شود.
تست تحریکی سریع، تنها یک تست غربالگری بوده و به دنبال نتایج غیرطبیعی آن، باید تست تحریکی 3 روزه انجام شود.
1-3: تست تحریکی سریع (Rapid stimulation test): ابتدا یک نمونه خون برای اندازهگیری میزان پایه کورتیزول تهیه میشود. سپس 250 میکروگرم از کوسینتروپین بهصورت وریدی (IV) و یا عضلانی (IM) در طی 2 دقیقه تزریق شده و در طی 30 و 60 دقیقه پس از تزریق، مجدداً نمونهگیری انجام میشود.
2-3: تست تحریکی 3 روزه: ابتدا یک نمونه خون برای اندازهگیری میزان پایه کورتیزول تهیه میشود. سپس 250 میکروگرم از کوسینتروپین بهصورت عضلانی (IM) به فواصل هر 8 ساعت به مدت 3- 2 روز متوالی تزریق میشود. میزان کورتیزول در فواصل 12، 24، 36، 48، 60 و 72 ساعت پس از تزریق، اندازهگیری میگردد.
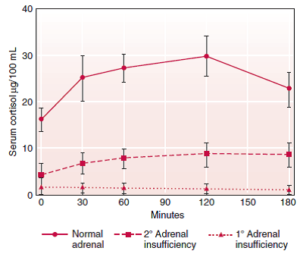
پاسخ طبیعی، افزایش سطح کورتیزول خون و ادرار، متعاقب تزریق کوسینتروپین (کورتروسین) میباشد. در موارد طبیعی، میزان کورتیزول خون در تست تحریکی سریع باید بیش از 7 میکروگرم در دسی لیتر و در تست تحریکی 3 روزه باید بیش از 40 میکروگرم در دسی لیتر باشد.
تصویر: پاسخ کورتیزول سرم متعاقب تجویز 250 میکروگرم کوسینتروپین در 9 فرد طبیعی (آدرنال طبیعی)، 8 بیمار دارای نارسایی هیپوفیز (نارسایی ثانویه آدرنال) و 7 بیمار دارای بیماری آدیسون (نارسایی اولیه آدرنال)
- تست تحمل انسولین (ITT):
از تست تحمل انسولین (ITT) برای ارزیابی محور هیپوتالاموس- هیپوفیز استفاده میشود. برخلاف تست تحریکی ACTH، ITT، کل محور هیپوتالاموس- هیپوفیز را مورد ارزیابی قرار میدهد. در صورت سالم بودن محور هیپوتالاموس- هیپوفیز، هیپوگلیسمی حاصل از انسولین موجب تحریک هیپوتالاموس برای ترشح CRH و تحریک هیپوفیز برای ترشح ACTH شده که موجب افزایش میزان کورتیزول میشوند.
ابتدا یک نمونه خون جهت اندازهگیری مقادیر پایه کورتیزول از بیمار گرفته شده و سپس 0/1 واحد انسولین به ازای هر کیلوگرم وزن بدن به بیمار تزریق میشود. سپس در طی فواصل 30، 45، 60، 90 و 120 دقیقه، مجدداً از بیمار نمونهگیری میشود.
پاسخ مناسب افزایش کورتیزول، باید بیش از 550 نانومول در لیتر (بیش از 20 میکروگرم در دسی لیتر) باشد.
تست ITT در افراد بالای 70 سال، افراد با سابقه تشنج و بیماران ایسکمیک قلب نباید انجام شود. در این بیماران، بهجای تست ITT، میتوان از تست تحریکی ACTH استفاده نمود. کاربرد اصلی تست ITT، ارزیابی بیمارانی است که پاسخ مشکوکی به تست تحریکی ACTH داشتهاند.
توصیه میشود که برای انجام این آزمایش، با توجه به کاهشی که در میزان قند بیمار (هیپوگلیسمی) به وجود میآورد، وسایلی از قبیل گلوکومتر برای اندازهگیری سریع قند بیمار (در صورت لزوم) و محلول دکستروز برای تجویز احتمالی در دسترس باشد. بهتر است این آزمایش زیر نظر متخصص غدد و یا در محلی که به ایشان دسترسی وجود داشته باشد، انجام شود.
- تست تحریکی متیراپون:
کاربرد این تست نیز در ارزیابی محور هیپوتالاموس- هیپوفیز میباشد. اساس این تست، اثر مهاری متیراپون روی β 11- هیدروکسلاز است. نتیجه این اثر مهاری، کاهش تولید کورتیزول (از 11- داکسی کورتیزول) و درنتیجه، افزایش جبرانی در ترشح CRH (از هیپوتالاموس) و ACTH (از هیپوفیز) میباشد؛ که بهنوبه خود، موجب تحریک سنتز استروئیدها و تجمع 11- داکسی کورتیزول میشوند.
در نارسایی مرکزی آدرنال، CRH و (یا) ACTH تولید نشده و افزایشی در 11- داکسی کورتیزول رخ نمیدهد.
در این آزمایش، ابتدا از بیمار یک نمونه خون جهت داشتن سطح پایه کورتیزول گرفته شده و سپس متیراپون به میزان 30 میلیگرم به ازای هر کیلوگرم وزن بدن در ساعت 11 شب تجویز میشود. ساعت 8 روز بعد مجدداً از بیمار یک نمونه خون گرفته میشود.
برای جمعآوری ادرار 24 ساعته نیز، ابتدا یک ادرار 24 ساعته برای اندازهگیری میزان
17- هیدروکسی کورتیکواستروئیدهای (17-OHCS) پایه از بیمار گرفته شده و سپس متیراپون به میزان 750-500 میلیگرم هر 6-4 ساعت از ساعت 11 شب در طی 24 ساعت تجویز میشود. سپس از ساعت 8 صبح روز بعد، بیمار نسبت به جمعآوری ادرار 24 ساعته اقدام مینماید. ادرار 24 ساعته باید در طی مدت جمعآوری در یخچال و یا روی ظرف یخ نگهداری شود.
متعاقب تست تحریکی متیراپون، در موارد طبیعی، میزان 11- داکسی کورتیزول خون باید به بیش از 7 میکروگرم در دسیلیتر و میزان کورتیزول به کمتر از 10 میکروگرم در دسیلیتر برسد. مقدار طبیعی میزان دفع 17- هیدروکسی کورتیکواستروئیدها (17-OHCS) نیز در ادرار 24 ساعته باید به بیش از 2 برابر حد پایه برسد.
متعاقب تجویز متیراپون ممکن است بیمار دچار کریزهای شبه آدیسونی (Addisonian crisis) شود که در این مورد باید درمان شامل برگشت شوک، برقراری جریان خون و تجویز استروئیدهای ضروری (هیدروکورتیزون) صورت گیرد.
بهمنظور پیشگیری از بروز عوارض جانبی معدی- رودهای (GI side effects) متیراپون، باید با هر وعده آن، یک لیوان شیر مصرف شود.
- 17- هیدروکسی استروئیدها (17-OHCS):
اندازهگیری سطح 17- هیدروکسی کورتیکواستروئیدها (17-OHCS) در ادرار 24 ساعته، نشاندهنده وضعیت عملکرد غده آدرنال میباشد. کاهش سطح 17-OHCS در بیماران دارای نارسایی غده آدرنال مشاهده میشود.
مقدار طبیعی 17-OHCS در ادرار 24 ساعته، 10- 3 میلیگرم در 24 ساعت (27/6- 8/3 میکرومول در روز) در آقایان و 8- 2 میلیگرم در 24 ساعت (22/1- 5/2 میکرومول در روز) در خانمها میباشد.
- جستجوی اتوآنتیبادیها:
ممکن است آنتیبادیهای خاصی مانند آنتیبادی ضد آنتیژن 21- هیدروکسیلاز در بیمار مورد بررسی قرار گیرند.
مقدار طبیعی آنتیبادی 21- هیدروکسیلاز کمتر از 1 واحد در میلیلیتر میباشد.
تصویر: الگوریتم بررسی هیپوکورتیزولیسم (نارسایی آدرنال)
ACTH: Adrenocorticotropic hormone; هورمون آدرنوکورتیکوتروپیک
سایر مطالعات و بررسیها:
در بیماران مبتلا به نارسایی اولیه آدرنال، تکنیکهای CT “توموگرافی کامپیوتری” شکمی یا MRI “تصویربرداری رزونانس مغناطیسی” با تأکید روی غدد آدرنال برای تشخیص علت به کار میروند. غدد آدرنال بزرگ، نشاندهنده عفونت، خونریزی و یا بیماریهای متاستاتیک هستند.
CT یا MRI هیپوفیز نیز در بیماران دارای هیپوکورتیزولیسم ثانویه یا ثالثیه (نارسایی مرکزی آدرنال) باید انجام شود.
References:
1- Arneson W, Brickell J. Clinical chemistry; a laboratory perspective. 2007.
2- Pagana KD and Pagana TJ. Diagnostic and laboratory test refrence. 2015; 12th edition.
3-Kasper DL, Fauci AS, Hauser SL, Longo DL, Jameson JL, Loscalzo J. Harrison’s principles of internal medicine. 2015; 19th edition.
4- Crook MA. Clinical biochemistry and metabolic medicine. 2012; 8th edition.
5-Rodwell VW, Bender DA, Botham KM, Kennelly PJ, Weil PA. Harper’s illustrated biochemistry. 2015; 30th edition.
6- Smith CS, Marks AD, Lieberman M. Marks basic medical biochemistry. 2012; 4th edition.
7-Williamson MA, Snyder LM. Wallasch’s interpretation of diagnostic tests. 2015; 10th edition.
8- Chatterjea MN, Chawla R. Clinical chemistry. 2010; 2nd edition.
9- محمدی رضا. هورمون شناسی تئوری. 1392. چاپ اول.
اختلالات غده آدرنال (1) سندرم کوشینگ
سرطان آدرنال (سرطان غده فوقکلیه) (3)
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام