تازههایی از اسپيروكتها (بورليا، لپتوسپيرا و ترپونما)
(بخش دوم)
دكتر رضا ميرنژاد (استاد تمام دانشگاه)
در بخش اول در خصوص اسپیروکتها و ویژگیهای آنها و بهطور اجمال در مورد لپتوسپیرا و تشخیص آنها مطالبی ارائه شد. در این بخش سعی میگردد در خصوص بورلیاها بهخصوص عامل تب راجعهای اپیدمیک و اندمیک و بیماری لایم مطالبی ارائه شود.
بورلياها (Borrelia)
تب راجعه اپيدميك[1] يا بازگرد يا تب راجعه منتقله توسط شپش[2] به واسطه بورليا رکورنتیس[3]، باكتریي كه شپش بدن بنام Pediculus humanus را آلوده ميكند، ايجاد ميگردد. انسانها معمولاً وقتي با ناخن، شپش را له ميكنند، آلوده ميگردند. شپش بيماري را از طريق تخم به نسل بعدي منتقل نميكند، بنابراين براي حفظ بيماري در جمعيت شپشها، خونخواري از افراد آلوده الزامي است. سابقاً تب راجعه منتقله توسط شپش در همه جا بود، اما امروزه فقط در آفريقاي شمالي يافت ميشود. تبهاي راجعه كنوني عمدتاً كنهاي هستند.
تب راجعه اندميك[4] يا تب راجعه منتقله از كنه[5] با بورلياهاي ديگري يعني بورليا هرمسي[6]، بورليا پرسيكا، بورليا ميكروتي، بورليا لاتيشوي و بورليا بالتازاردي و بورليا دوتني[7] مرتبط است. عفونت از طريق گزش كنه آلوده از جنس اورنتيودوروس[8] که نوعی کنه آرگازیده است، حاصل ميشود. امروزه بورلیاهایی مانند بورلیا میامودی[9] و بورلیا لون استاری[10] از کنه گونههای ایکسودیده هم جداسازی شده اند، لذا نامگذاری گونههای بورلیای عامل TBRF که بر اساس گونههای کنه آرگازیده است که از آنها جداسازی میشدند، انجام میگردید دیگر رایج نیست. كنه بيماري را از طريق تخم به نسلهاي بعدي منتقل ميكند، بنابراين بيماري در يك جمعيت كنهاي پايدار باقي ميماند.
در ايران گونههای بورليا پرسيكا، بورليا ميكروتي، بورليا لاتيشوي و بورليا بالتازاردي در کنههای ايران يافت شده است و بورليا پرسيكا و بورليا بالتازاردي را از خون مبتلايان به تب راجعه کنهای جدا نمودهاند. عفونت از طريق گزش كنه اورنتيودوروس آلوده حاصل ميشود. كنه بيماري را از طريق تخم به نسلهاي بعدي میتواند منتقل کند و به دلیل اینکه این کنهها در مقابل کنههای ایکسودیده عمر طولانی و عادات تغذیهای چند میزبانه دارند، میتوانند اسپیروکتها و بيماري را برای دورههای طولانی در يك جمعيت و طبیعت حفظ کنند. اين كنهها كوچكند و سريعاً (در 10 تا 20 دقيقه) خونخواري خود را انجام میدهند، بيشتر در شب خونخواري ميكنند و در محل گزش انسان دردي ايجاد نميكنند، بنابراين بيشتر افراد متوجه نميشوند كه با كنه گزيده شدهاند.
امروزه تمام تبهاي راجعه در ايران از نوع اندميك است و مواردي در مناطق شمالي و غرب كشور نظير استانهای آذربايجان شرقي، اردبيل، آذربايجان غربي، زنجان، تهران، مركزي، سمنان، خراسان، همدان و كرمانشاه روي داده است. تمام تبهاي راجعه ایالات متحده آمريكا از نوع اندميك است و مواردي در تگزاس، دشتهای خشک مکزیک، نیومکزیکو، كلرادو و آريزونا، خصوصاً در گراندكانيون روي میدهد. جوندگان نيز ميتوانند مخزن عفونت باشند. بورلياها بر اساس ناقلي كه آنها را منتقل ميكند، تقسیمبندی شدهاند.
خصوصيات بورلياها
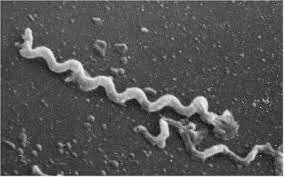
بورلیاها میکروآئروفیل و کاتالاز و اکسیداز منفی هستند. 30-5 میکرومتر طول و 0/5-0/2 میکرومتر قطر دارند و فاصله پیچها از هم 4-2 میکرومتر است. 10-7 فلاژل پریپلاسمی داشته و با تقسیم دوتایی تکثیر میشوند. ضخیمتر از ترپونماها هستند و پیچها کمتر و نامنظمتر است. برخلاف گونههای ترپونما، بورلیاها پروتئین ایمونوژن بسیاری را در سطح غشای خارجی خود بیان میکنند و گونههای زیادی از آنها را میتوان روی محیط کشت مصنوعی کشت داد، بعلاوه، پیچیدگی ژنوم بورلیاها با کروموزوم خطی 910 کیلوبازی و 21 پلاسمید خطی و حلقوی، آن را از نظر ژنتیکی به یک جنس خیلی پیچیدهتر از تروپونما تبدیل کرده است. از نظر انتقال خون این باکتریها اهمیت دارند. اغلب در 5% از بیماران مبتلا به تب راجعه تست VDRL مثبت میشود.
خصوصيات بورليا رکورنتیس، هرمسي و دوتنی
تب راجعه بورليايي قادر به تغيير پروتئینهای شاخص ايمني است كه پروتئینهای اصلي متغير[11] نام داشته و در غشاء خارجي قرار دارند. ژنهاي VMP بورليا بر روي پلاسميدهاي خطي قرار دارند. لازم به ذکر است که در 99 درصد باکتری، پلاسمیدهائی که وجود دارند حلقوی هستند و در باکتریهایی مانند بورلیاها و استرپتومایسسها و بعضی گونههای مایکوباکتریوم خطی هستند، همچنین انتهای پلاسمید خطی بورلیاها بهخصوص بورلیا بورگدورفری همانند ویروس واکسینیا و یوکاریوتها دارای تلومر است. از هر پلاسميد چنین كپي در یک باکتری وجود دارد و در يك لحظه، فقط يكي از ژنهاي پروتئینهای اصلي متغير بيان ميشوند.
اين ژن بیانشده در مجاورت تلومر قرار دارد، در حالي كه در ژنهايي كه بيان نميشوند و خاموش هستند صدها نوكلئوتيد دورتر از تلومر پلاسميد قرار دارند (شكل 1). در آغاز عفونت بر سطح هر بورليا يك VMP بيان ميشود. وقتي سيستم ايمني به اين پروتئینهای اصلي متغير واكنش نشان میدهد، آنتيبادي، بورلياها را از طريق اپسونيزاسيون و نيز مسیر وابسته به كمپلمان محدود ميكند. تعداد محدودي از بورلياها كه ميتوانند تغيير وضعیت دهند و VMP جديد بيان كنند، ميتوانند باقي بمانند، بنابراين توسط پاسخ ايمني كه به VMPهاي اول ايجاد شده بود، قابل تشخيص نيستند. بهزودی بورلياي حاوي پروتئینهای اصلي متغير جديد تكثير يافته و باكتريمي وسيعي به همراه علائم كلينيكي بروز میدهد و بيمار دچار عود ميشود.
مكانيسم سوئيچ ژني هنوز كاملاً مشخص نيست؛ محققين معتقدند كه ژنهاي خاموش وسط پلاسميد با ژنهاي تلومري يك پلاسميد ديگر تعويض ميشوند (شكل 1). ميزان ژني كه قبلاً بيان ميشده، كم ميشود؛ اما ژني كه تازه بيان ميشود در هر دو پلاسميد ديده ميشود. حركت اين ژن به سمت تلومر منجر به بيان ژن ميشود، زيرا از مكاني كه در بالادست آن پروموتوري وجود ندارد، بهجایي ميرود كه بلافاصله در بالادست آن پروموتور وجود دارد (و تلومر بلافاصله در پائیندست قرار میگیرد). ژني كه حالا نزديك پروموتور است، خوانده ميشود و VMPجديد توليد ميگردد.
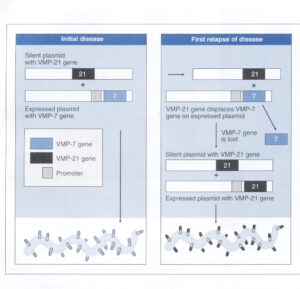
شكل 1: كنترل ژنتيك تغييرات آنتیژنيك عامل عود كه در مبتلايان به تب راجعه بوجود میآید
بورليا كه سبب بيماري راجعه میگردد، میتواند پروتئینهای شاخص ايمني– كه پروتئینهای اصلي متغير (VMP) ناميده میشوند– را در غشاء خارجي خود تغيير دهد. در طي دوره آغازين بيماري (شكل سمت چپ)، بورليا 7- VMP را بر روي غشاء خارجي خود بيان مینماید، زيرا ژن 7- VMP در تلومر، درست در پاییندست يك پروموتور قرار دارد. ژن 21-VMP بر روي پلاسميد ديگر، در جايي قرار دارد كه بيان نمیشود و به عبارتی ” خاموش” است، زيرا پروموتور مناسبي وجود ندارد. يك آنتیبادی علیه 7- VMP ايجاد شده و بورليا را از خون پاك مینماید و سبب میشود كه بيماري بهتر شود.
در بعضي از بورلياها يك ترانسپوزيشن روي میدهد كه سبب میگردد كه عود رخ بدهد (شكل سمت راست). در طي ترانسپوزيشن، ژن 7- VMP جدا شده و بجاي آن ژن 21- VMP در نزديكي تلومر قرار میگیرد كه در نتيجه بورليا از حالا به بعد بهجای 7- VMP، بر روي سطح خود 21- VMP را بيان مینماید. از آنجايي كه پاسخ ايمني اين آنتیژن جديد را نمیشناسد، بورليا آزادانه تكثير نموده و بيماري بازمیگردد. (برگرفته از کتاب میکروبشناسی پزشکی واکر)
بيماريهاي حاصل از بورلیاها
تظاهرات باليني:
از 2 تا 15 روز بعد از گزش توسط كنه آلوده يا بعد از له كردن شپش آلوده، بيماران مبتلا به تب راجعه (TBRF يا LBRF) تظاهرات ناگهاني تب، لرز، سردرد، درد ماهيچه و مفصل و بیحالی شديد را نشان میدهند. در اين زمان ممكن است دچار ترس از نور، راش (در يك چهارم موارد) و بزرگي طحال و كبد بشوند. اين علائم 3 تا 6 روز طول كشيده، سپس بيمار بیحال و دچار فشار پايين ميشود و سريعاً دماي بدن بيمار پايين افتاده و براي 5 تا 10 روز تب پايين آمده و تعداد كمي بورليا در خونشان ديده ميشود (در حقيقت در اسمير معمولي نميتوان بورليا را يافت)، سپس دوباره قسمت ديگري از فاز حاد آغاز ميشود.
درگیری نورولوژیکی به اشکال مننژیت، فلج عصب هفتم، میلیت و آنسفالیت نیز گزارش شده است. 13 بار ممكن است بيمار اين حالتها را تكرار كند كه هر كدام از دفعه قبل شدت كمتري دارد و اغلب در بیشتر موارد پس از 2 تا 3 عود بیماران بهبود مییابند. وقتي بيمار ميميرد، معمولاً در انتهاي مرحلة اول بيماري و به دليل كلاپس ميوكارد است. مرگومیر با هموراژي مغزي و از كارافتادن كبد نيز مربوط است. TBRF از LBRF خفيفتر است.
تشخیص آزمایشگاهی:
بهطور کلی جهت جداسازی و شناسايي عامل بيماري از بيمار مبتلا به بورلیوزیس نمونه خون برداشت میشود و به طريق زير عمل میگردد:
آزمايش مستقيم:
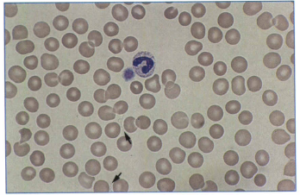
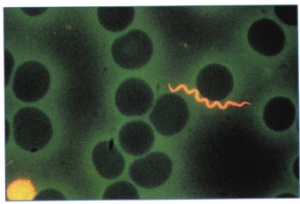
از نمونه خون مستقیماً گستره تهیه شده و زیر میکروسکوپ باکتریهای فنري شكل در آن مشاهده میشود. از مواردی است که نمونه خون مستقیماً برای ردیابی میکروارگانیسم استفاده میشود، بورلیوزیس است. بيماران اغلب ترومبوسیتوپني دارند و سطح سرمي آنزيمهاي كبديشان بالا رفته است. گستره ضخیم یا نازک مثل مالاریا تهیه شده و از رنگآمیزی با گیمسا، رایت و آکریدین نارنجی، استفاده میگردد (شکل 2 و 3). در اين صورت بورليا ها به رنگ صورتي در نمونه خوني مشاهده میشوند، از رنگآمیزی فونتانا هم میتوان استفاده نمود. لازم به ذکر است که حساسیت آزمایش مستقیم گسترههای خونی 70% است.
میتوان يك قطره نمونه خوني را بين لام و لامل قرار داده و توسط ميكروسكوپ زمينه سياه (Dark- field) حركت باكتري را بين توده گلبولهای خوني مشاهده نمود.
معایب روش میکروسکوپی شامل:
- نیاز به بار میکروبی بالا برای دیدن. اگرچه این مشکل با خونگیری در زمان تب از بین میرود.
- نیاز به تکنیسین باتجربه و آشنا با افتراق علائم بالینی یا مورفولوژی
- ناتوانی در شناسایی بورلیا در سطح گونه
در کل آزمایش میکروسکوپی خون محیطی که در زمان تب انجام شود بهترین روش آزمایشگاهی برای تشخیص تب راجعه است.
شکل 2: اسمیر خون رنگآمیزی شده با روش رایت
شکل 3: رنگآمیزی گسترههای خون محیطی با اکریدین نارنجی
كشت:
این باکتریها برخلاف ترپونماها روي محيطهاي باكتريولوژيك حاوي سرم يا عصارههاي بافتي كشت داده ميشوند. بورلیاها روی محیطهای Kellyیا BSKII (Barbour Stoenner Kelly)، اسمیت نگوشی، لیانپو و گالوی و روی پرده كوريوآلانتوئيك تخممرغ جنيندار در شرايط ميكروآئروفيليك و 33 درجه سلسیوس رشد میکند، ولی به دلیل اینکه زمانبر (حداقل 6 هفته) و غیرحساس هستند کمتر در آزمایشگاه از کشت استفاده میگردد و برای تشخیص، بیشتر از آزمایش مستقیم استفاده میشود.
تلقيح به حيوان آزمايشگاهي
با تلقیح خون بیمار به غشای کوریوآلانتوئیک جنین جوجه و به داخل صفاق موش سفید یا صحرایی، رشد و تکثیر باکتری افزایش مییابد و بورلمي ایجاد میگردد، سپس از خون موش برداشت شده و گسترش تهیه میشود و تعداد زياد باكتري مشاهده میگردد.
روشهای سرولوژی:
با روشهای سرولوژيك به جستجوي آنتیبادی موجود در سرم بيمار ميپردارند، بيماران ممكن است يك افزايش تيتر آنتیبادی نسبت به آنتیژن باكتري كه واكنش متقاطع با پروتئوس Oxk دارد، نشان دهند (تیتر بالای 1:80). از روشهای اليزا- ايمونوفلورسنت غیرمستقیم، وسترن بلات و روشهای ديگر هم براي شناسايي استفاده مینمایند.
نكات مهم:
- تستهای سرولوژی ارزش ندارند، چون باکتری دارای تغییرات آنتیژنیک است، ولی از آزمايش ثبوت مكمل در بعضي موارد استفاده ميشود.
- تشخيص معمولاً بيشتر از كشت مبتني بر لام خون مثبت است.
- اختصاصیت تستهای سرولوژی به دلیل وجود واکنشهای متقاطع با سایر اسپیروکتها بهویژه با عامل بیماری لایم پائین است.
- تستهایی که از پروتئین نوترکیب 34 کیلودالتونی GLPQ استفاده میکنند، برای اسپیروکتهای تب راجعه اختصاصی هستند.
- روشهای مولکولی PCR در تشخیص روتین تب راجعه اهمیت کمی دارند، هرچند از این روشها برای افتراق سویهها و گونهها و تعیین اتیولوژی برولیوزیس در مناطقی که اسپیروکتهای هر دو گروه تب راجعه و بیماری لایم یافت میشوند، استفاده زیادی میگردد.
درمان و پیشگیری
به دلیل اینکه روش استانداردی وجود ندارد و کشت این باکتری مشکل است، تستهای حساسیت آزمایشگاهی بهصورت روتین در آزمایشگاهها استفاده نمیشود. داكسي سايكلين براي تمام انواع تب راجعه استفاده ميشود و اريترومايسين و پنيسيلين G جانشينهاي قابل قبول آن هستند. درمان آنتيبيوتيكي بيماران مبتلا به LBRF و گاهي TBRF سبب واكنش جاريس– هركس هايمر (مثل سيفليس) ميشود. بيماران دچار لرز شديدي كه 2 تا 3 ساعت بعد از خوردن آنتیبیوتیک شروع ميشود، ميگردند. براي ساعتها حرارت بدن بالا رفته و فشارخون پايين ميافتد و سبب ميشود كه بيمار احساس سرما نمايد و سردرد و درد عضلاني بگيرد. علائم 12 تا 14 ساعت طول ميكشد و ندرتاً مرگآور است. مكانيسم مولکولی این پدیده تولید فراوان سایتوکینهای التهابزا مانند TNF آلفا، IL-6 و IL-8 است. با تزريق داخل رگي مايعات و كنترل افت فشار، واكنش مهار ميشود.
لازم به ذکر است که بدون درمان آنتیبیوتیکي حدود 40 درصد بيماران مبتلا به LBRF میمیرند. موارد TBRF درماننشده، خطر كمتري دارد و ميزان مرگومیر آن در موارد درماننشده در تمام موارد 2 تا 5 درصد و در بچهها 20 درصد است.
استراتژیهای پیشگیری از تب راجعه کنهای شامل کلبهها و خانههای روستایی محافظتشده در برابر جوندگان برای جلوگیری از انتشار کنههای نرم، استفاده از حشرهکشها در اطراف خانهها، استفاده از دافع حشرات موضعی در هنگام خواب و همچنین پرهیز از گردشهای شبانه در زیستگاه شناختهشده کنهها مانند غارها و اصطبلها است. در خصوص تب راجعه شپشی رعایت بهداشت فردی مناسب و پروسهای شپشزدایی میتواند مؤثر باشد. در حال حاضر واکسنی علیه این بیماری وجود ندارد.
بورليا بورگدورفري
تاریخچه بیماری لایم[12] توضیح اين امر است که چگونه گاهی اوقات بیماران بدون اینکه متوجه باشند، چشمان پزشکان را بر روي مسائل ناپيدا باز مینمایند. پالی مورای به مدت 10 سال از پزشکان ایالات لایم و شهر کانکتیکات برای مشکل بیماری طولانیمدت خود که امروزه معلوم شده به دلیل بیماری لایم بوده است، به دنبال کمک بود. قبل از پایان جستجوی او، هر پنج نفر افراد خانواده او نیز به بیماری دچار شده بودند. بالاخره در 1975 یک پزشک عمومی توجهش به موضوع جلب شد و یک روماتولوژیست بنام آلن استیر[13] را دعوت کرد تا در این مورد تحقیق کنند. استیر و دستیارش در دانشگاه Yale آزمایشهایی را شروع کردند تا بیماری جدید (بیماری لایم) را توضیح دهند و عامل آن یعنی بورلیا بورگدورفری[14] را کشف کنند.
با همکاری مادران، پزشکان، مدارس و آژانسهای سلامت محلی شهر کانکتیکات در ایالات لایم، لایم قدیم و هاوون شرقی (با جمعیتی بالغ بر 12000 نفر) گروه استیر توانستند 39 کودک و 12 بیمار بالغ را شناسایی کنند که حملات مکرر مختصری از آرتریت مهاجر خصوصاً در زانو داشتند. میزان حملات 12/2 در 1000 مورد بود که حداقل 100 بار بیشتر از آرتریت روماتوئید در جوانان بود. 13 بیمار اظهار داشتند که دارای پاپول قرمز رنگی بودند که بهصورت حلقه آنولار درآمده و این امر گروه استیر را به بیماری مشابهی– اریتمای مزمن مهاجر[15]– متوجه کرد که در اروپا در 1909 کشف شده بود و با گزش کنه ایگزودس ریسینوس[16] مرتبط بود. در 1983 ویلی بورگدورفری و همکارش در آزمایشگاه تحقیقات کوههای راکی نشان دادند که بیماری به دلیل یک بورلیا است که بعداً آن را بورلیا بورگدورفری نامیدند.
مرکز پیشگیری و کنترل بیماریها گزارش میکند که سالانه نزدیک به 30 هزار مورد تأییدشده لایم در ایالات متحده آمریکا وجود دارد و بنظر میرسد که هر سال این میزان افزایش مییابد. عامل محدودکننده انتشار، ناقلها هستند كه از عضوي از مجموعه کنههای ایگزودس ریسینوس (کنه گوسفند) میباشند. بيشترين بيماري منتقله از ناقل بندپا در ایالات متحده آمریکا، بيماري لايم است. ميزبان طبيعي اين کنههای بالغ گوزنهاي دم سفيد هستند كه با افزايش تعداد و دامنه زندگي آنها، بيماري لايم نيز افزايش مييابد. بيماري لايم در اروپا نيز رخ داده و سبب ظهور علائمي میشود كه با تظاهرات بيماري در ایالات متحده آمریکا متفاوت است و مهمترين عامل عفونتهای عصبي در اروپاي شمالي است.
ویژگیهای بورليا بورگدورفری
خصوصیات عمومي:
بورليا بورگدورفري بزرگترین (0/2 تا 0/3) و باريكترين (20 تا 30 ميكرومتر) بورلياهاست. در مقايسه با اسپيروكتها، مانند آنها شبيه چوبپنبه بازكن است اما داراي 7 تا 11 فيلامانت محوري بين غشای خارجي و غشای سيتوپلاسمي خود است؛ مانند ساير بورلياها در محیط Kelly اصلاحشده، در شرايط ميكروائروفيل قابل كشت است ولی كندرشد است. مثل بورلياي عامل تب راجعه، بورليا بورگدورفری داراي پلاسميدهاي خطي است، اما عامل بيماري لايم در يك ميزبان همانند عامل بيماري تب راجعه دچار تغييرات (موج) آنتيژنيكی نميشود.
بورليا بورگدورفری در كنههاي گروه ایگزودس ریسینوس شامل ایگزودس پاسيفيكوس[17] در شمال غربي ایالات متحده آمريكا و ایگزودس اسكاپولاريس[18] در شرق و غرب ميانه ایالات متحده آمريكا ايجاد ميشود. (كنهاي به نام ایگزودس داميني[19] حامل بورليا بورگدورفری و انگل بابزيا ميكروتي[20] است و انگل گوزنهاي دم سفيد است. البته جديداً حشرهشناسان به اين نتيجه رسيدهاند كه اين كنه از فاميل كنه ایگزودس اسكاپولاريس است كه انگل گوزن پا سياه است و لازم نيست نام ديگري داشته باشد).
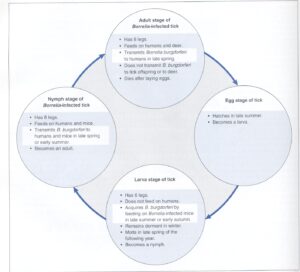
چرخة انتقال بورليا بورگدورفری در شكل 3 نشان داده شده است. زندگي گروه كنهاي ایگزودس ریسینوس 2 سال طول ميكشد. بورلياي عامل بيماري لايم از طريق تخم به نسل بعد كنه منتقل نميشود و تخم كه تابستان بعد باز ميشود، حاوي لارو 6 پايي است كه آلوده نيست. در پاييز لاروها با تغذيه از موشهای پا سفيد مزرعه[21] آلوده ميگردند. اين موشها به بورليا بورگدورفری آلوده هستند و در خونشان اسپيروكت دارند، اما توسط آن بيمار نميشوند. بهار بعد لاروهاي كنه دگرديسي كرده و به نمفهاي هشت پا تبديل ميشوند. اين نمفها از موشها و انسان تغذيه كرده و به اين ترتيب عفونت بورليا بورگدورفری را به ساير ميزبانها منتقل ميكنند. به دليل كوچك بودن نمفها (اندازه نوك مداد) زياد به آنها توجه نميشود.
در تابستان بعد نمف دگرديسي كرده و بالغ ميشود كه از گوزن دمسفيد و انسان تغذيه ميكند. ایگزودس اسكاپولاريس كنه كوچك و سختي است (شكل 3). براي انتقال قابل ملاحظه بورليا به انسان، كنه بايد با ولع خون بخورد كه 48 تا 72 ساعت طول ميكشد و بالاخره در اين مدت شخص متوجه كنه شده و آن را از خود دور ميكند. چون نمفها حداقل 2 برابر بالغين در نواحي اندميك حامل بورليا بورگدورفری هستند (28 درصد در مقابل 12 درصد)، بنابراين به نظر میرسد انسان بيشتر از طريق گزش نمف آلوده ميشود تا كنه، چراکه نمف كوچك بوده و زياد مورد توجه قرار نمیگیرد (در مقام مقايسه، بورليا فقط در 4 درصد لاروهاي كنه قابل جستجو است). اخيراً 2 گونه جديد بورليا كه عامل لايم در اروپا هستند، كشف شدهاند. بنظر میرسد كه بورليا افزلي[22] و بورليا گاريني[23] عامل شكلي از بيماري لايم هستند كه علائم آتيپيك دارند.
شكل 4: چرخه عفونت بورليا بورگدورفری در کنهها و انسان
هنگامي كه لاروهای ایگزودس اسكاپولاريس در اواخر تابستان يا اوايل پاييز، از موشهای پا سفيد مزرعه تغذيه میکنند، آلوده میشوند. در بهار بعد، دگرديسي كرده و به نمف تبديل میشوند كه از موشهای مزرعه و انسان تغذيه مینمایند؛ و هر دو اینها بهواسطه ميزباني از نمف آلوده میتوانند دچار عفونت شوند. نمف دگرديسيكرده و بالغشده از گوزن و انسان تغذيه میکند، اما نمف بالغ فقط انسان را بيمار میکند. (برگرفته از کتاب میکروبشناسی پزشکی واکر)
شكل 5: درشتنمایی ظاهر كنه گوزن پا سياه، ايگزودس اسكاپولاريس
شكل وسط، كنه گوزن است. شكل سمت چپ كنه سگ است (درماسنتور واريابيليس)، كه عامل تب دانهدار کوههای راكي را با خود حمل میکند. سمت راست حشرهای است كه بهعنوان ked شناسايي شده است. (برگرفته از کتاب میکروبشناسی پزشکی واکر)
مكانيسم بیماریزایی:
تظاهر شاخص بورليا بورگدورفری، توانايي آن براي ايجاد علائم كلينيكي مختلف است؛ مثل ضایعات پوستي، بيماري شبه آنفلوانزا (مرحلة اول بيماري)، مشكلات عصبي و قلبي (مرحلة دوم بيماري) و آرتريت پايدار (مرحلة سوم بيماري). چگونه يك عامل ميتواند اين همه تظاهرات را نشان دهد؟ به نظر میرسد كه در اين امر، هم محصولات باكتري و هم تخريبهاي وابسته به ايمني درگير هستند.
بورلياها باکتریهای گرم منفي هستند و تعدادي از محققين نشان دادهاند كه بورليا بورگدورفری داراي فعاليت شبه لیپوپلیساکارید[24] است كه با روشهايي مثل ليمولوس ليزات اسي[25] قابل اندازهگيري است. اگرچه لیپوپلیساکارید در بورليا بورگدورفری از نظر فارماكولوژيكي از لیپوپلیساکارید در اشرشیا کلی كم قابليتتر است، اما قادر به تحريك اينترلوكين -1 (IL-1) مترشحه از ماكروفاژ و منوسیت است. توليد 1IL- ممكن است بدين دليل مهم باشد كه 1- IL براي سلولهای سفيد كموتاكتيك است، سبب تب شده و آزادسازي پروتئینهای فاز حاد را تحريك کرده و سبب ميشود تا سلولها PGE2 و كلاژناز را ترشح كنند.
تزريق 1IL- به پوست ميتواند توليد زخمي (از نظر ظاهر و الگو) شبيه به ECM (بيشترين تظاهرات مرحلة اول بيماري) ايجاد كند، در حالي كه بيماران مبتلا به آرتريت لايم (مرحلة سوم بيماري) داراي 1IL-، PGE2 و كلاژناز در مايع سينوويال مفصل آلوده ميباشند؛ بنابراين محصولات اينترلوكين كه از تحريك لیپوپلیساکارید حاصل شده، ممكن است در ايجاد ECM و آرتريت نقش داشته باشد.
مطالعات تجربي نشان داده است كه ماكروفاژهاي مجاور شده با آنتیژنهای بورليا بورگدورفری سبب آرتريت در هامستر ميشوند كه از آرتريت بيماري لايم غير قابل تشخيص است، بهعلاوه آنتیبادیهای مستقيم عليه اينترلوكين 12(IL-12) سبب كاهش پاسخ ايمني Th1 و شدت آرتريت در موشها ميشود، پس پاسخ ماكروفاژ و Th1 در ايجاد آرتريت لايم نقش مهمي دارند.
مفصل مبتلايان حاوي کمپلکسهای ايمني و مقدار كمي بورلياست، همچنين داراي مراكز زاياي سلولهای T و B هستند كه در اثر پاسخ افزايش حساسيت تأخيري مزمن اين مفاصل ملتهب تبديل به ارگانهاي لنفاوي اكتوپيك میگردند. آرتريت مفاصل در اثر لايم، از بسياري جهات شبيه زخمهاي سيفليس مرحلة سوم و جذام لپروماتوز است كه در آن تعداد كمي ارگانيسم موجود است و سبب تحريك پاسخ پلاسماسل و سلولهای T ميشوند.
بهطور خلاصه، به نظر میرسد كه ECM مربوط به وجود بورليا در پوست باشد، چرا که سبب تحريك سلولهای التهابي و توليد IL-1 ميشوند. در مقابل، آرتريت در بيماري لايم در اثر حضور طولاني تعداد كمي بورليا در مفصل است و سبب تحريك كمپلكس ايمني شده كه منجر به فعال شدن كملپمان و تحريك ترشح IL-1، PGE2 و كلاژناز ميشوند (كه همگي سبب تخريب انسجام مفاصل ميگردند). حداقل قسمتي از علائم سيستميك مربوط به محصولات ايجادشده در اثر لیپوپلیساکارید و توليد سيتوكينها است. در موارد آرتريت مزمن تخريبي به نظر میرسد كه بيمار استعداد ژنتيكي ابتلا به اين بيماري را دارد.
حداقل يك مطالعه نشان داده كه بيشتر بيماران مبتلا از نظر HLA-DR4 آلوژنيك بودهاند، اما ساير مطالعات مقداري ارتباط بين وقوع آرتريت تخريبي لايم و بيان HLA-DR2 را نشان داده است. مشخص شده كه بيماران مبتلا، دچار تيتر بالارونده دائمي آنتیبادی ضد پروتئینهای غشای خارجي بورليا بورگدورفری به نامهای پروتئینهای سطح خارجي[26]، OSPA و OSPB هستند.
هنوز مكانيسم تظاهرات عصبي و قلبي (بيماري مرحلة دوم) بهخوبی معلوم نيست. البته گزارشهایی مبني بر حضور بورليا در سيستم اعصاب مركزي و ظهور آنتیبادی بر ضد ميلين در مايع نخاعي بيماران كه سبب آسيب عصبي بيماري لايم ميشود، در دست است. عامل اصلي اين یافتهها هنوز مشخص نيست و راه درازي تا تعيين وقايع بیماریزایی كه سبب بروز علائم باليني بيمار میشوند، باقي مانده است.
در نتیجهگیری نهايي، بنظر میرسد كه محوریترین عوامل بیماریزایی بيماري لايم عبارتند از:
(1) تمايل بورليا بورگدورفری به پوست، مفاصل و CNS؛
(2) توانايي باكتري براي سالها بقا به تعداد كم در محل؛
(3) پاسخ ايمني به ارگانهاي آلوده
مطالعات تجربي و باليني نشان میدهد كه احتمالاً اينترلوكين 4 (IL-4) هم نقشي در ايمني علیه بورليا بورگدورفری دارد. تجويز IL-4 نوتركيب در موش آلوده سبب كنترل سريع عفونت و تسكين مفصل آلوده ميشود. منوسیتهای نمونه خون محيطي بيماران لايم خيلي بيشتر از نمونه خون كنترل، IL-4 را ترشح ميكنند، بنابراين فقدان IL-4 در بيماران مبتلا ممكن است سبب بقاي عفونت بورليا بورگدورفری و توسعه بيماري شود.
بيماريهاي حاصل از بورليا بورگدورفری
تظاهرات و اصطلاحات بيماري:
بيماري لايم در اروپا و ایالات متحده آمريكا يافت میشود، البته نشانهها و علائم باليني آن بهکرات در اين دو ناحيه با هم تفاوت دارد. در اروپا بيشترين تظاهرات بهصورت اريتماي مهاجر مزمن (ECM) و ACA[27] و سندرم عصبي به نام سندرم Garin-Bajadoux-Bannwarth است. نوع ECM بهصورت پاپول در محل گزش كنه آغاز شده و سپس به اطراف پخش ميشود و يك تا چند تا حلقه اطراف نقطه مركزي ايجاد ميكند. نوع ACA التهاب قرمز قرينة پوست است كه در دست و پا بهصورت دو طرفه روي میدهد و معمولاً با هيپرتروفي لاية شاخي پوست و فلسي شدن آن همراه است.
نوع ACA فقط در كساني ايجاد ميشود كه با بورليا افزلي آلوده شدهاند. سندرم عصبي كه سندرم بان وارت نيز ناميده ميشود، داراي علائم سهگانه مننژيت لنفوسيتيكي (التهاب مننژ با اگزوداي لنفوسيتيك)، نوروپاتي كرانيال[28] (اغلب با Bell’s palsy روي میدهد) و نوروپاتي محيطي (التهاب ريشه نخاعي كه با درد نخاعي يا حسگرهاي عصبي همراه میباشد) است.
در ایالات متحده آمريكا، سه تظاهر عمده بهصورت ECM سندرم مزمن شبيه خستگي مفرط و آرتريت مفاصل بزرگ است، بهعلاوه 23 درصد بيماران از مشكلات قلبي (معمولاً انسداد دهلیز- بطن[29])، مشكلات عصبي يا تركيبي از آنها رنج ميبرند، درصد كمي مبتلا به ACA هستند.
در كودكان و بالغين سه مرحله بيماري لايم شناخته شده است. معلوم نيست كه بورليا بورگدورفری ميتواند از جفت عبور كرده و بيماري ارثي ايجاد نماید يا نه. گزارشهایی وجود داشته است كه زنان حاملهای كه مبتلا به بيماري لايم شدهاند، سقط كردند و گاهي بچههاي نارس دنيا آوردهاند. البته هنوز معلوم نشده كه بورليا بورگدورفری عامل آن بوده است. يك گزارش از مرگ يك نوزاد در مدتي كوتاه بعد از تولدش وجود دارد كه در مغز و كبدش بورليا بورگدورفری يافت شد. مادر اين نوزاد در طي حاملگي توسط پنيسيلين G كاملاً براي لايم درمان شده بود كه بنابراين در درمان مادر حامله بايد خيلي دقت كرد. در هر حال هنوز مشخص نيست كه آيا بيماري لايم در يك خانم حامله تهديد مستقيمي براي زندگي جنين هست يا خير.
تظاهرات باليني:
در جدول 1 تظاهرات باليني سه مرحله بيماري لايم نشان داده شده است.
(الف) بيماري مرحلة اول: در این مرحله، بيماري لايم عموماً با يك پاپول در محل گزش كنه، 3 تا 32 روز بعد از گزش ايگزودس ريسينوس آغاز ميشود. از اين نقطه حلقه اريتماتوسي شروع ميشود كه ملتهب است و همینطور به بزرگ شدن ادامه میدهد. لبة خارجي متورم است، اما قسمت داخلي حلقه صاف و رنگپریده است که ظاهری شبیه چشم گاو (bull’s-eye) دارد. ممكن است هر بيمار بيش از يك حلقه داشته باشد و هر حلقه ميتواند 70 سانتيمتر باشد. البته ميانگين اندازه آن 10 سانتيمتر است. بعضي بيماران درون يك حلقة بزرگ، حلقههاي کوچکتری دارند. زخمهايي كه قالب ECM را دارند، در عرض 3 تا 4 هفته ناپديد ميشوند.
بيماران در مرحلة اول دچار درد عضلاني، لرز، سفتي گردن، تب پايين و لنفادنوپاتي در محل هستند كه اين علائم به دليل انتشار اسپيروكت بهوجود ميآيد. حدود 17 درصد بيماران دچار زخمهاي ماهوارهاي ميشوند كه به دليل انتشار اسپيروكت است و از نظر ظاهر شبيه يكديگرند، اما از زخمهاي اوليه كوچكترند. حدود 10 تا 20 درصد بيماران مبتلا به لايم، هيچگاه دچار ECM نميشوند. بعضیها بدون نشانهاند و بعضيها علائم شبيه آنفلوانزا و بدون ECM را نشان میدهند. حدود 20 درصد بيماران مرحلة اول، تظاهرات بعدي بيماري را ندارند. مرحلة اول حدود 1 ماه طول ميكشد.
(ب) بيماري مرحلة دوم: در حدود 73 درصد از بيماران مرحلة اول، چند هفته يا ماه بعد (1 تا 4 ماه)، به مرحلة دوم بيماري ميروند. بعضي بيماران بدون نشانه قبلي نيز، علائم مرحلة دوم را نشان میدهند كه به دليل انتشار اسپيروكتهاست.
بيماران اين مرحله داراي يك يا دو علامت زير هستند:
موارد غيرطبيعي نورولوژيك (مثل سندرم بان وارت)؛ بيماري قلبي (مثل انسداد دهلیز- بطن) و دردهاي مهاجر در عضلات، مفاصل، تاندونها يا استخوانها.
مشكلات عصبي خودبهخود ظرف 1 تا 9 ماه و مشكلات عروقي در عرض 3 تا 6 هفته برطرف ميشوند. بهبودی از بدحالي و درد عضلانی ممكن است مدتها طول بكشد. اين تظاهرات لايم شبيه سندرم خستگي مزمن و فيبروميالژی است.
جدول 1: مراحل بيماري لايم و درصد بيماراني كه از هركدام از تظاهرات رنج میبرند
مرحله بيماري تظاهرات درصد بيماران
مرحله 1 اريتما كرونيكوم ميگرانس (ECM) 80 تا 90
مرحله 2 ناراحتیهای عصبي (مننژيت لنفوسيتي؛ نوروپاتي كرانيال؛ 15
راديكولونوروپاتي محيطي ناراحتیهای قلبي (بلوك آتريوونتريكولار) 8
ساير ناراحتیها (دردهاي ناتوانکننده يا خستگي مفرط، دردهاي مهاجر، هپاتيت خفيف؛ هماچوري يا پروتئينوري ميكروسكوپي)
مرحله 3 آرتريت (پلي آرتريت مهاجر در مفاصل بزرگ) 60
آرتريت مزمن با تخريب مفاصل (بيماري وابسته به HLA) 6
بورليوزيس مزمن (آكرودرماتيس آتروفيكاي مزمن؛ 5
آنسفالوپاتي؛ پلينوروپاتي با درد نخاعي يا راديكولار)
(ج) مرحلة سوم بيماري: مرحله سوم 5 تا 24 ماه بعد از مرحلة اول رخ میدهد و مشخصة آن آرتريت مهاجر است. آرتريت معمولاً در مفاصل بزرگ روي میدهد (بيشتر در زانو) و گاهي با تورم همراه بوده و در حدود 60 درصد بيماران درماننشده، ايجاد ميگردد. آرتريت عمدتاً ظرف چند سال خوب ميشود اما حدود 6 درصد بيماران دچار آرتريت مزمن تخريبي ميشوند كه ممكن است حتي با درمان مناسب نيز بهبود نيابند و به نظر میرسد يك بيماري وابسته به HLA باشد. ساير تظاهرات مرحلة سوم شامل ACA، آنسفالوپاتي، پلينوروپاتي به همراه درد نخاعي يا راديكولار است.
تشخیص آزمايشگاهي:
تشخيص بيماري لايم سه نکته دارد:
وضعيت كلينيكي كه تيپيك بيماري لايم است؛ بيماران در نقاطي هستند كه بيماري لايم در آنجا اندميك است و در سرم يا مايع مغزي- نخاعي بيماران آنتیبادی ضدبورليا بورگدورفری موجود باشد.
به دليل انتشار بيماري توسط نمف و كنه بالغ ايگزودس، بيماري لايم بيشتر در تابستان و اوايل پاييز، خصوصاً در ماههاي ژولاي و ژوئن بروز ميكند. تشخيص هيچگاه بر پايه كشت يا پيدا كردن باكتري در بافت استوار نيست، زيرا تعداد بورلياها بسيار كم است و روي محيط کشتهایی كه براي كشت نمونه بيماران استفاده میشود نيز بسيار كند رشد است. بنظر میرسد كه تشخيص بيماري لايم زياد مشكل نيست ولي گاهي تداخلهايي در تشخيص بهوجود ميآيد.
اولين مشكل در تشخيص اين است كه بيماران مرحلة اول مقدار كافي آنتیبادی ضدبورليا ندارند. پيك آنتیبادی IgM بين هفته 3 و 6 بيماري است اما آنتیبادی IgM اوليه اغلب علیه يك آنتیژن فلاژلي با وزن مولکولی 41 کیلو دالتون است كه بسيار غيراختصاصي است و علیه بسياري از اسپيروكتها ايجاد ميشود. آنتیبادی IgM مستقيم علیه آنتیژنهای بسيار اختصاصي OspC، Fla B و BmpA معمولاً تا انتهاي فاز اول توليد نميشود. آنتیبادیهای IgG ضد بورليا معمولاً 6 هفته بعد از آغاز ECM ترشح شده و ماهها بعد به پيك ميرسند، بنابراين احتمالاً تستهای استاندارد براي آنتیبادی تا زماني كه بيمار وارد مرحلة سوم بيماري نشود، مثبت نخواهد شد و بقيه تشخيص بر اساس حضور ECM بهتنهایی صورت ميگيرد.
آنتیبادیها (هم IgM و هم IgG) با الیزا قابل پيگيري هستند و با نتايج مناسب الیزا ميتوان Western blot انجام داد. بر اساس توصیهی CDC، بلاتهای اختصاصی IgG به حضور 7 تا 10 باند و آنالیزهای اختصاصی IgM به 2 تا 3 باند (آنتیژنهای فوق) نیاز دارند تا مثبت تلقی گردند. بيماران سرونگاتيو كه تظاهرات كلينيكي شديد بيماري لايم را نشان میدهند، از جهت پاسخ ايمني سلول به بورليا توسط تست لنفوسيت پروليفراتيو اسي[30] بررسی میشوند.
دومين مشكل اصلي، فقدان تستهای ايمونولوژيك استاندارد براي بيماري لايم است. به دليل اينكه تستها خوب استاندارد نميشوند، نتايج منفي كاذب معمول و نتايج مثبت كاذب، خيلي زياد است. اين مشكل بدين دليل پيش ميآيد كه بيمار مرحلة اول كه خوب درماننشده است ممكن است هيچگاه آنتیبادی قابل جستجو ايجاد نكند. افراد سروپزتيو معمولاً سالها آنتیبادی دارند، بنابراين افرادي كه سابقاً، بيماري لايم بدون علامت داشتهاند و بيماراني كه بهبود يافتهاند و حالا تظاهراتي دارند كه شبيه بيماري لايم است ممكن است سبب اشتباه در تشخيص شوند.
آيا اين امر خيلي اتفاق ميافتد؟ در يك مطالعه نشان داده شد كه فقط 23 درصد بيماري لايم فعال داشتهاند و 20 درصد قبلاً بيماري لايم داشتهاند، اما حالا از فيبروميالژي رنج ميبرند و 57 درصد هيچگاه بيماري لايم نداشتهاند، بنابراين 77 درصد از بيماران كه تشخيص بيماري لايم در آنها داده شده، اصلاً بيمار نيستند. وجود تشابه بين فيبروميالژي و سندرم خستگي بيماري لايم نيز تشخيص را مشكل میسازد.
بيماري مرحلة دوم نيز خصوصاً در بيماران مبتلا به تظاهرات عصبي بهسختی قابل تشخيص است. بيماري لايم را بايد از مننژيت ويروسي، Stroke، مالتيپل اسكلروزيس، سندرم گلينباره و ساير ناراحتیهای عصبي افتراق داد. تشخيص مرحلة دوم بيماري بر اساس نشان دادن پلئوسيتوز لنفاتيك[31] در مايع مغزي- نخاعي بيماران داراي علائم تيپيك عصبي بيماري لايم و خصوصاً در بيماران داراي علائم سهگانه مننژيت، نوروپاتي وراديكولونوروپاتي انجام ميشود. بيماراني كه اين علائم سهگانه را دارا هستند، در مايع مغزي- نخاعي و سرمشان آنتیبادی ضد بورليا دارند.
بيماري لايم به همراه علائم قلبي با توجه به حضور آنتیبادی ضد بورليا در سرم و همچنين با توجه به انسداد كامل قلبي كه در رماتيسم قلبي نادر است، از روماتيسم قلبي قابل تشخيص است. به خاطر داشته باشيد كه ECM در 10 تا 20 درصد بيماران مبتلا به لايم اتفاق نميافتد، بنابراين در خيلي از موارد، علائم مرحلة دوم جزء اولين علائم بيماري هستند.
بيماري مرحلة سوم با نشان دادن آنتیبادی ضد بورليا در سرم تأييد ميشود.
نکته مهم: اختصاصیت تستهای الیزا و ایمنوفلورسانت آنتیبادی به دلیل وجود واکنشهای متقاطع با سایر میکروارگانیسمها مانند هلیکوباکتر پیلوری، ابشتاین بار ویروس، سایر اسپیروکتها و چندین آنتیژن ضد هستهای که سبب بیماری لوپوس اریتماتوز سیستمیک میگردند بالا نبوده و تحت تأثیر این موارد قرار میگیرد. همچنین واکسیناسیون با واکسنهای حاوی زیرواحد OspA بیماری لایم ممکن است منجر به نتایج مثبت کاذب در تستهای الیزا و ایمنوفلورسانت آنتیبادی گردد.
امروزه روشهای مولکولی مختلف در مراحل متفاوت بیماری تعریف شده است که مطالعات نشان میدهد بهترین زمان استفاده از این روشهای مولکولی مانند PCR در طول بیماری لایم اولیه قبل از بروز تغییرات سرمی است. در کل تطابق اطلاعات بالینی با نتایج آزمایشگاهی صرفنظر از اینکه این نتایج از روشهای سرولوژی یا مولکولی است از اهمیت بالایی برخوردار است.
امروزه یک روش جدید لوسیفراز ایمنوپرسیپیتاسیون برای ردیابی آنتیبادیهای اختصاصی ارائه شده است، همچنین یک تست بر پایه به دام انداختن آنتیژن بر روی نمونههای ادرار و مایع نخاعی مورد استفاده قرار گرفته که نتایج خوبی به دنبال داشته است.
درمان و پیشگیری:
بيماران مبتلا به ECM به داكسيسايكلين يا آموكسيسيلين خوراكي واكنش مناسبي نشان میدهند. تشخيص زودهنگام بيماري در پيشگيري از بروز آرتريت بسيار مؤثر است در غير اين صورت فيبروميالژی ناشي از بورليا در ایالات متحده آمريكا بسيار ديده ميشود. بيشتر بيماران مبتلا به تظاهرات عصبي، آرتريت يا مشکلات قلبي بيماري لايم با سفترياكسون درمان ميشوند. هیچکدام از آرتريتهاي مزمن به درمان آنتیبیوتیک جواب نمیدهند، ولي آهسته بهبود مييابند. آرتريت مزمن پاسخ ضعيفي به آنتيبيوتيك میدهد. فيبروميالژي كه در نتيجه لايم به وجود ميآيد، با محدود كردن بورليا، ديگر بهوجود نميآيد.
برای پيشگيري، افرادي كه در نقاط اندميك بيماري لايم، پیادهروی میکنند، با پوشيدن جوراب بلند، لباس آستين بلند و قرار دادن پاچههای شلوار در چكمه، بايد از گزش كنه جلوگيري كنند يا از مواد دافع حشرات حاوي پرمترين استفاده نمايند. كنه را نبايد له كرد و بايد به آرامي گرفت و سريعاً از روي پوست بلند كرد. معمولاً يكي دو دقيقه بعد كنه پوست را آلوده ميكند. سپس میتوان كنه را در يك بطري به نزدیکترین آزمايشگاه رفرانس فرستاد تا از پاتوژن بودن آن اطلاع پيدا كرد. نزدیکترین مركز درماني بايد بتواند توصیههایی در مورد محلهایی كه اين تست را انجام میدهند، در اختيار مراجعين قرار دهد.
واکسیناسیون انسانی به عنوان تنها روش پیشگیریکننده مناسب، مدت زمان زیادی نیست که انجام میگردد. این واکسن زیرواحدی متشکل از آنتیژن نوترکیب OspA با یک لیپید بود که در ایمونیزاسیون سه مرحلهای بهطور قابلتوجهی بروز بیماری برولیوزیس را کاهش میداد. این محصول به دلیل فروش کم و شاید وجود یک ترس شناخته از عوارض آن در سال 2002 از بازار جمعآوری شد.
[1]– Epidemic relapsing fever
[2] – Louse-borne relapsing fever (LBRF)
[3] – Borrelia recurrentis
[4] – Endemic relapsing fever
[5] – Tick-borne relapsing fever (TBRF)
[6] – B. hermsii
[7] – B. duttonii
[8] – Ornithodoros
[9] – B. miyamotoi
[10] -B. lonestari
[11] – Variable Major Proteins (VMP)
[12] – Lyme disease
[13] -Allen Steere
[14] – Borrelia burgdorferi
[15] – Erythema chronicum migrans (ECM)
[16] – Ixodes ricinus
[17] – xodes pacificus
[18] – I. scapularis
[19] – I. dammini
[20] – Babesia microti
[21] – White-footed field mice
[22] – B. afzelii
[23] – B. garinii
[24] -LPS like
[25]– Limulus lysate assay
[26] – Outer surface proteins (OSP)
[27] – Acrodermatitis chronica atrophicans
[28] – Cranial neuropathy
[29] – Atrioventricular block
[30] – Lymphocyte proliferative assay
[31] – Lymphocytic pleocytosis
تازههایی از ريكتزيا و كوكسيلاها (1)
تازههایی از ريكتزيا و كوكسيلاها (2)
https://www.sciencedirect.com/topics/medicine-and-dentistry/borrelia
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام